В России уже несколько десятков лет используется термин «дисплазия соединительной ткани» (ДСТ): он включает как генетически обусловленные дифференцированные (синдромные), так и недифференцированные, мультифакторные формы, которые имеют генетическую основу, но проявляются под воздействием разнообразных факторов внешней среды [1].
В основе развития как синдромных, так и несиндромных форм ДСТ лежат мутации генов, ответственных за синтез и катаболизм структурных белков соединительной ткани или ферментов, участвующих в этих процессах, нарушения фибриллогенеза и др. [2]. У дифференцированных форм ДСТ (синдром Марфана, MASS-синдром, синдром Элерса–Данло, первичный пролапс митрального клапана, синдром гипермобильности суставов) реализация генетических детерминант мало зависит от внешних условий, тогда как при недифференцированных формах (МASS-подобный фенотип, марфаноидная внешность, элерсоподобный фенотип, доброкачественная гипермобильность суставов) она в наибольшей степени определяется именно факторами внешней среды.
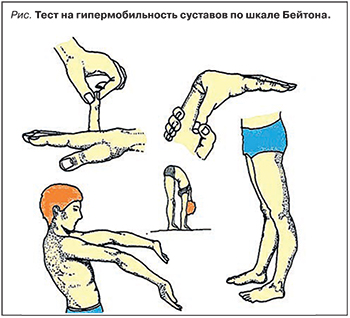 Одно из наиболее частых проявлений дисплазий соединительной ткани – гипермобильность суставов (ГМС). Ее распространенность варьирует от 6 до 57% в зависимости от возраста, пола и расовой принадлежности обследуемых [3]. Суставы считаются гипермобильными, если имеют избыточный диапазон движений по сравнению со среднестатистической нормой [4]. ГМС может быть локализованной, если поражен один или несколько суставов, или генерализованной, которая диагностируется при избыточной мобильности в суставах ≥4 групп.
Одно из наиболее частых проявлений дисплазий соединительной ткани – гипермобильность суставов (ГМС). Ее распространенность варьирует от 6 до 57% в зависимости от возраста, пола и расовой принадлежности обследуемых [3]. Суставы считаются гипермобильными, если имеют избыточный диапазон движений по сравнению со среднестатистической нормой [4]. ГМС может быть локализованной, если поражен один или несколько суставов, или генерализованной, которая диагностируется при избыточной мобильности в суставах ≥4 групп.
В рекомендациях Всероссийского научного общества кардиологов «Наследственные нарушения соединительной ткани» выделен термин «доброкачественная гипермобильность суставов», который, по сути, равнозначен понятию «гипермобильность суставов». Оба термина включают как случаи повышенной мобильности суставов, достигнутой регулярными физическими тренировками, так и ГМС, в основе которой лежат мутации тенаскина-Х и других генов, ответственных за формирование структуры и функции иных белков внеклеточного матрикса [5]. Следует подчеркнуть, что «доброкачественная гипермобильность суставов» у молодых людей, как правило, трансформируется в синдром гипермобильности суставов на любом этапе жизни, чаще в среднем и пожилом возрасте [1]. Случаев «доброкачественной гипермобильности суставов» в среднем и пожилом возрасте в современной литературе не описано.
В некоторых исследованиях продемонстрировано, что ГМС служит фактором риска возникновения раннего остеоартроза, который характеризуется тяжелым течением [6]. В связи с условностью термина «доброкачественная гипермобильность суставов» многие авторы считают целесообразным использование менее претенциозного термина «гипермобильность суставов».
 ДИАГНОСТИКА ГМС
ДИАГНОСТИКА ГМС
В настоящее время «золотым стандартом» диагностики ГМС считается 9-балльная шкала Бейтон. Это 5 тестов с балльной оценкой возможности обследуемого выполнить 5 движений: 4 парных для конечностей и 1 непарное для туловища (рис.). Тест считается положительным, если пациент набирает ≥4 из максимально возможных 9 баллов.
А. Хаким и Р. Грэхем разработали опросник, который используется для выявления у пациентов ГМС в прошлом (табл. 1).
Для первичного обследования пациента и верификации ГМС предложен также «Способ диагностики гипермобильности суставов для амбулаторной практики» (патент на изобретение № 2471418), включающий 7 простых тестов [7]. Во всех тестах 1 балл зачитывается при его выполнении с правой или левой стороны. В качестве критерия ГМС принята сумма ≥4 баллов (табл. 2).
При сочетании признаков суставной гипермобильности с клинической симптоматикой (вывихи, подвывихи суставов, артралгии и др.) диагностируют синдром гипермобильности суставов (СГМС). Для понимания взаимоотношений между ГМС и СГМС существует формула R. Grahame: ГМС + симптоматика = СГМС [4].
СГМС выделен в МКБ-10 в рубрике «Системные поражения соединительной ткани», имеет шифр М35.7 «Гипермобильный синдром разболтанности, излишней подвижности. Семейная слабость связок».
В настоящее время СГМС рассматривается как наследственное системное невоспалительное заболевание соединительной ткани [8]. Он связан с дефектами генов структурных белков соединительной ткани – коллагена и/или тенаскина X, что приводит к избыточной растяжимости связок и суставной капсулы, а также таким проявлениям, как сколиоз, миопия, растяжимость, дряблость кожи, пролапсы клапанов, грыжи, варикозные изменения сосудов. Ведущими проявлениями СГМС являются мышечно-суставные симптомы: боль (артралгии, дорсалгии), хруст, щелчки и другие, возникновение которых связывают с избыточной растяжимостью соединительнотканных структур и их повышенной чувствительностью к механической нагрузке, приводящей к микротравматизации околосуставных тканей и нередко к осложнениям (вывихи, тендиниты, бурситы) [9].

СГМС диагностируется на основании пересмотренных Брайтонских критериев [9] (табл. 3).
ГМС КАК РАННИЙ ПРИЗНАК НАСЛЕДСТВЕННЫХ ЗАБОЛЕВАНИЙ
Нужно учитывать, что ГМС выступает одним из ранних проявлений наследственных заболеваний соединительной ткани, таких как синдром Элерса–Данло (СЭД), синдром Марфана (СМ), несовершенный остеогенез, что имеет разную клиническую значимость [9]. К примеру, в Вильфраншских критериях диагностики СЭД при классическом, кифосколиотическом, гипермобильном, артрохалазическом типах генерализованная гипермобильность служит ведущим клиническим признаком заболевания и относится к большим критериям. При сосудистом типе СЭД ГМС относится к малым критериям [10].

В настоящее время нет договоренности относительно того, идентичен ли СГМС гипермобильному типу СЭД (СЭД III тип) или это качественно различные состояния. Некоторые исследования указывают, что различие «едва уловимо» и касается суставных осложнений, наличия или отсутствия проявлений со стороны кожи, ответа на местное применение анестетиков.
В критериях диагностики несовершенного остеогенеза ГМС рассматривается как клинический критерий вместе с повышенной ломкостью костей и голубыми склерами [9].
 В последней версии Гентских критериев синдрома Марфана (2010) было упразднено деление на большие и малые признаки, ряд малых признаков исключен [11]. Одновременно было выделено два наиболее специфичных признака синдрома — дилатация и/или расслоение аорты и эктопия хрусталика, а также предложена балльная оценка остальных признаков для расчета степени системного вовлечения соединительной ткани. В понятие «системная вовлеченность» включены признаки, характеризующие дефекты в разных органах и системах. Наиболее широко в списке признаков для балльной оценки представлена костная система (табл. 4).
В последней версии Гентских критериев синдрома Марфана (2010) было упразднено деление на большие и малые признаки, ряд малых признаков исключен [11]. Одновременно было выделено два наиболее специфичных признака синдрома — дилатация и/или расслоение аорты и эктопия хрусталика, а также предложена балльная оценка остальных признаков для расчета степени системного вовлечения соединительной ткани. В понятие «системная вовлеченность» включены признаки, характеризующие дефекты в разных органах и системах. Наиболее широко в списке признаков для балльной оценки представлена костная система (табл. 4).
Патология суставов при синдроме Марфана может проявляться как ограничением, так и избыточной подвижностью. Разгибание локтевого сустава считается неполным, если после полного разгибания угол между плечом и предплечьем составляет ≤170°. При оценке системного вовлечения соединительной ткани принимается во внимание именно ограничение разгибания локтя, которому присвоен 1 балл при диагностике синдрома Марфана. Следовательно, ГМС в пересмотренных Гентских критериях диагностики синдрома Марфана не является значимой величиной для постановки диагноза [12].
ТРУДНОСТИ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ
Особенности клинической картины СГМС могут создавать трудности в дифференциальной диагностике с системными заболеваниями соединительной ткани. Дебют артралгий приходится на молодой возраст, преимущественно у лиц женского пола. Чувство дискомфорта в суставах при СГМС обычно появляется после непривычных физических нагрузок, особенно часто в период быстрого роста ребенка с преимущественной локализацией в нижних конечностях. Такая клиническая картина может напоминать первые этапы развития ревматоидного артрита или реактивных артритов.
Главной отличительной чертой СГМС от ревматических заболеваний служит отсутствие системной воспалительной реакции и купирование мышечно-суставной симптоматики на фоне лечебной физкультуры и коррекции модели движений. Также необходимо помнить, что рентгенологические и иммунологические маркеры ревматических заболеваний могут проявиться через несколько месяцев от момента возникновения мышечно-суставного болевого синдрома, что требует повторных лабораторных исследований при отрицательных результатах первого этапа диагностики [13].
Таким образом, ГМС имеет разную клиническую значимость для диагностики синдромных форм ДСТ, а также является наиболее частым симптомом недифференцированных форм. Нужно понимать, что на данный момент под маской недифференцированных ДСТ может скрываться большое количество генетически неоднородных моногенных наследственных синдромных форм, обусловленных «мягкими» мутациями, протекающими со стертой клинической картиной. Для их верификации необходимы дальнейшие молекулярно-генетические исследования. Кроме того, выявление СГМС не должно быть поводом для отказа от обследования по поводу другого ревматического заболевания. Так, показано, что в течение года дебют системного заболевания соединительной ткани может манифестировать не только болевым синдромом, но и специфичными маркерами. Поэтому пациентов с ГМС необходимо направлять на повторные лабораторно-инструментальные обследования в течение года при появлении новых симптомов, так как могут быть получены положительные иммунологические маркеры ревматического заболевания, ранее дававшие отрицательные результаты.


