В последние годы клинические наблюдения показали, что чаще всего врачам на практике приходится сталкиваться не с отдельными нозологиями, а с их сочетанием. Согласно эпидемиологическим исследованиям, ишемическая болезнь сердца (ИБС) и хроническая обструктивная болезнь легких (ХОБЛ) в структуре заболеваний старших возрастных групп составляют 60%, причем число больных неуклонно возрастает [1–3].
В развитии ИБС и ХОБЛ важную роль играют общие факторы риска, такие как курение, отсутствие здорового образа жизни, возраст, повышенный уровень холестерина, артериальная гипертензия, ожирение, плохая экологическая обстановка, а также системное воспаление, оксидативный стресс и коагулопатия. Хорошо изучена роль воспаления в развитии атеросклероза. Повышение уровня высокочувствительной фракции С-реактивного белка (СРБ), основного маркера воспаления, способствует повышению риска развития атеросклероза, ИБС и возрастанию бронхиального сопротивления [4, 5]. Кроме того, активация иммунных клеток в атеросклеротической бляшке коронарных сосудов способствует усилению продукции провоспалительных цитокинов (интерлейкин-1β, интерлейкин-6, интерлейкин-8, фактор некроза опухоли α, интерферон γ), повышению числа лейкоцитов, уровней фибриногена и СРБ, что также может приводить к воспалению в бронхах при ХОБЛ [6].
По мнению ряда авторов, сочетание ИБС и ХОБЛ приводит к синдрому взаимного отягощения и требует особого подхода при лечении этой кардиопульмональной патологии, чьим конечным этапом становится развитие хронической сердечной недостаточности (ХСН), при которой смертность составляет более 50% [7–9]. Кроме того, прогрессирование гипоксемии повышает активность симпатоадреналовой и ренин-ангиотензин-альдостероновой систем (РААС), способствует развитию эндотелиальной дисфункции, нарастанию легочной гипертензии, что, наряду с повышением уровня провоспалительных цитокинов, приводит к тромбообразованию и нарушению реологических свойств крови, которые, в свою очередь, влияют на неблагоприятный прогноз больных ХСН с кардиопульмональной патологией [10–13].
Лечение ХСН, ИБС и ХОБЛ по отдельности рассматривалось во многих крупных международных исследованиях (CONSENSUS, SOLVD, CIBIS- 2, 3, MERIFT-HF, SENIORS, ISSIS-4, CEISSIS-3 и др.). Современная терапия ХОБЛ основывается на рекомендациях GOLD (Global Initiativefor Chronic Obstructive Lung Disease) и предполагает использование ингаляционных бронходилататоров длительного действия, ингаляционных глюкокортикостероидов (ИГКС) и их комбинации с целью стабилизации и предупреждения декомпенсации заболевания.
При ведении больных ХСН с низкой фракцией выброса левого желудочка (ФВ ЛЖ) в соответствии с принципами доказательной медицины применяется базисная терапия ингибиторами ангиотензинпревращающего фермента (ИАПФ) или сартанами, β-адреноблокаторами, блокаторами минералокортикоидных рецепторов, а также по потребности диуретиками и сердечными гликозидами. Особых рекомендаций по ведению больных ХСН и кардиореспираторной патологией в настоящее время нет.
К сожалению, в современной литературе нет убедительных данных о влиянии β-адреноблокаторов и блокаторов РААС на состояние тромбоцитарного звена гемостаза и реологических свойств крови у больных ХСН ишемического генеза в сочетании с ХОБЛ. Поэтому изучение этого вопроса представляется актуальным.
Цель настоящего исследования – оценка клинического статуса, качества жизни, изменений тромбоцитарного звена гемостаза и реологических свойств крови при ХСН II–III функциональных классов (ФК) у больных ИБС в сочетании с ХОБЛ II–III степеней и возможности их коррекции.
Материал и методы
В исследовании были включены мужчины и женщины в возрасте 45–75 лет, имеющие ХСН II–III ФК на фоне ИБС и постинфарктного кардиосклероза, страдающие ХОБЛ среднетяжелого и тяжелого течения (в соответствии с GOLD-2013) с дыхательной недостаточностью I–II степеней. Легочный процесс был вне обострения. ФВ ЛЖ по данным эхокардиографии (ЭхоКГ) у всех больных составляла менее 45%.
Для оценки тяжести ХСН использовали классификацию Нью-Йоркской ассоциации кардиологов NYHA (New York Heart Association) и национальные рекомендации по диагностике и лечению ХСН (2013).
Диагноз ХОБЛ ставился на основании рекомендаций международной программы GOLD (2013) и отечественных стандартов по диагностике и лечению больных ХОБЛ (2013) [14, 15].
Количественную оценку выраженности дыхательной недостаточности определяли с помощью шкалы диспноэ MRC (Medical Research Council Dyspnea Scale) – модификации шкалы Флетчера.
В исследование не включались пациенты с ХСН IV ФК по NYHA, дыхательной недостаточностью III cт., острым инфарктом миокарда в течение 6 мес, предшествовавших включению в исследование, с врожденными или приобретенными пороками сердца, дилатационной и гипертрофической кардиомиопатией, артериальной гипотензией (систолическое артериальное давление <90 мм рт. ст.), артериальной гипертензией (АГ) 3-й степени, обострением ХОБЛ, бронхиальной астмой без формирования ХОБЛ, стенозом почечных артерий, выраженными нарушениями функции печени и почек.
Всего были обследованы 158 больных, из них 128 (78,8%) мужчин и 30 (21,2%) женщин. Средний возраст составил 63,5±4,8 года, средний балл одышки по шкале MRS – 1,9±0,4, средний функциональный класс ХСН – 2,6±0,8. Курильщиками были 125 (79%) больных, стенокардию II–III ФК определили у 43 (27,2%) пациентов. Сердечные гликозиды по поводу тахисистолической формы мерцательной аритмии получали 52 (33%) больных, ИГКС в стабильно низких дозах применяли 36 (23%) пациентов.
На первом этапе исследования, проходившем в условиях стационара, проводили терапию, направленную на прекращение приступов сердечной астмы, уменьшение отеков и одышки, достижение положительного диуреза и появление возможности эффективной пероральной и ингаляционной терапии. Затем после подписания информированного согласия пациентов случайным образом распределяли в 3 группы.
Больные всех групп наблюдения получали базисную терапию ХСН с использованием диуретиков, пролонгированных нитратов, дезагрегантов (по показаниям), сердечных гликозидов (при наличии тахисистолической формы мерцательной аритмии) и базисную терапию ХОБЛ с применением тиотропиума бромида 18 мкг/сут однократно через ингалятор Handihaler и ИГКС в стабильно низкой дозе, по меньшей мере в течение 3 мес, предшествовавших исследованию.
 В 1-ю группу вошли 60 пациентов (48 мужчин, 12 женщин), средний возраст составил 64,4±3,3 года, из них 81% были курильщиками. Больные этой группы в дополнение к указанной терапии получали ИАПФ эналаприл (Берлиприл) и β-адреноблокатор небиволол (Небилет). Средняя доза эналаприла составила 8,1±1,8 мг/сут, небиволола – 4,4±1,3 мг/сут. Сердечные гликозиды назначались 22 (36,7%) больным с тахисистолической формой мерцательной аритмии в дозе 250 мкг/сут 5 дней в неделю. Стенокардия II–III ФК была определена у 21 (35%) больного, АГ I–II степени – у 42 (70%) больных. ИГКС в низких дозах получали 13 (22%) пациентов.
В 1-ю группу вошли 60 пациентов (48 мужчин, 12 женщин), средний возраст составил 64,4±3,3 года, из них 81% были курильщиками. Больные этой группы в дополнение к указанной терапии получали ИАПФ эналаприл (Берлиприл) и β-адреноблокатор небиволол (Небилет). Средняя доза эналаприла составила 8,1±1,8 мг/сут, небиволола – 4,4±1,3 мг/сут. Сердечные гликозиды назначались 22 (36,7%) больным с тахисистолической формой мерцательной аритмии в дозе 250 мкг/сут 5 дней в неделю. Стенокардия II–III ФК была определена у 21 (35%) больного, АГ I–II степени – у 42 (70%) больных. ИГКС в низких дозах получали 13 (22%) пациентов.
2-я группа состояла из 40 больных (30 мужчин, 10 женщин), средний возраст пациентов составил 63,7±4,2 года, из них 79,7% были курильщиками. Все пациенты этой группы получали небиволол в средней дозе 4,5±1,1 мг/сут и антагонист рецепторов ангиотензина II лозартан (Козаар) в средней дозе 44,5±3,5 мг/сут. Дигоксин в дозе 250 мкг/сут 5 дней в неделю назначался 13 (32,5%) пациентам с тахисистолической формой мерцательной аритмии. Стенокардию II–III ФК имели 13 (32,5%) человек, АГ I–II степени была у 30 (75%) больных. ИГКС применяли 10 (25%) пациентов.
В 3-ю группу были включены 58 человек (50 мужчин, 8 женщин) в среднем возрасте 62,9±4,2 года, из которых курильщиками были 45 (77,6%) человек. Они получали стандартную терапию ХСН без добавления небиволола, средняя доза эналаприла составила 12,4±2,4 мг/сут. Необходимость в применении дигоксина была у 17 (29,3%) больных. Стенокардия II–III ФК была установлена у 20 (34,5%) пациентов, АГ I–II степени – у 43 (74%) человек. ИГКС получали 13 (22,4%) больных.
Таким образом, группы наблюдения исходно не отличались по основным клиническим характеристикам, что позволило сравнивать их в дальнейшем.
Подбор дозы изучаемых препаратов проводился методом титрования. Так, небиволол назначали в условиях стационара в начальной дозе 1,25 мг/сут под тщательным контролем клинического состояния больного, показателей функции внешнего дыхания. Этапы титрования составляли 2 нед. Целевой была доза 5 мг/сут. Эналаприл назначали по 2,5 мг/ сут 2 раза в сутки (в случае исходной артериальной гипотонии начальная доза была снижена до 1,25 мг/ сут). При этом оценивалась динамика клинического состояния больных с учетом уровня артериального давления (АД) и суточного диуреза. В процессе титрования достигалась наибольшая переносимая доза; при этом целевой была доза 20 мг/сут. Подбор дозы лозартана также проводился в стационарных условиях методом титрования: начальная доза составила 12,5 мг/сут, целевая – 50 мг/сут.
В ходе титрования дозы препаратов удваивались каждые 2 нед после клинического осмотра больных. При этом учитывалась динамика самочувствия пациентов за истекший период, выраженность одышки, слабости, утомляемости, суточный диурез, кратность приема диуретиков, появление или нарастание отеков, масса тела больного, динамика уровня АД, частоты сердечных сокращений (ЧСС) и т.д. Во время подбора дозы препаратов контрольные явки больных после выписки из стационара назначались каждые 2 нед, в дальнейшем 1 раз в месяц.
Больные наблюдались в течение 6 мес. После окончания исследования пациенты, нуждавшиеся в госпитализации, проходили обследование в стационаре, остальные – в амбулаторных условиях.
Всем больным было проведено комплексное клинико-инструментальное обследование. Оценку клинической эффективности терапии проводили по динамике симптомов ХСН и ХОБЛ с определением наличия и степени выраженности застойных явлений по малому и большому кругам кровообращения, явлений бронхообструкции. Ключевыми моментами в оценке клинического состояния были определение ФК ХСН (по NYHA), степени выраженности одышки (по MRS) и ХОБЛ. Толерантность к физической нагрузке изучали с помощью пробы с 6-минутной ходьбой (ТШХ). Оценка качества жизни пациентов проводилась с помощью опросника Миннесотского университета MLHFQ (Minnesota Livingwith Heart Failure Questionnaire) для больных ХСН, шкалы оценки клинического состояния (ШОКС, модификация Мареева В.Ю.) и анкеты госпиталя святого Георгия SGRQ (St. George Respiratory Questionnaire). Исследование параметров внутрисердечной гемодинамики, функционального состояния миокарда, степени легочной гипертензии оценивали посредством ЭхоКГ на аппарате Voluson 730 Expert (США) с применением допплерографии по стандартной методике.
Для оценки эпизодов безболевой ишемии миокарда (ББИМ) проводилось суточное мониторирование электрокардиограммы (ЭКГ) с использованием портативного регистратора ЭКГ и АД (осциллометрическим методом) CardioTens (Меditech, Венгрия). Определялось число и продолжительность эпизодов ББИМ до включения больных в исследование и через 6 мес терапии. В качестве признаков ББИМ рассматривалась депрессия или подъем сегмента ST ишемического типа на 1 мм и более через 0,08 с после точки J продолжительностью не менее 1 мин (Лупанов В.П., 2002).
Исследование функции внешнего дыхания осуществлялось на спирометре открытого типа SPIROUSB, работающем с компьютерной программой Spida5 по стандартной методике.
Исследование тромбоцитарного звена гемостаза проводили на фотоэлектроколориметре РФК-2МП по методу Born в модификации В.Г. Лычевa с вычислением суммирующего индекса по Ховарду (Xoward М.А., 1973). В процессе исследования определяли спонтанную и индуцированную агрегацию тромбоцитов. В качестве индуктора агрегации использовали аденозинфосфат (АДФ) в конечной концентрации 2 мкМ.
Вязкость крови (Вкр.) определяли с помощью вискозиметра ротационного типа – анализатора крови реологического АКР-2 (МП «Комад», Россия) путем центрифугирования при различных скоростях сдвига (20, 100, 200 об./с) Измерение вязкости плазмы (Впл.) проводилось аналогично измерению Вкр.
Липидный спектр крови исследовался ферментативным методом с использованием реактивов фирмы Boehinger-Mannheim.
Статистическая обработка данных делалась с помощью пакета программ Statistica 6,0 (StatSoft, США). Применялся модуль описательной статистики: средние арифметические показатели, стандартные отклонения и др.; модуль непараметрического статистического анализа с использованием критериев Манна–Уитни, Вилкоксона. За величину значимости различий было принято р <0,05.
Результаты
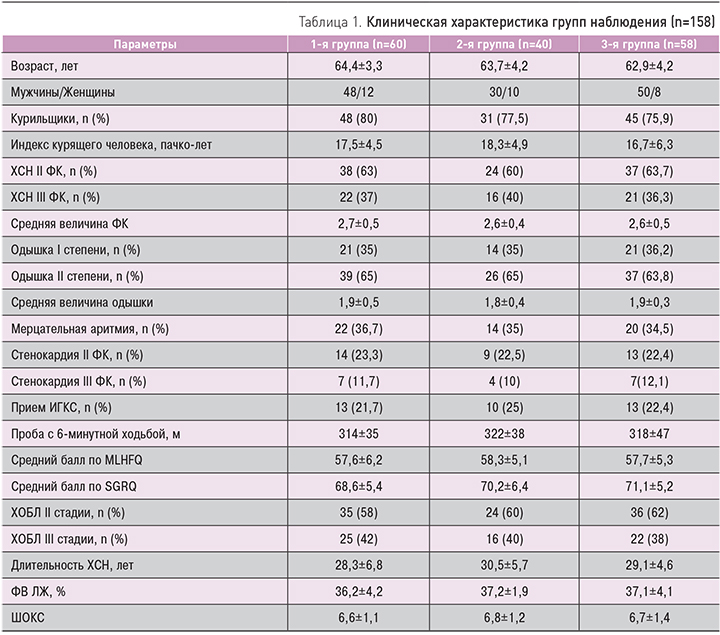
В исследование были включены 158 больных ХСН II–III ФК с ИБС и постинфарктным кардиосклерозом, имевших снижение ФВ ЛЖ ≤45%, в сочетании с ХОБЛ II–III стадии (GOLD, 2013). Клиническая характеристика групп наблюдения представлена в табл. 1.
У больных всех групп на фоне комплексной терапии отмечалось улучшение клинического течения заболевания, качества жизни, что выражалось в уменьшении ФК ХСН, степени выраженности одышки, увеличении толерантности к физической нагрузке и улучшении качества жизни больных.
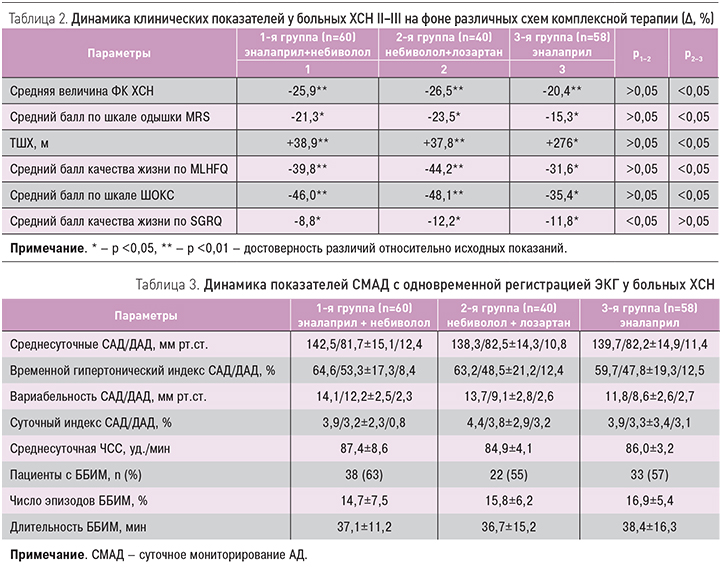
При сравнении динамики средней величины ФК ХСН как интегрального показателя улучшения клинического состояния больных ХСН с кардиопульмональной патологией, а также среднего балла одышки по шкале MRS, качества жизни, согласно опроснику MLHFQ, по шкале ШОКС и результатам ТШХ, статистически значимых различий в 1-й и 2-й группах наблюдения получено не было (р >0,05), кроме оценки качества жизни по SGRQ, где р1–2 <0,05. Различия между изменениями во 2-й и 3-й группах (контрольной и не получавшей небиволол) по большинству исследуемых клинических показателей носили достоверный характер, что указывает на повышение эффективности лечения при включении в схему терапии небиволола с эналаприлом или лозартаном. Что касается сравнения динамики показателей среднего балла качества жизни по SGRQ, то в данном случае существенных различий не наблюдалось (р2–3 >0,05). Динамика изучаемых клинических показателей представлена в табл. 2.
Максимально позитивные изменения в клиническом статусе пациентов 1-й и 2-й группах, по-видимому, получены не только благодаря базисной терапии ХСН и ХОБЛ, но и за счет присутствия в схеме лечения комбинаций эналаприла и небиволола (1-я группа) или небиволола и лозартана (2-я группа) вследствие вазопротективного и органопротективного действия этих препаратов. Такое действие приводит к уменьшению эндотелиальной дисфункции, благоприятной реакции сердечно-сосудистой системы, уменьшению холинергического тонуса дыхательных путей. Конечным результатом является улучшение клинического статуса пациента с кардиопульмональной патологией, что проявляется в уменьшении одышки, повышении толерантности к физической нагрузке и улучшении качества жизни больных.
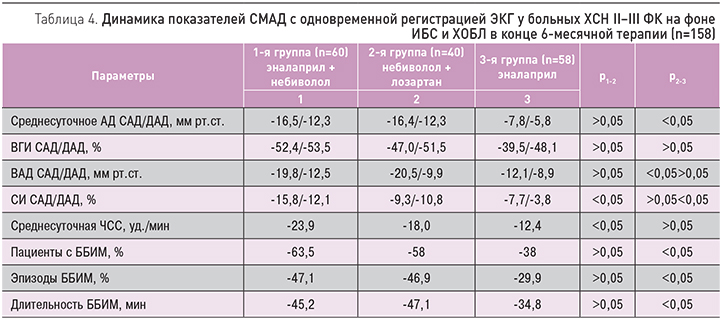
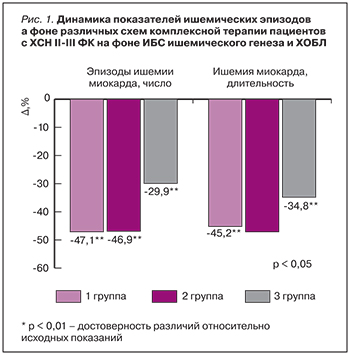
Снижение уровней систолического АД (САД) и диастолического АД (ДАД) при изучаемых схемах лечения требует определенной осторожности в подборе оптимальных доз препаратов. Путем постепенного увеличения дозы исследуемых препаратов и медленного титрования доз небиволола, эналаприла и лозартана во всех случаях удалось избежать клинически значимой гипотонии, а средние цифры АД не снизились ниже нормальных значений. Это было подтверждено при проведении суточного мониторирования АД (СМАД) с одновременной регистрацией ЭКГ с целью выявления эпизодов ишемии миокарда, характерных при сочетанной патологии ИБС и ХОБЛ (табл. 3) [6, 8, 10].
По результатам СМАД, на фоне терапии улучшился исходно нарушенный профиль АД во всех трех группах, произошло уменьшение среднесуточного АД, ЧСС, индекса времени гипертензии (ВГИ), суточного индекса (СИ) и вариабельности АД (табл. 4). Во всех трех группах наблюдения на фоне различных схем лечения отмечалось достоверное уменьшение частоты (на 47,1, 46,9, 29,9% соответственно) и общей длительности эпизодов ишемии (на 45,2, 47,1, 34,8% соответственно), что можно расценивать как более выраженное проявление антиишемического действия небиволола в сочетании с эналаприлом или лозартаном. Достоверных различий между 1-й и 2-й группами наблюдения не получено (р >0,05).
Таким образом, по сравнению с контрольной группой (3-я группа) комбинированная терапия с суперселективным β-адреноблокатором небивололом достоверно лучше (р <0,05) контролирует эпизоды ишемии как по числу эпизодов, так и по их длительности. Динамика частоты и продолжительности эпизодов ишемии миокарда на фоне различных схем комплексной терапии, выявленная в исследовании, отражена на рис. 1.
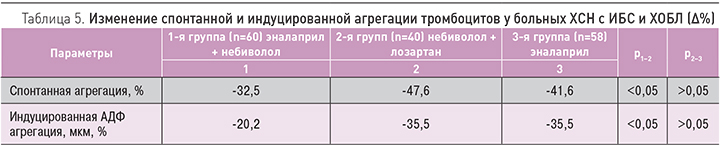
Динамика агрегационных свойств тромбоцитов и реологических свойств крови у больных ХСН II–III ФК на фоне ИБС и ХОБЛ при различных схемах терапии
При оценке исходных показателей 158 больных отмечались повышенные уровни спонтанной и АДФ-индуцированной агрегации тромбоцитов. В среднем уровень спонтанной агрегации составил 28,2±2,1% в 1-й группе, 27,9±1,2% – во 2-й, 27,1±3,4% – в 3-й. Уровень АДФ-индуцированной агрегации составил 93,4±6,4% в 1-й группе, 92,1±7,4% – во 2-й, 91,5±7,6% – в 3-й. К завершению наблюдения во всех группах произошло достоверное снижение агрегационной активности тромбоцитов, более выраженное в 1-й и 2-й группах.
Уменьшение спонтанной и АДФ-индуцированной агрегации тромбоцитов составило 44,5 (р <0,05) и 26,2% (р <0,05) в 1-й группе, 46,5 (р <0,01) и 28,5% (р <0,01) во 2-й группе, 31,6 (р <0,01) и 20,5% (р <0,01) в 3-й группе соответственно. Результаты изменений агрегационной активности тромбоцитов представлены в табл. 5. Отметим, что различия в динамике вышеуказанных показателей между контрольной (1-я группа) и основными группами наблюдения были достоверными (р <0,05). Различия в динамике агрегационных свойств тромбоцитов между 1-й и 2-й группами были не достоверны (р ≥0,05).
Выявленные изменения, по-видимому, связаны как с улучшением гемодинамических показателей, так и с антиагрегационным действием изучаемых препаратов. Более выраженный положительный эффект в 1-й и 2-й группах обусловлен сочетанным применением небиволола с эналаприлом и лозартаном, которые оказывают взаимоусиливающее влияние на агрегационные свойства тромбоцитов с улучшением тромбоцитарного звена гемостаза и, по-видимому, положительно влияют на плазменный и сосудистый гемостаз за счет оказания вазопротективного действия с нормализацией функции эндотелия. Особое влияние на положительную динамику агрегации тромбоцитов оказывает небиволол, высокоселективный β-адреноблокатор с дополнительным сосудорасширяющим действием, обусловленным воздействием на систему L-аргинин/NO, особенно на активность эндотелиальной формы NO-cинтазы (эNOc). Предполагается, что NO играет важную роль в нормализации функции эндотелия, так как способствует снижению адгезии и агрегации тромбоцитов, ингибирует образование тромбина, адгезию моноцитов к сосудистой стенке и пролиферацию гладкомышечных клеток [16].
Кроме того, образующийся эндотелиальный NO противодействует вазоконстрикторному действию тромбоксана А2 и серотонина, которые продуцируются тромбоцитами. Дополнительная модуляция синтеза NO, антиоксидантный эффект наряду с блокадой β-адренергических рецепторов при приеме небиволола у больных ИБС на фоне двойной антиагрегантной терапии способствуют улучшению функции эндотелия и обусловливают более выраженный антиагрегантный эффект препарата по сравнению с бисопрололом, метопрололом и карведилолом [16].
В нашем исследовании через 6 мес лечения в обеих группах наблюдения отмечалась благоприятная динамика исходно нарушенных реологических свойств крови. У всех больных уменьшилась вязкость крови при 200, 100 и 20 об./с на 11,5% (р <0,05), 12,3 (р <0,05) и 24,1% (р <0,01) в 1-й группе и на 21,7% (р <0,05), 22,3 (р <0,05) и 25,2% (р<0,05) во 2-й соответственно, однако не достигнув нормальных значений во всех случаях.
Индекс деформируемости эритроцитов увеличился на 5,7% (р >0,05), 5,6% (р >0,05) и 6,5% (р >0,05), индекс агрегации эритроцитов – на 9,7% (р <0,05), 10,1 (р <0,05), 11,4% (р <0,05) в 1-й, 2-й, 3-й группах соответственно. Различия между группами наблюдения по данным параметрам не носили достоверного характера (р >0,05). Изменения реологических свойств крови в группах наблюдения, на наш взгляд, можно связать как с улучшением показателей внутрисердечной гемодинамики и увеличением скорости кровотока, так и со снижением агрегации эритроцитов. Кроме того, у больных 2-й группы, получавших небиволол и лозартан, полученный результат можно объяснить улучшением вязкостно-эластических свойств мембран эритроцитов, что увеличивает их деформируемость и способствует нормализации кровообращения в микроциркуляторном русле.
Изменение липидного спектра на фоне различных схем комплексной терапии ХСН и ХОБЛ
Известно, что β-адреноблокаторы и диуретики снижают чувствительность к инсулину и усугубляют дислипидемию. Это особенно актуально для больных ХСН, которые вынуждены регулярно применять мочегонные средства. Однако исследования последних лет показали, что ИАПФ и β-адреноблокаторы 3-го поколения с вазодилатирующим эффектом не ухудшают липидный профиль [10, 14]. Поэтому для нас было особенно интересно отследить изменения липидного спектра крови на фоне проводимой терапии.
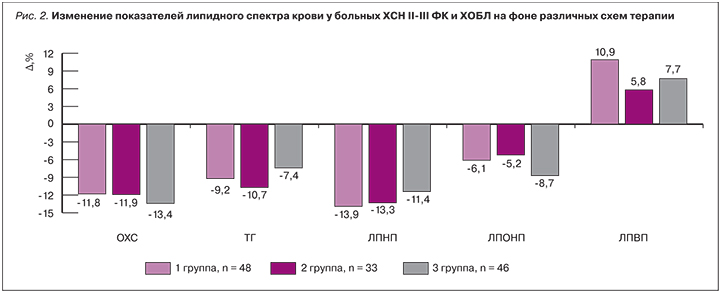
У 127 (80%) больных были исходно нарушены липидные показатели крови в виде повышения уровня холестерина плазмы (ХС), триглицеридов (ТГ), липопротеидов очень низкой плотности (ЛПОНП), значительного повышения липопротеидов низкой плотности (ЛПНП) и снижения липопротеидов высокой плотности (ЛПВП). При этом отмечалось значительное повышение индекса атерогенности (ИА).
Через 6 мес комбинированной терапии во всех группах наблюдения отмечалась положительная динамика, не носившая, однако, достоверного характера. Так, было показано, что снижение уровня общего холестерина, его атерогенных фракций (ЛПОНП, ЛПНП), ТГ и прирост ЛПВП в сумме привело к снижению ИА на 21,1, 18,4 и 16,0% в 1-й, 2-й и 3-й группах соответственно (рис. 2).
Таким образом, небиволол при ХСН у больных кардиопульмональной патологией оказывает метаболически нейтральное действие и способствует улучшению профиля липидного обмена благодаря вазопротективному, антиоксидантному действиям, обусловленным дополнительной модуляцией синтеза NO и синергизмом с блокаторами РААС.
Заключение
У больных ХСН ишемического генеза в сочетании с ХОБЛ II–III стадии прием небиволола в сочетании с эналаприлом или лозартаном в равной степени улучшает качество жизни, повышает толерантность к физической нагрузке, уменьшает частоту и продолжительность безболевой ишемии, приводит к нормализации суточного профиля АД, способствует улучшению агрегационной активности тромбоцитов, реологических свойств крови и липидного обмена.


