Одна из наиболее актуальных проблем последнего десятилетия – растущая резистентность Нelicobacter pylori (Н.р.) к противомикробным средствам, которые используются для эрадикации этого микроорганизма [1, 2].
Грамотрицательная спиралевидная хеликобактерия, заселяющая слизистую оболочку желудка, хорошо приспосабливается к желудочной кислой среде за счет мутации в условиях, неблагоприятных для ее проживания [1, 2]. Трансформируясь в кокковидную форму, H.p. способен выживать при продвижении через кишечник, попадать во внешнюю среду и сохраняться в ней. Основной путь инфицирования организма Н.р. – фекально-оральный, главный источник хеликобактерной инфекции – человек [3, 4].
Согласно региональным оценкам, в 2015 г. во всем мире было около 4,4 млрд человек с инфекцией H.p. При этом самая высокая ее распространенность наблюдалась в Африке (70,1%), а самая низкая – в Океании (24,4%) [5]. Если взять суммарные данные из различных регионов России, то инфекция Н.р. обнаруживается в настоящее время у 65–92% взрослого населения [6].
ПРИЧИНЫ И МЕХАНИЗМЫ РАЗВИТИЯ РЕЗИСТЕНТНОСТИ Н. PYLORI
Эрадикационная терапия (ЭТ) служит основой лечения заболеваний, ассоциированных с Н.р. Чем выше уровень инфицированности Н.р., тем выше вероятность развития хронического гастрита, язвенной болезни и других кислотозависимых и ассоциированных с Н.р. заболеваний; в связи с этим ЭТ входит во все современные рекомендации по их лечению [1, 2]. Коме того, в последние годы ЭТ признана одним из наиболее перспективных направлений канцеропревенции при злокачественных заболеваниях желудка [7, 6, 8].
Вместе с тем актуальной проблемой медицинской практики, отмеченной Всемирной организацией здравоохранения (ВОЗ) и различными международными и национальными ассоциациями гастроэнтерологов и терапевтов, является непрерывная тенденция к снижению эффективности общепринятых схем ЭТ [1, 2]. В первую очередь ее связывают с прогрессирующим ростом антибиотикорезистентности Н.р. [1, 2]. Причем если на ранних этапах применения ЭТ наблюдались лишь редкие случаи выявления резистентных штаммов Н.р., то в последнее десятилетие эта проблема приобретает всемирный масштаб [1, 2].
Главным фактором антибиотикорезистентности Н.р. выступает способность его генома к спонтанным мутациям, которые приводят к изменениям экспрессии и структуры белков, участвующих в рецепции, трансмембранном транспорте и метаболизме противомикробных средств [9].
Кроме того, в настоящее время установлено наличие у генетически однородной популяции бактерий фенотипической гетерогенности и пластичности, что при воздействии на нее бактерицидных доз антибиотиков обусловливает выживание малочисленной субпопуляции (0,001–1%) на фоне гибели большинства клеток [10, 11, 12]. Причиной этого феномена, впервые обнаруженного в 1942 г. при наблюдениях за гибелью культуры стафилококка, обработанной пенициллином, является переход малого числа клеток, генотипически чувствительных к антибиотикам, в фенотип выживания (персистенции) в присутствии противомикробного препарата [11, 13]. В соответствии с принятой точкой зрения, эти клетки, названные персистерами (persister – стойкая бактерия) [14], безразличны к наличию любых антибиотиков в их окружении. Впоследствии это явление устойчивости, отличное от классической антибиотикорезистентности, получило название множественной лекарственной толерантности (multidrug tolerance – MDT), или антибиотикотолерантности (АТ) [13, 15]. При этом в популяции генетически устойчивых антибиотикорезистентных клеток будет присутствовать небольшая субпопуляция клеток-персистеров, обеспечивающих выживание популяции при действии различных стрессорных факторов (противомикробных средств иной природы, других факторов микроокружения) [9]. В настоящее время феномен бактериальной персистенции, обеспечивающей устойчивость инфекции к антибиотикотерапии, подтвержден и для Н.р. [16].
Еще один важный механизм персистенции Н.р. и одна из наиболее вероятных причин низкой эффективности ЭТ – способность бактерий к формированию биопленки на поверхности слизистой оболочки желудка, которая обнаруживается, как правило, вблизи устьев желудочных желез [17]. Биопленка представляет собой структурированное сообщество бактериальных клеток, заключенных в продуцируемый ими самими полимерный матрикс и адгезированных к инертным или живым поверхностям [19]. По современным представлениям, именно способность к образованию биопленки обеспечивает колонизацию, персистенцию и патогенное воздействие микроорганизма [18].
В составе микробных сообществ выживаемость бактерий значительно увеличивается за счет повышенной устойчивости к факторам иммунной защиты человека и действию антимикробных препаратов [20]. Способность Н.р. к образованию биопленки как in vitro, так и в естественных условиях существования убедительно продемонстрирована в ряде оригинальных сообщений [17, 20, 21, 22]. Причем эта способность свойственна и так называемым кокковидным формам H.p. [23].
Важная особенность Н.р. заключается в том, что он заселяет трудно доступные для терапии участки слизистой оболочки желудка, а препятствием для биодоступности антибиотика является еще и кислая среда желудка. Поэтому обязательное включение в антихеликобактерную терапию ингибиторов протоновой помпы (ИПП) ведет к повышению возможности эрадикации, так как препараты этой группы изменяют интрагастральную рН в щелочную сторону [6].
Еще одно препятствие для эффективной ЭТ – пристеночная желудочная слизь, которая служит защитой для Н.р. и своеобразным барьером для противомикробного средства. Поэтому антибиотик должен назначаться в высокой концентрации и воздействовать на бактерию в течение достаточно длительного времени [1, 24].
В последние годы начато изучение генетических механизмов устойчивости Н.р. к противомикробным препаратам, что является перспективным научно-медицинским направлением [25].
H.P.-РЕЗИСТЕНТНОСТЬ К РАЗЛИЧНЫМ АНТИБИОТИКАМ
Тройная стандартная ЭТ (ИПП + кларитромицин + амоксициллин или метронидазол), или так называемая терапия I линии, является наиболее изученной и продолжает широко использоваться в практической медицине [26–30]. Однако в последнее время отмечается снижение ее эффективности до 60% [31, 32]. Этот феномен связывают со следующими факторами:
- резистентностью Н.р. к используемым препаратам [33, 34];
- персистированием в желудке высокопатогенных штаммов H.p., содержащих ген cagA и обладающих высокой адгезивной способностью к слизистой оболочке желудка [35];
- высокой степенью обсемененности желудка бактериями;
- наличием атрофического гастрита;
- возрастанием доли населения с повышенной массой тела;
- низким комплаенсом пациентов и даже с широким использованием дженериков в схемах ЭТ [36].
В пользу того, что встречаемость резистентных штаммов Н.р. коррелирует с количеством общего потребления населением антибиотиков, причем нередко бесконтрольного и необоснованного, свидетельствуют данные многочисленных исследований [37]. Так, показано, что у коренного населения Аляски повышенная резистентность к кларитромицину статистически достоверно была связана с применением макролидов в анамнезе, причем резистентность была тем выше, чем большее количество курсов лечения этими препаратами осуществлялось ранее [38].
В разных европейских странах проводились исследования, которые показали, что с 2000-х гг. средний уровень резистентности к кларитромицину в мире составляет 9,8% с колебаниями от 4,2% в странах на севере Европы до 18,4% в ее южных регионах [39, 40].
В 2017 г. ВОЗ определила проблему резистентности H.p. к кларитромицину как первоочередную задачу для исследований и разработки новых противомикробных средств. В связи с этим было проведено 178 исследований [41], включающих 66 142 изолята из 65 стран. Показатели первичной и вторичной резистентности к кларитромицину составляли ≥15% во всех регионах ВОЗ, за исключением Северной и Южной Америки (10%) и региона Юго-Восточной Азии (10%). Устойчивость к кларитромицину была в значительной степени связана с отказом от режимов терапии, содержащих этот антибиотик (отношение шансов 6,97; p <0,001). Что касается метронидазола, то показатели первичной и вторичной резистентности H.p. к этому противомикробному средству составляли также ≥15% [41].
В 2005 г. в Москве был зафиксирован уровень резистентности H.p. к кларитромицину 19,3% [42]. Однако эти показатели могут не отражать истинного положения вещей, поскольку выводы в отношении России, как правило, базируются на результатах изучения штаммов, полученных в Москве и Московской области. При этом в последние годы были проведены микробиологические исследования в ряде других регионов России, которые демонстрируют незначительные межрегиональные различия чувствительности Н.p. к антибиотикам.
Большинство отечественных авторов считает, что в России критический порог кларитромициновой резистентности в 20%, определенный IV Маастрихтским соглашением, не преодолен [43–46], и даже отмечается ее снижение [43, 47]. В настоящее время в России применение кларитромицина в составе I линии эрадикационной терапии Н.р. остается клинически оправданным, поскольку убедительных исследований, свидетельствующих о преодолении в большинстве регионов России критического порога устойчивости Н.р. к кларитромицину, на данный момент нет [48].
Исследования, проведенные в различных регионах России (и в разные годы) по изучению резистентности Н.р. к кларитромицину, представлены в таблице 1.
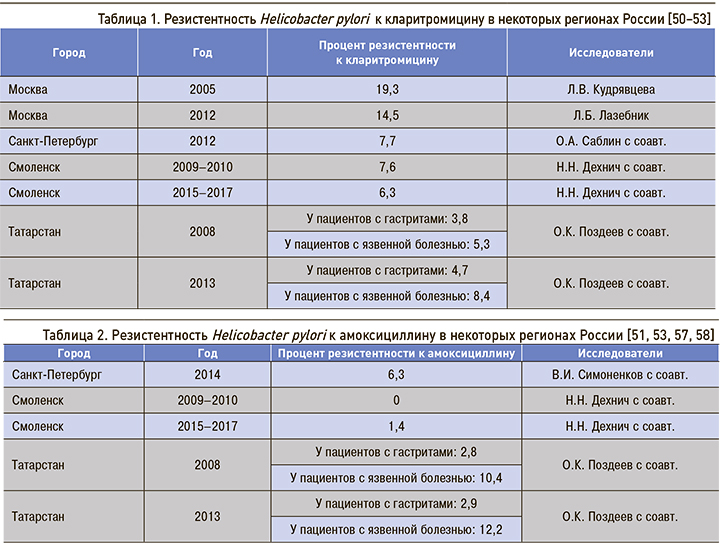
Антибиотикорезистентность характеризует определенную популяцию в определенном географическом регионе [49]. Тем не менее следующим, V Маастрихтским, соглашением эмпирически было снижено пороговое значение резистентности к кларитромицину до 15% [49].
Антибиотик амоксицилин из группы бета-лактамов, используемый для эрадикации H.p., обладает преимуществом перед макролидами: резистентность к нему практически не развивается или встречается очень редко [54].
В соответствии с данными Российской группы по изучению Н.p., у пациентов после проведенной ЭТ I линии было выделено три штамма H.p. со стабильной резистентностью к амоксициллину, а в последующие несколько лет штаммов, устойчивых к этому антибиотику, выявлено не было [55].
Европейское мультицентровое исследование антибиотикорезистентности Н.p. в 1990-х гг. в Италии, Германии и Великобритании установило, что показатели резистентности Н.p. к амоксициллину составляют 8,2; 4,0 и 1,2% соответственно [56]. Аналогичные данные по ряду регионов России приведены в таблице 2.
Российской группой по изучению H.p. еще в 1996 г. было обнаружено превышение среднеевропейского уровня резистентности этих бактерий к метронидазолу. В последующие годы в России доля штаммов, устойчивых к производным нитроимидазола, увеличивалась и к 1998 г. достигла 56,6%. [55]. Более актуальные данные об устойчивости H.p. к метронидазолу в некоторых регионах России отражены в таблице 3. Данная информация свидетельствует о том, что целесообразность назначение метронидазола в составе стандартной трехкомпонентной антихеликобактерной терапии I линии сомнительна. В то же время в IV Маастрихских соглашениях была отмечена эффективность схемы «ИПП + метронидазол + кларитромицин», причем она была признана эквивалентной схеме «ИПП + кларитромицин + амоксицилин» (уровень доказательности 1а, степень рекомендации А) [58].

СХЕМЫ И ВАРИАНТЫ АНТИХЕЛИКОБАКТЕРНОЙ ТЕРАПИИ
Согласно рекомендациям Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции H.p. у взрослых, опубликованным в 2012 г. и обновленным в 2017 г. после дискуссии в рамках 23-й Объединенной Российской гастроэнтерологической недели, а также в соответствии с VI Национальными рекомендациями по диагностике и лечению кислотозависимых и ассоциированных с Н.р. заболеваний (VI Московские соглашения), принятых XVI съездом Национального общества гастроэнтерологов России (НОГР) и XI Национальным конгрессом Российского научного медицинского общества терапевтов (РНМОТ) в 2016 г., в состав ЭТ I линии входит один из следующих ИПП:
- лансопразол – 30 мг 2 раза/сут;
- омепразол – 20 мг 2 раза/сут;
- пантопразол – 40 мг 2 раза/сут;
- рабепразол – 20 мг 2 раза/сут;
- эзомепразол – 20 мг 2 раза/ сут.
К антибиотикам для ЭТ I линии отнесен амоксициллин (по 1000 мг 2 раза/сут) в сочетании с кларитромицином (по 500 мг 2 раза/сут), которые применяют в течение 14 дней, если эффективность 10-дневной терапии не доказана локальными исследованиями [1, 2].
При сочетанном применении с ИПП наблюдается рН-зависимое увеличение антихеликобактерной эффективности амоксициллина с уменьшением минимальной подавляющей концентрации (МПК) по отношению к H.p.
V Маастрихтским соглашением представлено несколько причин уменьшения эффективности препаратов, входящих в тройную схему эрадикации «ИПП + кларитромицин + амоксициллин или метронидазол». Это высокая кислотность, высокое обсеменение желудка хеликобактериями, виды штаммов и возрастание резистентности H.p. к кларитромицину. Основанная на кларитромицине терапия считалась наиболее переносимой и безопасной, однако увеличение уровня устойчивости к антибиотику привело к снижению ее результативности [59]. По мнению ряда авторов, эта терапия должна быть зарезервирована для тех географических областей, где устойчивость к кларитромицину составляет менее 15%, а также для пациентов без предшествующего широкого использования макролидного антибиотика [28–30].
Так, если IV Маастрихтское соглашение считало низкой резистентность к кларитромицину в пределах 15–20%, то V консенсус рекомендует определять низкую резистентность на уровне не выше 15%. В некоторых случаях уровень эрадикации может быть заведомо известен, если знать ее частоту для чувствительных и резистентных штаммов и распространенность резистентности в популяции. Для определения индивидуальной антибиотикорезистентности необходимо как знание приема пациентом конкретных антибиотиков в анамнезе, так и осведомленность об уровне резистентности к этим антибиотикам у населения региона, где данный пациент проживает.
Китайскими учеными [60] проводилось исследование, в которое были включены больные с безуспешной ЭТ I линии (ИПП + кларитромицин + метронидазол или амоксициллин): в нем определялась чувствительность H.р. с посевом культуры. По результатам этого исследования у 97% больных была зафиксирована резистентность к этому препарату. С учетом высокой резистентности H.p. к метронидазолу кларитромицин был также расценен исследователями как препарат с высокой резистентностью H.р., поскольку он входит в ЭТ I линии.
Возможно, принимая во внимание эти факты, итальянские ученые [61, 62] предприняли многоцентровое исследование эффективности 10-дневной двойной схемы лечения: эзомепразол по 40 мг 2 раза в день + амоксициллин по 1000 мг 2 раза в день. Частота эрадикации H.p. при приеме такой комбинации составила 87,5%. При этом следует отметить, что двойная терапия не указана как возможная к применению даже в итальянском соглашении по лечению хеликобактерной инфекции [63]. В последние годы чаще применяется один из вариантов гибридной антихеликобактерной терапии [28], включающий элементы эрадикационной схемы I линии: в первые 7 дней – омепразол по 40 мг 2 раза/сут + амоксициллин по 1000 мг 2 раза/ сут (7 дней); в последующие 7 дней – омепразол по 40 мг 2 раза/сут + амоксициллин по 1000 мг 2 раза/сут + кларитромицин по 500 мг 2 раза/сут + производное 5-нитроимидазола по 500 мг 2 раза/ сут. Подчеркнем также, что, если раньше использовались стандартные дозы ИПП, в настоящее время назначаются максимальные дозировки (40 мг 2 раза/сут), причем предпочтение отдается эзомепразолу [61].
В Италии было предложено два варианта антихеликобактерной терапии:
- Сопутствующая квадротерапия: эзомепразол по 40 мг 2 раза/сут + амоксициллин по 1000 мг 2 раза/сут + левофлоксацин по 500 мг 2 раза/сут + тинидазол по 500 мг 2 раза/сут в течение 5 дней.
- Последовательная терапия: эзомепразол по 40 мг 2 раза/сут + амоксициллин по 1000 мг 2 раза/ сут в течение 5 дней, затем эзомепразол по 40 мг 2 раза/сут + левофлоксацин по 500 мг 2 раза/сут + тинидазол по 500 мг 2 раза/сут на протяжении еще 5 дней.
По результатам лечения частота эрадикации как в первом, так и во втором случае не превышала 90% [64].
Исследователи из Испании, применив ЭТ с двойной дозой ИПП в течение 14 дней, обозначили ее как оптимизированную сопутствующую терапию [65]. Это название в дальнейшем стало использоваться другими исследователями как понятие, определяющее повышение частоты успешного лечения инфекции H.р. С точки зрения эффективности и безопасности сравнивались два оптимизированных варианта эрадикации – тройная и сопутствующая терапия [66]. В первом случае пациенты в течение 14 дней получали эзомепразол (по 40 мг 2 раза/сут) + кларитромицин (по 500 мг 2 раза/ сут) + амоксициллин (по 1000 мг 2 раза/ сут). Во втором случае схема терапии включала эзомепразол (по 40 мг 2 раза/сут) + кларитромицин (по 500 мг 2 раза/сут) + амоксициллин (по 1000 мг 2 раза/сут) + метронидазол (по 500 мг 2 раза/сут), которые также применялись в течение 14 дней. Чувствительность к антибиотикам и метронидазолу не определялась. При оптимизированном тройном варианте терапии частота эрадикации H.p. составила 82,3%, а при сопутствующей терапии – 93,8% (р <0,001). Частота же побочных эффектов при сопутствующей терапии была выше, чем при тройной: 47 против 39%.
В странах с высокой резистентностью к кларитромицину (20% и более) используется квадротерапия с ИПП, препаратом висмута и двумя противомикробными средствами из следующего списка: фуразолидон, тетрациклин, амоксициллин, метронидазол. При ее применении частота эрадикации H.p. составляет 90%.
В России хорошие результаты дает квадротерапия в виде следующей схемы: ИПП + коллоидный субцитрат висмута + амоксициллин + фуразолидон. При ее использовании в течение 14 дней эрадикация H.p. составляла 80% [67].
Таким образом, если в регионе зафиксирована низкая резистентность к кларитромицину (менее 15%), то тройная терапия (ИПП + кларитромицин + амоксициллин или ИПП + кларитромицин + метронидазол) может использоваться в течение 14 дней как терапия I линии без предварительного определения чувствительности к кларитромицину. Также обосновано применение в качестве терапии I линии 14-дневной квадротерапии: ИПП + коллоидный субцитрат висмута + амоксициллин + фуразолидон.
ЗАКЛЮЧЕНИЕ
Таким образом, проблема эффективности ЭТ при заболеваниях, ассоциированных с инфекцией Н.р., остается актуальной и требует в первую очередь поиска причин ее снижения. Несомненно, среди этих причин наиболее значимо возрастание антибиотикорезистентности, что в большей или меньшей степени наблюдается исследователями во всех регионах земного шара.
В связи с тем что ЭТ I линии до настоящего времени широко используется в практической медицине, а наиболее уязвимым с точки зрения развития резистентности Н.р. противомикробным средством является кларитромицин, V Маастрихтскими соглашениями и последними Российскими рекомендациями по лечению заболеваний, ассоциированных с хеликобактериозом, рекомендовано определять пороговую резистентность к этому антибиотику на уровне не выше 15%.
Учитывая, что, по имеющимся данным литературы, в России доля штаммов Н.р., резистентных к кларитромицину, пока не превышает указанного порога, использование кларитромицина в схемах ЭТ полностью оправданно. При этом одной из приоритетных задач медицинской науки следует считать проведение широких исследований, направленных на установление порога антибиотикорезистентности штаммов Н.р. к ведущим антибиотикам, используемым в схемах ЭТ, в федеральном масштабе. Перспективным и актуальным также можно считать углубление знаний о различных механизмах антибиотикорезистентности и антибиотикотолерантности Н.р. и разработка новых схем ЭТ, направленных на их преодоление.



