СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
- АГ – артериальная гипертония
- АГТ – антигипертензивная терапия АГП – антигипертензивные препараты АД – артериальное давление
- АМКР – антагонисты минералокортикоидных рецепторов
- АПФ – ангиотензинпревращающий фермент АТI – ангиотензин I
- АТII – ангиотензин II
- АТ1-рецептор – рецептор ангиотензина II 1-го типа АТ2-рецептор – рецептор ангиотензина II 2 -го типа АФК – активные формы кислорода
- АЦП – ацилгидроперекиси АУ – альбуминурия
- БАБ – β-адреноблокаторы
- БКК – блокаторы кальциевых каналов
- БРА – блокаторы рецепторов ангиотензина II ДАД – диастолическое артериальное давление ДДАХ – длительно действующий антихолинергический препарат
- ДДБА – длительно действующий β2-агонист ДН – дыхательная недостаточность
- ДЭ – дисфункция эндотелия ИАГ – индекс апноэ/гипопноэ
- ИАПФ – ингибиторы ангиотензинпревращающего фермента
- ИБС – ишемическая болезнь сердца
- ИГКС – ингаляционный глюккокортикостероид ИЛ – интерлейкин
- ИМ – инфаркт миакарда ИМТ – индекс массы тела
- НМК – нарушение мозгового кровообращения КДАХ – коротко действующий антихолинергический препарат
- КДБА – коротко действующий β2-агонист КТ – компьютерная томография
- ЛЖ – левый желудочек
- ЛПНП – липопротеины низкой плотности ОААС – общая антиоксидантная активность (емкость) сыворотки крови
- ОАС – обсруктивное апноэ сна
- ОФВ1 – объем форсированного выдоха за первую секунду
- ОФВ1/ФЖЕЛ – объем форсированного выдоха за первую секунду/форсированная жизненная емкость легких
- ПЖ – правый желудочек
- ПОЛ – перекисное окисление липидов ПООГ – поражение органов, обусловленное гипертензией
- РААС – ренин-ангиотензин-альдостероновая система
- РКИ – рандомизированное контролируемое исследование
- САД – систолическое артериальное давление САС – симпатоадреналовая система
- СМАД – суточное мониторирование АД СНС – симпатическая нервная система СКФ – скорость клубочковой фильтрации СОД – супероксиддисмутаза
- СрАД – среднее АД
- СРБ – C-реактивный белок
- ССЗ – сердечно-сосудистые заболевания ССС – сердечно-сосудистые события ТИА – транзиторная ишемическая атака ФНО-α – фактор некроза опухоли альфа ХБП – хроническая болезнь почек
- ХНЗЛ – хронические неспецифические заболевания легких
- ХОБЛ – хроническая обструктивная болезнь легких ХСН – хроническая сердечная недостаточность ЧДД – частота дыхательных движений
- ЧСС – частота сердечных сокращений
- GOLD – Global initiative for Chronic Obstructive Lung Disease
- CAT – оценочный тест ХОБЛ (COPD Assessment Test)
- ICAM-1 и VCAM-1 – молекулы межклеточной адгезии
- MCP-1 – моноцитарный хемотаксический протеин–1
- MCH-II – главный комплекс гистосовместимости класса II
- mMRC – шкала одышки (Medical Research Council Dyspnea Scale)
- PaCO2 – парциальное давление углекислого газа в артериальной крови
- PaO2 – парциальное давление кислорода в артериальной крови
- ROS – активные формы кислорода SaO2 – сатурация кислорода
- NO – оксид азота
- Ve/Va – показатель диастолической дисфункции левого желудочка
1. ВВЕДЕНИЕ
Цель настоящих рекомендаций – ознакомить врачей первичного звена с современными данными по ведению пациентов с хронической обструктивной болезнью легких (ХОБЛ) и артериальной гипертензией (АГ), сформулировать диагностические подходы, алгоритмы ранней диагностики, принципы немедикаментозной и лекарственной терапии.
Рекомендации являются актуальными для врачей общей практики, терапевтов, пульмонологов, кардиологов, представляют интерес для врачей других специальностей.
Медицинская и социальная значимость ХОБЛ и АГ не вызывают сомнений. К сожалению, в большинстве случаев практикующие врачи мало информированы о сущности коморбидности ХОБЛ и АГ, затрудняются дать пациенту обоснованные рекомендации по коррекции образа жизни, не владеют технологией медикаментозной и немедикаментозной терапии. Одной из причин недостаточной осведомленности терапевтов является отсутствие единых терминологических и классификационных подходов. Также существуют разногласия относительно рациональных путей диагностики и лечения пациентов ХОБЛ и АГ.
Внедрение в повседневную клиническую практику терапевта данных рекомендаций позволит унифицировать подходы к эффективному лечению пациентов с артериальной гипертензией и ХОБЛ. Предполагается, что рекомендации будут совершенствоваться по мере накопления научных знаний и практического опыта.
Основные положения рекомендаций базируются не только на мнении экспертов, но и на результатах рандомизированных клинических исследований (РКИ). В настоящее время принято указывать класс конкретной рекомендации, уровень ее доказательности. Это дает основу, позволяющую сравнивать состояние научного знания в разных областях медицины. Некоторые рекомендации вынужденно исходят из соображений здравого смысла и личного клинического опыта, хотя и то, и другое может быть ошибочными. Понимание этого поможет врачу не воспринимать рекомендации как императивные. Это будет способствовать проведению исследований по тем аспектам проблемы, где превалируют мнения, а не доказательные данные.
При подготовке настоящих рекомендаций были использованы рекомендаций Европейского общества кардиологов (ESC), Европейского общества по гипертонии (ESH), Европейского респираторного общества (ERS), а также рекомендации Российского медицинского общества по артериальной гипертонии и Российского респираторного общества «Диагностика и лечение пациентов с артериальной гипертонией и хронической обструктивной болезнью легких» 2013 г.
Проект Рекомендаций был открыт для широкого обсуждения, что позволило существенно уточнить многие позиции, упростить и улучшить текст. Замечания и дополнения, которые были конструктивными и способствовали реальному усовершенствованию документа, мы использовали при подготовке его окончательной редакции.
2. ПРОБЛЕМА КОМОРБИДНОСТИ В ТЕРАПЕВТИЧЕСКОЙ ПРАКТИКЕ
Одно из ведущих мест в реальной клинической практике занимает сочетанная патология, которая требует изучения и выработки новых подходов к диагностике, ведению и лечению больных с наличием нескольких значимых заболеваний. Под коморбидностью понимают одновременное поражение двух или более органов и систем человеческого организма. Известны два клинических варианта:
- синтропия (поражение органов под влиянием общих патогенетических факторов);
- интерференция (возникновение одного заболевания под влиянием другого).
Термин коморбидность, введенный A. Feinstein в 1970 г., подразумевает отдельные заболевания, которые существуют или развиваются на фоне основного заболевания и носят вторичный, «подчиненный» характер. При этом основное и коморбидные заболевания, как правило, имеют единые этиологические факторы и патогенетические механизмы и не исключается их взаимное влияние на течение, лечение и прогноз. В последние годы появился термин «мультиморбидность» как своеобразная альтернатива коморбидности; он носит более «демократичный» характер, подразумевая сосуществование двух и более заболеваний, при отсутствии какой-либо привилегированности одного из них. При этом предлагается оценивать клиническую симптоматику как целостный, суммарный результат сочетанной патологии [1–3].
АГ и ХОБЛ относятся к группе хронических неинфекционных болезней. Отмечается неуклонный рост распространенности этих заболеваний в общей популяции, что вносит свой вклад в рост смертности от сердечно-сосудистой и бронхолегочной патологии во всем мире.
Наглядным примером актуальности и важности проблемы коморбидных состояний служит ХОБЛ, представления о которой претерпели в последнее десятилетие революционные изменения. Одним из ключевых положений является утверждение о коморбидности как неотъемлемой черте данного заболевания. Лидирующее положение по распространенности и влиянию на прогноз больных ХОБЛ занимают коморбидные сердечно-сосудистые заболевания (ССЗ), среди которых наиболее часто встречается АГ [4–8].
В среднем у пациентов с ХОБЛ выявляются ≥2 хронических заболеваний, которые имеют неблагоприятное прогностическое значение [9].
3. ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ: ЭПИДЕМИОЛОГИЯ, ДЕФИНИЦИИ, ФЕНОТИПЫ
3.1. Определение ХОБЛ
22 октября 2018 г. на 7 Международной конференции по ХОБЛ в Риме (Италия) был принят новый Доклад рабочей группы по «Глобальной стратегии диагностики, лечения и профилактики ХОБЛ» (GOLD), который стал результатом длительной совместной работы представительной группы международных экспертов. Доклад базируется на результатах современных научных исследований с высоким уровнем доказательности, опубликованных до июля 2018 г. [10].
ХОБЛ является распространенным, предотвратимым и поддающимся лечению гетерогенным заболеванием, которое характеризуется стойкими респираторными симптомами с ограничением воздушного потока, связанными с изменениями структуры дыхательных путей и/или альвеол по причине регулярного/значительного воздействия вредных частиц или газов.
Длительно существующее хроническое воспаление вызывает деструкцию паренхимы легкого (с развитием эмфиземы) и нарушает нормальные восстановительные и защитные механизмы, препятствующие фиброзу мелких бронхов. Стойкое ограничение скорости воздушного потока является суммарным результатом болезни мелких бронхов (обструктивный бронхиолит) и деструкции паренхимы, вклад которых варьирует от пациента к пациенту. Более того, абнормальное воспаление способствует структурным изменениям в виде сужения воздушных путей и разрушения легочной паренхимы. Утрата структуры мелкими бронхами усиливает ограничение возможности проведения воздушного потока и дренажа слизи (мукоцилиарного клиренса), что закономерно усиливает респираторные симптомы заболевания: одышку, кашель, экспекторацию мокроты. В ряде случаев характерные респираторные симптомы предшествуют выраженному ограничению воздушного потока, что связано с обострением заболевания. Однако они могут наблюдаться и у пациентов с нормальными спирометрическими показателями, поскольку значительное число курильщиков без признаков ограничения воздушного потока имеют структурные нарушения (эмфизема), утолщение стенок дыхательных путей и обширные «воздушные ловушки» [11, 12].
3.2. Фенотипы ХОБЛ
Очевидно, что существующая гетерогенность клинических симптомов у пациентов ХОБЛ, ее системный, полиорганный характер, различные темпы прогрессирования болезни, частота обострений, вариабельный ответ на базисную бронхолитическую терапию, наличие разнообразных сопутствующих заболеваний в пределах одной и той же стадии заболевания не могут быть объяснены только прогрессирующим снижением легочной функции, падением объема форсированного выдоха за первую секунду маневра (ОФВ1). Это означает, что для адекватной оценки клинического многообразия ХОБЛ, прогноза и исхода заболевания, выбора эффективных терапевтических стратегий необходимо формирование представлений о фенотипе ХОБЛ [13].
В современных условиях в понятие фенотипа ХОБЛ входит определенный признак или совокупность таковых, которые характеризуют отличия у больных ХОБЛ:
- клинические исходы заболевания;
- симптомы и их выраженность;
- частота обострений;
- темпы прогрессирования болезни;
- смертность.
Перечень этих характерных групповых признаков может быть дополнен определенным рентгенологическим паттерном, биомаркерами воспаления, различным сочетанием внелегочных системных проявлений и коморбидной патологии, и в идеале для каждого фенотипа предполагается наличие сходного эффекта от терапии ХОБЛ [13, 14].
Предложенные принципы выделения фенотипов значительно расширяют возможности классификации гетерогенной популяции больных ХОБЛ, являются перспективными для дальнейшего изучения патогенетических, патофизиологических и патоморфологических механизмов, составляющих основу формирования различных клинических вариантов течения заболевания, а следовательно, будут способствовать дальнейшему развитию и поиску новых эффективных методов лечения данной патологии.
По-прежнему представляет интерес детальное исследование двух основных фенотипов, известных с 1947 г., обозначаемых как «розовые пыхтелки» (эмфизематозный) и «синие с кашлем» (бронхитический). В настоящее время установлено, что эти две категории пациентов c ХОБЛ различаются не только по возрасту, степени тяжести бронхиальной обструкции, темпам падения легочной функции, выраженности эмфиземы и гиперинфляции, совокупности внелегочных системных проявлений (включая нарушения нутритивного статуса), причинам смертности, но и по частоте встречаемости сопутствующих сердечно-сосудистых заболеваний (ССЗ). Больные, относящиеся к бронхитическому типу ХОБЛ, как правило, имеют меньшую степень обструктивных нарушений, но чаще страдают ССЗ, среди которых преобладает АГ (у 58–62% пациентов). Соответственно эта категория пациентов имеет повышенный риск смерти от ССЗ, в то время как у больных, относящихся к эмфизематозному фенотипу, основной причиной смерти являются осложнения ХОБЛ [15–19].
Наличие большой когорты больных ХОБЛ с ССЗ определенным образом связано с повышенной предрасположенностью к развитию атеросклероза у этой категории пациентов. Не исключается существование вполне определенного отдельного фенотипа больных ХОБЛ с ССЗ, у которых атеросклеротический процесс имеет свои индивидуальные особенности. Исследования, проведенные J.R. Enriquez et al., выявили отличительные черты коронарного атеросклероза у больных ХОБЛ в виде многососудистого типа поражения с меньшим количеством окклюзий коронарных артерий, но имеющего большую распространенность по сравнению с больными, не страдающими ХОБЛ [20]. Данный диффузный вариант коронарного атеросклероза, ассоциированный с ХОБЛ, менее перспективный для интервенционных методов лечения и имеющий худший прогноз, является аргументом в пользу наличия отдельного клинического варианта течения ХОБЛ или фенотипа – ХОБЛ и атеросклероз [21].
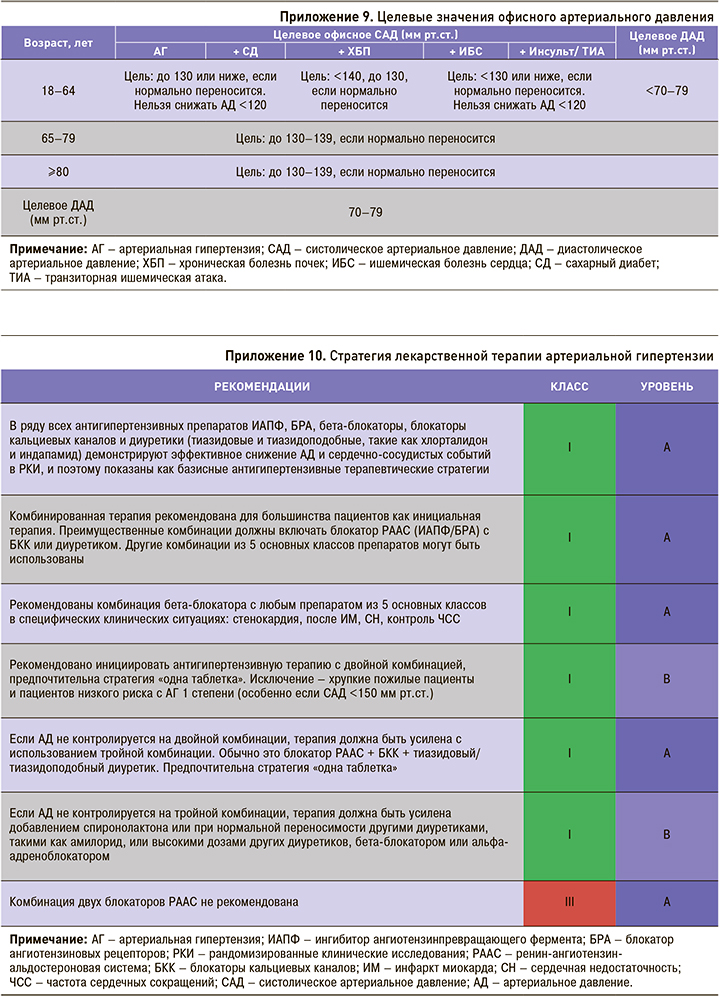
Более того, установлены взаимосвязи между обменными процессами, нутритивным статусом и фенотипами, существенно изменяющими объем и характер медикаментозной терапии. Так, принято выделять «кахектический» фенотип (по сути эмфизематозный) и «метаболический» фенотип (по сути бронхитический), принципиально различные по выраженности обострений и смертности пациентов ХОБЛ (рис. 1) [21].
Одно из объяснений патологического диффузного атеросклеротического ремоделирования коронарных сосудов – неконтролируемая экспрессия провоспалительных цитокинов, активация системы протеиназ с повышенной выработкой металлопротеиназы, особенно во время обострений ХОБЛ, которые создают подходящую микросреду для повреждения сосудистой стенки [20, 23–29].
Таким образом, возрастающее количество пациентов с сочетанием ХОБЛ и ССЗ, расширение сведений о взаимовлиянии и взаимозависимости коморбидных состояний, появившиеся новые данные о влиянии дополнительных (помимо уровня ОФВ1) факторов на прогноз у больных ХОБЛ, среди которых важная роль отводится патологии сердечно-сосудистой системы, а также доказанная роль ХОБЛ как независимого фактора риска кардиальной патологии определяет необходимость дальнейшего детального исследования данной сочетанной патологии с целью разработки новых терапевтических стратегий [30].
3.3. Диагностические критерии и классификация ХОБЛ
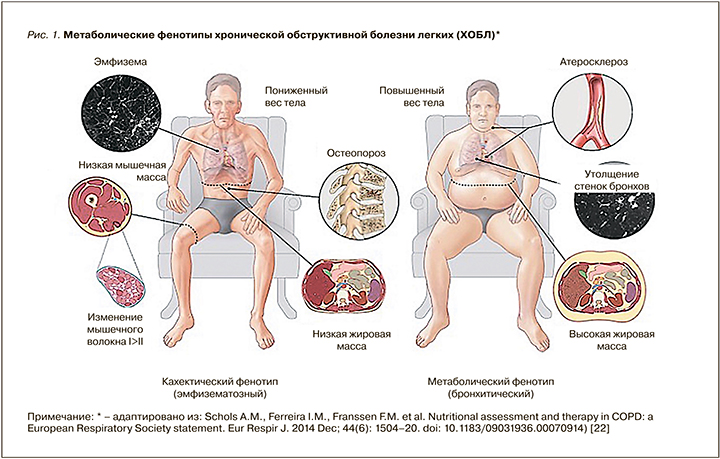
На сегодня классификационная матрица ХОБЛ предназначена для определения объема лекарственной и немедикаментозной терапии пациентов со стабильным течением в зависимости от выраженности симптомов и количества обострений болезни. Алгоритм диагностики построен на сочетании клинической оценки респираторных симптомов по шкале влияния болезни на пациента (COPD Assessment Test (CAT™)), истории частоты обострений и данных спирометрии (обструкция по ОФВ1, воздушная ловушка по ОФВ1/ФЖЕЛ) [5]. Ключевые клинические показатели для диагностики ХОБЛ представлены в табл. 1.
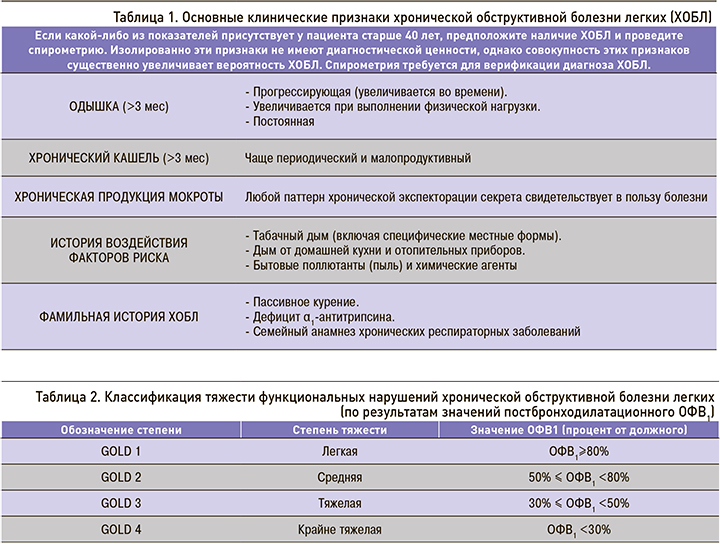
Спирометрия необходима для установления клинического диагноза ХОБЛ. Наличие постбронходилатационного отношения ОФВ1/ФЖЕЛ<0,70 подтверждает наличие воздушной ловушки и ХОБЛ. Снижение постбронходилатационного ОФВ1 в процентах от должного служит критерием степени тяжести функциональных нарушений при ХОБЛ (табл. 2).
Необходимым условием выполнения алгоритма является оценка степени одышки по шкале mMRC (Medical Research Council Dyspnea Scale – mMRС™) и выраженности симптомов по шкале CAT™ (см. приложение 1, 2). При значениях mMRC <2 баллов и САТ <10 баллов пациент признается «малосимптомным», а при mMRC ≥2 баллов и САТ ≥10 баллов «значительно симптомным». Число обострений болезни за год (по истории болезни) ≥2 или ≥1 с госпитализацией оценивается как высокий риск, менее указанного порога – низкий риск (рис. 2).
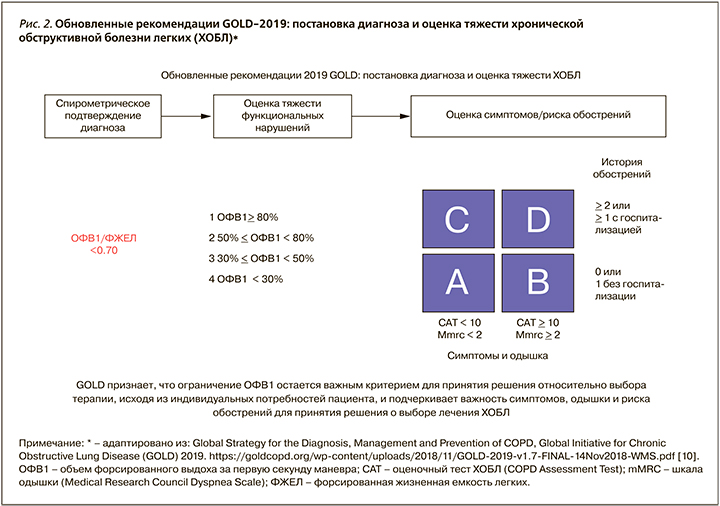
Необходимо отметить, что предлагаемый принцип разделения пациентов на группы А, B, С, D является стратификационным, т.е. разделяющим выборку на категории (страты) в соответствии с определенными критериями. Стратификация используется в основном для контроля над вмешивающимися факторами и выявления модификаторов эффекта. Обоснованность существования такого принципа обусловлена отсутствием прямой взаимосвязи между величиной ОФВ1 и степенью выраженности симптомов болезни, а также невозможностью установления стадии заболевания (стадия болезни обычно используется для объяснения тяжести заболевания и отрицательных прогностических факторов). В случае пациентов ХОБЛ именно стратификационный подход с выделением групп А, B, С, D позволяет наиболее точно определить объем и характер базисной терапии, предложить стратегию воздействия на модифицирующие и прогностические факторы заболевания, дать характеристику ожидаемых последствий ХОБЛ [31].
Использование стратификационных показателей, согласно Российским национальным рекомендациям 2017 г., для практических нужд допустимо, но формулировка диагноза должна включать указание на преобладающий фенотип, степень тяжести вентиляционных нарушений (COLD), степень влияния болезни на качество жизни (САТ), частоту обострений (в год) и степень дыхательной недостаточности (см. приложение 3) [32].
Современный принцип классификации расширяет возможности эффективного «менеджмента» широкой популяции больных ХОБЛ и является перспективным для дальнейшего изучения патогенетических, патофизиологических и патоморфологических механизмов, составляющих основу формирования разных клинических вариантов течения ХОБЛ.
Ключевые положения, блок 1:
- Распространенность ХОБЛ во взрослой популяции составляет 10–12%.
- Для адекватной оценки клинического многообразия ХОБЛ, прогноза и исхода заболевания, выбора эффективных терапевтических стратегий необходимо внедрение принципа фенотипирования ХОБЛ.
- Классические эмфизематозный («кахектический») и бронхитический («метаболический») фенотипы ХОБЛ имеют принципиальные различия не только по клинически значимым характеристикам заболевания, но и по распространенности коморбидной сердечно-сосудистой патологии и причинам смертности.
- Алгоритм диагностики ХОБЛ построен на сочетании клинической оценки респираторных симптомов, истории частоты обострений и данных спирометрии.
- Классификационная матрица ХОБЛ предназначена для определения объема лекарственной и немедикаментозной терапии пациентов со стабильным течением в зависимости от выраженности симптомов заболевания и количества ежегодных обострений болезни.
4. АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
4.1. Эпидемиология артериальной гипертензии, контроль в общей популяции
АГ – наиболее часто встречающееся неинфекционное заболевание в общей популяции. Распространенность АГ среди взрослого населения составляет 30–45% [33].
АГ служит одним из основных факторов риска развития ССЗ [34].
Несмотря на совершенствование подходов к диагностике и ведению АГ, постоянную коррекцию тактики назначения антигипертензивной терапии (АГТ), проблема контроля артериального давления (АД) в популяции больных АГ не теряет своей актуальности [35, 36]. По данным крупных эпидемиологических исследований, встречаемость АГ в российской популяции пациентов не снижается и составляет около 40%. Доля пациентов с целевым уровнем АД составляет 27–30% среди женщин и 14–18% среди мужчин [37, 38]. В проспективном эпидемиологическом исследовании (The Prospective Urban Rural Epidemiologic (PURE) study, 2012), в котором изучалась распространенность, осведомленность и контроль АГ в широкой популяции пациентов в различных странах, также приводятся данные по недостаточному контролю над АГ у леченых больных –32,5%. Среди факторов, влияющих на эффективность контроля над АД, ведущими называются экономический статус страны, место проживания (деревня, город), образование пациентов [33].
Возникает диссонанс между накопленным международным опытом и реальной клинической практикой. Одним из возможных путей преодоления сложившейся ситуации служит индивидуализация подходов к лечению АГ с подбором антигипертензивных препаратов, исходя из конкретной клинической ситуации, с учетом сопутствующей и ассоциированной патологии.
АГ часто сочетается с другими заболеваниями, такими как диабет, хроническая болезнь почек, бронхиальная астма, ХОБЛ. Наличие коморбидной с АГ патологии диктует необходимость коррекции стратегии менеджмента АГ (диагностика, лечебная тактика).
4.2. Классификация артериальной гипертензии, оценка общего сердечно-сосудистого риска
Накопленный клинический опыт, результаты международных исследований позволили сформулировать достаточно четкие подходы к классификации, диагностике АГ, стратификации сердечно-сосудистого риска, терапии и профилактике АГ и ее осложнений, которые изложены в европейских рекомендация по ведению АГ 2018 г. [35] и обсуждаются в меморандуме экспертов РКО 2018 г. [39].
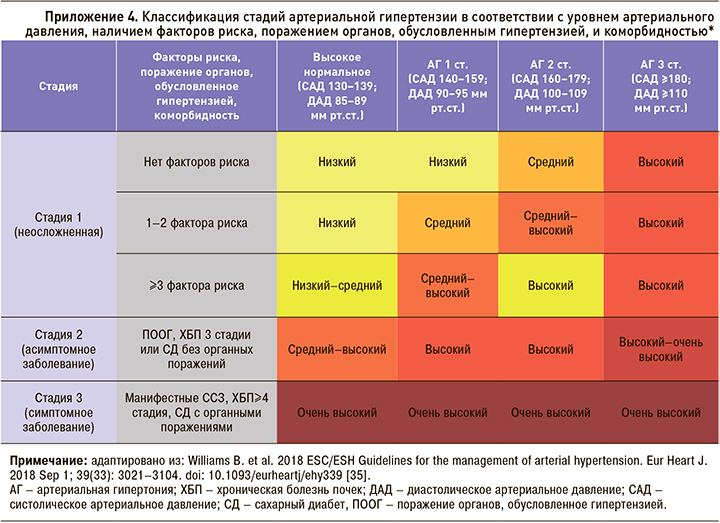
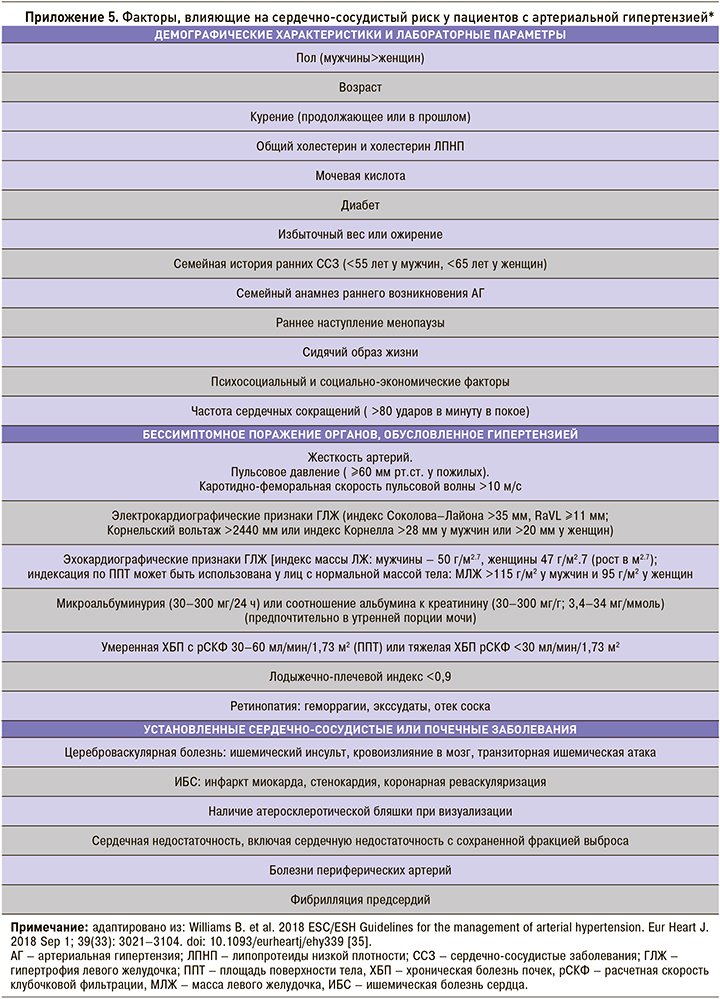
Концепция стратификации сердечно-сосудистого риска при АГ включает определение факторов риска, диагностику бессимптомного поражения органов мишеней (поражение органов, обусловленное гипертензией – ПООГ) с учетом наличия уже имеющихся ССЗ, поражения почек и сахарного диабета. Классификации факторов риска и критериев поражения органов-мишеней динамически пересматриваются; в настоящее время приняты критерии, утвержденные в европейских рекомендациях по ведению АГ 2018 г. [35] (см. приложение 4, 5). Несмотря на то что ХОБЛ ассоциирована с развитием сердечно-сосудистой патологии, рассматривается многими экспертами как состояние высокого сердечно-сосудистого риска, ХОБЛ не включена в современные схемы стратификации рисков.
Ключевые положения, блок 2:
- АГ – наиболее часто встречающееся неинфекционное заболевание в общей популяции. Ее распространенность среди взрослого населения составляет 30–45%.
- АГ часто ассоциирована с другими заболеваниями. Наличие коморбидной с АГ патологии диктует необходимость коррекции стратегии менеджмента АГ.
- Несмотря на признание ХОБЛ состоянием высокого сердечно-сосудистого риска, это заболевание не включено в современные схемы стратификации рисков.
5. АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ И ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ
5.1. Хроническая обструктивная болезнь легких как состояние высокого сердечно-сосудистого риска
В настоящее время наблюдается значительный рост заболеваемости и смертности от ХОБЛ в мире. За период 1990–2000 гг. благодаря развитию интервенционной кардиологии, разработке и применению новых кардиологических препаратов и профилактических стратегий смертность от ССЗ в целом и от инсульта в мире снизилась на 19,9 и 6,9% соответственно, а смертность от ХОБЛ возросла на 25,5%, особенно среди женщин [40]. Анализ смертности от 235 причин среди 20 возрастных групп населения земного шара в 1990 и 2010 г., опубликованный в декабре 2012 г. в журнале Lancet, демонстрирует, что ХОБЛ поднялась с 4-го на 3-е место в списке причин смерти в мире [41]. На данный момент можно констатировать, что ХОБЛ – это нозология, смертность от которой продолжает увеличиваться [42].
Изучение причин смертности пациентов с ХОБЛ дало основание говорить и о «внелегочных» причинах, на долю которых приходится около 50% случаев. D.M. Mannino et al. проанализировали смертность среди пациентов, умерших с диагнозом ХОБЛ с 1979 по 1993 г. Меньше чем в половине случаев (43,3%) ХОБЛ служила основной причиной смерти. В остальных случаях летальный исход был результатом ССЗ, опухолей и необструктивных болезней дыхательной системы, лидировали острый инфаркт миокарда, другие осложнения ишемической болезни сердца (ИБС) и рак легкого [43]. По данным различных авторов, от 25,0 до 48,8% всех случаев смерти у больных ХОБЛ составляют ССЗ, 23,3% – дыхательная недостаточность, 20,9% – рак легкого [44]. Аналогичные данные по значимости ССЗ как причин смертности пациентов с ХОБЛ продемонстрированы в работе отечественных авторов [45].
По данным эпидемиологических исследований установлено, что прогрессирующее снижение функции легких является столь же сильным предиктором сердечно-сосудистой смертности, как и основные кардиоваскулярные факторы риска. В исследование The Lung Health Study (5887 курильщиков в возрасте 35–60 лет с умеренной степенью бронхиальной обструкции) установлено, что 10%-ное уменьшение ОФВ1 увеличивало общую смертность на 14%, сердечно-сосудистую смертность – на 28%, риск развития ИБС – на 20% [46].
ССЗ – одни из самых частых и серьезных заболеваний, развивающихся у больных ХОБЛ, влияющих на качество и продолжительность жизни этих пациентов [4, 5, 47–50]. Риск развития ССЗ у больных ХОБЛ в 2–3 раза выше, чем у людей, не страдающих ХОБЛ [43, 51–53]. Частота ССЗ у больных ХОБЛ составляет 50,0–56,5%, в то время как в такой же возрастной группе пациентов, не страдающих ХОБЛ, они регистрируются только в 25,6% случаев [51].
Результаты Роттердамского исследования (The Rotterdam study), в которое вошло 14 926 человек (из них 1615 больных ХОБЛ), показали, что ХОБЛ повышает риск внезапной сердечной смерти. Особенно высокий риск ее имеют больные с частыми обострениями ХОБЛ [54].
В настоящее время степень и темпы снижения ОФВ1 остаются одними из основных показателей тяжести, прогрессирования и прогноза у больных ХОБЛ. Наряду с этим исследователи едины во мнении, что снижение ОФВ1 относится к факторам сердечно-сосудистой летальности [51, 55–61]; имеются данные, что показатель ОФВ1/ФЖЕЛ является независимым фактором риска коронарных событий [56, 62]. Кроме результатов The Lung Health Study, предикторная значимость снижения ОФВ1 в оценке риска сердечно-сосудистой смертности продемонстрирована в таких крупных эпидемиологических исследованиях, как Framingham Study, Copenhagen City Heart Study, Takahata Study [55, 63, 64].
Таким образом, многие исследователи выделяют ХОБЛ как независимый фактор развития сердечно-сосудистых осложнений и смертности.
5.2. АГ и ХОБЛ: эволюция представлений
Приоритеты в изучении коморбидной сердечнососудистой и легочной патологии принадлежат отечественной терапевтической школе. Так, в 1954 г. российский терапевт академик А.Л. Мясников выявил наклонность к повышению АД у больных эмфиземой легких и предположил ведущую роль гипоксии головного мозга в развитии гипертензивных реакций. Он писал: «В подобных условиях легче возникают, при действии психоэмоциональных факторов, соответствующие нарушения высшей нервной деятельности, которые ведут в ряде случаев к развитию гипертонии» [65]. Н.М. Мухарлямов в 1966 г. отметил, что у 20–25% больных хроническими неспецифическими заболеваниями легких (ХНЗЛ) диагностируется АГ, связь которой с состоянием бронхиальной проходимости позволяет выделить ее в качестве самостоятельной симптоматической «пульмогенной» гипертонии. В качестве доказательств существования последней автор использовал следующие аргументы: наиболее выраженные подъемы АД наблюдаются через некоторое время после возникновения приступов бронхиальной обструкции; купирование приступа в 85% случаев приводит к снижению АД без применения гипотензивных средств. В последующих работах Н.М. Мухарлямов выделил две фазы пульмогенной АГ: в первой фазе она носит лабильный характер и проявляется в момент острого нарушения бронхиальной проходимости (лабильная АГ), во второй фазе АГ становится стабильной, хотя сохраняется четкая связь колебаний АД с течением бронхообструктивного синдрома. Диагностическими критериями пульмогенной АГ, по мнению Н.М. Мухарлямова, являются начало повышения АД через 4–7 лет после манифестации ХНЗЛ; повышение АД в момент обострения легочного процесса; снижение АД (до нормализации) в процессе затихания обострения; снижение или нормализация АД по мере разрешения бронхообструктивного синдрома, несмотря на применение симпатомиметиков и глюкокортикоидов. В генезе этой формы АГ Н.М. Мухарлямов предполагал участие гипоксии и гиперкапнии, нарушение роли легких в метаболизме вазоактивных веществ (катехоламинов, серотонина, гистамина, кининов, ангиотензина II) [66].
В свою очередь В.Ф. Жданов с соавт. отмечали связь развития АГ с бронхиальной обструкцией при участии гипоксии, гиперкапнии, нарушений легочного газообмена и гемодинамики малого круга кровообращения у больных ХНЗЛ, что было подтверждено и в более поздних исследованиях [67–69].
Значительная роль в механизмах повышения АД принадлежит также нарушениям обмена адреналина, дофамина, серотонина, простагландинов, кинина и других, связанных с изменениями так называемой нереспираторной функции легких при хронических легочных заболеваниях [7, 70].
Далее в работах отечественных авторов стала поддерживаться точка зрения об отсутствии взаимосвязи бронхолегочной патологии и АГ, обосновывалась позиция сочетанной патологии в рамках мультиморбидности [71, 72].
На рубеже веков наши представления о взаимосвязи сердечно-сосудистой патологии и ХОБЛ стали стремительно меняться, что связано с получением новых данных о структуре сердечно-сосудистой заболеваемости и смертности у пациентов с коморбидной патологией. Так же изменились представления и о взаимоотношениях АГ и ХОБЛ.
5.3. АГ и ХОБЛ: современные позиции – коморбидность или мультиморбидность?
Сочетание АГ и ХОБЛ – частая клиническая ситуация в терапевтической практике. Оба заболевания относятся к значимым болезням второй половины жизни, при этом АГ является наиболее часто встречающейся сердечно-сосудистой патологией у больных ХОБЛ.
Известно, что АГ встречается более чем у 50% больных ХОБЛ, диагностированной на уровне первичной помощи [8, 73]. По данным отечественных и зарубежных авторов, частота АГ при ХОБЛ варьирует в широких пределах, достигая, согласно отдельным публикациям, 76,3%. В поперечном исследовании J.M. Echave et al. изучалась частота сопутствующей патологии у 977 больных ХОБЛ (средний возраст 70,1±9,8; 87,4% мужчин): при использовании индекса Charlson у 65,7% исследуемых выявлены коморбидные состояния, среди которых 57,7% пришлось на АГ [74].
Результаты Kaiser Permanente Medical Care Program также продемонстрировали большую частоту встречаемости АГ, стенокардии, инфаркта миокарда, нарушений ритма, сахарного диабета, гиперлипидемии, инсульта, хронической сердечной недостаточности (ХСН) у больных, госпитализированных по поводу обострения ХОБЛ [75]. Согласно данным, полученным F. Holguin et al., наличие ХОБЛ при сочетании с АГ, ИБС, ХСН и сахарным диабетом значительно увеличивает частоту госпитализаций и уровень смертности [76].
D.M. Mannino et al. изучили распространенность и влияние ССЗ, сахарного диабета и АГ на частоту госпитализаций и риск смерти у больных ХОБЛ с различными стадиями по GOLD (20 296 пациентов). У 10 009 участников была выявлена ХОБЛ (от 0 до 4 по GOLD), что составило 49,3% от общего количества обследованных лиц, при этом распространенность АГ варьировала от 40,4 до 51,1% и превышала аналогичные показатели в группе без ХОБЛ. В результате проведения мультивариационного регрессионного анализа выявлено повышение риска АГ в 1,6 раза при тяжелой ХОБЛ (GOLD 3–4). Также отмечено увеличение частоты госпитализаций у больных ХОБЛ, страдающих АГ [43].
Не вызывает сомнения, что АГ выступает одним из основных коморбидных состояний, ассоциированных с ХОБЛ. Это продемонстрировано в популяционном исследовании «случай–контроль», которое было проведено в Щвейцарии с участием 340 948 пациентов с ХОБЛ во время госпитализации. Авторы обнаружили 82 коморбидных состояния, при этом АГ была заболеванием с самой высокой распространенностью у больных ХОБЛ (24%) против 16% пациентов без ХОБЛ (ОШ 1,7; 95% ДИ [1,6–1,7]; р <0,001) [77].
Подобные результаты были получены в KNHANES V когорте (Korean National Health and Nutrition Examination Survey), где в результате многофакторного логистического регрессионного анализа среди 15 коморбидных состояний только АГ и история легочного туберкулеза были независимо связаны с ХОБЛ после поправки на конфаундеры [78].
В последнем исследовании Kim et al. (2017) ХОБЛ была диагностирована у 22,9% лиц, страдающих АГ, и у 14,3% лиц без АГ. Посредством линейного регрессионного анализа была выявлена отрицательная корреляционная связь между пульсовым давлением и показателями легочной функции (ОФВ1 и ОФВ1/ФЖЕЛ, р <0,001). Даже после поправки на возраст, статус курения, индекс массы тела, диабет, метаболический синдром и инсульт ХОБЛ была независимо связана с АГ, что может объяснить связь между сердечно-сосудистыми заболеваниями и ХОБЛ (ОШ 1,71; 95% ДИ 1,37–2,13; р <0,01) [79].
В другом японском исследовании продемонстрировано, что 25% больных с ССЗ имеют ХОБЛ, которая не была ранее диагностирована [80]. Показано, что 17,6% курящих больных АГ с респираторными симптомами и 12% без респираторных симптомов имеют ХОБЛ. Причем у пациентов с респираторными симптомами в 56% случаев ХОБЛ не была диагностирована [81].
Эти данные диктуют необходимость активного внедрения стратегий диагностики ХОБЛ на ранних стадиях развития болезни у пациентов высокого риска.
Таким образом, результаты различных исследований продемонстрировали двунаправленный характер взаимосвязи АГ и ХОБЛ. С одной стороны, АГ ухудшает прогноз и увеличивает частоту госпитализаций у больных ХОБЛ. С другой стороны, отмечается увеличение распространенности АГ и сердечно-сосудистых осложнений по мере нарастания степени тяжести ХОБЛ.
В настоящее время не вызывает сомнений тот факт, что высокая частота сочетания ХОБЛ и ССЗ является не просто результатом все чаще диагностируемой поливалентной патологии, а отражением существования взаимосвязей между этими заболеваниями с общими звеньями патогенеза, требующими детального изучения и неоднозначного подхода к терапии.
5.4. АГ и ХОБЛ: факторы риска
ХОБЛ и ССЗ имеют общие факторы риска, такие как курение, возраст, пол, гиподинамия, ожирение и единые патогенетические механизмы (системное воспаление, оксидативный стресс, дисфункция эндотелия). Контроль факторов риска, модификация образа жизни у больных АГ и ХОБЛ могут существенно замедлить прогрессирование этих заболеваний и улучшить эффект терапевтических вмешательств [43, 82–84].
Табакокурение. Относится к наиболее важным факторам риска развития ХОБЛ и сердечно-сосудистой патологии, в том числе АГ. Курение в течение длительного времени сопряжено с 15–50% риском возникновения ХОБЛ [85–86], недавние исследования показали, что популяционный атрибутивный риск составляет 51–72% [87]. Вероятность развития ХОБЛ увеличивает пассивное курение (ОШ 1,48; 95% ДИ 1,18–1,85) [88], экспозиция продуктов сгорания биотоплива в развивающихся странах (ОШ 2,44; 95% ДИ 1,9–3,33) [89].
Хронические курильщики также демонстрируют 3–6-кратное увеличение риска развития инфаркта миокарда в сравнении с лицами без анамнеза курения [90]. Пассивное курение, экспозиция продуктов сгорания биотоплива также увеличивают риск развития ССЗ [91]. Это объясняется влиянием курения на местное и системное воспаление, ремоделирующими эффектами на респираторную и сердечно-сосудистую системы (активация симпатоадреналовой системы, сосудистое повреждение, стабилизация АГ, атерогенез). Курение сопровождается снижением эффективности антигипертензивной и бронхолитической терапии.
Возраст и старение. Так как увеличение распространенности ХОБЛ и сердечно-сосудистой патологии, включая АГ, ассоциировано с возрастом, привлекательная концепция – считать эти заболевания частью процесса старения [92, 93]. Большинство возраст-ассоциированных заболеваний связано с хроническим воспалением, которое приводит к структурным изменениям и функциональной недостаточности органов, оксидативный стресс ведет к укорочению теломер, повреждению ДНК. Таким образом, присутствует двунаправленная взаимосвязь: с одной стороны, возраст ассоциирован с хроническим воспалением и оксидативным повреждением, с другой стороны, любые заболевания, связанные с активизацией этих процессов, приводят к ускоренному старению.
Пол. Вопреки традиционным представлениям о преобладающей частоте развития ХОБЛ у мужчин, в последних исследованиях установлена почти одинаковая распространенность ХОБЛ среди мужчин и женщин в экономически развитых странах, что, вероятно, связано с изменением общей картины табакокурения [94]. В ряде исследований установлена высокая восприимчивость к сигаретному дыму у женщин [95, 96]. Точные механизмы этого феномена неизвестны, возможно, это связано с меньшим размером дыхательных путей у женщин и различиями в метаболизме сигаретного дыма [95, 97]. Кроме того, не вызывает сомнений, что мужчины имеют больший сердечно-сосудистый риск, чем женщины, но есть основания полагать, что женщины более восприимчивы к вредоносным сосудистым эффектам курения, чем мужчины [90]. Также показано снижение уровня эстрогенов у курильщиков, что, в свою очередь, может влиять на сердечно-сосудистый риск [98].
Избыточный вес и ожирение. АГ тесно связана с избыточной массой тела, а снижение массы тела сопровождается снижением АД [99]. В метаанализе, проведенном J.E. Neter et al., выявлено снижение систолического (САД) и диастолического АД (ДАД) на 4,4 и 3,6 мм рт.ст. при уменьшении веса на 5,1 кг [100]. У пациентов c ожирением эффективность антигипертензивных препаратов снижается, и монотерапия, как правило, не приводит к достижению целевого АД [36].
Сочетание ХОБЛ и ожирения – достаточно частая клиническая ситуация. Установлено достоверное преобладание ожирения среди пациентов с ХОБЛ в сравнении с общей популяцией больных [101, 102]. Ожирение у больных ХОБЛ сопровождается более выраженным снижением уровня физической активности и возрастанием частоты госпитализаций в отличие от больных ХОБЛ с нормальной массой тела. По данным K.B. Lam et al., несмотря на более высокий риск развития метаболического синдрома у больных ХОБЛ в сравнении с пациентами, не страдающими этим заболеванием, только ожирение служит компонентом, имеющим связь со степенью бронхиальной обструкции [103].
Предполагается, что наличие ожирения у больных ХОБЛ оказывает негативное влияние на течение заболевания и ассоциировано со значительным снижением спирометрических параметров, переносимости физической нагрузки, показателей качества жизни и выживаемости, частыми обострениями, развитием инсулинорезистентности и активацией системных воспалительных реакций [104, 105].
В ряде исследований установлено, что абдоминальное ожирение сопровождается снижением ФЖЕЛ и ОФВ1, при наличии избыточной жировой ткани усугубляется бронхиальная обструкция, нарушается механика дыхательных движений грудной клетки на вдохе и выдохе, ухудшается проходимость дистальных дыхательных путей [103, 106, 107].
Согласно современным научным данным, предполагается активное участие жировой ткани в процессах системного воспаления и формировании нарушений углеводного обмена у больных ХОБЛ, ожирению отводится роль независимого фактора риска развития и потенцирования системных воспалительных реакций. Ожирение у больных ХОБЛ – один из ключевых механизмов развития сопутствующей сердечно-сосудистой патологии [108, 109].
Обструктивное апноэ сна. Наличие причинноследственной связи между обструктивным апноэ сна (ОАС) и АГ не вызывает сомнения [110]. В многочисленных исследованиях наличие апноэ/ гипопноэ выступало независимым предиктором развития АГ, причем степень тяжести ОАС коррелировала с уровнем АД с исключением влияния таких факторов риска, как возраст, ожирение, пол и т.д. [111, 112]. Так, в исследовании WSCS (Wisconsin Sleep Cohort Study) при индексе апноэ/гипопноэ (ИАГ) 15 событий в час относительный риск развития АГ в течение 4 лет составил 2,89 в сравнении с ИАГ 0, также установлена корреляционная связь между степенью тяжести ОАС и распространенностью АГ [111]. В исследовании Sleep Heart Health Study (6132 пациента) риск развития АГ увеличивался почти в 1,5 раза при наличии ОАС тяжелой степени [113].
В настоящее время ОАС признается наиболее частой причиной развития резистентной АГ. Эпидемиологические исследования свидетельствуют о наличии тесной связи между ОАС и неконтролируемой АГ: при повышении степени нарушений дыхания во время сна снижается вероятность достижения целевых уровней АД, несмотря на увеличение количества принимаемых антигипертензивных препаратов [114–122].
Последние 20 лет частота ОАС значительно увеличилась, в частности, описаны случаи сочетания ХОБЛ и ОАС, что носит название синдрома перекреста (overlap syndrome). За счет взаимного утяжеления двух составляющих, тотальной гипоксемии течение заболевания становится более злокачественным, в несколько раз повышается риск сердечно-сосудистых событий. В сравнении с больными ХОБЛ и больными ОАС, пациенты с синдромом перекреста имеют более выраженную ночную гипоксемию, что увеличивает у них риск смертности, чаще всего из-за сердечно-сосудистых осложнений [123–127].
Ключевые положения, блок 3:
- Приоритеты в изучении коморбидной сердечно-сосудистой и легочной патологии принадлежат отечественной терапевтической школе. Впервые этиопатогенетические взаимосвязи АГ и хронических заболеваний легких описаны в работах А.Л. Мясникова, Н.М. Мухарлямова в 1950–60-х гг.
- Сочетание АГ и ХОБЛ – частая клиниче ская ситуация в терапевтической практике. Частота АГ при ХОБЛ, по данным различных исследований, достигает 60–70%.
- АГ и ХОБЛ имеют общие факторы риска (табакокурение, возраст, избыточный вес и ожирение и т.д.).
- АГ и ХОБЛ имеют двунаправленный характер взаимодействий. АГ ухудшает прогноз и частоту госпитализаций больных ХОБЛ, по мере нарастания степени тяжести ХОБЛ увеличивается распространенность АГ и сердечнососудистых осложнений.
5.5. АГ и ХОБЛ: патогенетические взаимосвязи
Для ХОБЛ характерны рецидивирующие эпизоды гипоксии, гиперкапнии, повышения внутриторакального давления вследствие обструкции дыхательных путей, активация процессов оксидативного стресса и системного воспаления, которые прямо или опосредованно могут приводить к формированию или усугублению АГ.
5.5.1. Патогенетические механизмы АГ у больных ХОБЛ
Среди вероятных механизмов, связывающих ХОБЛ и АГ, обсуждаются следующие:
1. Дисфункция автономной нервной системы. В настоящее время ХОБЛ позиционируется как заболевание с выраженным системным компонентом и с негативным влиянием на сердечно-сосудистую и автономную нервную систему [128]. По мнению ряда исследователей, основным триггером, стимулирующим развитие легочной и системной АГ на фоне ХОБЛ, является гипоксия. По мере усиления степени вентиляционных нарушений увеличивается количество больных со стойким повышением артериального давления. На фоне интермиттирующей или хронической гипоксии со снижением оксигенации головного мозга происходит формирование застойных очагов возбуждения в подкорковых структурах с вазоконстрикторной доминантой и активацией симпатической нервной системы (СНС). Повышение внутриторакального давления вследствие обструкции и хронического воспаления дыхательных путей приводит к уменьшению барорефлекторной активности и увеличению активности симпатической нервной системы. Эти изменения автономной нервной функции могут объяснить повышение АД у больных ХОБЛ [129–132]. Гипоксия и в меньшей степени гиперкапния стимулируют центральные (продолговатый мозг) и периферические (аорта, синокаротидная зона) хеморецепторы. Повышенная импульсация от хеморецепторов возбуждает сосудо-двигательный центр, в результате повышается симпатическая активность и снижается парасимпатическая, что приводит к повышению АД и частоты сердечных сокращений (ЧСС). Хроническая симпатическая гиперактивация может быть одной из причин увеличения сердечно-сосудистой заболеваемости и смертности у больных ХОБЛ [131, 133].
Высокая ЧСС признается независимым фактором риска сердечно-сосудистой заболеваемости и смертности в общей популяции, а тахикардия в покое характерна для больных ХОБЛ [134]. Эти данные потенциировали пересмотр наших представлений о месте и роли бета-блокаторов в терапии пациентов с ХОБЛ.
2. Активация ренин-ангиотензин-альдостероновой системы. В недавних исследованиях подтверждена роль ренин-ангиотензин-альдостероновой системы (РААС) в патогенезе как самой ХОБЛ, так и экстрапульмональных проявлений этого заболевания (рис. 3).
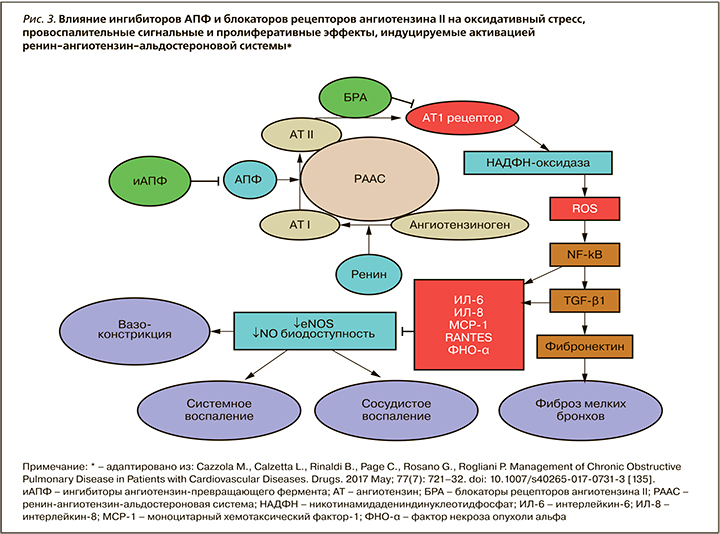
Тканевые РААС активированы во многих тканях, в том числе в легких, скелетных мышцах. Установлен высокий уровень экспрессии ангиотензинпревращающего фермента (АПФ) и рецепторов ангиотензина II в легких. Хроническая гипоксия напрямую или через повышение активности симпатоадреналовой системы (САС) может активировать циркулирующие и тканевые компоненты РААС, в том числе в почках [136–139]. Также показано увеличение плазменной активности ренина и альдостерона у пациентов с ХОБЛ [140].
РААС вовлечена в патогенез ХОБЛ посредством индукции выработки провоспалительных медиаторов в легких [141]. Aнгиотензин (АТ) II стимулирует выработку интерлейкина-6 (ИЛ-6), фактора некроза опухоли-α (ФНО-α), моноцитарного хемотаксического протеина (МРС-1), который обладает иммуномодулирующим эффектом на Т-клетки, что ассоциировано с легочным повреждением при ХОБЛ [142– 144]. В недавнем исследовании показано, что продукция альвеолярными клетками 1 типа провоспалительных цитокинов в ответ на легочное повреждение модулируется системой РААС, и этот процесс может быть ингибирован антагонистом АТ1-рецепторов лозартаном [145]. Хроническое воспаление дыхательных путей является ключевой характеристикой ХОБЛ, связанной с процессами ремоделирования в легких, паренхиматозной деструкцией и развитием эмфиземы [146] (см. рис. 3).
У больных ХОБЛ выявлено 5–6-кратное увеличение отношения АТ1-/АТ2-рецептор в областях фиброза, окружающих бронхиолы, которое коррелировало со снижением ОФВ1. Это подтверждает роль АТ II в увеличении бронхиального сопротивления посредством активации АТ1-рецептора [147]. Под контролем РААС (через АТ1-рецептор) также находится продукция активных форм кислорода (ROS), потенцирующая митохондриальную дисфункцию, которая способствует оксидативному стрессу и нарушению редокс-сигналингу, наблюдаемому при ХОБЛ [148, 149].
Существенную роль в патогенезе ХОБЛ играет легочный фиброз. Во-первых, это один из основных компонентов ремоделирования дыхательных путей при ХОБЛ, во-вторых, хорошо известно, что часть больных ХОБЛ имеет сидром CPFE (сочетание фиброза и эмфиземы) с определенными клиническими особенностями. АТ II обладает профибротическими свойствами. Показано, что активация легочной РААС вовлечена в развитие фибротических процессов [150–152].
Легочная гипертензия развивается вторично по отношению к ХОБЛ: она инициируется хронической гипоксией и связана с эндотелиальной дисфункцией, ремоделированием легочных сосудов, которые развиваются вследствие активации оксидативного стресса, увеличения выработки провоспалительных цитокинов и протромботических медиаторов, многие из которых находятся под контролем РААС [153].
Дисфункция скелетных мышц – еще одно ключевое системное коморбидное расстройство при ХОБЛ. Слабость, наблюдаемая у пациентов с ХОБЛ, наиболее выражена в двигательных мышцах, и при биопсии в квадрицепсах наблюдается классический паттерн изменений с доминированием 2 типа волокон, редукцией капиллярной сети [154–157]. Важно, что уменьшение силы квадрицепсов у больных ХОБЛ связано со снижением переносимости физических нагрузок, ухудшением общего состояния и возрастанием смертности независимо от степени дыхательных расстройств [158]. Через модуляцию провоспалительного статуса (цитокинов, ROS) AТ II играет роль в патогенезе мышечной дисфункции при ХОБЛ. Протективные эффекты блокаторов РААС (периндоприл, эналаприл) в отношении миопатии скелетных мышц продемонстрированы в эксперименте и на клинических моделях ХОБЛ [159, 160].
Показано, что D/D генотип АПФ чаще представлен у курильщиков и ассоциирован с 2-кратным увеличением риска развития ХОБЛ. Эти данные доказывают, что существует генетическая связь: активность АПФ повышена при ХОБЛ и ассоциирована с нарушением легочной функции [161, 162].
Таким образом, экспрессия системы РААС, помимо вазоконстрикторных эффектов с повышением системного АД, потенцирует целый ряд органных и сосудистых повреждений посредством активации оксидативного стресса, системного воспаления, эндотелиального повреждения. В настоящее время активно обсуждаются легочные эффекты активации РААС: ремоделирование легких, деструкция паренхимы, эмфизема, фиброз, нарушение бронхиальной проходимости, дисфункция скелетных мышц, апоптоз эпителиальных клеток, легочная гипертензия [163]. С этой точки зрения блокада эффектов этой системы в настоящее время признается новой терапевтической стратегией у больных ХОБЛ.
3. Дисфункция эндотелия. Дисфункция эндотелия (ДЭ) – независимый фактор риска развития и прогрессирования ССЗ. Результаты экспериментальных и клинических исследований последних лет подтвердили концепцию о важной причинноследственной взаимосвязи между эндотелиальной дисфункцией, развитием и прогрессированием атеросклероза и АГ [164–176].
В последние годы актуальными являются исследования, посвященные изучению вазорегулирующей функции сосудов у больных с респираторными заболеваниями. Сочетание АГ и ХОБЛ оказывает негативное влияние на состояние сосудистой стенки. Повреждение эндотелия и эндотелиальная дисфункция при коморбидной патологии выражены в большей степени, чем при монопатологии [177, 178].
Основное значение в механизме развития ДЭ имеет окислительный стресс и системное воспаление с продукцией провоспалительных цитокинов, активных форм кислорода (АФК), которые подавляют активность NO и увеличивают синтез мощных вазоконстрикторов (эндопероксиды, эндотелины, ангиотензин II), что ведет к дальнейшему нарастанию оксидативного стресса. Кроме того, системная и тканевая гипоксия вызывает структурные изменения эндотелиальных клеток, нарушает их функцию, антитромбогенную активность эндотелия (гиперпродукция тромбоксана, снижение простациклина) [179, 180].
Активация эндотелия также связана с патологической выработкой большого количества сосудистых факторов, включающих молекулы адгезии, такие как ICAM-1 и VCAM-1. Показано увеличение выработки молекул адгезии при ХОБЛ в сочетании с АГ с ростом экспрессии VCAM-1 по мере усугубления степени тяжести вентиляционных нарушений (снижение ОФВ1) [181, 182]. При воздействии воспалительных медиаторов адгезивные молекулы способствуют прилипанию циркулирующих макрофагов и Т-лимфоцитов к эндотелию и их проникновению в интиму сосудов, что ведет к дальнейшему его повреждению и персистенции неспецифического воспаления и активации процессов атерогенеза. Это, в свою очередь, создает предпосылки для манифестации атеросклероза и АГ или способствует их прогрессированию [183– 187].
Показано, что нарушение функции эндотелия связано с низким ОФВ1 и степенью выраженности эмфиземы легких по компьютерной томографии (КТ) у бывших курильщиков [188].
4. Повышение жесткости крупных сосудов. Повышение сосудистой жесткости ассоциировано с ХОБЛ и может служить причиной развития АГ [189–190]. Эластин – структурный белок, который поддерживает эластичность и проходимость дыхательных путей и регулирует (упорядочивает) гладкомышечные клетки в стенке сосуда. Артериальная жесткость, как полагают, является результатом процесса ремоделирования с фрагментацией эластина и заменой коллагеном во внеклеточном матриксе [191]. Развитие артериальной жесткости и деградация эластина – маркеры нормального процесса старения. Однако увеличение деградации эластина и изменение баланса протеазы/антипротеазы в тканях, приводящие к эмфиземе у больных ХОБЛ, параллельно ускоряют развитие артериальной жесткости [192–194].
Проведено достаточное количество исследований, посвященных изучению жесткости сосудов при ХОБЛ. Пациенты с ХОБЛ имеют более жесткие артерии по сравнению со здоровыми лицами [195, 196]. Увеличение деградации эластина в коже больных ХОБЛ в сравнении с контролем, связь с тяжестью эмфиземы и скоростью распространения пульсовой волны, подтверждающие системную трансформацию эластина за пределами легких при ХОБЛ, продемонстрированы в исследовании J.D. Maclay et al. [197, 198].
Жесткость крупных сосудов, оцененная посредством измерения каротидно-феморальной скорости распространения пульсовой волны, увеличена у пациентов с ХОБЛ, особенно при наличии эмфиземы независимо от степени экспозиции табачного дыма [199–201].
Примечательно, что в исследовании, проведенном N.L. Mills et al., увеличение жесткости сосудистой стенки у больных ХОБЛ сопровождалось повышенными значениями АД [190]. В этом исследовании при изучении артериальной жесткости у пациентов с ХОБЛ средний возраст обследованных составил 67 лет, а параметры жесткости сосудистой стенки были аналогичны группе относительно здоровых обследованных 80 лет. Параметры жесткости сосудистой стенки у пациентов с ХОБЛ были выше, чем у аналогичной категории пожилых людей с подтвержденной ИБС [190].
Повышенную артериальную ригидность возможно рассматривать в качестве связующего фактора между ХОБЛ и ССЗ. Повышение жесткости артерий изменяет давление, работу сердца и коронарную перфузию с последующим развитием ССЗ [191, 202]. В обзоре I. Vivodtzev et al. (2014) жесткость артерий предполагается рассматривать в качестве прогностического маркера ранней сердечно-сосудистой заболеваемости при ХОБЛ [203, 204].
Таким образом, при коморбидной патологии (сочетание ХОБЛ и АГ) установлено повышение основных показателей сосудистой жесткости по сравнению с контрольной группой и изолированной АГ.
5.5.2. Механизмы локального и системного воспаления при ХОБЛ
Воспаление в легких у больных ХОБЛ представляет собой патологически усиленный воспалительной ответ дыхательных путей на длительное воздействие раздражающих факторов, основным из которых является табачный дым. Механизмы патологического усиления воспалительного процесса окончательно не изучены, значительную роль ученые отводят генетической предрасположенности, лежащей в основе активизации аутоиммунных процессов в легких, что обусловливает продолжение воспалительной реакции в бронхолегочной системе даже после отказа от курения [205]. У больных ХОБЛ легкие служат очагом патологического персистирующего воспаления с выбросом в кровоток провоспалительных цитокинов, оксидантов, что, в свою очередь, ведет к системному воспалению, усугублению процессов атерогенеза, поражению сосудов, сердца, почек, истощению скелетной мускулатуры [23, 24] (рис. 4).
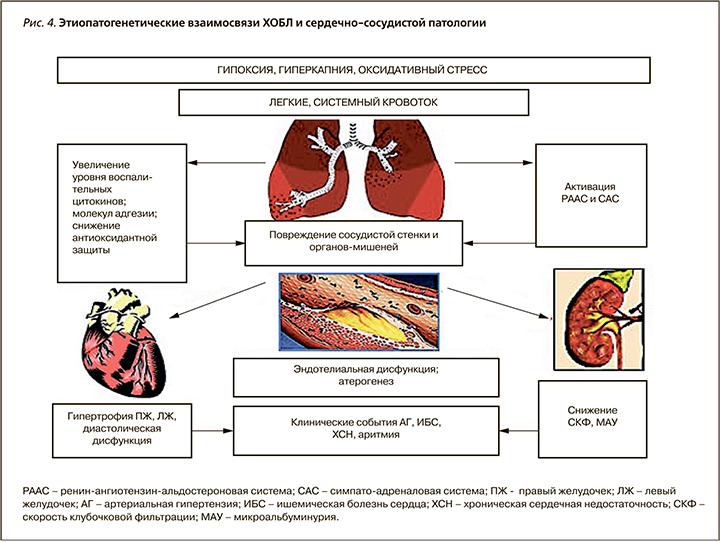
Альвеолярныемакрофаги, эпителиальныеклетки бронхов, некоторые лимфоциты у больных ХОБЛ вырабатывают ИЛ-6, ФНО-α, ИЛ-1β, ИЛ-12. Эти цитокины вызывают не только местные воспалительные реакции, но и проникают в системный кровоток и стимулируют гепатоциты к синтезу острофазовых белков – С-реактивного белка (СРБ), фибриногена. СРБ, ФНО-α, ИЛ-6 – маркеры системного воспаления. Эпидемиологические исследования показали, что повышение СРБ, ИЛ-6, фибриногена – предикторы плохого исхода у больных ХОБЛ, которые связаны с ускоренным падением легочной функции, большей склонностью к инфекционным обострениям и смертностью [206–211].
СРБ – один из основных маркеров системного воспаления. Он активирует систему комплемента, способствует усилению продукции цитокинов, усиливает адгезию лейкоцитов к эндотелию сосудов [212, 213]. СРБ связывается с фосфолипидным комплексом поврежденных клеток, стимулируя ускоренный захват этих клеток макрофагами, усиливает поглощение макрофагами липопротеинов низкой плотности, активируя образование пенистых клеток, индуцирует экскрецию адгезивных молекул и хемокинов клетками эндотелия, стимулирует продукцию моноцитами тканевого фактора и образование моноцитарного белка хемоаттрактанта-1 – ключевого фактора миграции моноцитов в интиму сосудов [183, 214]. Все это ведет к ускорению процессов атерогенеза.
Высокий уровень СРБ связан с большим ежегодным падением ОФВ1 и прогрессированием ХОБЛ. В проведенном метаанализе 14 исследований, посвященных определению маркеров системного воспаления при ХОБЛ, W.O. Gan et al. выявили значительное повышение уровня цитокинов и СРБ у больных ХОБЛ по сравнению с группой сравнения, при этом выраженность воспаления прогрессивно нарастала по мере снижения ОФВ1 [215].
СРБ – не только маркер системного воспаления и активный фактор атерогенеза, но и независимый предиктор сердечно-сосудистой заболеваемости и смертности больных ХОБЛ. Исследования показали связь между уровнем СРБ и повышением риска смерти от ССЗ [191, 216–218].
По результатам Framingham Study, концентрация СРБ менее 1 мг/л, в диапазоне 1–3 мг/л и более 3 мг/л соответствует низкому, умеренному и высокому риску сердечно-сосудистых событий [219]. В работе S.F. Man et al., проводимой на базе исследования Lung Health Study (4803 больных), показано, что у больных ХОБЛ уровень СРБ связан со смертностью от всех причин, сердечнососудистой смертностью и летальностью от рака легких [219]. Согласно результатам исследования V.M. Pinto-Plato et al., при использовании данной стратификации СРБ 60% больных ХОБЛ со стабильным течением относятся к категории высокого риска развития сердечно-сосудистой патологии [220, 221].
В ряде исследований у больных АГ выявлена повышенная концентрация таких провоспалительных цитокинов, как ИЛ-6, ИЛ-1β, ФНО-α, и установлена их связь с уровнями САД, ДАД, средним и пульсовым АД [222, 223]. Показана прямая связь повышенного значения СРБ с уровнями САД, ДАД и среднего АД у пациентов с АГ по сравнению с нормотензивными лицами, которая сохранялась и при исключении остальных факторов сердечно-сосудистого риска [224]. В проспективном исследовании Woman’s Health Study у пациенток постменопаузального возраста с инициальным повышением значения СРБ на момент включения в исследование и отсутствием симптомов АГ в течение 7 лет зарегистрировано развитие АГ [225]. Аналогичные результаты получены в результате 11-летнего наблюдения за нормотензивными мужчинами среднего возраста европеоидной расы – у лиц с изначальными уровнями СРБ >3 мг/л развитие АГ отмечалось в 3,3 раза чаще по сравнению с участниками исследования с СРБ ≤1 мг/л [226].
Крайне важные результаты, значительно изменившие область знаний о системном воспалении у больных ХОБЛ и ставшие убедительным доказательством гетерогенности клинических проявлений заболевания, которая не может быть обусловлена только степенью тяжести бронхиальной обструкции, были получены в широкомасштабном обсервационном продольном исследовании ECLIPSE (Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-point). Основными целями исследования были: 1) определение клинически значимых подтипов (фенотипов) ХОБЛ; 2) выявление прогностических параметров прогрессирования заболевания в этих подтипах; 3) исследование известных биомаркеров и разработка новых биологических и/или генетических маркеров, которые коррелируют с подтипами ХОБЛ и являются предикторами прогрессирования заболевания.
Исследование проводилось с участием 2164 больных ХОБЛ, контрольную группу составили 337 курящих и 245 некурящих лиц.
Одним из значимых выводов данного исследования следует считать результаты, опровергающие универсальный характер системного воспаления у больных ХОБЛ. У 30% больных – участников исследования отсутствовало значимое повышение изученных 6 воспалительных маркеров, в то время как у 16% пациентов определялся паттерн персистирующего системного воспаления, ассоциированный с частыми обострениями и повышенным риском смерти. Это позволило выделить стабильный фенотип ХОБЛ с частыми обострениями. Факторами риска системного воспалительного ответа явились возраст (ОШ 1,045; 95% ДИ 1,014–1,077); ИМТ (ОШ 1,125; 95% ДИ 1,063–1,190) и курение (ОШ 2,228; 95% ДИ 1,471–3,375). Частота встречаемости коморбидных сердечно-сосудистых заболеваний, диабета и АГ у больных ХОБЛ со стойким повышением биомаркеров воспаления достоверно превышала аналогичный показатель в группе с отсутствием воспалительных реакций [208].
Примечательно, что коморбидная АГ, присутствующая у больных ХОБЛ в данном исследовании, сопровождалась стойким повышением фибриногена, индекса массы тела, степени одышки по шкале mMRC и снижением результатов теста с 6-минутной ходьбой, при этом значимое изменение уровня СРБ отсутствовало [227].
5.5.3. Состояние оксидативной и антиоксидантной систем у больных ХОБЛ
Ткань легких содержит в большом количестве субстрат перекисного окисления липидов (ПОЛ) – ненасыщенные жирные кислоты, продукты окисления которых стимулируют активность протеинкиназы-С, высвобождение кальция, снижают синтез NO, уменьшают эндотелийзависимую вазодилатацию, нарушают репликацию эндотелиальных клеток и ангиогенез, индуцируют апоптоз. В крови больных ХОБЛ наблюдается высокая активность перекисного окисления липидов, что истощает систему антиоксидантной защиты, развивается дисбаланс в системе «оксидант/антиоксидант». Среди стимулирующих развитие оксидативного стресса факторов ведущая роль придается гипоксии и гипоксемии [23, 26, 27, 228–230].
При АГ также подтверждено наличие окислительного стресса, который тесно связан с инактивацией NO, поражением эндотелия как важного органа-мишени [168, 179, 231, 232]. В ряде клинических и экспериментальных исследований выявлено возрастание активных форм кислорода при одновременном снижении уровня показателей антиоксидантной защиты, таких как супероксиддисмутазы, глутатионредуктазы, у больных АГ [233–235]. В исследовании P. Bhadoria et al. обнаружено повышение сывороточного уровня малонового диальдегида у больных АГ в сочетании с ХОБЛ по сравнению с нормотензивными пациентами [236].
В работах отечественных авторов выявлено увеличение продуктов ПОЛ у больных сочетанием АГ и ХОБЛ – ацилгидроперекисей (АЦП) в сравнении со здоровыми курильщиками на 50% (p <0,0001) и пациентами с изолированной АГ на 31,3% (p <0,004), что отражает высокий уровень оксидативных повреждений. Отмечено увеличение активности ПОЛ по мере усугубления степени тяжести вентиляционных нарушений у пациентов в ХОБЛ и АГ [181, 182].
В исследованиях, проведенных M. Shameem et al., выявлена положительная связь между значением общей антиоксидантной активности (емкости) сыворотки крови (ОААС) и уровнем ОФВ1 и ФЖЕЛ у больных ХОБЛ при наличии отрицательных связей между эритроцитарной активностью супероксиддисмутазы и ОФВ1 [237]. В работах российских исследователей выявлено повышение ОААС у больных АГ и ХОБЛ и изолированной АГ в сравнении с группой здоровых курильщиков (р <0,0001), что свидетельствует о закономерной активизации антиоксидантных механизмов защиты на фоне усиления оксидативного стресса. Однако ОААС у больных АГ и ХОБЛ был ниже на 28,6% (р <0,0001) в сравнении с изолированной АГ, что может отражать нарушение антиоксидантных протекторных механизмов на фоне выраженной активации ПОЛ [181, 182].
В связи с доказанной ролью окислительного стресса в формировании и прогрессировании как АГ, так и ХОБЛ логично предполагать, что сосуществование этих заболеваний усугубляет тяжесть общего патологического процесса и повышает степень кардиоваскулярного риска.
Таким образом, в настоящее время существует ряд неопровержимых аргументов в пользу признания ХОБЛ системным («полиорганным») заболеванием с коморбидными ССЗ, среди которых лидирует АГ. Ключевым ассоциативным патогенетическим механизмом прогрессирования данной коморбидной патологии является системное воспаление [5, 40, 238–240].
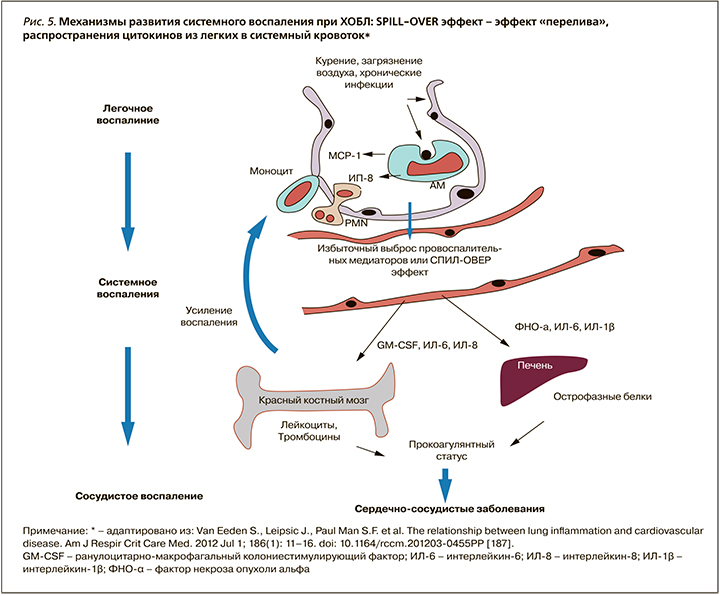
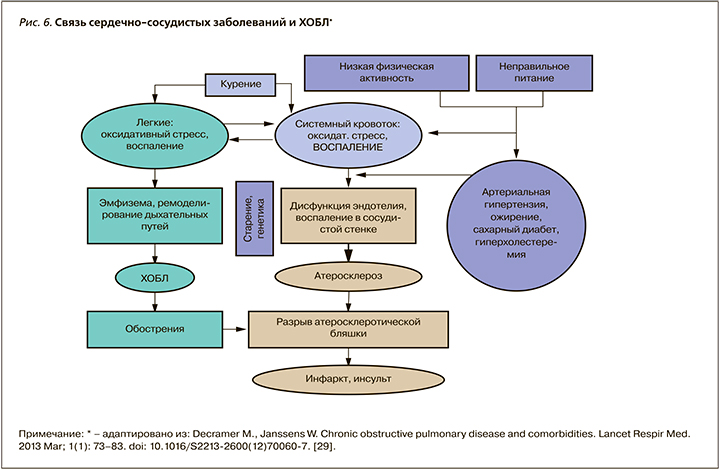
Эпицентром воспаления у больных ХОБЛ являются легкие, откуда происходит распространение воспалительных цитокинов и оксидантов в системный кровоток (spill-over-эффект – эффект перелива) с развитием системной воспалительной реакции [23, 24, 187, 239, 241] (рис. 5). Воспаление играет ключевую роль в ремоделировании бронхолегочной и сердечно-сосудистой систем у больных ХОБЛ (падение легочной функции, развитие атеросклероза и сердечно-сосудистых заболеваний) (рис.6).
5.6. Клинико-функциональные характеристики АГ у больных ХОБЛ
На основании анализа проведенных исследований установлены следующие клинико-функциональные особенности АГ у больных АГ и ХОБЛ.
1. Нарушения суточного профиля АД с преобладанием повышения АД в ночном периоде (non-dippers, night-peakers), высокие показатели вариабельности АД, особенно в ночное время [30, 182, 242–248].
Этот факт связан с увеличением степени бронхиальной обструкции во время сна у больных ХОБЛ и возникновением значительной гипоксемии и гиперкапнии с активацией нейрогуморальных систем, регулирующих АД. Помимо гипоксии, причиной повышения АД могут служить резкие колебания интраторакального давления, возникающие во время эпизодов затруднения дыхания, которые приводят к значительной активации симпатической нервной системы, развитию вазоконстрикции и, как следствие, к повышению АД. Эти же механизмы, вероятнее всего, лежат в основе повышения вариабельности АД у пациентов с сочетанием АГ и ХОБЛ.
2. Высокая частота поражения органов-мишеней: увеличение степени диастолической дисфункции и гипертрофии левого желудочка [30, 182, 242–245].
Изменения функции и структуры левого желудочка (ЛЖ), такие как гипертрофия ЛЖ, диастолическая дисфункция, уменьшение размеров полостей камер сердца и ударного объема, описаны при ХОБЛ [249]. В популяционном исследовании показано, что выраженная эмфиземы по КТ, тяжелые обструктивные нарушения были линейно связаны с нарушением наполнения ЛЖ, редукцией ударного объема и низким сердечным выбросом без изменения фракции выброса [250]. ХОБЛ ассоциирована с нарушением диастолической функции ЛЖ. Обнаружена линейная ассоциация постбронходилатационной ОФВ1 с диастолической функцией ЛЖ, однофакторный и многофакторный анализы показали, что тяжелая ХОБЛ является значимым предиктором повышения VE/VA (показатель диастолической функции). Причина диастолической дисфункции ЛЖ при ХОБЛ – механическое воздействие на сердце легочной гиперинфляции [251–253].
Некоторые авторы также демонстрируют превалирование гипертрофии ЛЖ у нормотензивных пациентов с ХОБЛ без гипоксии [254]. Системное воспаление, активация тканевых РААС играют роль в структурном ремоделировании ЛЖ. Показано значимое нарушение геометрии ЛЖ (концентрическое ремоделирование) у пациентов с ХОБЛ без манифестирующих ССЗ и АГ [251].
Все вышеописанное касается пациентов с изолированной ХОБЛ. У пациентов с АГ и ХОБЛ проведено небольшое количество исследований структуры и функции левых камер сердца. При анализе морфофункциональных параметров сердца, наряду с закономерным нарушением функции правых отделов у больных АГ и ХОБЛ в сравнении с изолированной АГ, показана большая частота развития гипертрофии ЛЖ, обнаружено более выраженное нарушение диастолической функции ЛЖ с преобладанием патологических типов геометрии (концентрическая гипертрофия), что свидетельствует о большем ремоделировании при сопоставимом уровне АД. Не было выявлено статистически значимых отличий в объемных показателях и контрактильной функции желудочков. Более выраженное ремоделирование ЛЖ у больных АГ и ХОБЛ, вероятнее всего, связано с влиянием гипоксических и воспалительных стимулов с активацией САС и тканевой РААС и свидетельствует о прогрессировании органных повреждений и повышении сердечно-сосудистого риска [182, 242–246].
У больных АГ и ХОБЛ необходимо мониторирование состояния органов-мишеней для ранней диагностики и инициации органопротективной терапии.
3. Высокая частота поражения органов-мишеней: хроническая болезнь почек.
В настоящее время не вызывает сомнений, что хроническая болезнь почек (ХБП) – состояние высокого сердечно-сосудистого риска. Показано увеличение общей и сердечной-сосудистой смертности по мере снижения скорости клубочковой фильтрации (СКФ) и увеличения альбуминурии (АУ) у пациентов с АГ, диабетом и в общей популяции [255–257].
Распространенность альбуминурии среди пациентов с ХОБЛ превышает аналогичный показатель в общей популяции, составляя приблизительно 25% после поправки на статус курения, АГ и диабет. Доказана связь между альбуминурией и степенью вентиляционный нарушений у больных ХОБЛ [258–261].
АУ признается «новым» биомаркером высокого сердечно-сосудистого риска у пациентов с ХОБЛ [262]. Показана связь между СКФ, отношением альбумин/креатинин мочи и показателем общей смертности у больных ХОБЛ независимо от коморбидных состояний [262]. По результатам когортных исследований и метаанализов установлено, что вероятность развития ХБП у пациентов с ХОБЛ увеличивается в 1,61 раз после поправки на потенциальные конфаундеры (возраст, пол, статус курения и индекс массы тела) [263, 264].
Воспаление, дисфункция эндотелия, тромбогенные факторы определены как потенциальные механизмы связи между протеинурией и ССЗ. Среди факторов, влияющих на развитие почечного повреждения у больных ХОБЛ, обсуждаются гипоксемия, гиперкапния, провоспалительный статус, оксидативный стресс, активация РААС. Гипоксемия, гиперкапния снижают эффективный почечный кровоток, потенциируют гломерулярное и тубулоинтерстициальное повреждение. Системное микроваскулярное повреждение связывает ХОБЛ и ХБП [259, 260].
Коморбидность АГ и ХОБЛ ассоциирована с более выраженным и ранним почечным повреждением. При сравнении пациентов с изолированной АГ и группы сочетанной патологии были выявлено более значимое снижение скорости клубочковой фильтрации и увеличение уровня альбуминурии у пациентов с АГ и ХОБЛ при сопоставимом уровне АД [243, 244, 246, 265, 266].
Таким образом, больные ХОБЛ и АГ имеют высокий риск развития ХБП, что связано с высоким уровнем воспаления и оксидативного повреждения, с активацией нейрогуморальных механизмов и обосновывает активное использование нефропротективных стратегий в этой клинической группе.
4. Изменения в системе тромбоцитарного гемостаза, реологии крови и микроциркуляторные нарушения [182, 242–245, 267].
Важная функциональная характеристика АГ при ХОБЛ – выраженная степень реологических и агрегационных нарушений. Показано влияние гипоксии и гиперкапнии на мембрану клеток крови с уменьшением деформируемости эритроцитов и увеличением количества активирующихся тромбоцитов. Данные изменения приводят к нарушению кислородотранспортной функции крови и замыкают порочный круг патологических гипоксических реакций. Установлена зависимость эластичности эритроцита от происходящих в нем процессов диффузии газов (О2, СО2), что отражается на реологических свойствах крови [268, 269]. У больных АГ в сочетании с ХОБЛ выявлено увеличение среднего радиуса агрегатов по сравнению с изолированной АГ при спонтанной агрегации и индуцированной агрегации тромбоцитов, а также индексов агрегации и деформируемости эритроцитов, которые оставались нормальными у больных АГ [270].
Тромбоцитарный гемостаз и реология крови влияют на состояние тканевой перфузии. Установлено, что при АГ в сочетании с ХОБЛ преобладают патологические спастико-гиперемический и гиперемический гемодинамические типы микроциркуляции, а также присутствуют наиболее неблагоприятные спастико-стазический и стазический типы. При изолированной АГ превалирует спастический тип и отсутствуют застойные явления в микроциркуляторном русле [244, 245].
Таким образом, для больных АГ в сочетании с ХОБЛ характерны патофизиологические изменения в системе микроциркуляции с преобладанием гиперемических и застойных явлений в венулярном звене, к которым присоединяются реологические расстройства, связанные с внутрисосудистой агрегацией эритроцитов, нарушением функции тромбоцитов и локальным стазом в микрососудах. Эти процессы тесно связаны с вентиляционноперфузионными нарушениями, с воздействием гипоксии, гиперкапнии на микрокровоток [84].
5. Высокая степень системного воспаления, эндотелиальной дисфункции и оксидативного стресса.
Механизмы сосудистого повреждения при ХОБЛ реализуются прежде всего через активацию хронического воспаления, интенсификацию процессов свободно-радикального окисления на фоне бронхиального воспалительного повреждения и гипоксии [181, 243, 265, 271–274].
Ключевые положения, блок 4:
- ХОБЛ и ССЗ имеют общие факторы риска, такие как курение, возраст, пол, гиподинамия, ожирение.
- Исследованы патогенетические механизмы формирования и стабилизации АГ у больных ХОБЛ:
- нарушение функции автономной нервной системы с активацией САС;
- активация РААС (показано участие РААС в ремоделировании мелких бронхов, формировании легочного фиброза, легочной гипертензии и дисфункции скелетных мышц у больных ХОБЛ);
- сосудистое повреждение с повышением жесткости крупных сосудов.
- Общими патогенетическими механизмами развития ХОБЛ и сердечно-сосудистых заболеваний являются:
- системное воспаление. Локальное воспаление в бронхолегочной системе со spill-over-эффектом (эффект распространения провоспалительных цитокинов в системный кровоток);
- дисбаланс в системе «оксидант/антиоксидант» с формирование оксидативного повреждения на локальном и системном уровнях;
- эндотелиальное и сосудистое повреждение с ускорением процессов атерогенеза.
- Установлены следующие клинико-функциональные особенности АГ у больных ХОБЛ:
- нарушения суточного профиля АД с преобладанием повышения АД в ночной период, повышенная вариабельность АД;
- высокая частота поражения органов-мишеней (ремоделирование ЛЖ, почечное повреждение, сосудистое ремоделирование);
- изменения в системе тромбоцитарного гемостаза, реологии крови, нарушение тканевой перфузии.
6. ТЕРАПЕВТИЧЕСКИЕ СТРАТЕГИИ У ПАЦИЕНТОВ С ХОБЛ И АГ
6.1. Изменение образа жизни, коррекция факторов риска
К рекомендованным изменениям образа жизни с доказанным действием на уровень АД относятся ограничение соли, снижение употребления алкоголя, диета с большим потреблением овощей и фруктов, низкожировая и другие виды диеты, снижение и удержание массы тела и регулярные физические нагрузки [35, 275]. Абсолютно обязательным является отказ от курения для уменьшения сердечно-сосудистого риска и стабилизации АД [276, 277]. К традиционным немедикаментозным вмешательствам при ХОБЛ относят отказ от курения, программы физической реабилитации. У больных ХОБЛ на всех стадиях отмечается положительная динамика на фоне программ физической тренировки, что выражается как в улучшении переносимости физической нагрузки, так и в уменьшении одышки и слабости [5, 10, 84, 278–280].
6.2. Терапия ХОБЛ
Для лечения ССЗ и бронхолегочных заболеваний применяется широкий арсенал терапевтических средств и немедикаментозных подходов. Однако ведение больных с легочно-кардиальной коморбидностью остается серьезной проблемой из-за трудностей диагностики, взаимного отягощения течения каждой из коморбидных патологий, а также наличия межлекарственных взаимодействий и лекарственной ятрогении в условиях вынужденной полипрагмазии [281, 282].
6.2.1. Базисная бронхолитическая терапия
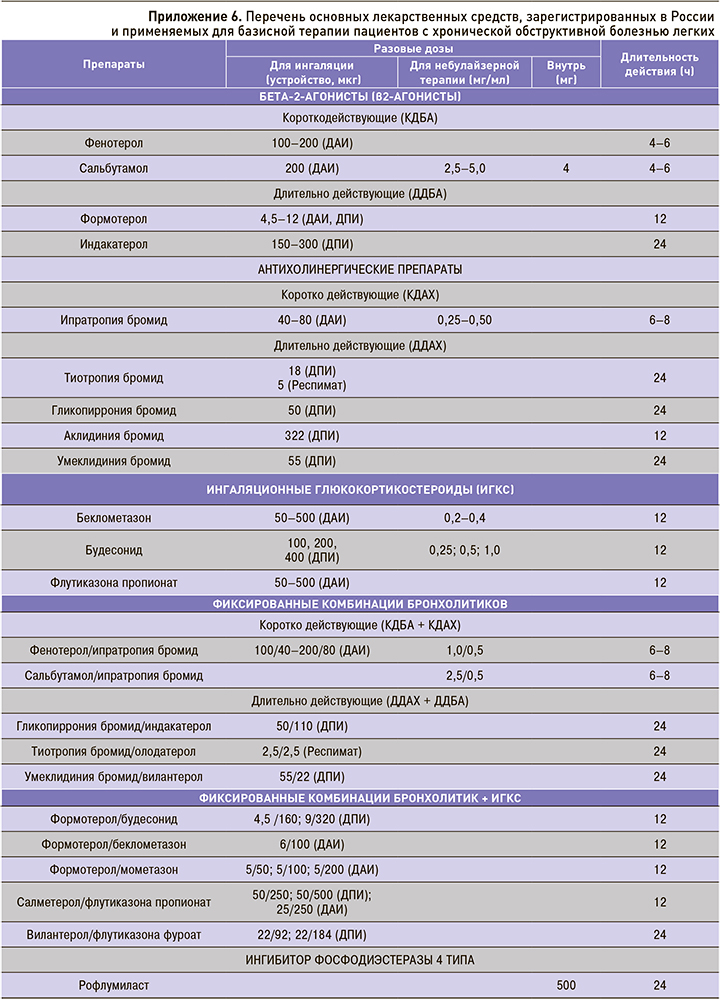
Установлено, что ни один из современных препаратов, используемых для лечения стабильной ХОБЛ, в долгосрочной перспективе не оказывает значительного влияния на прогрессирование заболевания, оцениваемое по средней скорости снижения ОФВ1, существенно не влияет на летальность. Центральное место в фармакотерапии ХОБЛ занимают два класса бронходилататоров: β2-агонисты и антихолинергические препараты. Согласно действующим клиническим рекомендациям, предпочтение отдается длительно действующим антихолинергическим препаратам (ДДАХ), длительно действующим β2-агонистам (ДДБА) и фиксированной комбинации ДДАХ/ДДБА. Применение данных ингаляционных препаратов в режиме монотерапии позволяет положительно влиять на функцию легких, симптомы и риск обострений ХОБЛ. Двойная бронходилатирующая терапия обеспечивает более стойкое, выраженное влияние на легочную функцию (включая легочную гиперинфляцию), степень одышки и качество жизни, риск обострений ХОБЛ в сравнении с монокомпонентной терапией и комбинацией ингаляционных глюкокортикостероидов (ИГКС) с ДДБА [10, 32, 283].
ИГКС у больных ХОБЛ назначаются дополнительно в составе двойной ИГКС/ДДБА или тройной ИГКС/ДДБА/ДДАХ терапии больным с высоким риском обострений заболевания, особенно при наличии сопутствующей бронхиальной астмы. В настоящее время эозинофилия мокроты или периферической крови не может быть использована в рутинной клинической практике как предиктор эффективного влияния ИГКС на риск обострений ХОБЛ, несмотря на данные, полученные в ходе анализа нескольких исследований [10, 284, 285].
На пересмотр дифференцированного подхода к выбору фармакотерапии ХОБЛ большое влияние оказали результаты широкомасштабного исследования ECLIPSE, свидетельствующие о том, что уровень ОФВ1 не является универсальным маркером тяжести ХОБЛ и не имеет строгой корреляции со степенью выраженности симптомов, риском обострений и влиянием болезни на пациента [31, 286].
В связи с этим уровень базисной терапии ХОБЛ в настоящее время определяется не степенью бронхиальной обструкции, а связан с выраженностью симптомов, частотой обострений и влиянием болезни на пациента по шкале CAT. Однако необходимо учитывать и тот факт, что у пациентов с коморбидной патологией (например, ХОБЛ+АГ) симптомы могут быть обусловлены не только респираторной, но и сердечно-сосудистой патологией. На практике это может привести к неоправданному увеличению объема и интенсивности такой терапии. Таким образом, при сохранении привычного уровня кашля, мокроты, одышки, частоты обострений не существует клинически обоснованного решения об усилении уровня и характера базисной терапии пациентов ХОБЛ [32, 287].
В последние десятилетия клинические рекомендации (руководства) стали основным документом, в котором определяются различные аспекты ведения больных ХОБЛ. Очень важным разделом клинических руководств являются алгоритмы ведения пациента и принятия клинических решений, основная проблема которых – достижение баланса между различными вариантами течения заболевания и простотой графического изображения. Важное условие применимости алгоритма в условиях реальной клинической практики – реалистичный подход.
Ниже представлен отечественный алгоритм, отражающий современные взгляды на дифференцированные подходы к ведению больных ХОБЛ [32] (рис.7). Особенностью алгоритма является его применимость врачами первичного звена (нет необходимости использования спирометрического теста в оценке тяжести функциональных нарушений) и начало базисной терапии с пролонгированных бронхолитических препаратов. Необходимо признать, что именно двойная бронхолитическая терапия пролонгированными ингаляционными препаратами на сегодняшний день повсеместно признается своеобразным «патогенетическим» лечением, поскольку выполняемое ими воздухоносное стентирование мелких бронхов достоверно уменьшает «воздушную ловушку» – основной функционально-структурный дефект («перераздутое легкое»), лежащий в основе патогенетических механизмов одышки и воспаления у пациентов ХОБЛ.
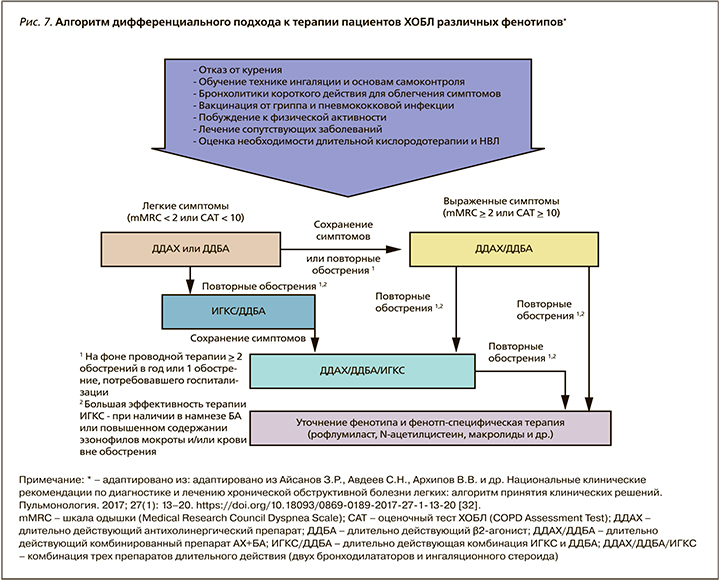
При наличии повторных обострений болезни (более 2 в год или более 1 с госпитализацией в стационар) в терапию пациентов ХОБЛ активно добавляются ингаляционные глюкокортикостероиды, которые, воздействуя на эозинофильный компонент воспаления, существенно уменьшают тяжесть и число обострений пациентов ХОБЛ, особенно при бронхитическом фенотипе, сочетании ХОБЛ и астмы и числе эозинофилов >2–3% или >200–300 клеток/мкл. Фенотипическая терапия пациентов с ХОБЛ возможна только по решению специалиста, обладающего навыком и знанием особенностей ее применения. Перечень основных лекарственных препаратов, зарегистрированных в России и применяемых для базисной терапии больных ХОБЛ, с дозировками и фармакодинамическими характеристиками представлен в приложении 6.
6.2.2. Действие бронхолитиков на сердечно-сосудистую систему
Необходимо отметить, что практически все бронхорасширяющие препараты, активно используемые в терапии ХОБЛ, влияют на сердечнососудистую систему, особенно у пациентов с ССЗ. Принято выделять «терапевтическое окно» дозировок лекарственных препаратов и выход за пределы указанного диапазона. Это имеет значение, поскольку бесконтрольное увеличение суточных доз β2-агонистов (как пролонгированных, так и короткого действия) и М-холинолитиков может существенно изменять ЧСС, уменьшать содержание калия, способствуя тем самым увеличению риска ишемических событий, проаритмогенных эффектов. Установлено также действие на тонус периферических сосудов, нестабильность АД (снижение ДАД и повышение САД), ухудшение сердечной недостаточности вплоть до формирования кардиомиопатий [288].
Агонисты β2-адренорецепторов. Считается, что изменение автономной функции сердца, связанное с ингаляцией агониста β2-адренорецептора, существенно увеличивает риск сердечно-сосудистых осложнений. Однако в исследовании M. Wilchesky et al. базисная терапия β2-агонистами короткого (КДБА) и пролонгированного действия (ДДБА) была связана с весьма скромным увеличением рисков [289]. Кроме того, описанные случаи ухудшения аритмии, увеличения частоты сердечного ритма у пациентов с ХОБЛ, ранее испытывавших аритмии и гипоксемию, существенно зависели от дозы используемого препарата и его рецепторной активности (полный или частичный агонист) [290].
Дозозависимые эффекты бронхолитиков мало изменяются при продолжающемся табакокурении, стаже ХОБЛ, хронических сосудистых заболеваниях, повышенном риске ССЗ. Проведенный метаанализ 24 РКИ по оценке безопасности ингаляционных ДДБА у пациентов ХОБЛ установил отсутствие повышения риска фатальных сердечнососудистых событий (ССС). Более того, в субанализе установлено достоверное снижение фатальных ССС при применении ДДБА как при длительном наблюдении, так в краткосрочных исследованиях (не более 6 мес) [291].
Показано, что ингаляционные бронходилататоры играют существенную роль в терапии пациентов с хронической сердечной недостаточностью (ХСН) из-за их возможности достоверно улучшать легочную функцию, особенно при наличии обструкции дыхательных путей [292].
Антагонисты мускариновых рецепторов (М-холинолитики). В метаанализе S. Singh et al. (2008) было установлено влияние М-холинолитиков на возрастание нежелательных кардиоваскулярные явлений [293]. В другом исследовании S. Singh et al. (2013) были также установлены проаритмические и проишемические эффекты пролонгированных М-холинолитиков у пациентов ХОБЛ [294].
Однако данные закономерности были полностью опровергнуты в крупном рандомизированным клиническом исследовании (РКИ) TIOSPIR (2013) и серии метаанализов [295–297].
Актуальным является проведенный N. Horita et al. (2017) и M.T. Wang et al. (2018) метаанализ всех РКИ применения пролонгированных М-холинолитиков (ДДАХ), пролонгированных β2-агонистов (ДДБА), комбинированных препаратов и пролонгированных ингаляционных глюкокортикостероидов (ИГКС). У пациентов ХОБЛ, принимавших тиотропия бромид, достоверно реже развивались ССС (ОР 0,83; 95% ДИ 0,71–0,98) и фатальные ССС (ОР 0,77; 95% ДИ 0,60–0,98). ОР для острого инфаркта миокарда, сердечной недостаточности и инсульта составил 0,78 (95% ДИ 0,59–1,02), 0,82 (95% ДИ 0,69–0,98) и 1,03 (95% ДИ 0,79–1,35) соответственно [298, 299]. Аналогичные результаты безопасности применения тиотропия бромида в терапии пациентов ХОБЛ получены и в ходе последнего метаанализа сравнения различных средств доставки: ингаляторов HandiHaler (18 мкг) или Respimat (5 мкг). Убедительно показано, что терапевтические дозы тиотропия бромида в различных системах доставки снижают риски неблагоприятных и фатальных сердечно-сосудистых событий пациентов ХОБЛ при периоде терапии более 12 мес [300].
Двойная бронходилатация – пролонгированные β2-агонисты и пролонгированные М-холинолитики. В настоящее время краеугольной стратегией терапии пациентов с ХОБЛ служит двойная бронходилатация с использованием фиксированной комбинации ДДАХ/ДДБА в одном ингаляционном устройстве. Несмотря на высокую терапевтическую дозу бронхолитиков, существенных мультипликативных или аддитивных взаимодействий между ДДБА и ДДАХ с точки зрения их сердечно-сосудистой безопасности для пациентов ХОБЛ установлено не было [135]. Более того, по данным систематического обзора с метаанализом на фоне терапии двойной фиксированной комбинацией ДДБА/ДДАХ пациентов стабильной ХОБЛ не обнаружил каких-либо существенных различий профиля сердечно-сосудистой безопасности по сравнению с лечением монокомпонентными препаратами [301].
Интересно, что при применении фиксированной комбинации умеклидиния бромид/вилантерол наблюдалась тенденция к повышению профиля сердечно-сосудистой безопасности (p=0,057), в то время как комбинация индакатерол/гликопиррония бромид достоверно уменьшала (p <0,05) тяжелые нежелательные ССС у больных ХОБЛ [302].
В других исследованиях достоверных различий по частоте развития осложнений со стороны сердечно-сосудистой системы между пациентами, получавшими тиотропия бромид/олодатерол, и пациентами групп сравнения не выявлено. В исследовании OTEMTO частота развития нежелательных явлений со стороны сердечно-сосудистой системы при использовании тиотропия бромида/олодатерола была даже ниже, чем при применении плацебо (группа тиотропия бромид/ олодатерола – 0,0–3,0%, группа тиотропия бромида – 1,0–1,5%, группа плацебо – 2,0–3,9%) [303].
Ключевые положения, блок 5:
- К традиционным немедикаментозным вмешательствам при АГ и ХОБЛ относятся отказ от курения, программы физической реабилитации, ограничение употребления соли и алкоголя, снижение массы тела.
- Базисная бронхолитическая терапия ХОБЛ в сочетании с АГ проводится по общепринятым алгоритмам. «Золотым стандартом» признается использование двойной бронхолитической терапии пролонгированными препаратами (ДДБА+ДДАХ).
- Современные бронхолитические препараты (β2-агонисты и М-холинолитики), используемые в терапевтических дозах, не оказывают негативного влияния на сердечно-сосудистую систему у больных АГ.
6.3. Антигипертензивная терапия у больных ХОБЛ и АГ
6.3.1. Общие принципы антигипертензивной терапии
В рекомендациях Европейского общества кардиологов/Европейского общества по артериальной гипертензии и Меморандуме экспертов Российского кардиологического общества (2018) обосновывается целый ряд положений по тактике ведения пациентов с АГ, которые претерпели изменения по сравнению с предыдущими рекомендациями [36]: Инициация антигипертензивной терапии. Произошел возврат к позициям рекомендаций ESC/ESH 2007 г. о необходимости назначения терапии пациентам с высоким нормальным АД: «…рассмотреть назначение антигипертензивной терапии при наличии ССЗ, особенно ИБС» (приложение 7).
Инициация антигипертензивной терапии у пожилых пациентов. Снижены уровни АД для инициации терапии и целевые показатели для пожилых пациентов. Уровень АД для инициации терапии АГ в возрасте 65–79 лет стал таким же, как в общей популяции пациентов: >140/90 мм рт.ст. (рекомендации ESC/ESH 2013 ≥160 мм рт.ст.) при хорошей переносимости терапии (приложение 8).
В рекомендациях сделан акцент на анализ преимущественно биологического, а не паспортного возраста (т.е. должны учитываться хрупкость, самостоятельность, переносимость терапии). В соответствии с клиническим статусом пациента необходимо индивидуализировать пороговый уровень АД для старта и целевые значения АД. У хрупких пациентов антигипертензивная терапия может рассматриваться при хорошей переносимости. Основное положение рекомендаций: в лечении не должно быть отказано или лечение не должно быть прекращено из-за возраста при условии хорошей переносимости терапии.
Терапия при низком–среднем риске с АГ 1 степени. Рекомендована, если у пациента сохраняется АГ после периода модификации образа жизни.
Целевые значения АД. Рекомендации ESC/ESH (2018) поддерживают концепцию более низкого целевого уровня АД у большинства пациентов с АГ (<130/80 мм рт.ст.). Однако предлагается определенная последовательность при достижении целевого АД: на первом этапе достижение уровня <140/90 мм рт.ст., далее при условии хорошей переносимости терапии <130/80 мм рт.ст. для большинства пациентов. Это позволяет индивидуализировать терапию с учетом особенностей пациентов. Введена нижняя граница для снижения САД и ДАД для пациентов с АГ – 120/70 мм рт.ст. (приложение 9).
Целевые уровни АД снижены как в общей популяции пациентов с АГ, так и при основных коморбидных заболеваниях (диабет, ХБП, ИБС, нарушения мозгового кровообращения/транзиторная ишемическая атака). Обоснована менее консервативная стратегия терапии у пациентов старших возрастных групп (65–79 и ≥80 лет): обозначены одинаковые цели лечения у пожилых и очень пожилых – АД менее 140 до 130 мм рт.ст. – с запретом снижать АД менее 130 мм рт.ст. Таким образом, провозглашен принцип интенсификации терапии во всех клинических группах пациентов [35]. Тактика антигипертензивной терапии. Традиционное назначение монотерапии у больных АГ и ступенчатый подход с наращиванием доз и количества препаратов приводит к тому, что большинство пациентовостаетсянамонотерапии. Рекомендации ESC/ESH (2018) утверждают концепцию, что инициальная терапия для большинства пациентов с АГ должна быть двухкомпонентной. Лишь ограниченный круг пациентов нуждается в монотерапии: это больные с низким исходным АД, близким к рекомендованной цели; хрупкие пожилые и очень пожилые пациенты, у которых более деликатное снижение АД может быть желательным (приложение 10, 11) [35].
Стратегия single pill для терапии АГ (стратегия одной таблетки) должна использоваться у большинства пациентов. Исследования показали прямую корреляцию между количеством принимаемых таблеток и плохой приверженностью к терапии; стратегия одной таблетки обеспечивает улучшение приверженности к терапии. Эта стратегия обеспечивает возможность для более прагматичного и простого подхода к терапии для контроля над АД у большинства пациентов с АГ. Стратегия одной таблетки является предпочтительной и в настоящее время доступна как в двойной, так и в тройной комбинации (приложение 10, 11).
Алгоритмы терапии АГ. Подтвержден принцип использования препаратов пяти основных классов как базовая терапевтическая стратегия терапии АГ. Разработан упрощенный терапевтический алгоритм с преимущественным использованием ИАПФ/БРА + БКК или/и тиазидовый/тиазидоподобный диуретик в качестве стартовой терапии для большинства пациентов с использованием бетаблокаторов по специальным показаниям (приложение 11). В рекомендациях впервые представлены алгоритмы терапии АГ как при неосложненном течении, так и при различной коморбидной патологии (ИБС, ХБП, диабет и т.д.) [35].
Для выбора оптимального препарата для лечения пациентов ХОБЛ и АГ необходимо учитывать следующие факторы:
- влияние препаратов, используемых для лечения ХОБЛ, на сердечно-сосудистую систему;
- влияние антигипертензивных препаратов на бронхолегочную систему;
- совместимость пульмонологических и кардиологических терапевтических стратегий;
- сопутствующие факторы риска и коморбидные состояния (дислипидемия, гиперурикемия, диабет, хроническая болезнь почек).
Проведенные исследования свидетельствуют о более высокой степени сосудистого и органного повреждения у пациентов с сочетанием АГ и ХОБЛ, что увеличивает сердечно-сосудистый риск и диктует необходимость индивидуализации схем терапии с подбором антигипертензивных препаратов с выраженными органопротективными, антиоксидативными и эндотелий-регулирующими эффектами в сочетании с базисной терапией ХОБЛ.
Не вызывает сомнения, что в лечении АГ при ХОБЛ оправдано назначение препаратов не только эффективно снижающих АД, но и отвечающих ряду требований:
- обеспечение 24-часового контроля АД при приеме 1–2 раза в сутки;
- адекватный контроль АД в ночные и ранние утренние часы;
- совместимость препаратов с базисными средствами лечения ХОБЛ;
- отсутствие эффектов, ухудшающих бронхиальную проходимость, усугубляющих гипоксию;
- положительное влияние на гемодинамику малого круга кровообращения;
- выраженные кардиои вазопротективные эффекты;
- отсутствие влияния гипоксии на фармакодинамику антигипертензивных препаратов [243, 245, 266, 267, 304, 305].
К желательным эффектам антигипертензивного препарата при наличии сопутствующей ХОБЛ относится воздействие на патогенетические звенья АГ при ХОБЛ – регресс системного воспаления и уменьшение влияний провоспалительных стимулов, антиоксидантная защита и положительное влияние на эндотелиальную функцию.
Не существует РКИ антигипертензивной терапии у пациентов с ХОБЛ и АГ. Проведенные исследования отличаются малой выборкой, небольшой длительностью наблюдения и из-за этого не позволяют оценивать жесткие конечные точки. Врачам, наблюдающим пациентов с АГ и ХОБЛ, важно понимать, что ни одна из клинических рекомендаций не подтверждена в ходе РКИ, рекомендации по антигипертензивной терапии основываются на исследованиях «случай–контроль» или согласованном мнении экспертов.
6.3.2. Тиазидные/тиазидоподобные диуретики
Тиазидные и тиазидоподобные диуретики не имеют прямых отрицательных эффектов на проходимость дыхательных путей и легочные функции [306]. Они могут быть полезны для профилактики задержки жидкости у больных ХСН, которая часто осложняет течение ХОБЛ.
Препараты этой группы в настоящее время рассматриваются в качестве инициации терапии у большинства пациентов с неосложненной АГ. Существует ограниченное количество исследований по изучению не только эффективности, но и безопасности тиазидных диуретиков у пациентов с ХОБЛ и АГ.
Тиазидные диуретики не имеют негативного влияния на дыхательные пути и могут быть эффективно использованы при ХОБЛ. Однако следует учитывать их потенциальные гипокалиемические эффекты. Эта проблема приобретает особую значимость в связи со способностью β2-агонистов и системных ГКС, используемых при обострениях ХОБЛ, вызывать гипокалиемию [307, 308]. Как известно, препараты первой группы влияют на транспорт калия внутрь клетки, а препараты второй группы могут немного увеличивать экскрецию калия с мочой. Необходимо отметить, что гипокалиемия выступает дозозависимым эффектом тиазидных диуретиков.
У пациентов с ХОБЛ и хронической гиперкапнией могут быть другие потенциальные проблемы при использовании диуретиков. Это прежде всего развитие метаболического алкалоза, который может подавлять активность дыхательного центра и усугублять гиперкапнию [309]. Кроме того, диуретики способны увеличивать гематокрит и нарушать мукоцилиарный клиренс в бронхиолах [310–312].
Индапамид обладает хорошим профилем эффективности и безопасности. В 28-недельном исследовании пациентов с АГ и ХОБЛ на базисной терапии бронходилататорами отмечено снижение АД и улучшение респираторных показателей [313]. Комбинированная антигипертензивная терапия у больных ХОБЛ, включавшая индапамид, сопровождалась достижением целевых цифр АД, нормализацией суточного профиля АД, снижением повышенной вариабельности и скорости утреннего подъема АД при отсутствии негативного влияния на клинические проявления ХОБЛ, вентиляционную функцию легких и уровень калия в сыворотке [314].
При мониторировании электролитов и газового состава крови использование диуретиков может быть безопасным. Кроме того, в современных схемах комбинированной антигипертензивной терапии диуретики используются в небольших дозах и часто с препаратами, способными уменьшить потери калия (ингибиторы АПФ, блокаторы рецепторов ангиотензина II).
Таким образом, прием тиазидных диуретиков в небольших дозах при ХОБЛ является безопасным, особенно в комбинациях с препаратами, блокирующими РААС.
Петлевые диуретики
Среди пациентов с нормальной функцией почек петлевые диуретики имеют меньший антигипертензивный эффект, чем тиазидные мочегонные средства. Это может быть связано с более короткой продолжительностью действия петлевых диуретиков. В то же время петлевые диуретики могут быть полезны у пациентов с ХОБЛ и резистентной АГ с объем-зависимыми механизмами резистентности и у пациентов, имеющих скорость клубочковой фильтрации (СКФ) <30 мл/мин/м2 [35]. Больные ХОБЛ с хроническим респираторном алкалозом, получающие глюкокортикоиды и β2-агонисты, при назначении петлевых диуретиков должны подвергаться тщательному мониторингу электролитов с назначением калийсберегающих средств [305]. Кроме того, при систематичном применении в высоких дозах они способны вызывать увеличение гематокрита, что ведет к нарушению тканевой перфузии. [315].
Калийсберегающие диуретики
Триамтерен и амилорид обладают минимальным антигипертензивным эффектом и широко не используются в лечении АГ [316]. Однако эти препараты могут иметь преимущество при добавлении к комбинированной терапии у пациентов с резистентной АГ. Нет специфических противопоказаний или данных по использованию этих препаратов у пациентов с ХОБЛ.
Антагонисты минералокортикоидных рецепторов Препараты этого класса доказали преимущество при включении в многокомпонентные схемы при резистентной АГ [121, 122, 317]. В европейских рекомендациях по АГ (2018) препараты этой группы присоединяются к трехкомпонентной схеме антигипетензивной терапии на третьей ступени [35]. Нет специфических противопоказаний к использованию этих препаратов у пациентов с ХОБЛ.
Спиронолактон следует использовать в качестве дополнительного средства для лечения резистентной АГ у пациентов с ХОБЛ. Присоединение к базисной терапии АГ у больных ХОБЛ спиронолактона ассоциировалось со снижением гипертрофии ЛЖ, размеров полостей сердца, легочной гипертензии и повышением контрактильной функции (р <0,05) [318].
6.3.3. Блокаторы кальциевых каналов
Недигидропиридиновые (верапамил, дилтиазем) блокаторы кальциевых каналов (БКК) обладают отрицательным хроно-, дромои батмотропным эффектами. Они противопоказаны у пациентов со сниженной фракцией выброса ЛЖ (<40%), однако могут с успехом использоваться у пациентов с ХОБЛ для контроля ЧСС при синусовой тахикардии, фибрилляции предсердий как антиангинальные препараты при стенокардии.
Дигидропиридиновые БКК изначально считались потенциально опасными у пациентов с ХОБЛ из-за ухудшения вентиляционно-перфузионного соотношения и усугубления гипоксемии (подавление компенсаторной вазоконстрикции артериол в условиях гипоксии в невентилируемых участках легких). Дальнейшие исследования показали незначительное ухудшение гипоксемии, которое компенсировалось за счет улучшения центральной гемодинамики [319].
БКК вызывают релаксацию гладких мышц в бронхиолах и ингибируют снижение ОФВ1, индуцированное физической активностью и метахолином. Они способны потенцировать β2-рецепторопосредованную бронходилатацию и уменьшать неспецифическую бронхореактивность, поэтому прием БКК может быть полезным у пациентов с ХОБЛ и АГ [310, 311].
Показана способность БКК улучшать гемодинамику малого круга, уменьшать степень легочной гипертензии. Учитывая увеличение ЧСС на фоне дигидропиридиновых БКК, что является нежелательным у больных ХОБЛ, которые демонстрируют тахикардию на фоне активации СНС и гипоксии, необходимо использовать ретардированные формы нифедипина, избегать высоких доз.
К числу дополнительных показаний для использования БКК относятся гипертрофия ЛЖ, атеросклероз сонных и коронарных, периферических артерий, изолированная систолическая АГ, стенокардия. Это связано с наличием плейотропных эффектов БКК, опосредованных влиянием прежде всего на процессы сосудистого, органного повреждения и атерогенеза [36].
Вазопротективные эффекты БКК связаны с их эндотелий-регулирующими, антиоксидантными свойствами. БКК дигидропиридинового ряда в эксперименте и в клинических исследованиях улучшают эндотелийзависимую вазодилатацию за счет увеличения активности NO (амлодипин, лацидипин, нифедипин, фелодипин) [320–325]. Дигидропиридиновые БКК, особенно липофильные его представители, такие как амлодипин и лацидипин, обладают антиоксидантными свойствами [323–327]. Антагонисты кальция ингибируют ПОЛ в клеточных мембранах путем биофизического взаимодействия с липофильным бислоем клеточных мембран. Нифедипин приводит к увеличению NO за счет антиоксидантных механизмов, ингибирует отложение ацетилированных ЛПНП в эндотелиальной клетке за счет NO-эффекта. Показано улучшение эндотелиальной функции при гиперхолестеринемии на фоне терапии нифедипином за счет уменьшения разрушения NO [324]. Амлодипин улучшает функцию эндотелия за счет увеличения продолжительности полураспада NO, ингибирует пролиферацию гладкомышечных клеток, предотвращая цитокин-опосредованный апоптоз. Липофильные БКК уменьшают экспрессию молекул адгезии – ICAM-1, VCAM-1 и E-селектин. Механизм антиагрегантного действия БКК связан со способностью угнетать синтез тромбоксана А2 и стимулировать высвобождение простациклина и NO. Показано также усиление высвобождения брадикинина под воздействием БКК [328, 329].
Такие свойства БКК дигидропиридинового ряда, как антиатеросклеротические, антипролиферативные (подавление миграции и пролиферации гладкомышечных клеток и макрофагов), антиагрегационные (увеличение NO тромбоцитов), также в определенной мере обусловлены NO-эффектом. В небольшом количестве открытых нерандомизированных исследований установлен ряд положительных эффектов БКК, в основном группы дигидропиридинов (амлодипин), у пациентов с ХОБЛ и АГ. К ним относятся снижение АД, коррекция суточного профиля с уменьшением количеств пациентов с повышением АД в пассивный период, органопротективные свойства (уменьшение гипертрофии ЛЖ, степени диастолической дисфункции, снижение альбуминурии), а также плейотропные эффекты (антиоксидантный, противоспалительный, эндотелий-регулирующий) [265, 272, 330, 331].
Вывод: БКК служат препаратами выбора у пациентов ХОБЛ и АГ.
6.3.4. Бета-адреноблокаторы
В рекомендациях ESC/ESH (2018) впервые в перечень факторов сердечно-сосудистого риска у больных АГ введена ЧСС (ЧСС покоя >80 в минуту). Бета-адреноблокаторы (ББ) рекомендованы на любой ступени терапии АГ при наличии специфических показаний (СН, стенокардия, после инфаркта миокарда, фибрилляция предсердий или молодые женщины беременные/планирующие беременность). Рекомендована комбинация ББ с любым антигипертензивным препаратом из основных классов в специфических клинических ситуациях, в том числе для контроля ЧСС [35]. Патогенетической особенностью АГ у больных ХОБЛ является высокий уровень активации СНС с увеличением ЧСС.
Традиционные представления, которые доминировали до последнего десятилетия, постулировали противопоказания к применению ББ у пациентов с любыми бронхообструктивными заболеваниями из-за способности вызывать обструкцию бронхов и конкурировать с β2-агонистами [332]. Поэтому многие интернисты избегали назначать ББ у пациентов с ХОБЛ. В последние годы произошел пересмотр традиционных представлений о месте и роли ББ при ХОБЛ [333–335].
Метаанализ показал, что как однократное, так и длительное назначение высокоселективных ББ не способно значительно влиять на показатели бронхиальной проходимости (ОФВ1), ответ на β2-агонисты или респираторные симптомы [336]. Даже пациенты с ХОБЛ, имеющие обратимый компонент бронхообструкции и использующие высокоселективные ББ, демонстрируют лишь незначительное снижение ОФВ1 при приеме первой дозы, которое нивелируется при постоянном применении препаратов [336, 337]. Кардиоселективные ББ, такие как метопролол, бисопролол и небиволол, могут с успехом применяться при ХОБЛ и АГ [338]. Неселективные ББ, такие как пропранолол, могут вызвать бронхоспазм и не должны быть использованы у пациентов с ХОБЛ. Однако даже высокоселективные ББ при назначении в высоких дозах могут терять свою кардиоселективность, поэтому необходимо избегать назначения высоких доз со старта и придерживаться принципа постепенной титрации.
Следует подчеркнуть, что атенолол, несмотря на свой относительно безопасный профиль у пациентов с ХОБЛ, имеет очень ограниченную эффективность при лечении АГ, в том числе небольшое или даже отрицательное влияние на центральное АД, артериальную жесткость (пульсовое давление), сосудистое сопротивление, профилактику поражений органов-мишеней. В связи с этим его следует избегать в качестве препарата выбора при лечении пациентов с ХОБЛ и АГ.
В течение последнего десятилетия в многочисленных метаанализах и ретроспективных обсервационных исследованиях показаны положительные эффекты ББ: снижение риска смерти на 22–61% у пациентов, поступающих в стационар с обострением ХОБЛ и на фоне стабильного течения, снижение частоты обострений ХОБЛ на 27–38% в различных когортах пациентов [336, 339–345]. Хотя РКИ не проведены, все доступные исследования подтверждают уменьшение смертности у больных ХОБЛ, принимающих ББ.
Во время инициации терапии ББ у пациентов с ХОБЛ необходимо мониторировать такие симптомы, как диспноэ, снижение толерантности к физическим нагрузкам, кашель, увеличение потребности в короткодействующих бронходилататорах. Безопасность инициации терапии ББ при ХОБЛ во время обострения не известна, однако здравый смысл предостерегает от такой терапии или диктует необходимость тщательного клинического и спирометрического контроля.
Принципы использования БАБ при ХОБЛ:
- применять селективные ББ (метопролол, бисопролол, небиволол), которые демонстрируют дозозависимую способность блокировать β2-рецепторы;
- неселективныый ББ (карведилол) не относится к препаратам выбора, поскольку чаще вызывает бронхоконстрикторные реакции, чем селективные β1-блокаторы;
- медленная титрация дозы β1-блокаторов с 1–2-недельным интервалом до достижения поддерживающей дозы;
- медленный темп титрации с мониторированием потенциальных побочных эффектов особенно актуален у пожилых пациентов с коморбидной патологией и во время обострений;
- применение ДДАХ может предупреждать потенциальные бронхоспастические реакции.
Метаанализ Salper et al. (2005) показал, что неселективные ББ уменьшают, а кардиоселективные улучшают эффект бронходилатации β2-агонистов вследствие сверхрегуляции β2-рецептора [336]. Постоянное использование ББ повышает чувствительность β2-адренорецепторов к дальнейшей стимуляции посредством увеличения их плотности в целевых тканях. В результате β1-адреноблокаторы могут даже улучшать эффективность β2-агонистов во время обострения посредством потенциирования бронхидолатационных эффектов. Этот парадоксальный терапевтический механизм еще широко не исследован [346, 347].
Таким образом, ББ могут быть использованы у пациентов с ХОБЛ и АГ при соблюдении принципов баланса эффективности и безопасности. Однако необходимо отметить, что в настоящее время ББ не позиционируются как средство выбора при инициальной терапии АГ, а применяются в схемах комбинированной антигипертензивной терапии, особенно у пациентов с ИБС, ХСН и нарушениями ритма.
6.3.5. Ингибиторы АПФ
Известно, что наиболее частым побочным эффектом ингибиторов АПФ (ИАПФ) является кашель, частота которого составляет от 5 до 20% [348]. Кашель обычно описывается как сухой, раздражающий, стойкий, редко продуктивный и, как правило, требует отмены препарата. Кашель – дозонезависимый симптом. Обычно он появляется вскоре после назначения препарата, однако может развиться и через месяцы, и даже годы приема. Замена ИАПФ другим препаратом той же группы устраняет кашель в единичных случаях. В ряде случаев у пациентов может быть аллергия на сульфгидрильную группу некоторых ИАПФ (каптоприл, зофеноприл). Важно понимать, что частота ИАПФ-индуцированного кашля у пациентов ХОБЛ не выше, чем в общей популяции [349]. Однако препараты этой группы способны ухудшать течение астмы. Увеличение уровня брадикинина и субстанции Р связано с этим нежелательным эффектом [311]. ИАПФ корректируют β2-агонист-индуцированную гипокалиемию [350].
В недавних исследованиях было показано, что прием ИАПФ связан со снижением падения легочной функции у курильщиков (ОФВ1). Этот протективный эффект сильнее выражен в отношении ОФВ1, чем в редукции легочных объемов. Это позволяет предполагать, что ИАПФ более эффективны в предупреждении развития обструктивных, чем рестриктивных легочных нарушений среди курильщиков [351].
К сожалению, исследования, включавшие пациентов АГ и ХОБЛ, были малочисленны, с краткой продолжительностью, без рандомизации и группы контроля. В этих исследованиях ИАПФсвязанные побочные эффекты встречались редко, переносимость терапии была хорошей, отмечался выраженный антигипертензивный эффект с коррекцией патологических суточных профилей АД, показателей тромбоцитарного гемостаза и тканевой перфузии [243, 270].
Также доказана позитивная ассоциация между использованием ИАПФ и улучшением функции скелетных мышц [352, 353].
Показано, что прием ИАПФ ассоциирован с уменьшением смертности у пожилых пациентов, госпитализированных с обострением ХОБЛ [354]. Значительная активация РААС как патогенетическая особенность АГ при ХОБЛ может служить дополнительным аргументом в пользу назначения этого класса препаратов.
6.3.6. Блокаторы рецепторов ангиотензина II
Важное обстоятельство применения блокаторов рецепторов ангиотензина I (БРА) – отсутствие кашля, редкие случаи ангионевротического отека. Пациенты с историей ИАПФ-индуцированного кашля демонстрируют одинаковую частоту этого побочного эффекта на БРА в сравнении с плацебо [355]. Однако в одном из исследований применение лозартана увеличивало частоту кашля – побочного эффекта, связанного с ингибированием эндогенного высвобождения NO [355]. В другой работе лозартан индуцировал метахолин-индуцированный бронхоспазм, вследствие чего уменьшал ОФВ1 [356]. Среди пациентов с симптомной астмой одно исследование также показало увеличение бронхиальной гиперреактивности на фоне БРА [357].
Блокада АТ1-рецепторов потенциально полезна, так как гипоксия стимулирует симпатическую нервную активность и опосредованно РААС [310, 311].
В канадском исследовании показано, что БРА улучшали и сердечно-сосудистые, и пульмонологические исходы, особенно в комбинации со статинами [350]. Ретроспективное когортное исследование показало, что прием БРА у пациентов с ХОБЛ связан со снижением смертности [358].
В небольших, неконтролируемых исследованиях продемонстрированы эффекты антагонистов АТ1-рецепторов у больных ХОБЛ: антигипертензивный эффект, органопротективное действие (снижение степени гипертрофии ЛЖ, легочной гипертензии, диастолической дисфункции ЛЖ), антиоксидантные, противовоспалительные, вазопротективные свойства при отсутствии клинически значимых побочных эффектов, в том числе на легочные функции [271, 304, 359].
Блокаторы РААС: общие свойства
Ангиотензин II – мощный вазоконстриктор, модулятор воспалительного ответа, клеточный ростовой фактор. АТ II вовлечен в воспалительный каскад, который служит важной патогенетической характеристикой ХОБЛ [228]. Поэтому блокада этой системы признается в настоящее время перспективным терапевтическим вмешательством при ХОБЛ.
Известно, что применение блокаторов РААС (ИАПФ/БРА) ассоциировано со снижением госпитализаций при ХОБЛ и общей смертности [345, 350, 360].
Влияние ИАПФ/БРА на смертность были показаны в большом ретроспективном исследовании у пожилых пациентов, которые госпитализировались с обострением ХОБЛ. После исключения влияния потенциальных конфаундеров (демографические характеристики, другие коморбидные состояния, используемые лекарственные препараты) было показано, что прием ИАПФ/БРА статистически значимо связан со снижением 90-дневной летальности [354]. Эти данные соотносятся с результатами другого ретроспективного исследования «случай–контроль» у двух когорт с различным сердечно-сосудистым риском. Применение комбинации статин + ИАПФ/БРА было связано со снижением госпитализаций и смертности у пациентов обеих групп (высокого и низкого сердечно-сосудистого риска) [350].
Показано снижение риска инфекционных осложнений, в том числе развития пневмоний у пациентов с ХОБЛ, принимающих ИАПФ/БРА [361]. У пациентов с АГ исследовалось влияние впервые назначенной терапии ИАПФ, БРА, БКК в сравнении с контрольной группой, принимающих диуретики, на развитие легочных осложнений (пневмонии, инфекций верхних дыхательных путей, ХОБЛ и других воспалительных состояний и ассоциированных заболеваниях). Использование ИАПФ и БРА значительно снижало частоту инфекций, воспаления и других исходов [361].
Основной недостаток всех вышеперечисленных исследований в том, что это были небольшие РКИ или же обсервационные, ретроспективные исследования. Доступных крупных РКИ по влиянию блокаторов РААС на смертность и обострения при ХОБЛ на сегодня нет.
Таким образом, блокада РААС имеет потенциальное двунаправленное кардиопульмональное воздействие. ИАПФ и БРА служат препаратами выбора у больных ХОБЛ и АГ.
6.3.7. Альфа-адреноблокаторы и альфаи бета-адреноблокаторы
Исследования по этим группам препаратов у пациентов с ХОБЛ проводились достаточно давно, в 80–90-е гг. прошлого века. Они подтвердили антигипертензивную эффективность и безопасность (отсутствие отрицательного воздействия на проходимость дыхательных путей) препаратов этих групп. В частности, празозин способен частично тормозить индуцированную холодным воздухом бронхоконстрикцию. Такие препараты могут быть использованы в схемах комбинированной терапии при резистентности АГ, но не как средство первого ряда [310]. Лабеталол не действует на проходимость дыхательных путей, однако карведилол из-за его очень слабой α1-блокирующей способности и выраженной неселективной β-блокады может потенциально увеличивать риск бронхоспазма. Однако у пациентов с ХСН карведилол не продемонстрировал негативного влияния на легочную функцию [310]. Комбинированные неселективные β1, 2 и α1-блокаторы (карведилол) могут применяться при ХОБЛ без обратимого компонента бронхообструкции. Альфа-адреноблокада может способствовать слабой бронходилатации. В исследовании A. Jabbour et al. при сравнении влияния карведилола на легочную функцию с метопрололом и бисопрололом у пациентов с ХОБЛ и ХСН установлено снижение ОФВ1 в группе карведилола и отсутствие динамики в группах метопролола и бисопролола [362]. Поэтому препараты этой группы не рассматриваются как средства выбора для антигипертензивной терапии у пациентов с ХОБЛ.
6.3.8. Антигипернтензивные препараты других классов
Агонисты α2-адренорецепторов уменьшают центральный симпатический тонус, активность РААС и относительно увеличивают активность парасимпатической нервной системы, что может приводить к бронхоспастическим реакциям. Кроме того, α2-агонисты могут потенциировать гистамин-индуцированный бронхоспазм, поэтому не рекомендуются к использованию у гипертензивных пациентов с ХОБЛ.
Применение более специфических препаратов для уменьшения центральной симпатической активности – агонисты I1-имидазолиновых рецепторов – не исследовано у пациентов ХОБЛ и АГ. Эти препараты могут назначаться как средства второй, третьей линии в комбинированных схемах антигипертензивной терапии.
Резюмирующая информация по применению антигипертензивных препаратов у пациентов с ХОБЛ приведена в таблице 3.
6.3.9. Комбинированная антигипертензивная терапия у больных ХОБЛ и АГ
При подборе комбинированной терапии необходимо следовать принципам, разработанным в рекомендациях по ведению АГ. В рекомендациях Европейского общества кардиологов/ Европейского общества по артериальной гипертензии (2018) с высоким классом и уровнем доказанности (IA) отдается предпочтение комбинированной терапии. Впервые провозглашен принцип назначения комбинированной терапии со старта у большинства больных АГ с использованием фиксированных комбинаций (стратегия single pill) (приложение 10, 11) [35].
К сожалению, пока недостаточно данных об эффективности различных схем антигипертензивной терапии при лечении пациентов с ХОБЛ и АГ. В одной из работ показано преимущество комбинации тиазидный диуретик + ИПФ/БРА и тиазидный диуретик + дигидропиридиновый БКК в сравнении с ББ + ИАПФ/БРА в плане снижении риска госпитализаций по поводу ХСН у пациентов с АГ и ХОБЛ без ХСН [363].
В исследовании отечественных авторов подтверждена антигипертензивная эффективность, безопасность, органо-, вазопротективные свойства, эндотелий-регулирующие, противовоспалительные эффекты, коррекция баланса оксидант/антиоксидант на фоне терапии БРА+БКК [181].
Таким образом, для фармакологического лечения АГ в сочетании с ХОБЛ не существует строгих рекомендаций и прямых правил, поскольку индивидуальные характеристики пациента могут изменять ответ на различные препараты и комбинации. Исходя из вышеизложенных особенностей патогенеза АГ у больных ХОБЛ и дополнительных (плейотропных) эффектов антигипертензивных препаратов, можно рекомендовать БКК, блокаторы РААС или комбинации БКК/ блокаторы РААС как средства преимущественного выбора. При недостаточном эффекте показаны тиазидные диуретики, высокоселективные ББ, особенно с дополнительными эффектами (небиволол, целипролол) или альфа1-адреноблокаторы [364].
Безусловно, наличие коморбидных заболеваний неизбежно приводит к вынужденной полипрагмазии. У пациентов с ХОБЛ и АГ список принимаемых лекарственных препаратов может составлять 5–6 наименований, и это необходимо учитывать при назначении фармакотерапии [281, 282]. Помимо учета возможных межлекарственных взаимодействий, в этом случае возникает проблема приверженности к терапии. Особенно это актуально для больных ХОБЛ, которые в условиях системной гипоксии и в период обострения заболевания переживают депрессивные расстройства, что снижает их приверженность к терапии.
Современная фармакотерапия АГ и ХОБЛ основана на применении фиксированных комбинаций бронхолитических (двойная бронходилатация) и антигипертензивных препаратов, что существенно повышает комплаенс и позволяет воздействовать на различные стороны патогенеза заболеваний.
Для терапии АГ у пациентов высокого риска в настоящее время разрабатывается концепция полипилл (сочетание в одной фиксированной комбинации двух антигипертензивных препаратов, статина и(или) ацетилсалициловой кислоты). Применение такого подхода у больных с коморбидной патологией потенциально может улучшить эффективность терапевтических вмешательств.
Ключевые положения, блок 6:
- Дополнительные требования к антигипертензивной терапии у больных ХОБЛ:
- адекватный контроль АД в ночные и утренние часы;
- отсутствие отрицательных эффектов антигипертензивных препаратов на бронхолегочную систему;
- совместимость антигипертензивных препаратов с базисными средствами лечения ХОБЛ;
- выраженные кардиои вазопротективные эффекты, противовоспалительное и эндотелий-регулирующее действие.
- Препаратами первой линии служат блокаторы РААС (патогенетическая терапия в условиях гиперактивации РААС, торможение легочных ремоделирующих эффектов, выраженное органопротективное действие, противовоспалительные, эндотелий-регулирующие эффекты, снижение частоты обострения ХОБЛ, влияние на прогноз).
- БКК также признаются средствами первой линии терапии (органопротективное действие, коррекция эндотелиальной дисфункции воспалительного и оксидативного сосудистого повреждения, коррекция легочной гемодинамики).
- ББ не являются препаратами выбора для инициальной терапии АГ, однако могут безопасно использоваться в комбинированной терапии, особенно у пациентов с сердечно-сосудистой патологией (ИБС, ХСН, аритмии).
- Комбинация БКК с блокаторами РААС рассматривается как средство преимущественного выбора.
- Принципы антигипертензивной терапии у больных с АГ и ХОБЛ: использовать препараты с максимальной продолжительностью действия для контроля АД в ночные часы; применять фиксированные комбинации для улучшения приверженности к терапии.
6.4. Применение статинов у больных ХОБЛ и АГ
В настоящее время терапия ХОБЛ включает два направления: симптом-модифицирующее (уменьшение симптомов ХОБЛ, улучшение толерантности к физической нагрузке и качества жизни) и болезнь-модифицирующее (влияние на прогноз – замедление прогрессирования ХОБЛ, предупреждение обострений ХОБЛ, снижение смертности) [10, 365].
Современные пульмонологические стратегии лечения ХОБЛ с использованием м-холинолитиков, β2-агонистов и ГКС уменьшают выраженность симптомов ХОБЛ, риск и тяжесть обострений, повышают переносимость физических нагрузок, улучшают качество жизни пациентов с ХОБЛ [10, 365], но существенно не влияют на смертность и не могут в значительной мере препятствовать прогрессированию заболевания.
В связи с этим необходим поиск новых препаратов для лечения ХОБЛ, влияющих на легочное и системное воспаление и оказывающих воздействие как на патологический процесс в легких, так и на системные внелегочные проявления ХОБЛ и коморбидные заболевания.
К новым противовоспалительным стратегиям в лечении ХОБЛ относится:
- применение ингибиторов фосфодиэстеразы-4. При этом следует отметить, что показанием к использованию рофлумиласта является лишь тяжелое течение ХОБЛ (постбронходилатационный ОФВ1 <50%) у пациентов с частыми обострениями ХОБЛ в анамнезе [366];
- создание новых препаратов для лечения ХОБЛ, механизм действия которых тесно связан с патогенезом ХОБЛ (антагонисты хемокиновых рецепторов, ингибиторы цитокинов, антипротеазы, ингибиторы phosphatidylinositol-3 киназы (IP3K), ингибиторы селектина, ингибиторы P38 митоген-активированной протеинкиназы). Их можно назвать препаратами будущего для лечения ХОБЛ [367–369];
- применение уже известных препаратов, назначаемых по другим показаниям, но обладающих антиоксидантными, противовоспалительными свойствами. К ним относятся N-ацетилцистеин, макролиды, блокаторы РААС, статины [370, 371]. Наиболее перспективным представляется изучение плейотропных эффектов статинов у больных ХОБЛ. В течение последних 10–12 лет появились работы, посвященные приему статинов у больных ХОБЛ, в которых были обнаружены следующие положительные эффекты этой группы препаратов: снижение смертности (общей, сердечно-сосудистой, от ХОБЛ), количества обострений и числа госпитализаций, повышение толерантности к физической нагрузке, уменьшение потребности в интубации, риска развития рака легких, ослабление снижения легочной функции [23, 24, 350, 367, 372–382].
Общеизвестно, что статины ингибируют синтез холестерина в печени, проявляя тем самым гиполипидемический эффект. Плейотропные эффекты статинов обусловлены тем, что при ингибировании синтеза предшественника холестерина (мевалоната) они прерывают образование продуктов каскада синтеза холестерина, а именно фарнезилпирофосфата и геранилгеранилпирофосфата, которые путем изопрениляции активируют внутриклеточные сигнальные регуляторные молекулы семейства GTP-связывающих белков (Ras, Rho, Rос), способствующие выработке цитокинов, хемокинов, ферментов молекул адгезии [24, 29, 239, 241, 383–386] (рис. 8).

Описаны следующие плейотропные (дополнительные) эффекты статинов у больных ХОБЛ:
- противовоспалительный – снижение уровня СРБ, продукции провоспалительных цитокинов и циклооксигеназы-2, участвующей в воспалительной реакции, торможение нейтрофильной инфильтрации и притока макрофагов;
- антиоксидантный – снижение уровня оксидантов, вызывающих оксидативный стресс;
- иммуномодулирующий – снижение концентрации провоспалительных цитокинов (ФНО-α, ИЛ-8), Т-хелперов, макрофагов, количества молекул гистосовместимости II класса (МНС-II), ответственных за развитие Th1-иммунного ответа;
- эндотелий-протективный – повышение уровня NO в крови, снижение активности процессов ПОЛ и адгезии лейкоцитов;
- антиадгезивный – снижение уровня молекул межклеточной ICAM и сосудистой адгезии VCAM-1, уменьшение матриксных металлопротеиназ, адгезии нейтрофилов и миграции моноцитов в стенку сосуда;
- ремоделирующий – ингибирование процессов фиброобразования, уменьшение выработки и высвобождения матриксных металлопротеиназ-2, -9, следовательно, уменьшение разрушения паренхимы легких;
- антитромботический эффект – уменьшение активации тромбоцитов и ингибиторов активатора плазминогена, повышение тканевых активаторов плазминогена, повышение экспрессии и активности на эндотелии белка тромбомодулина;
- торможение злокачественной трансформации клеток в легких [23, 239, 386, 387].
В работах отечественных авторов показаны противовоспалительные, эндотелий-протективные, антиоксидантные свойства розувастатина (Мертенил) на фоне терапии в течение 12 мес, а также клинические эффекты в виде уменьшения количества обострений и одышки, повышения толерантности к физической нагрузке, торможения темпов снижения легочной функции. Авторы делают вывод о целесообразности включения розувастатина в схемы терапии больных ХОБЛ, поскольку этот препарат воздействует на ключевые механизмы прогрессирования ХОБЛ и сердечно-сосудистое повреждение, способен модифицировать течение ХОБЛ и улучшать прогноз больных ХОБЛ [273, 274, 388–391].
В 2014 г. были опубликованы результаты единственного крупного проспективного рандомизированного плацебо-контролируемого исследования симвастатина на предупреждение обострений ХОБЛ – STATCOPE (Simvastatin in the Prevention of COPD Exacerbations) [392]. Это и не подтвердило ожидаемых результатов. Не было получено снижения количества обострений ХОБЛ и сердечно-сосудистых рисков на фоне терапии симвастатином, в то время как предшествующие обсервационные исследования демонстрируют 30–50%-ное снижение обострений ХОБЛ на фоне терапии статинами [23, 350, 354, 378].
Такое разногласие объясняется следующими фактами. В исследовании STATCOPE была создана рафинированная группа пациентов, не отражавшая общую популяцию больных ХОБЛ и реальную ситуацию в клинической практике. Пациенты с ХОБЛ, которые получали статины по поводу наличия ССЗ, сахарного диабета или которым требовалось назначение статинов в соответствии с наличием высокого сердечнососудистого риска, не включались в исследование STATCOPE. И это притом что манифестирующие или субклинические ССЗ у больных ХОБЛ встречаются до 75% случаев [393]. Именно коморбидный фенотип больного ХОБЛ имеет высокий уровень системного воспаления, высокий риск госпитализаций с обострениями ХОБЛ и высокую смертность. Что же касается исследования STATCOPE, то в него в соответствии с критериями включения вошли пациенты с низким сердечно-сосудистым риском, которые составляют всего ≈20–30% больных ХОБЛ. У этих пациентов не было показаний к назначению статинов в соответствии с американскими критериями Adult Treatment Panel III, они имели более низкий уровень системного воспаления и хороший прогноз [393].
Диссонанс результатов исследования STATCOPE (и ряда обсервационных исследований) также связан с его дизайном. Всем пациентам назначалась фиксированная доза симвастатина 40 мг, при этом не было понятия целевых значений ХС-ЛПНП. Доза 40 мг симвастатина в STATCOPE привела к снижению ХС-ЛПНП только на 23%; это меньше, чем ожидалось, и значительно меньше рекомендованного уровня [392]. В STATCOPE в группе плацебо была более низкая смертность за период наблюдения – 6%; это меньше по сравнению с другими исследованиями, например, с исследованием TORCH, где смертность была в 2 раза выше [394]. 73% пациентов в STATCOPE получали ингаляционные ГКС, а в обсервационных исследованиях – 7% пациентов. В STATCOPE значительно чаще использовалась дополнительная терапия кислородом (более 40%), а продолжительность терапии статинами была значительно короче (менее 2 лет в 56% случаев), чем в обсервационных исследованиях [392].
С одной стороны, ХОБЛ признается состоянием высокого сердечно-сосудистого риска, с другой стороны, это заболевание не входит ни в одни стратификационные схемы расчета рисков. В связи с этим назначение липидкорригирующей терапии у пациентов с ХОБЛ должно производиться по общепризнанным критериям, исходя из калькуляции риска по SCORE. Исследования показывают, что большинство пациентов с ХОБЛ без манифестирующей сердечно-сосудистой патологии, имеющие умеренную дислипидемию и небольшое повышение АД, при расчете риска относятся к категории высокого и очень высокого риска, и здесь основную роль играют такие критерии, как пол, возраст, курение [273, 274, 390, 391].
Всем пациентам с ХОБЛ необходимо рассчитывать сердечно-сосудистый риск в соответствии с клиническими рекомендациями, определять показания к назначению статинов и индивидуальные целевые значения ХС-ЛПНП [395].
Таким образом, у больных ХОБЛ и АГ целесообразным является применение комбинированных антигипертензивных и гиполипидемических препаратов. Идеальной с точки зрения влияния на патогенетические звенья АГ при ХОБЛ является комбинация ИАПФ + БКК + статин. Единственной фиксированной антигипертензивной двухкомпонентной комбинацией в сочетании со статином является лизиноприл + амлодипин + розувастатин. Применение такого подхода у больных с коморбидной патологией потенциально способно улучшить эффективность терапевтических вмешательств.
Ключевые положения, блок 7:
- Всем пациентам с ХОБЛ необходимо рассчитывать сердечно-сосудистый риск в соответствии с клиническими рекомендациями, определять показания к назначению статинов и индивидуальные целевые значения ХС-ЛПНП.
- Целесообразно применение комбинированных антигипертензивных и гиполипидемических препаратов.
7. ЗАКЛЮЧЕНИЕ
Таким образом, существует ряд отличительных особенностей АГ у больных ХОБЛ, что является основанием для выделения этой патологии в отдельный клинический вариант. У пациентов с АГ и ХОБЛ наблюдается высокая степень сосудистого и органного повреждения, что увеличивает сердечно-сосудистый риск и требует в перспективе рассмотрения вопроса о включении ХОБЛ в шкалы стратификации риска, диктует необходимость индивидуализации схем терапии с выбором антигипертензивных препаратов с выраженными органопротективными, антиоксидантными и эндотелий-регулирующими эффектами. У больных ХОБЛ необходимо использовать весь комплекс вмешательств, направленных на уменьшение сердечно-сосудистого риска.
8. ПРИЛОЖЕНИЕ
Приложение 3. Примеры формулировки диагноза ХОБЛ
Инструкция. При формулировке диагноза указываются:
- название болезни (ХОБЛ);
- при возможности фенотип (бронхитический или эмфизематозный);
- степень функциональных нарушений по критериям GOLD: легкие (80% <ОФВ1<100%); среднетяжелые (50% <ОФВ1<80%); тяжелые (30% <ОФВ1<50%); крайне тяжелые (ОФВ1<30%);
- выраженность симптомов: малые (CAT <10) – выраженные (CAT >10);
- частота обострений (менее 2 раз в год – более 2 раз в год);
- сопутствующие заболеванию феномены (рентгенологические);
- степень дыхательной недостаточности (ДН) по критериям SpO2: 94% <ДН=0 <99%; 90%<ДН=1<94%; 75%<ДН=2<94%; ДН=3<75%.
Пример 1: ХОБЛ: бронхитический фенотип, среднетяжелые функциональные нарушения (GOLD=2), малые симптомы (CAT=7), редкие обострения (<2 раз в год), мелкие бронхоэктазы обоих легких. ДН=1.
Пример 2: ХОБЛ: эмфизематозный фенотип, легкие функциональные нарушения (GOLD=1), малые симптомы (CAT=7), редкие обострения (<2 раз в год). ДН=1.