СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
- АГ – артериальная гипертония АД – артериальное давление
- АМКР – антагонисты минералокортикоидных рецепторов ББ – β-адреноблокаторы
- БРА – блокаторы рецепторов ангиотензина II ВСС – внезапная сердечная смерть
- ДДАХ – длительно действующий антихолинергический препарат ДДБА – длительно действующий β2-агонист
- ДДЛЖ – диастолическая дисфункция ЛЖ Евд – емкость вдоха
- ИАПФ – ингибиторы ангиотензинпревращающего фермента ИБС – ишемическая болезнь сердца
- КДАХ – коротко действующий антихолинергический препарат КДБА – коротко действующий β2-агонист
- КДО – конечно-диастолический объем
- КТ – компьютерная томография ЛГ – легочная гипертензия
- ЛЖ – левый желудочек ЛП – левое предсердие
- МЖП – межжелудочковая перегородка ММЛЖ – масса миокарда левого желудочка МРТ – магнито-резонансная томография ОЕЛ – общая емкость легких
- ООЛ – остаточный объем легких
- ОФВ1 – объем форсированного выдоха за первую секунду
- ОФВ1/ФЖЕЛ – объем формированного выдоха за первую секунду/функциональная жизненная емкость легких
- ПЖ – правый желудочек
- РААС – ренин-ангиотензин-альдостероновая система РКИ – рандомизированное контролируемое исследование САС – симпатоадреналовая система
- СИ – сердечный индекс
- СН – сердечная недостаточность
- СНнФВ – сердечная недостаточность со сниженной ФВ ЛЖ СНсФВ – сердечная недостаточность с сохраненной ФВ ЛЖ СРБ – С-реактивный белок
- ССЗ – сердечно-сосудистые заболевания ССС – сердечно-сосудистые события
- УО – ударный объем ФВ – фракция выброса
- ФЖЕЛ – функциональная жизненная емкость легких ЧДД – частота дыхательных движений
- ЧСС – частота сердечных сокращений
- ХОБЛ – хроническая обструктивная болезнь легких ХСН – хроническая сердечная недостаточность ЭХОКГ – эхокардиография
- BNP – В-тип натрийуретического пептида
- CAT – оценочный тест ХОБЛ (COPD Assessment Test)
- mMRC – шкала одышки (Medical Research Council Dyspnea Scale) NP – натрийуретический пептид
- NT-proBNP – N-концевой пептид натрийуретического гормона (В-типа) Ve/Va – показатель диастолической дисфункции левого желудочка
1. ВВЕДЕНИЕ
Цель настоящих рекомендаций – ознакомить врачей первичного звена с современными данными по ведению пациентов с хронической обструктивной болезнью легких (ХОБЛ) и хронической сердечной недостаточностью (ХСН), сформулировать диагностические подходы, алгоритмы ранней диагностики, принципы лекарственной терапии и обсудить проблемы межлекарственных взаимодействий.
Рекомендации являются актуальными для врачей общей практики, терапевтов пульмонологов, кардиологов, а также представляют интерес для врачей других специальностей.
Медицинская и социальная значимость ХОБЛ и ХСН не вызывает сомнений и обусловлена высокой частотой встречаемости этой коморбидной патологии, плохим прогнозом, трудностями диагностики и терапии.
Внедрение в повседневную клиническую практику терапевта данных рекомендаций позволит унифицировать подходы к ведению пациентов с ХОБЛ и ХСН и помочь врачам в принятии ежедневных практических решений.
Рекомендации разработаны с учетом научных и медицинских данных, доступных на момент их написания. При подготовке настоящих рекомендаций были использованы рекомендации Европейского общества кардиологов (ESC), Европейского респираторного общества (ERS), Российского респираторного общества (РРО), Общества специалистов по сердечной недостаточности (ОССН), Российского кардиологического общества (РКО).
2. ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ И ХРОНИЧЕСКАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ЭПИДЕМИОЛОГИЯ И ПРОГНОЗ
2.1. Определение, эпидемиология и прогноз ХСН
ХСН – это патофизиологический синдром, при котором в результате того или иного заболевания сердечно-сосудистой системы или под влиянием других этиологических причин происходит нарушение способности сердца к наполнению или опорожнению; оно сопровождается дисбалансом нейрогуморальных систем (ренин-ангиотензин-альдостероновой, симпатоадреналовой системы, системы натрийуретических пептидов, кинин-калликреиновой системы) с развитием вазоконстрикции и задержкой жидкости, что приводит к дальнейшему нарушению функции сердца (ремоделированию) и других органов-мишеней (пролиферации), а также к несоответствию между обеспечением органов и тканей организма кровью и кислородом и их метаболическими потребностями [1].
Приблизительно 1–2% взрослой популяции в развитых странах имеют сердечную недостаточность (СН), с преобладанием риска >10% среди пациентов в возрасте старше 70 лет [2–6]. Риск возникновения СН в возрасте 55 лет составляет 33% для мужчин и 28% для женщин [5]. Распространенность ХСН в различных регионах России варьирует в пределах 7–10% [7–12]. За 16 лет число пациентов с ХСН увеличилось в 2 раза (с 7,18 до 14,92 млн), а пациентов с тяжелой ХСН III–IV функционального класса – в 3,4 раза (с 1,76 до 6 млн человек) [13]. Больные ХСН стали достоверно старше: их средний возраст увеличился с 64,0±11,9 лет (1998) до 69,9±12,2 лет (2014) [13].
Применение современных диагностических и терапевтических стратегий, четких алгоритмов ведения пациентов с ХСН за последние 30 лет позволило увеличить выживаемость пациентов и уменьшить частоту госпитализаций больных ХСН со сниженной фракцией выброса (ФВ). Данные последних исследований ESC демонстрируют, что уровень смертности от всех причин для госпитализированных и амбулаторных пациентов с СН составляет 17 и 7% соответственно, а частота госпитализаций – 44 и 32% [14]. Большинство летальных исходов у больных СН (как госпитализированных, так и амбулаторных) происходит по сердечно-сосудистым причинам, главным образом вследствие внезапной сердечной смерти (ВСС) и ухудшения течения СН. Принципиальным является тот факт, что уровень госпитализации по сердечно-сосудистым причинам не менялся с 2000 по 2010 г., в то время как по другим причинам увеличивался [15]. Именно поэтому особую актуальность приобретает разработка терапевтических стратегий ведения коморбидной патологии при ХСН.
2.2. ХОБЛ – состояние высокого сердечно-сосудистого риска
Согласно современным представлениям, ХОБЛ является хроническим гетерогенным заболеванием, которое можно предотвратить и лечить. Оно характеризуется персистирующими респираторными симптомами и ограничением проведения воздушного потока, связанными с развитием аномалий структуры дыхательных путей и/или альвеол из-за значительного воздействия токсических частиц или газов. Такое хроническое воспаление может вызывать деструкцию паренхимы (ведущую к развитию эмфиземы) и нарушает нормальные восстановительные и защитные механизмы, препятствующие фиброзу мелких бронхов [16–17].
Распространенность ХОБЛ во взрослой популяции составляет в среднем 10–12%. В 2014 г. приблизительно у 15 млн американцев была диагностирована ХОБЛ. Заболеваемость увеличивается с возрастом от 2,6% в возрастной группе 18–34 лет до 12,5% у 75-летней популяции. Показано, что более 50% взрослого населения имеют легочную дисфункцию и игнорируют это заболевание, поэтому распространенность ХОБЛ может быть больше заявленной [18–19]. В настоящее время наблюдается значительный рост заболеваемости и смертности от ХОБЛ в мире [20]. Анализ смертности от 235 причин среди 20 возрастных групп населения земного шара в 1990 и 2010 г., опубликованный в декабре 2012 г. в журнале Lancet, демонстрирует, что ХОБЛ поднялась с 4-го на 3-е место в списке причин смерти в мире [21].
По данным эпидемиологических исследований, установлено, что прогрессирующее снижение функции легких является столь же сильным предиктором сердечно-сосудистой летальности, как и основные кардиоваскулярные факторы риска. В исследование The Lung Health Study было включено 5887 курильщиков в возрасте 35–60 лет с умеренной степенью бронхиальной обструкции. Для каждого из них 10%-ное уменьшение объема форсированного выдоха за первую секунду (ОФВ1) увеличивало общую смертность на 14%, сердечнососудистую – на 28%, риск развития ИБС – на 20% [22]. Риск развития сердечно-сосудистых заболеваний (ССЗ) у больных ХОБЛ в 2–3 раза выше, чем у людей, не страдающих ХОБЛ [23, 24].
Результаты Роттердамского исследования (the Rotterdam study), в которое вошло 14 926 человек (из них 1615 больных ХОБЛ), показали, что наличие ХОБЛ повышает риск ВСС. Особенно высок риск ВСС у больных с частыми обострениями ХОБЛ [25].
Таким образом, ХОБЛ в настоящее время признается независимым фактором риска развития сердечно-сосудистых осложнений и смертности.
2.3. ХОБЛ и ХСН – двунаправленна связь. Эпидемиология и прогноз
ХОБЛ и ХСН имеют общие предсуществующие факторы риска, особенно длительную историю курения, возраст, патофизиологические механизмы («кардиопульмональный континуум» и системное воспаление, активация нейрогуморальных систем), и часто сосуществуют.
Данные о распространенности ХОБЛ у пациентов с ХСН варьируют от 10 до 50% и выше у пациентов с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ), чем со сниженной ФВ [26]. Пациенты с сохраненной ФВ старше, чаще являются женщинами и имеют больше коморбидных состояний. Кроме того, существует точка зрения, что значительная доля пациентов с так называемой СН с сохраненной ФВ ЛЖ ошибочно диагностирована, так как многие из них имеют одышку вследствие ХОБЛ [27, 28]. Эксперты признают необходимость дальнейших исследований в этой области.
Пациенты с ХОБЛ имеют высокий риск развития ХСН [29], причем ХОБЛ увеличивает смертность у пациентов с ХСН; это увеличение более значительно в группе СН с сохраненной ФВ в сравнении с СН со сниженной ФВ [27, 30–32]. Распространенность ХСН среди пациентов ХОБЛ составляет в среднем 10–20%, хотя некоторые исследования показывают более высокий процент – 50% [33–35]. Этот диссонанс, вероятнее всего, означает, что большая пропорция пациентов, включенных в COPD-регистры, может иметь недиагностированную ХСН. Это может частично объяснить, почему значительная часть пациентов с ХОБЛ не получает кардиотропную терапию, но умирает от сердечно-сосудистых причин, а не прогрессирования респираторных заболеваний [25, 36–39].
Сердечно-сосудистые события – одни из основных, если не самые главные причины для госпитализации больных ХОБЛ [40]. Исследования по аутопсиям показали, что около 60% пациентов поступили и умерли от тяжелой ХОБЛ, из них скончались от сердечной недостаточности 37% пациентов, легочного эмболизма – 21%; остальные 28% умерли от пневмонии, но только 15% умерли вследствие прогрессирования ХОБЛ [41]. По результатам 12-летнего наблюдения G. Testa et al. (2016), смертность среди пациентов с диагнозом ХСН составила 68,6%, ХОБЛ – 56,9%; при сочетании ХОБЛ и ХСН этот показатель составил 86,2% [42].
В многоцентровом итальянском исследовании (частота сочетания ХСН и ХОБЛ в респираторных и кардиологических амбулаторных центрах – SUSPURIUM) распространенность ХСН среди пациентов с первичным диагнозом ХОБЛ была равна 11,9%, встречаемость ХОБЛ у пациентов с ХСН составила 31,5%. Пациенты с ХОБЛ и ХСН имели статистически значимо выше частоту артериальной гипертензии (АГ), были физически не активны и имели более тяжелую ХОБЛ (GOLD 3–4), были старше, чаще курили, имели более высокий функциональный класс ХСН [43].
В недавно опубликованном обсервационном исследовании распространенности некардиальной коморбидности у пациентов с сохраненной и сниженной ФВ ЛЖ было показано, что в среднем 24% пациентов с ХСН имеют ХОБЛ без статистически значимой разницы между клиническими вариантами СН; также отмечено значительное ухудшение прогноза у коморбидных пациентов [44]. Высокий процент диагностики ХОБЛ у пациентов с ХСН исследователи частично объясняют гипердиагностикой из-за пограничных или незначительно сниженных показателей спирометрии у пациентов с ХСН со сниженной ФВ.
Таким образом, результаты различных исследований продемонстрировали двунаправленный характер взаимосвязи ХОБЛ и ХСН. С одной стороны, ХСН ухудшает прогноз и увеличивает частоту госпитализаций у больных ХОБЛ. С другой стороны, отмечается увеличение распространенности ХСН и сердечно-сосудистых осложнений по мере нарастания степени тяжести ХОБЛ. Не вызывает сомнений наличие тесных патогенетических взаимосвязей этих двух патологий, требующих детального изучения.
Ключевые положения, блок 1:
- Сочетание ХОБЛ и ХСН является частой клинической ситуацией в терапевтической практике. Частота ХСН при ХОБЛ, по данным различных исследований, составляет 10–20%. Частота ХОБЛ при ХСН варьирует от 10 до 50%.
- ХОБЛ и ХСН имеют общие факторы риска.
- ХОБЛ и ХСН имеют двунаправленный характер взаимодействий. ХСН ухудшает прогноз частоту госпитализаций больных ХОБЛ, по мере нарастания степени тяжести ХОБЛ увеличивается распространенность и тяжесть ХСН.
- ХОБЛ – независимый фактор сердечно-сосудистого риска.
3. ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ И СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ – ПАТОГЕНЕТИЧЕСКИЕ ВЗАИМОСВЯЗИ
3.1. Механизмы формирования сердечной недостаточности у больных ХОБЛ
3.1.1. Морфофункциональные характеристики правых камер сердца
С момента первого описания легочной циркуляции в XVI в. наши знания о комплексном взаимодействии между сердцем и легкими постоянно совершенствуются [45]. В настоящее время признается, что существуют нейрогуморальные, механические взаимодействия между этими двумя органами и различные механизмы, которые ведут к структурным и функциональным изменениям желудочков на фоне коморбидных респираторных заболеваний.
Термин «легочное сердце», вероятнее всего, впервые предложен в 1931 г. Paul D. White [46]. В 1962 г. экспертный комитет Всемирной организации здравоохранения (ВОЗ) сформулировал следующее определение: «Гипертрофия правого желудочка (ПЖ) в результате болезней, поражающих функцию и/или структуру легких, за исключением легочного повреждения в результате первичного заболевания левых камер сердца» [47]. В дальнейшем легочная гипертензия (ЛГ) была включена в это понятие как причина гипертрофии и дилатации ПЖ [47]. На самом деле в настоящее время точность термина «хроническое легочное сердце» (ХЛС) вызывает сомнения. В недавнем исследовании в группе пациентов с ХОБЛ, обследованной с помощью эхокардиографии (ЭхоКГ) и катетеризации правых камер сердца, показано наличие гипертрофии и дилатации ПЖ в отсутствии легочной гипертензии [48, 49].
Основным патогенетическим механизмом легочного сосудистого повреждения и формирования ЛГ традиционно считалась гипоксия. Обсуждаются два механизма влияния гипоксии: легочная вазоконстрикция в результате острой гипоксемии и сосудистые структурные изменения легочного сосудистого русла (ремоделирование) на фоне хронической гипоксемии [50]. Опосредованно гипоксемия может быть связана с увеличением легочного сосудистого сопротивления через индукцию полицитемии и выделение провоспалительных медиаторов [51, 52]. Альвеолярная гипоксемия и легочная вазоконстрикция могут приводить к ремоделированию легочного сосудистого русла посредством следующих механизмов: переключения кровотока из областей региональной альвеолярной гипоксемией к зонам с лучшей вентиляцией; гипертрофии медии легочных артерий; пролиферации сосудистых гладкомышечных клеток в сосудах немышечного типа легочной гемоциркуляции [53, 54]. Когда значительная часть легких вовлекается в этот процесс, развивается легочная гипертензия с увеличением нагрузки на ПЖ, что приводит к его дилатации и гипертрофии и правожелудочковой сердечной недостаточности [55, 56].
Механические факторы, такие как потеря сосудистого ложа у пациентов с эмфиземой, тромбозами и гиперинфляцией, также связаны с увеличением давления в легочной артерии [57, 58]. Показана корреляционная связь между параметрами легочной функции (показатели обструкции) и функциональными характеристиками ПЖ [59].
Несмотря на доказательства взаимосвязи между гипоксемией/тяжелой ХОБЛ и ЛГ/дисфункцией ПЖ, недавние исследования показали наличия нарушения анатомии и функции ПЖ у пациентов без гипоксемии и легочной гипертензии, даже при ХОБЛ средней степени тяжести [48, 59, 60]. Эти данные подтверждают предположение, что легочное сердце – это континуум болезней правого сердца, который стартует гораздо раньше, чем дебютирует легочная гипертензия в покое. Небольшое изменение среднего давления в ЛА даже в пределах нормальных значений, так же как перемежающиеся изменения во время сна и физической нагрузки, играет важную роль в адаптивном увеличении толщины стенки ПЖ, дилатации и функциональном повреждении [49, 61, 62]. Несколько исследований также подтверждают клиническое значение диастолической дисфункции ПЖ у пациентов с ХОБЛ [63].
3.1.2. Современные представления о патогенезе СН у больных ХОБЛ
В литературе в качестве предикторов развития ХСН у больных ХОБЛ ранее обсуждались только изменения морфофункциональных характеристик правых камер сердца, по мере прогрессирования поражения которых в результате межжелудочковых взаимодействий происходит ремоделирование левого предсердия (ЛП) и левого желудочка (ЛЖ) [64–67]. В последнее время происходит пересмотр представлений о механизмах миокардиального повреждения и ремоделирования при ХОБЛ [68, 69]. Показаны прямые механизмы влияния ХОБЛ на миокард, в том числе ЛЖ, при отсутствии сопутствующих сердечно-сосудистых заболеваний (ИБС, АГ, сахарного диабета и других факторов) [70–75]. Ассоциация между ХОБЛ и ХСН является более комплексной с вовлечением множества факторов: механических и функциональных (снижение ОФВ1, эмфизема, гиперинфляция) [76–78], биологических (гипоксемия, воспаление, окислительный стресс, сосудистая жесткость, атерогенез) [79–81], нейрогуморальных (активация симпатоадреналовой системы (САС) и ренин-ангиотензин-альдостероновой системы (РААС)) [82] и генетических (полиморфизм металлопротеиназ, укорочение теломер) [83, 84].
Физиологический стресс, гипоксия [85–87]. Пациенты с ХОБЛ имеют постоянную (хроническая дыхательная недостаточность) или интермиттирующую (физическая нагрузка, обострения, период сна) гипоксию. Гипоксия может приводить к нарушению расслабления и контрактильности из-за изменений метаболизма кардиомиоцитов [88]. Одним из основных факторов нарушения расслабления и формирования диастолической дисфункции является нарушение транспорта внутриклеточного кальция в кардиомиоцитах на фоне гипоксии (перегрузка кальцием). Гипоксия также может быть вовлечена в патогенез атеросклероза посредством разнообразных механизмов, включая системное и сосудистое воспаление, повышение С-реактивного белка, активации оксидативного стресса [89, 90]. Ускорение процессов атерогенеза с ранним развитием ИБС, которое показано в многочисленных исследованиях у больных ХОБЛ, также вносит свой вклад в формирование СН. Кроме того, гипоксия может индуцировать гемодинамический стресс из-за увеличения ЧСС в результате активации САС [91, 92]. И наконец, гипоксия вовлечена в ремоделирование легочных сосудов с формированием легочной гипертензии и поражением правых камер сердца, что негативно влияет на наполнение ЛЖ в результате межжелудочковых взаимодействий. Активация нейрогуморальных систем (САС и РААС) на фоне гипоксии также приводит к прямым ремоделирующим эффектам с формированием гипертрофии, фиброза и функциональным изменениям [76].
Межжелудочковые взаимодействия. Межжелудочковые взаимодействия описываются как феномен, при котором повышение давление в ПЖ и увеличение его объема приводят к движению межжелудочковой перегородки (МЖП) в сторону ЛЖ с изменением его геометрии (D-shape). Дилатация ПЖ также увеличивает констриктивный эффект перикарда. Эти механизмы приводят к уменьшению растяжимости и наполнения ЛЖ [76] и объясняют, почему наблюдается сохраненная фракция ЛЖ, несмотря на субоптимальное наполнение.
Нейрогуморальная активация [53]. При обоих заболеваниях наблюдается активация системы РААС [53, 93, 94]. Важно, что активация РААС происходит не только в системной циркуляции, но и на тканевом уровне, особенно в легких [94, 95]. Ангиотензин II является потенциальным бронхиальным констриктором и обладает митогенным эффектом на легочные фибробласты. Кроме того, он может потенцировать апоптоз легочных эпителиальных клеток [96]. Также увеличение уровня ангиотензина II в легких может быть связано с уменьшением альвеолярного газообмена, увеличением легочного воспаления и легочной вазоконстрикции [95–97].
Другой, не вызывающий сомнений, механизм прогрессирования сердечной недостаточности – это симпатическая гиперактивация. Это приводит к down-регуляции и редукции плотности β1-адренорецепторов в миокарде [98]. Активация САС также приводит к увеличению частоты сердечных сокращений (ЧСС) с коротким периодом увеличения контрактильности и вазоконстрикции посредством активации РААС. Кроме того, это ведет к кардиотоксическим эффектам с индукцией апоптоза кардиомиоцитов, фокальными некрозами миокарда и развитием гипертрофии и дисфункции ЛЖ [99].
Таким образом, на фоне гипоксии, воспаления, оксидативного стресса, активации нейрогуморальных систем (РААС и САС) осуществляются прямые и опосредованные цитотоксические эффекты: повреждение кардиомиоцитов, апоптоз, ишемия в результате микрососудистой дисфункции, нарушение транспорта внутриклеточного кальция, что в результате приводит к структурно-функциональному (гипертрофия, диастолическая и систолическая дисфункция, фиброз) и электрическому (фибрилляция предсердий, желудочковые нарушения ритма) ремоделированию правого и левого желудочков с формирование симптомокомплекса СН (рис. 1).
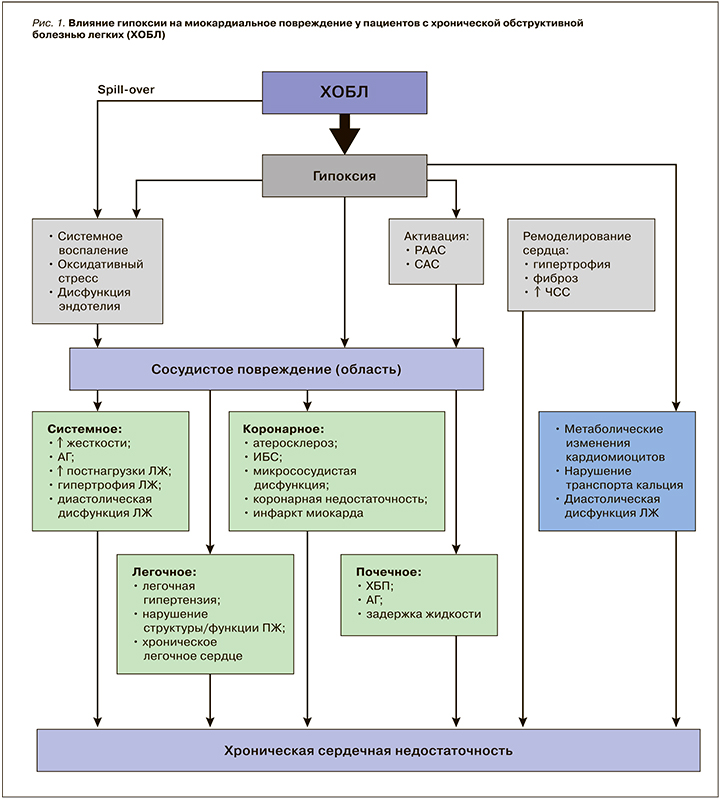
Также на поздних стадиях прогрессии обоих заболеваний существуют другие важные общие патогенетические механизмы. Оба заболевания имеют сходные типы метаболических расстройств – клеточные переключения с метаболизма глюкозы на липиды, приводящие к генерализованной мышечной дисфункции с развитием истощения и кахексии в конечных стадиях обоих заболеваний [100–102].
3.1.3. Влияние гиперинфляции и эмфиземы на левый и правый желудочки
Благодаря современным возможностям и широкому использованию различных методов визуализации, влияние эмфиземы и гиперинфляции на функцию ЛЖ с настоящее время исследовано в деталях.
Более 10 лет назад в работах K. Jorgensen показано, что гиперинфляция и высокое внутреннее положительное давление в конце выдоха приводят к уменьшению интраторакального объема крови и преднагрузки желудочков в результате «гиповолемической диастолы». K. Jorgensen et al. продемонстрировали значимое снижение конечно-диастолического объема (КДО) ПЖ и ЛЖ, сердечного индекса (СИ) и ударного объема (УО) у пациентов с тяжелой эмфиземой по сравнению с группой здоровых лиц и увеличение данных параметров после проведения хирургической редукции объема легких [103, 104]. Роль легочной гиперинфляции и эмфиземы в нарушениях внутрисердечной гемодинамики изучена в эхокардиографическом исследовании, проведенном H. Watz et al. у 138 больных стабильной ХОБЛ различной степени тяжести без сопутствующей кардиоваскулярной патологии. Авторами оценены взаимосвязи между показателями, характеризующими бронхиальную обструкцию, диффузионную способность легких, статическую гиперинфляцию и размерами камер сердца [105, 106]. В качестве характеристики статической гиперинфляции легких использовалось отношение емкости вдоха (Евд) к общей емкости легких (ОЕЛ) – Евд/ОЕЛ ≤0,25. Исследователи установили тесную корреляционную связь Евд/ ОЕЛ c конечно-диастолическим размером ЛЖ (r=0,56; p <0,001) и диаметром ПЖ (r=0,36; p <0,001). Больные ХОБЛ с величиной Евд/ОЕЛ<0,25 имели не только значимое нарушение диастолического наполнения ЛЖ, но и снижение индекса функции миокарда ПЖ (индекса Тея) по сравнению с пациентами с Евд/ОЕЛ >0,25. На основании проведенного многофакторного линейного регрессионного анализа показатель Евд/ОЕЛ был признан независимым предиктором развития диастолической дисфункции ЛЖ и нарушения глобальной функции ПЖ у больных ХОБЛ [106].
В других работах также показано влияние гиперинфляции на диастолическую функцию ЛЖ [107].
ХОБЛ влияет на конечно-систолическое и конечно-диастолическое напряжение стенки ЛЖ (по данным МРТ), что способствует увеличению массы миокарда ЛЖ (ММЛЖ) и диастолической дисфункции ЛЖ, ведущую роль в патогенезе играет гиперинфляция [108]. Основным механизмом диастолической дисфункции ЛЖ у больных ХОБЛ с выраженной гиперинфляцией является снижение преднагрузки [109, 110].
Известно, что не только статическая гиперинфляция легких оказывает негативное воздействие на функцию сердечно-сосудистой системы. В ряде исследований доказано, что динамическая гиперинфляция у больных ХОБЛ, которая развивается во время физической нагрузки, является главной причиной снижения ее переносимости, развития одышки и ухудшения функции миокарда ЛЖ [111–113]. Установлено, что нарастание степени динамической гиперинфляции при проведении кардиопульмонального нагрузочного теста сопровождается не только возрастанием уровня потребления кислорода, но и увеличением двойного произведения (произведение величин систолического артериального давления и ЧСС) [113]. Данный параметр коррелирует с миокардиальным потреблением кислорода, так как отражает степень напряжения стенки ЛЖ, его контрактильную способность и уровень ЧСС. Доказано, что уменьшение степени динамической гиперинфляции вследствие хирургической редукции объема легких у больных с тяжелой эмфиземой, как и проведение легочной реабилитации, сопровождается значительным улучшением гемодинамических показателей во время проведения кардиопульмонального нагрузочного теста [114].
В научной работе R.G. Barr et al. проведена комплексная оценка внутрисердечной гемодинамики и количественной распространенности эмфиземы с применением магнитно-резонансной томографии (МРТ) сердца и компьютерной томографии (КТ) легких у 2816 участников обсервационного исследования MESA-Lung Study (Multi-Ethnic Study of Atherosclerosis Lung Study), которые не имели клинических признаков сердечно-сосудистых заболеваний [115]. Исследователями установлена обратная линейная зависимость между степенью эмфиземы легких и величинами КДО, УО и сердечного выброса ЛЖ у больных ХОБЛ с сохраненной фракцией выброса ЛЖ.
В двух подысследованиях MESA определялась прямая связь между гиперинфляцией и массой миокарда ЛЖ (МРТ) и обратная – между степенью эмфиземы и площадью поперечного сечения просвета легочных вен, которая была меньше по сравнению с контрольными значениями (p=0,006). Регрессионная модель учитывала влияние пола, возраста, массы, АД и другие сердечно-сосудистые факторы риска. Уменьшение диаметра легочных вен на фоне эмфиземы отражает ремоделирование легочного кровотока, обусловленного деструкцией легочной паренхимы, гипоксической вазоконстрикцией, перераспределением кровотока в периферийные участки из-за чрезмерного повышения внутреннего положительного давления в конце выдоха. Эмфизема, гиперинфляция вызывает механическую компрессию камер сердца, повышает ригидность миокарда. Перечисленные изменения нарушают диастолическое наполнение ЛЖ [73, 74].
Впервые в работе B.M. Smith et al. установлена прямая взаимосвязь между величиной остаточного объема легких (ООЛ) как характеристики гиперинфляции и возрастанием ММЛЖ независимо от уровня АД и других факторов сердечно-сосудистого риска у больных ХОБЛ легкой и умеренной степени тяжести [74]. Одним из потенциальных механизмов развития гипертрофии миокарда ЛЖ, по мнению авторов, может быть нарушение механики дыхания. Чрезмерное повышение отрицательного внутриплеврального давления во время вдоха в условиях гиперинфляции сопровождается возрастанием напряжения стенки левого желудочка, которое в перспективе может приводить к увеличению его массы.
Таким образом, современные научные данные наглядно демонстрируют значимое влияние ключевых патофизиологических параметров ХОБЛ, таких как эмфизема и легочная гиперинфляция, на геометрические характеристики и параметры диастолической функции ЛЖ у больных ХОБЛ, не имеющих сопутствующей сердечно-сосудистой патологии и хронического легочного сердца (рис. 2) [105].

3.1.4. Морфофункциональные изменения левого желудочка при ХОБЛ
Многочисленные работы подтверждают раннее вовлечение в патологический процесс ЛЖ (гипертрофия, систолическая и диастолическая дисфункция) даже при среднетяжелой ХОБЛ без значимого поражения правых камер сердца и сопутствующей сердечно-сосудистой патологии, изменения параметров ЛЖ зависят от степени тяжести ХОБЛ [116–119].
При ХОБЛ часто формируется клинический вариант СН с сохраненной ФВ ЛЖ [120]. По данным исследования R. Marcun et al. (2016), клинический вариант ХСН с сохраненной ФВ ЛЖ встречается в среднем у 19% пациентов с ХОБЛ, поступивших в клинику с обострением ХОБЛ или с впервые диагностированным заболеванием. Пациенты с диагностированной ХСН были старше, имели большую ММЛЖ, размер ЛП и соотношение Ve/Va [121]. Кроме того, другие многочисленные коморбидные состояния при ХОБЛ (ожирение, диабет, артериальная гипертензия, хроническая болезнь почек, ИБС) являются доказанными факторами риска развития ХСН с сохраненной фракцией выброса ЛЖ. По данным крупного перекрестного исследования, в среднем 1/5 пациентов с ХОБЛ имеет СН и половина из них ХСН с сохраненной ФВ ЛЖ [121, 122]. Различная частота ХСН с сохраненной фракцией выброса связана с отличиями в когортах включенных пациентов и используемыми диагностическими алгоритмами.
Анализ крупной национальной когорты больных ХСН с сохраненной ФВ ЛЖ (США, 2843 пациента) показал, что они имеют более высокую частоту некардиальных коморбидных заболеваний, среди которых одно их первых мест занимает ХОБЛ [122].
Диастолическая дисфункция ЛЖ ассоциирована не только со степенью тяжести ХОБЛ, но и высоким уровнем провоспалительных маркеров (СРБ, матриксной металлопротеиназой-9, тканевым ингибитором тканевой металлопротеиназа-1, интерлейкином-6) [117, 123].
Другим патогенетическим механизмом развития гипертрофии миокарда ЛЖ может являться измененная сосудистая жесткость у больных ХОБЛ. В последнее десятилетие получены данные о повышении жесткости сосудистой стенки, наличии взаимосвязей между скоростью распространения пульсовой волны в аорте и степенью снижения объема форсированного выдоха за первую секунду (ОФВ1), тяжестью эмфиземы у больных ХОБЛ при отсутствии каких-либо признаков сердечно-сосудистых заболеваний и факторов риска их развития [124]. В свою очередь, увеличение скорости пульсовой волны в аорте нарушает диастолическую функцию ЛЖ, способствует развитию фиброза миокарда [125].
Основные патогенетические механизмы формирования СН у больных ХОБЛ представлены на рисунке 3.

3.2. Респираторные эффекты СН
Сердечная недостаточность – это синдром со значимым влиянием на легочные функции. Один из наиболее важных легочных эффектов ХСН – это периоды увеличения давления заклинивания легочных капилляров (давление заклинивания легочной артерии) и застоя в малом круге с интерстициальным и перибронхиальным отеком. Это состояние способствует уменьшению диффузионной способности и индукции ремоделирования легочного сосудистого русла в отдаленном периоде, приводя к гипертрофии стенки артериол [126, 127]. Также увеличение давления в легочной артерии может быть причиной вторичной левожелудочковой недостаточности [128]. Кардиомегалия, гидроторакс и гидроперикард также могут ограничивать внутригрудной объем и нарушать функцию легких и уменьшать легочные объемы [126].
При стабильной СН легочные функциональные тесты выявляют в основном рестриктивные изменения (пропорционально редукции легочных объемов). Снижение около 20% ОФВ1 и ФЖЕЛ (функциональная жизненная емкость легких) с коррекцией по возрасту, полу ожидаемо ввиду СН [129]. К счастью, ОФВ1 и ФЖЕЛ изменяются почти в одинаковой степени, по крайней мере у стабильных пациентов, у которых нет задержки жидкости. Поэтому отношение ОФВ1/ ФЖЕЛ (оба снижаются около 20%) меняется незначительно при сердечной недостаточности, когда спирометрия проводится в стабильной фазе болезни [129].
Острая декомпенсация или более тяжелая ХСН может приводить к бронхиальной обструкции (сердечная астма) со свистящим дыханием, удлиненным выдохом при физикальном обследовании, часто трудно отличимым от дыхательных шумов при истинной ХОБЛ [130, 131]. У пациентов со стабильной ХСН со сниженной фракцией выброса внутривенное введение 1 л физиологического раствора значительно снижает ОФВ1 и ОФВ1/ФЖЕЛ, но не ФЖЕЛ. В этом же исследовании показано отсутствие изменения этих показателей при введении такого же количества раствора контрольной группе здоровых [132]. При декомпенсации и тяжелой ХСН отек и застой в легких могут провоцировать бронхиальную гиперреактивность и механическую обструкцию бронхиол посредством увеличения интерстициального давления жидкости, что отражается на ХОБЛ-подобных (обструктивных) изменениях при функциональных легочных тестах [130, 131, 133–135]. После компенсации ХСН вентиляционные показатели могут улучшаться и даже нормализоваться [134–136]. Таким образом, обструкция из-за задержки жидкости и бронхиальной гиперреактивности может приводить к снижению ОФВ1/ФЖЕЛ менее 0,7 у пациентов с ХСН даже в отсутствии истинной ХОБЛ [135], что, безусловно, требует взвешенного подхода к диагностике ХОБЛ на фоне СН.
Ключевые положения, блок 2:
- Установлены патогенетические механизмы формирования СН у больных ХОБЛ:
- развитие легочной гипертензии и морфофункциональные изменения ПЖ и формирование ХЛС. Ведущие патогенетические механизмы: острая и хроническая гипоксемия (легочная вазоконстрикция, ремоделирование легочного сосудистого русла). Влияние на ЛЖ вторично в результате межжелудочковых взаимодействий;
- патогенетические механизмы формирования сочетанного поражения ЛЖ и ПЖ: гипоксия, воспаление, оксидативный стресс, активация нейрогуморальных систем (САС, РААС) с прямым цитотоксическим воздействием на кардиомиоциты (апоптоз, ишемия, перегрузка кальцием, структурное и электрическое ремоделирование);
- влияние гиперинфляции и эмфиземы на ПЖ и ЛЖ (уменьшение внутрисердечных объемов, гипертрофия, диастолическая дисфункция).
- Показано преобладание среди пациентов с ХОБЛ клинического варианта сердечной недостаточности с сохраненной ФВ.
- Установлены патогенетические механизмы нарушения респираторных функций у больных ХСН: задержка жидкости, застой в малом круге кровообращения с интерстициальным и перибронхиальным отеком, которые приводят к:
- механической обструкции бронхиол на фоне увеличения интерстициального давления (обструктивным изменениям);
- уменьшению легочных объемов (рестриктивным изменениям);
- повышению бронхиальной реактивности;
- уменьшению диффузионной способности легких.
4. КЛИНИКА И ДИАГНОСТИКА ХОБЛ И ХСН
4.1. Клиническая симптоматика
ХОБЛ и СН имеют сходные симптомы и клинические признаки, которые могут маскировать респираторную или кардиальную симптоматику. Диагностика каждого из этих состояний в присутствии другого затруднена ввиду сходности клинической симптоматики. ХОБЛ маскирует систолическую и диастолическую дисфункцию ЛЖ и, наоборот, при первичном диагнозе СН симптомы ХОБЛ могут трактоваться как проявление сердечной недостаточности. Диспноэ – кардинальный симптом как сердечной недостаточности, так и ХОБЛ. К общим симптомам относятся одышка в покое и при нагрузке; ночная одышка; плохая переносимость физической нагрузки; кашель; отеки нижних конечностей; усталость и быстрая утомляемость; свистящее дыхание; дискомфорт в груди; сердцебиение. Клинические признаки, определяемые при физикальном осмотре, также могут быть одинаковыми: хрипы в легких; симметричные отеки лодыжек; шумы в сердце; расширение яремных вен; смещение верхушечного толчка; тахикардия; увеличение печени. Хрипы при отеке легких могут быть не слышны из-за гиперинфляции при ХОБЛ.
Присутствие одной болезни может помешать правильной диагностике другого заболевания. Пациент с известной ХОБЛ и усилением одышки чаще трактуется как обострение ХОБЛ, чем декомпенсация ХСН или острая СН. У пациента с известной СН при усилении одышки при физической нагрузке или появлении в покое чаще диагностируется декомпенсация СН, чем предпринимаются попытки поиска другой причины. Кроме того, коморбидность ХОБЛ и ХСН может значительно влиять на терапевтические стратегии при обоих состояниях и усугублять исходы.
В многочисленных исследованиях показана гиподиагностика СН и ХОБЛ на фоне друг друга. В хорошо спланированном исследовании у пациентов с диагнозом ХОБЛ или ХСН, поставленным в соответствии с современными рекомендациями, проводился анализ клинической симптоматики и дополнительное, с соблюдением всех стандартов, обследование (спирометрия для пациентов с ХСН и эхокардиография, уровень BNP у пациентов с ХОБЛ). В результате признаки ХСН с систолической дисфункцией ЛЖ и увеличением BNP были обнаружены у 17% пациентов с ХОБЛ. Бронхиальная обструкция соответствующая критериям ХОБЛ у 37,3% пациентов с ХСН [137].
Ключевые положения, блок 3:
- ХОБЛ и СН имеют сходные симптомы и клинические признаки, которые могут маскировать респираторную или кардиальную симптоматику:
- общие симптомы: одышка в покое и при нагрузке; ночная одышка; плохая переносимость физической нагрузки; кашель; отеки нижних конечностей; усталость и быстрая утомляемость; свистящее дыхание; дискомфорт в груди; сердцебиение;
- общие клинические признаки: хрипы в легких; симметричные отеки лодыжек; шумы в сердце; расширение яремных вен; смещение верхушечного толчка; тахикардия; увеличение печени.
- Присутствие одной болезни может помешать правильной диагностике другого заболевания. В многочисленных исследованиях показана гиподиагностика СН на фоне ХОБЛ и наоборот, что может влиять на терапевтические стратегии и прогноз.
4.2. Диагностика СН на фоне ХОБЛ
До конца XX в. считалось, что ХСН редко диагностируется при ХОБЛ, чаще встречается ПЖ недостаточность (хроническое легочное сердце) у пациентов с длительно текущей тяжелой ХОБЛ. В 2003 г. McCullough et al. показали, что 21% пациентов с ХОБЛ и астмой, поступивших в отделение интенсивной терапии с усугублением одышки, имеют ранее не диагностированную левожелудочковую недостаточность [138]. Подобные результаты были опубликованы в 2005 г. и у пожилых пациентов с ХОБЛ, диагностированной врачами общей практики [139]. В настоящее время не вызывает сомнения, что частота выявления ХСН на фоне ХОБЛ далека от реальной, имеет место гиподиагностика, что влияет на тактику ведения и прогноз.
Диагностика ХСН у пациентов с ХОБЛ проводится согласно существующим рекомендациям [1, 2]. Алгоритм диагностики СН в неострой ситуации следующий: рекомендовано начинать с анализа клинико-анамнестических данных и ЭКГ покоя, при наличии подозрений на СН далее следует скрининг натрийуретических пептидов для выявления группы пациентов, которые нуждаются в ЭхоКГ (исследование назначается при повышении NР выше порога исключения или при невозможности определить NР) (приложение 1). В европейских рекомендациях по диагностике и лечению острой и хронической сердечной недостаточности 2016 г. впервые были выделены клинические варианты СН в зависимости от ФВ ЛЖ и даны рекомендации по диагностике (приложение 2). Выделение клинического варианта ХСН с промежуточной и сохраненной ФВЛЖ значительно повышает распространенность и вероятность выявления СН у больных ХОБЛ ввиду наличия общих факторов риска, клинических признаков и патофизиологических путей миокардиального и легочного повреждения при данной коморбидности [2].
Однако нужно принимать во внимание ряд особенностей, касающихся интерпретации данных дополнительных методов исследования при СН, способность ХОБЛ влиять да результаты лабораторно-инструментальных тестов.
Электрокардиография (ЭКГ). Отсутствие отклонений на ЭКГ покоя с высокой степенью вероятности исключают наличие систолической сердечной недостаточности при рутинной диагностике СН. Однако при ХОБЛ ЭКГ может иметь неспецифические отклонения, не позволяющие подтвердить/исключить ХСН (отклонение электрической оси сердца вправо, блокада ПНПГ, P-pulmonale, гипертрофия ПЖ, маскирующая гипертрофию ЛЖ). На фоне гипоксемии при ХОБЛ характерны изменения конечной части желудочкового комплекса (инверсия T, депрессия S-T), которые также носят неспецифический характер [140]. На ЭКГ могут фиксироваться различного рода смешанные изменения: p-pulmonale и отклонение электрической оси сердца влево; p-pulmonale и БЛНПГ и прочие, которые заставляют задуматься о коморбидной патологии, но не являются подтверждением диагноза. Кроме того, ЭКГ не дает информацию о диастолической дисфункции ЛЖ [140].
Рентгенография грудной клетки. Гиперинфляция маскирует размеры сердца и ремоделирование легочных сосудов и может затруднить визуализацию интерстициального отека [141, 142]. Гиперинфляция уменьшает кардиоторакальный индекс. Ремоделирование легочных сосудов и изменение альвеолярно-капиллярной мембраны фоне ХОБЛ защищает легкие от отека и маскирует рентгенологические признаки интерстициального отека легких. Ассиметричные, локальные и ретикулярные изменения являются общими как для СН, так и для ХОБЛ. Изменения сосудистого русла на фоне эмфиземы приводят к нарушению венозной циркуляции в верхних долях легких, что может имитировать СН [143–147].
Эмфизема из-за диффузной деструкции капиллярной сети может быть причиной атипичных изменений при отеке легких [140].
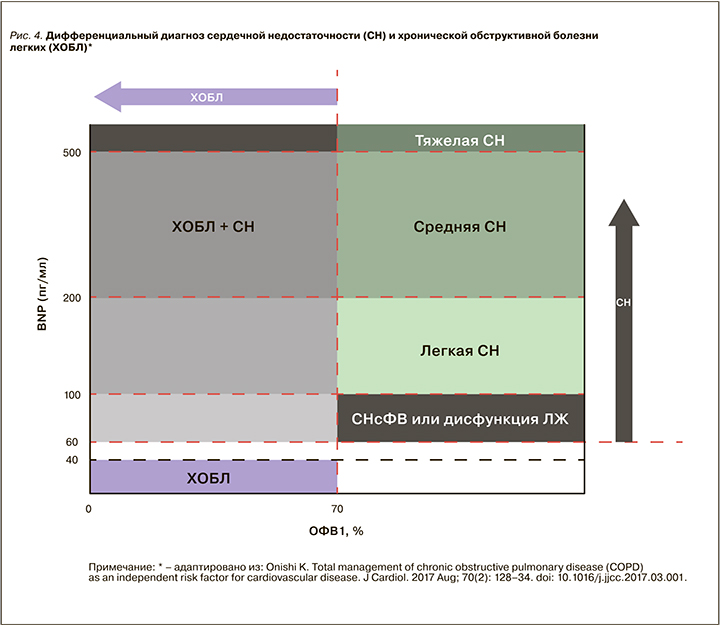
Натрийуретические пептиды. В соответствии с современными рекомендациями определение натрийуретических пептидов (NP) может быть использовано в качестве начального диагностического теста [2]. Повышение NP позволяет определить первоначальный диагноз и произвести селекцию пациентов для дальнейшего обследования. У пациентов с нормальными значениями NP вероятность СН низкая. Для пациентов в стабильном состоянии вне обострения верхняя граница нормальных значений для BNP составляет 35 пг/мл и для NT-proBNP – 125 пг/мл. Уровень NT-proBNP >125 пг/мл и/или BNP >35 пг/мл в сочетании со структурной патологией сердца (например, увеличение ЛП) или диастолической дисфункцией означает диагноз СН с сохраненной ФВ у пациентов с симптомами и клиническими признаками.
В острой ситуации максимально допустимые значения границ составляют 100 и 300 пг/мл соответственно. Этот диагностический алгоритм применим как для пациентов с сердечной недостаточностью с низкой ФВ (СНнФВ), так и сердечной недостаточностью с сохраненной ФВ (СНсФВ), у пациентов с сохраненной ФВ ЛЖ значения ниже [148, 149]. Позиция современных рекомендаций: определение NP необходимо не для подтверждения СН, а для исключения ее наличия. Среди факторов, ослабляющих диагностическую ценность NP, – возраст, фибрилляция предсердий, почечная недостаточность (повышение уровня NP), при ожирении уровни NP могут снижаться [149–151].
У пациентов с ХОБЛ плазменные натрийуретические пептиды – достоверные маркеры в диагностике СН со сниженной ФВ ЛЖ. Уровень BNP для исключения СНнФВ 100 пг/мл. Значения от 100 до 500 пг/мл могут быть при легочном сердце, умеренной ЛЖ дисфункции или при сочетании [152]. Уровень BNP >500 пг/мл у пациентов с ХОБЛ с клиникой обострения должен вызывать подозрение в отношении явной СН и является поводом для назначения активной терапии СН [140, 152]. NT-proBNP <300 пг/мл исключает СНнФВ у пациентов ХОБЛ [153]. Значения NT-proBNP >450 пг/мл (для пациентов <50 лет) и NT-proBNP >900 пг/мл (у пациентов >50 лет) выявляют СНнФВ у пациентов с острым диспноэ [153].
В исследовании Rutten et al. среди 405 пациентов с ХОБЛ СН была диагностирована в 20,8% случаев. Повышение NT-proBNP имело высокую отрицательную предиктивную значимость для исключения СН в этой группе пациентов [154]. В исследовании McCullough et al. у пациентов, поступающих в отделения интенсивной терапии с диспноэ с диагнозом ХОБЛ/астма, средние значения получены BNP 587 и 108,8 пг/мл для пациентов с и без СН соответственно.
Пограничное значение BNP 100 пг/мл имело следующие статистические значения: чувствительность 93,1%, специфичность 77,3%, положительное предиктивное значение 51,9%, отрицательное предиктивное значение 97,7%, точность 80,6% [155]. Изменения ПЖ и легочная гипертензия могут способствовать повышению NT-proBNP (и других маркеров) даже при отсутствии систолической дисфункции ЛЖ [156–158].
Однако в настоящее время не существует четких алгоритмов использования NP в группе ХОБЛ и ХСН. Показана тенденция к повышению NP у пожилых с АГ, при легочном сердце, фибрилляции предсердий, состояниях, которые часто ассоциированы с ХОБЛ. Необходимо проведение дополнительных исследований для определения роли натрийуретических пептидов в диагностике и определении прогноза у пациентов ХОБЛ. Современные представления по использованию NP при дифферециальной диагностике ХОБЛ и СН представлены на рисунке 4.
Эхокардиография. ЭхоКГ в настоящее время признается референсным тестом в диагностике СН. Правильность проведения и оценки параметров ЭхоКГ особенно важна для диагностики СН с сохраненной и промежуточной ФВ ЛЖ. В рутинной клинической практике должны исследоваться следующие параметры трансторакальной эхокардиография: размер ПЖ, размер ПП, среднее давление в легочной артерии, систолическая и диастолическая функция ЛЖ, размеры ЛЖ и ПП, показатели гипертрофии ЛЖ.
Технические сложности и ограничения при ХОБЛ: узкое акустическое окно, неадекватная визуализация в условиях гиперинфляции, эмфиземы, ожирения [159]. По данным исследований, плохая визуализация при ХОБЛ наблюдается у 10,4% пациентов [160]. Эта пропорция увеличивается до 35% у пациентов среднетяжелой ХОБЛ и до 50% при тяжелой ХОБЛ [160]. Тем не менее выявленные изменения при ЭхоКГ часто ложатся в основы диагноза СН у пациентов с ХОБЛ в условиях малой диагностической значимости других критериев.
Магнито-резонанснаятомография. МРТ является референсным стандартом в оценке размеров полостей сердца и фракции выброса. Рекомендуется для оценки функции ЛЖ у пациентов СН в условиях плохой визуализации. Показатели МРТ сердца не меняются в условиях гиперинфляции и эмфиземы. МРТ позволяет точно изменить размеры правых камер сердца и систолическую функцию ПЖ. Сочетание измеренных с помощью МРТ ФВ ЛЖ, объемов ПП и ЛП и конечно-систолического размера ЛЖ имеет высокое диагностическое значение для верификации СН. Однако использование этого метода в реальной клинической практике ограничено высокой стоимостью [140].
Таким образом, скрининг уровня натрийуретических пептидов и выполнение ЭХОКГ у амбулаторных и стационарных пациентов с ХОБЛ может быть стратегией раннего выявления СН и выделения пациентов высокого риска с коррекцией применяемых терапевтических стратегий. Так же как применение этих диагностических методик у пациентов с усугублением симптоматики ХОБЛ будет способствовать выделению группы больных с коморбидной патологией и предотвратит назначение и/или увеличение доз препаратов с побочными кардиальными эффектами.
Ключевые положения, блок 4:
- Установлена малая диагностическая значимость рутинных тестов: ЭКГ (неспецифические изменения при ХОБЛ не позволяют подтвердить/ исключить СН); рентгенография грудной клетки (гиперинфляция, эмфизема, изменения легочного сосудистого русла при ХОБЛ могут маскировать размеры сердца и затруднять визуализацию отека легких).
- Определение натрийуретических пептидов:
- определение натрийуретических пептидов у больных ХОБЛ с подозрением на СН производится в соответствии с современными рекомендациями по диагностике СН;
- у пациентов с ХОБЛ плазменные натрийуретические пептиды – достоверные маркеры в диагностике СН со сниженной ФВ;
- факторы, ослабляющие диагностическую значимость NP: возраст, фибрилляция предсердий, почечная недостаточность, ожирение;
- показано повышение NP при хроническом легочном сердце и легочной гипертензии даже в отсутствии признаков поражения ЛЖ;
- в настоящее время нет четких алгоритмов использования NP в группе ХОБЛ и СН.
- Проведение ЭхоКГ:
- ЭхоКГ – референсный тест в диагностике СН;
- правильность проведения и оценки параметров ЭхоКГ особенно важна для диагностики СН с сохраненной и промежуточной ФВ ЛЖ;
- существуют технические сложности и ограничения при ХОБЛ: узкое акустическое окно, неадекватная визуализация в условиях гиперинфляции, эмфиземы, ожирения;
- тем не менее выявленные изменения при ЭхоКГ часто ложатся в основу диагноза СН у больных ХОБЛ в условиях малой диагностической значимости других критериев.
- Магнито-резонансная томография (МРТ):
- МРТ служит «золотым стандартом» в оценке размеров полостей сердца и фракции выброса;
- рекомендуется для оценки функции ЛЖ у пациентов СН в условиях плохой визуализации;
- показатели МРТ не меняются в условиях гиперинфляции и эмфиземы при ХОБЛ. МРТ позволяет точно оценить размеры правых камер сердца и систолическую функцию ПЖ;
- использование этого метода в реальной клинической практике ограничено высокой стоимостью.
- Скрининг уровня натрийуретических пептидов и выполнение ЭхоКГ у амбулаторных и стационарных пациентов с ХОБЛ может быть стратегией раннего выявления СН и выделения пациентов высокого риска с коррекцией применяемых терапевтических стратегий.
4.3. Диагностика ХОБЛ на фоне СН
4.3.1. Распространенность ХОБЛ при ХСН – диагностическая дилемма
Предыдущие исследования показывают различную частоту ХОБЛ у пациентов с ХСН от 19 до 48% [161]. Частота диагностики ХОБЛ при первичном диагнозе ХСН во многих исследованиях значительно выше, чем ХСН на фоне ХОБЛ. Патофизиологические аспекты формирования обструктивных и рестриктивных нарушений при ХСН, сопровождающейся задержкой жидкости, обсуждены ранее в данном документе. Высокий процент диагностики ХОБЛ у пациентов ХСН исследователи частично объясняют гипердиагностикой из-за пограничных или незначительно сниженных показателей спирометрии у пациентов с ХСН со сниженной ФВ. Принципиальным является формулирование правильных диагностических стратегий из-за опасности назначения излишней терапии и полипрагмазии.
4.3.2. Исследование респираторных функций у пациентов ХСН
В соответствии с рекомендациями GOLD-2019 базисным критерием функциональной диагностики ХОБЛ является фиксированное отношение ОФВ1/ФЖЕЛ <0,7 (FR) после пробы с бронхолитиком. Клинически это означает наличие «воздушной ловушки» (захватывания воздуха внутри дыхательных путей при попытке выдоха пациента) – принципиального различия схожих между собой хронического обструктивного бронхита (ХБ) и ХОБЛ [17].
Существует опасность гипердиагностики ХОБЛ у пожилых пациентов, так как спирометрические критерии ХОБЛ не скорректированы по возрасту. Это связано как с чувствительностью спирометрического теста при маневре форсированного выдоха определять ОФВ1/ФЖЕЛ, так и с возрастной инволюцией легких (например, у лиц старше 70 лет) [137, 162, 163]. Европейское респираторное общество (ERS) и Американское торакальное общество (ATS) рекомендуют использование возраст и пол специфического критерия – пятой перцентили возрастного соотношения ОФВ1/ФЖЕЛ в качестве нижнего предела нормы (lower limit of normal – LLN). Клинически это означает, что объективное формирование «воздушной ловушки» высоко вероятно у лиц различных возрастных групп при LLN <0,7.
Рекомендации ATS/ERS подтверждены в перекрестных исследования, показывающих снижение ОФВ1/ФЖЕЛ с возрастом [164–167]. Это согласуется с данными, показывающими, что использование критериев GOLD приводит к неправдоподобно частому диагностированию бронхиальной обструкции у асимптомных, пожилых с низким риском развития ХОБЛ и никогда не куривших пациентов [168, 169].
Более того, в широкомасштабном исследовании S. Karrasch et al. (2016) убедительно показано, что в популяционной когорте взрослых в возрасте до 90 лет распространенность ХОБЛ, определяемая спирометрически, была выше по критерию FR, чем по критерию LLN, и увеличивалась с возрастом. Установлено, что использование критерия FR приводит к неправдоподобно частому диагностированию бронхиальной обструкции у асимптомных, никогда не куривших пожилых лиц с низким риском развития ХОБЛ [170].
Клинически оправданным следует признать позицию диагностирования ХОБЛ у пациентов, имеющих оба критерия одновременно (FR и LNN), даже при существовании скудных респираторных симптомов. Следует особо отметить, что клиническая картина заболевания при изменении только критерия FR менее совместима с диагнозом ХОБЛ, чем изменение LNN <0,7, даже у некурящих пациентов с редкими респираторными симптомами [171].
Однако необходимо отметить, что критерий LLN имеет ограничения: низкая чувствительность на ранних стадиях и самое важное отсутствие валидации диагностических преимуществ над GOLD критериями [172–175].
В исследовании R. Steinacher et al. (2012) сравнивались стандартные спирометрические критерии и критерий LLN (ATS/ERS) у пациентов ХСН с целью верификации ХОБЛ. Среди пациентов с ХСН с симптомами задержки жидкости 24,7% соответствовали критериям LLN ATS/ERS и 43,8% критериям GOLD для бронхиальной обструкции. Среди пациентов с ОФВ1/ФЖЕЛ >LLN 25,4% были ошибочно диагностированы, когда использовались критерии GOLD. Большинство случаев гипердиагностики соответствовали обструкции GOLD 1 степени (ОФВ1 ≥80%), этих пациентов было значительно меньше среди истинно положительных (76,5 vs 31,8%). Только 31,8% пациентов с обструкцией по ATS/ERS-критериям имели анамнез ХОБЛ [164]. В других исследованиях также подтверждается гипердиагностика ХОБЛ на фоне ХСН и необходимость использования других критериев. При стабильном течении ХСН (амбулаторные пациенты) также отмечается достаточно высокий процент обструктивных нарушений при активном скрининге – около 25% [129].
Когда мы ставим диагноз ХОБЛ на фоне ХСН, необходим очень аккуратный и тщательный подход на основании детального анализа медицинской истории (курение, факторы риска, респираторная симптоматика до дебюта сердечно-сосудистой патологии), физикального обследования (оценка симптомов задержки жидкости, застоя в легочной гемоциркуляции, рестриктивных изменений, наличие эмфиземы и т.д.), анализ ответа на ингалируемые бронхолитики (если назначены) и терапию декомпенсации ХСН.
Достоверность при постановке диагноза ХОБЛ при ХСН может быть улучшена при использовании бодиплетизмографии, так как ХОБЛ часто ассоциирована с воздушными ловушками, гиперинфляцией (увеличением отношения «остаточный объем/общая емкость легких» (RV/TLC)), которые могут служить индикаторами истинной ХОБЛ, в том числе у пациентов с ХСН с симптомами застоя [136]. Таким образом, для правильного диагностирования ХОБЛ у пациентов с ХСН необходимо более детальное функциональное пульмонологическое обследование, включая бодиплетизмографию в дополнении к спирометрии.
При верификации ХОБЛ у больных ХСН важно выполнить еще одно условие: не производить спирометрию во время декомпенсации СН в условиях задержки жидкости. Оценку респираторной функции целесообразно проводить в условиях стабильной СН по крайней мере в течение последних 3 мес для того, чтобы избежать эффекта обструкции бронхов за счет задержки жидкости в паренхиме легких [176]. В исследовании Brenner et al. (2013) производилась серия спирометрий у пациентов с СН со сниженной ФВЛЖ, было показано, что «очевидная» ХОБЛ купировалась у 50% пациентов, которые лечились только препаратами для ХСН [136].
4.3.3. Влияние неправильной диагностики ХОБЛ на фоне ХСН на тактику ведения пациентов
Гипердиагностика ХОБЛ на фоне ХСН: использование не показанных препаратов, имеющих потенциальные кардиальные побочные эффекты (β2-агонисты, М-холинолитики); ограничение использования рекомендованных при ХСН препаратов (β-адреноблокаторы, ИАПФ). Кроме того, у пациентов, уже получающих β-адреноблокаторы (ББ) при использовании больших доз и препаратов с малой селективностью, нужно внимательно относиться с выявляемой бронхиальной обструкцией из-за риска индуцированного бронхоспазма.
Гиподиагностика ХОБЛ у пациентов с ХСН: часто симптомы обострения ХОБЛ принимаются за декомпенсацию ХСН, что приводит к неправильной тактике ведения пациентов с увеличением доз диуретиков, кардиотропных препаратов, в том числе низкоселективных или неселективных БАБ, которые в условиях обострения ХОБЛ могут реализовывать свои побочные эффекты (нарушение мукоцилиарного клиренса, обструкция бронхов).
4.3.4. Определение тяжести ХОБЛ у пациентов с ХСН
Если диагноз ХОБЛ на фоне ХСН установлен, адекватное назначение ингаляционной терапии ХОБЛ может быть затруднено, так как при всех комбинированных вентиляционных расстройствах (наличие обструктивных и рестриктивных нарушений) ОФВ1 может быть скомпроментирован не только из-за бронхиальной обструкции, но и ввиду рестриктивных нарушений, т.е. при ХСН даже в стабильной фазе течения заболевания. Поэтому градация тяжести ХОБЛ, базируясь на степени снижения ОФВ1, может привести к завышению степени тяжести обструкции у пациентов с ХОБЛ и ХСН [129].
Тяжесть симптомов ХОБЛ, в соответствии с современными рекомендациями, должна быть оценена с помощью опросников mMRC и CAT (приложения 3, 4). Так как в вопросниках отсутствует дифференциация между симптомами кардиальной и респираторной патологии и обострения ХОБЛ могут также быть триггером эпизодов кардиальной декомпенсации, проблема гипердиагностики степени тяжести ХОБЛ и, кроме того, сверхлечения пациентов с ХСН и ХОБЛ остается актуальной. Например, пациент с NYHA III с диагностированной ХОБЛ и имеющий ОФВ1>80% в соответствии с рекомендациями получает длительно действующие бронходилататоры, даже если диспноэ обусловлено не легочными причинами.
Таким образом, в рутинной клинической практике ХСН плохо диагностируется у пациентов с ХОБЛ, и наоборот. Кардиологи и пульмонологи обычно фокусируются на заболевании одного органа/системы и часто плохо диагностируют наличие ХОБЛ у пациентов с СН, и наоборот, не обладают навыками интерпретации респираторных тестов (кардиологи) и кардиологического обследования (пульмонологи) [177]. Не используются или неправильно интерпретируются рутинные диагностические тесты: BNP (пограничные значения), эхокардиография (диастолическая дисфункция ЛЖ – СН с сохраненной ФВ), спирометрия (обструктивные и рестриктивные нарушения), у респираторных и кардиальных пациентов симптомы объясняются основным заболеванием. Такой подход также подтверждается очевидной инерцией в отношении коррекции терапии. В реальной клинической практике необходима ранняя и систематическая оценка сердечной функции у всех пациентов ХОБЛ, так же как и оценка респираторной функции в пациентов у СН (рис. 5).

Ключевые положения, блок 5:
- В предыдущих исследованиях показана различная частота ХОБЛ у пациентов с СН от 19 до 48%. Высокая распространенность ХОБЛ у больных СН объясняется гипердиагностикой из-за изменений показателей спирометрии (рестриктивные и обструктивные нарушения) в условиях задержки жидкости в паренхиме легких при СН со сниженной ФВ ЛЖ.
- При исследовании респираторной функции у больных ХОБЛ необходимо соблюдать следующие условия:
- не производить спирометрию во время декомпенсации ХСН в условиях задержки жидкости;
- оценку респираторной функции целесообразно проводить в условиях стабильной СН в течение последних 3 мес;
- в соответствии с GOLD критерий диагностики ХОБЛ – ОФВ1/ФЖЕЛ <0,7. Незначительное снижение этого показателя показано у пациентов с ХСН со сниженной ФВ ЛЖ даже в стабильной фазе заболевания, а также при декомпенсации;
- для исключения гипердиагностки ХОБЛ рекомендуется использование возрасти пол-специфического критерия – нижний предел нормального значения (lower limit of normal (LLN)) ОФВ1/ФЖЕЛ. Однако критерий LLN имеет ограничения: низкую чувствительность на ранних стадиях и самое важное – отсутствие валидации диагностических преимуществ над GOLD-критериями;
- достоверность при постановке диагноза ХОБЛ при ХСН может быть улучшена при использовании бодиплетизмографии. Наличие воздушных ловушек, гиперинфляции (увеличение отношения «остаточный объем/общая емкость легких» (RV/TLC)) может служить маркером истинной ХОБЛ, в том числе у пациентов с ХСН с симптомами застоя.
- Для исключения гипердиагностики ХОБЛ на фоне СН необходимо проводить детальный анализ анамнеза (курение, факторы риска, респираторная симптоматика до дебюта сердечно-сосудистой патологии), физикального обследования (оценка симптомов задержки жидкости, застоя в легочной гемоциркуляции, рестриктивных изменения, наличие эмфиземы и т.д.), анализ ответа на ингалируемые бронхолитики и терапию декомпенсации ХСН.
- Необходимо учитывать возможность гипердиагностики степени тяжести ХОБЛ у пациентов с декомпенсацией ХСН.
- Неправильная диагностика ХОБЛ на фоне ХСН может влиять на тактику ведения пациентов:
- гипердиагностика ХОБЛ на фоне ХСН: использование не показанных препаратов, имеющих потенциальные кардиальные побочные эффекты (β2-агонисты, М-холинолитики); ограничение использования рекомендованных при ХСН препаратов (β-адреноблокаторы, ИАПФ);
- гиподиагностика ХОБЛ у пациентов с ХСН: симптомы обострения ХОБЛ трактуются как декомпенсация СН, что приводит к неправильной тактике ведения пациентов с увеличением доз диуретиков, кардиотропных препаратов, в том числе низкоселективных или неселективных БАБ, которые в условиях обострения ХОБЛ могут реализовывать свои побочные эффекты (нарушение мукоцилиарного клиренса, обструкция бронхов).
5. ТЕРАПЕВТИЧЕСКИЕ СТРАТЕГИИ У ПАЦИЕНТОВ С ХОБЛ И ХСН
Терапевтические стратегии у пациентов с ХОБЛ и ХСН в настоящее время открыты для обсуждения в отсутствии адекватных рандомизированных клинических исследований (РКИ). Терапевтические подходы при сердечной недостаточности и хронической обструктивной болезни легких сформулированы в клинических рекомендациях. Отдельных рекомендаций по ведению пациентов с ХОБЛ и СН в настоящее время не существует, и терапия осуществляется в соответствии с национальными и европейскими рекомендациями [1, 2, 16, 17, 20]. Однако ведение больных с легочно-кардиальной коморбидностью остается серьезной проблемой ввиду сложностей диагностики, взаимного отягощения течения каждой из коморбидных патологий, а также проблеме межлекарственных взаимодействий и лекарственной ятрогении в условиях вынужденной полипрагмазии [178, 179].
5.1. Базисная бронхолитическая терапия ХОБЛ
Алгоритм, отражающий современные взгляды на дифференцированные подходы к ведению больных ХОБЛ, изложен в отечественных рекомендациях и представлен в приложении 5 [20]. Особенностью алгоритма является его простота применения врачами первичного звена (нет необходимости использования спирометрического теста в оценке тяжести функциональных нарушений) и начало базисной терапии с пролонгированных бронхолитических препаратов. В настоящее время в качестве базисной терапии применяется двойная бронхолитическая терапия пролонгированными ингаляционными препаратами и признается «патогенетическим» лечением, поскольку воздухоносное стентирование мелких бронхов в условиях двойной бронходилатации достоверно и устойчиво устраняет «воздушную ловушку» – основной функционально-структурный дефект, лежащий в основе механизмов одышки и воспаления у пациентов ХОБЛ.
Перечень основных лекарственных препаратов, зарегистрированных в России и применяемых для базисной терапии больных ХОБЛ, с дозировками и фармакодинамическими характеристиками представлен в приложении 6.
5.2. Действие бронхолитиков на сердечно-сосудистую систему
Большинство бронхорасширяющих препаратов, используемых в терапии ХОБЛ, способно влиять на сердечно-сосудистую систему, особенно у пациентов с сердечно-сосудистой патологией. Описаны следующие побочные эффекты бронхолитиков: увеличение ЧСС, уменьшение содержание калия с увеличением риска ишемических событий и аритмий. Показано также их действие на тонус периферических сосудов, АД (снижение диастолического АД и повышение систолического), ухудшение сердечной недостаточности вплоть до формирования кардиомиопатий [180].
Принято выделять «терапевтическое окно» дозировок лекарственных препаратов и выход за пределы указанного диапазона. Это имеет большое значение, так как риск описанных «кардиотоксических» эффектов увеличивается на фоне бесконтрольного увеличения суточных доз β2-агонистов (как пролонгированных, так и короткого действия) и М-холинолитиков.
Агонисты β2-адренорецепторов. Принята точка зрения, что с ингаляцией именно агонистов β2-адренорецепторов связано увеличение риска сердечно-сосудистых осложнений. Однако в исследовании M. Wilchesky et al. базисная терапия β2-агонистами короткого (КДБА) и пролонгированного действия (ДДБА) продемонстрировала незначительное увеличение рисков [181]. Кроме того, наблюдался четкий дозозависимый эффект: описанные случаи ухудшения аритмии, увеличения ЧСС у пациентов, ранее имевших аритмии и гипоксемию, отмечались на фоне больших доз препаратов и зависели также от их рецепторной активности (полный или частичный агонист) [182].
В метаанализе N. Xia et al. 2015 г. (24 контролируемых РКИ по оценке безопасности ингаляционных ДДБА у пациентов с ХОБЛ) выявлено отсутствие повышения риска фатальных сердечно-сосудистых событий (ССС) на фоне применения ДДБА. В субанализе установлено достоверное снижение фатальных ССС при использовании ДДБА как при длительном наблюдении, так в краткосрочных исследованиях (не более 6 мес). При выделении группы пациентов с ХСН также не отмечено отрицательных эффектов этой группы лекарственных средств на фатальные ССС [183].
Не вызывает сомнений влияние СН на легочную функцию. Обструктивные и рестриктивные нарушения, изменения диффузионной способности часто встречаются при ХСН, даже в стабильном состоянии без явных признаков задержки жидкости [184, 185]. Поэтому не удивительно, что ингалируемые бронходилататоры могут играть роль в ведении пациентов с ХСН из-за их потенциальной возможности улучшать легочную функцию, особенно в условиях бронхиальной обструкции [186]. У пациентов с обострением ХОБЛ ЛЖ систолическая дисфункция является частым состоянием и уровень плазменных NP повышен [187, 188]. В исследованиях показано, что КДБА сальбутамол и М-холинолитик индакатерол приводят к более быстрому снижению уровня BNP у пациентов, поступивших с обострением ХОБЛ. Вероятнее всего, β2-агонисты уменьшают воздушные ловушки, вызывая снижение внутриторакального давления, в том числе и в камерах сердца, и, следовательно, улучшение преднагрузки ПЖ и диастолической функции ЛЖ [184, 189].
Таким образом, применение β2-агонистов у пациентов ХСН не несет значительного риска усугубления ССС при условии использования длительно действующих препаратов без превышения среднетерапевтических доз.
Агонисты мускариновых рецепторов (М-холинолитики). В метаанализе S. Singh et al. 2008 г. было установлено влияние М-холинолитиков на возрастание нежелательных кардиоваскулярные явлений [190]. В другом исследовании этих же авторов показаны проаритмические и проишемические события на фоне применения пролонгированных М-холинолитиков у больных ХОБЛ [191]. Эти данные не подтвердились в крупнейшем объединенном анализе данных о нежелательных кардиоваскулярных событиях при использовании тиотропия бромида с устройством доставки HandiHaler (18 мкг) или Respimat (5 мкг) у 14 909 пациентов ХОБЛ, принявших участие в РКИ с периодом лечения более 4 нед. Было достоверно установлено, что терапия тиотропия бромидом у больных ХОБЛ не ассоциируется с возрастанием риска значимых неблагоприятных и фатальных сердечно-сосудистых явлений [192]. Подтверждение безопасности применения тиотропия бромида в терапии пациентов ХОБЛ получено и в ходе последнего метаанализа сравнения HandiHaler (18 мкг) или Respimat (5 мкг): терапевтические дозы этого препарата в различных системах доставки снижают риски неблагоприятных и фатальных ССС у пациентов с ХОБЛ при периоде терапии более 12 мес [193].
Двойная бронходилатация – пролонгированные β2-агонисты и пролонгированные М-холинолитики. В настоящее время признанной стратегией терапии пациентов ХОБЛ служит двойная бронходилатация, а именно использование комбинированного ингаляционного устройства, содержащего ДДБА и пролонгированный M-холинолитик (ДДАХ).
В 2015–2016 гг. были опубликованы результаты нескольких систематических обзоров и метаанализов, посвященных этой проблеме. При оценке профиля безопасности комбинированной или монотерапии ДДБА и ДДАХ у больных с сопутствующей сердечно-сосудистой патологией не было выявлено статистически достоверных различий профиля безопасности между применением ДДБА/ДДАХ в режиме комбинированной или монотерапии, показана эффективность и безопасность двойной бронходилатации у данной категории пациентов.
Не установлено отрицательных эффектов в отношении сердечно-сосудистой системы при комбинированном применении этих препаратов (отсутствие аддитивных и синергетических эффектов) [184]. Систематический обзор с метаанализом терапии двойной фиксированной комбинацией ДДБА/ДДАХ у пациентов со стабильной ХОБЛ не обнаружил каких-либо существенных различий профиля сердечно-сосудистой безопасности по сравнению монотерапией [194].
В то же время фиксированная комбинация умеклидиния бромид/вилантерол показала тенденцию к повышению профиля сердечно-сосудистой безопасности (p=0,057), а комбинация индакатерол/гликопиррония бромид даже достоверно уменьшала (p <0,05) тяжелые нежелательные ССС у пациентов с ХОБЛ [195].
Ключевые положения, блок 6:
- Терапевтические стратегии при СН и ХОБЛ сформулированы в современных национальных и европейских клинических рекомендациях. Отдельных рекомендаций по ведению пациентов с ХОБЛ и СН в настоящее время не существует.
- Все бронхорасширяющие препараты, активно используемые в терапии ХОБЛ, влияют на сердечно-сосудистую систему, особенно у пациентов с ССЗ. Принято выделять «терапевтическое окно» дозировок лекарственных препаратов и выход за пределы указанного диапазона.
- Бесконтрольное увеличение суточных доз β2-агонистов (как пролонгированных, так и короткого действия) и М-холинолитиков может существенно изменять ЧСС, уменьшать содержание калия, способствуя тем самым увеличению риска ишемических событий, проаритмогенных эффектов.
- Применение ДДБА в средних терапевтических дозах не приводит к повышению риска фатальных ССС.
- Показаны положительные эффекты применения среднетерапевтических доз β2агонистов при СН:
- уменьшение бронхиальной обструкции, потенцированной задержкой жидкости в паренхиме легких;
- уменьшение воздушных ловушек, снижение внутриторакального давления, снижение давления в камерах сердца, что ведет к улучшению преднагрузки ПЖ и диастолической дисфункции ЛЖ.
- Терапевтические дозы М-холинолитиков не ведут к увеличению сердечно-сосудистых рисков, более того, тиотропия бромид снижает риски неблагоприятных и фатальных ССС у пациентов с ХОБЛ.
5.3. Терапия ХСН у больных ХОБЛ
Терапия СН у больных ХОБЛ регламентирована текущими рекомендациями по СН [1, 2]. Сформулированы четкие алгоритмы ведения пациентов со сниженной ФВ ЛЖ, способные улучшить клинический статус пациентов и прогноз (приложение). Однако терапевтически стратегии у больных с сохраненной и промежуточной ФВ ЛЖ не разработаны. Все существующие терапевтические подходы у пациентов с СНсФВ не приводят к улучшению прогноза. Некоторые исследования показали уменьшение госпитализаций в этой клинической группе при применении небиволола, дигоксина, спиронолактона и кандеcартана. Признанная тактика ведения этих пациентов – адекватное лечение коморбидной патологии, лежащей в основе патогенеза этого клинического варианта СН, в том числе ХОБЛ [1, 2].
При анализе базы данных Ломбардии (сравнение данных 2002 и 2009 г.) в когорте пациентов с ХСН в сравнении с ХСН+ХОБЛ показано значительное увеличение использования β-блокаторов, а также отмечено возрастание назначений ББ в группе ХОБЛ+ХСН [45]. Однако назначение ББ и блокаторов РААС в группе ХСН и ХОБЛ по-прежнему остается низким, что подтверждается и в других исследованиях реальной клинической практики [196, 197]. Таким образом, наличие коморбидных состояний приводит к ограничению применения рекомендованных терапевтических вмешательств. Особого внимания при ведении ХСН у пациентов ХОБЛ заслуживает ряд моментов:
- применение ББ;
- сочетанное применение ББ и β2-агонистов;
- применение ИАПФ;
- применение диуретиков.
5.3.1. Диуретики
Диуретики входят во все современные схемы ведения пациентов с СН, сопровождающей ся симптомами задержки жидкости. Однако при назначении диуретической терапии пациентам с ХОБЛ необходимо учитывать ряд моментов.
Диуретики не обладают прямыми отрицательными эффектами на проходимость дыхательных путей и легочные функции. Однако при применении в больших дозах они способны увеличивать гематокрит со снижением тканевой перфузии и нарушать мукоцилиарный клиренс в бронхиолах [198–201].
У пациентов с ХОБЛ и хронической гиперкапнией могут быть другие потенциальные проблемы при использовании диуретиков. Это прежде всего метаболический ацидоз, индуцированный тиазидовыми диуретиками, который может подавлять дыхательную активность и потенциально ухудшать степень гипоксемии и гиперкапнии [202].
Особенно важно принимать во внимание потенциальные гипокалиемические эффекты, особенно у петлевых диуретиков. Эта проблема также связана со способностью β2-агонистов и системных глюкокортикоидов, используемых при обострениях ХОБЛ, вызывать гипокалиемию [203, 204]. Снижение уровня калия при комбинированной терапии диуретиками, бронхолитиками и системными глюкокортикоидами может потенцировать аритмические события с усугублением коронарной недостаточности.
Пациенты с ХОБЛ, имеющие хронический респираторный ацидоз и получающие глюкокортикоиды и β2-агонисты, при назначении петлевых диуретиков должны подвергаться тщательному мониторингу электролитов. Показано раннее введение в схемы терапии пациентов ХОБЛ и ХСН калийсберегающих диуретиков (антагонистов минералокортикоидных рецепторов (АМК)).
5.3.2. Блокаторы РААС
Использование ингибиторов ангиотензинпревращающего фермента (ИАПФ) в настоящее время признается ключевым терапевтическим вмешательством при СН со сниженной ФВ ЛЖ. Блокаторы ангиотензиновых рецепторов (БРА) рекомендуется использовать при непереносимости ИАПФ [1, 2].
С другой стороны, наши представления о механизмах воздействия блокады РААС при ХОБЛ также претерпевают в последние годы существенные изменения. Блокада РААС, по мнению многих исследователей, служит новой терапевтической мишенью при ХОБЛ даже за рамками существующей сердечно-сосудистой патологии. В недавних исследованиях утверждается роль ренин-ангиотензин-альдостероновой системы (РААС) в патогенезе как самой ХОБЛ, так и экстрапульмональных проявлений этого заболевания.
В настоящее время активно обсуждаются легочные эффекты активации РААС: ремоделирование легких, деструкция паренхимы, эмфизема, фиброз, нарушение бронхиальной проходимости, дисфункция скелетных мышц, апоптоз эпителиальных клеток, легочная гипертензия [205]. Поэтому блокада эффектов этой системы в настоящее время признается новой терапевтической стратегией у больных ХОБЛ.
Однаконекоторыеисследованияпоказывают, что при диагностировании СН на фоне ХОБЛ уменьшается доля назначений ИАПФ, что, вероятнее всего, связано с опасениями по поводу побочных эффектов. Известно, что наиболее частым побочным эффектом ИАПФ выступает кашель, частота которого составляет от 5 до 20% [206]. Важно понимать, что частота ИАПФ-индуцированного кашля у больных ХОБЛ не выше, чем в общей популяции [207]. Увеличение уровня брадикинина и субстанции Р связана с этим нежелательным эффектом [208]. С другой стороны, ИАПФ способны снижать β2-агонист-индуцированную гипокалиемию, что важно при использовании диуретиков на фоне СН [209].
Показано, что применение ИАПФ связано со снижением падения легочной функции у курильщиков (ОФВ1). Этот положительный эффект сильнее выражен в отношении ОФВ1, чем в отношении редукции легочных объемов; это позволяет предполагать, что ИАПФ более эффективны в предупреждении развития обструктивных, чем рестриктивных легочных нарушений среди курильщиков [210].
Влияние ИАПФ/БРА на показатели смертности были показаны в большом ретроспективном исследовании у пожилых пациентов, которые госпитализировались с обострением ХОБЛ: использование блокаторов РААС статистические значимо связано со снижением 90-дневной летальности [211]. Эти данные соотносятся с результатами другого исследования «случай–контроль» двух ретроспективных когорт с различным сердечно-сосудистым риском. Применение комбинации статин + ИАПФ/БРА было связано со снижением госпитализаций и смертности в обеих группах (высокого и низкого сердечно-сосудистого риска) [212].
Показано снижение риска инфекционных осложнений, в том числе развития пневмоний, у пациентов с ХОБЛ, принимающих ИАПФ/БРА [213]. Также отмечено улучшение функции скелетных мышц у больных ХОБЛ на фоне терапии ИАПФ [214, 215].
Основной недостаток всех вышеперечисленных исследований – небольшие РКИ или обсервационные, ретроспективные исследования. Нет доступных крупных РКИ по приему ИАПФ у пациентов с сочетанием ХОБЛ и ХСН.
Таким образом, блокада РААС имеет потенциальное двунаправленное кардиопульмональное воздействие. ИАПФ служат препаратами выбора у больных ХОБЛ и СН.
Ключевые положения, блок 7:
- Терапия СН у больных ХОБЛ регламентирована текущими рекомендациями по СН. Сформулированы четкие алгоритмы ведения пациентов со сниженной ФВ ЛЖ, способные улучшить клинический статус пациентов и прогноз. Однако терапевтические стратегии для больных с сохраненной и промежуточной ФВ ЛЖ не разработаны. Признанной тактикой ведения этих пациентов считается адекватное лечение коморбидной патологии, лежащей в основе патогенеза этого клинического варианта СН, в том числе ХОБЛ.
- Особенности терапии диуретиками:
- препараты этой группы способны потенцировать гипокалиемические эффекты β2-агонистов, системных глюкокортикоидов у больных ХОБЛ, поэтому целесообразно раннее назначение антагонистов минералокортикоидных рецепторов;
- необходимо учитывать риск развития метаболического ацидоза у больных ХОБЛ с гиперкапнией на фоне применения диуретиков;
- пациенты с ХОБЛ, имеющие респираторный алкалоз, на фоне терапии системными глюкокортикоидами и/или β2-агонистами должны подвергаться тщательному мониторингу электролитов на фоне терапии петлевыми диуретиками с назначением калийсберегающих диуретиков.
- Особенности терапии блокаторами РААС:
- использование ингибиторов АПФ (ИАПФ) в настоящее время признается ключевым терапевтическим вмешательством при СН со сниженной фракцией выброса ЛЖ, блокаторы ангиотензиновых рецепторов рекомендуется применять при непереносимости ИАПФ;
- в недавних исследованиях утверждается роль РААС в патогенезе как самой ХОБЛ, так и экстрапульмональных проявлений этого заболевания. Установлены легочные эффекты активации РААС: ремоделирование легких, деструкция паренхимы, эмфизема, фиброз, нарушение бронхиальной проходимости, дисфункция скелетных мышц, апоптоз эпителиальных клеток, легочная гипертензия. Поэтом блокада эффектов этой системы в настоящее время признается новой терапевтической стратегией у больных ХОБЛ;
- частота ИАПФ-индуцированного кашля у пациентов ХОБЛ не выше, чем в общей популяции;
- ИАПФ способны снижать β2-агонистиндуцированную гипокалиемию, что важно при применении диуретиков;
- установлены экстрапульмональные эффекты блокады РААС при ХОБЛ: снижение риска госпитализаций, обострений, уменьшение риска смертности, инфекционных осложнений, улучшение функции скелетных мышц;
- в настоящее время установлено двунаправленное кардиопульмональное воздействие ИАПФ при ХОБЛ, что позволяет рассматривать их как препараты выбора при ХОБЛ.
5.3.3. Бета-адреноблокаторы
Гиперактивация САС – основная патогенетическая характеристика и ХСН, и ХОБЛ. Повышение активности САС оказывает органоповреждающие эффекты: снижение тканевой перфузии из-за вазоспазма, активация системы РААС, повышение ЧСС, прямые кардиотоксические эффекты (гипертрофия, апоптоз кардиомиоцитов, некрозы миокарда, электическое ремоделирование с проаритмогенными эффектами, структурное ремоделирование с формированием СН). Применение ББ при СН со сниженной ФВ в настоящее время считается «золотым стандартом» терапии, приводящей к улучшению прогноза.
Опасения врачей, связанные с назначением ББ больным ХОБЛ, объясняются фармакологическими свойствами препаратов этой группы: блокада β2-адренорецепторов может вызывать бронхоконстрикцию и ухудшать функцию внешнего дыхания. В официальных инструкциях по медицинскому применению ББ рекомендовано использовать их у больных ХОБЛ с осторожностью, а в ряде случаев тяжелая ХОБЛ даже рассматривается как противопоказание к применению этих препаратов, в том числе кардиоселективных [216].
В ряде эпидемиологических исследований получены данные о том, что от 30 до 50% больных ХОБЛ не получают ББ, которые абсолютно показаны им для лечения сопутствующих ССЗ. Возможно, это одна из причин более тяжелого течения сердечно-сосудистой патологии и высокой частоты неблагоприятных исходов у этой категории пациентов [217–220].
Среди доводов против приема ББ можно привести потенциальное уменьшение ОФВ1 и бронходилатационного ответа на β2-агонисты, снижение эффективности ДДБА, в то время как аргументами в пользу их использования можно считать меньшую выраженность кардиотонического действия эндогенных катехоламинов, связанного с активацией симпатической нервной системы и применением β2-агонистов, снижение интенсивности системного воспаления [221] (рис. 6). Все это побудило к пересмотру наших традиционных представлений о месте и роли ББ в терапии пациентов с ХОБЛ.
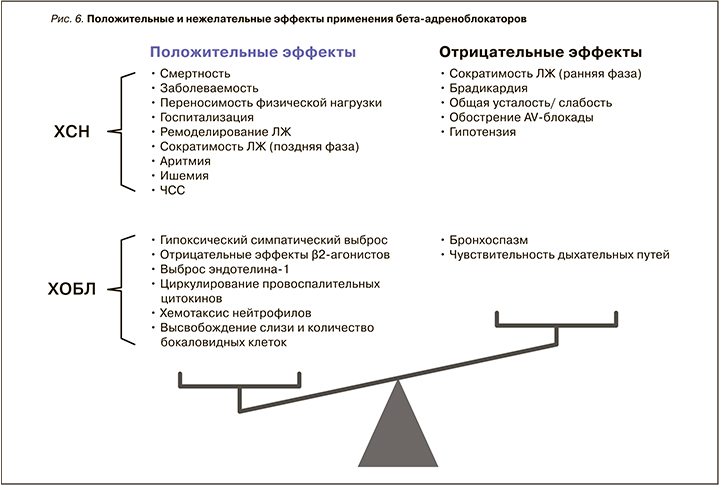
Ввиду того что больные ХОБЛ обычно не включались в рандомизированные плацебо-контролируемые исследования эффективности и безопасности ББ у больных с сопутствующими ССЗ, понимание потенциальной пользы их применения у этой категории пациентов стало приходить после получения результатов ряда ретроспективных исследований, в которых было показано снижение смертности и уменьшение числа госпитализаций у пациентов с ХОБЛ и ССЗ, получавших как кардиоселективные, так и неселективные ББ [222–227]. Значительный интерес представляют результаты ретроспективного когортного исследования применения ББ у больных ХОБЛ и ССЗ, согласно которым после 4,35 лет наблюдения общая смертность в группе больных, получавших эту группу препаратов, была на 22% ниже в отсутствие значимого влияния на функцию внешнего дыхания. Кроме того, прием ББ позволил снизить дозу системных глюкокортикостероидов и число госпитализаций, связанных с обострением ХОБЛ, при отсутствии влияния на функцию легких независимо от степени тяжести ХОБЛ [228]. С этими результатами согласуются данные метаанализа 9 ретроспективных когортных исследований о снижении общей смертности у больных ХОБЛ при применении ББ для лечения сопутствующей сердечно-сосудистой патологии [229]. Также показано, что на фоне приема ББ уменьшается выраженность симптомов, снижается частота и тяжесть неинфекционных обострений ХОБЛ, улучшается переносимость физической нагрузки, снижается смертность, и, наоборот, после отмены этих препаратов смертность может возрастать [217, 230].
Отчасти объяснение этим фактам было получено в экспериментальных моделях на животных. В работах Z. Callaerts-Vegh et al. (2004), L.P. Nguyen et al. (2008) показано, что ББ при систематическом применении могут уменьшать воспаление, секрецию слизи в дыхательных путях, степень бронхиальной обструкции и улучшать легочную гемодинамику [231, 232].
С 80–90-х гг. ХХ в. проведено большое число исследований, свидетельствующих о хорошем профиле безопасности ББ в этой группе больных. Большой интерес в связи с этим вызывают результаты немногочисленных проспективных рандомизированных контролируемых исследований.
В проспективном исследовании, проведенном S.P. Bhatt et al. (2016), оценивали частоту всех обострений и тяжелых обострений у 3464 пациентов с ХОБЛ, получавших ББ (средний период наблюдения составил 2,1 года). Получены данные о статистически значимом снижении общей частоты обострений (IRR 0,73; 95%CI 0,60 to 0,90; p=0,003) и тяжелых обострений (IRR 0,67; 95%CI 0,48 to 0,93; p=0,016) в этой группе пациентов. Особенно интересно то, что аналогичные результаты были получены в подгруппах пациентов с тяжелой ХОБЛ, получавших длительную кислородную терапию (GOLD III–IV) [233]. Эти результаты согласуются с полученными ранее результатами исследования применения ББ у больных ХОБЛ и ХСН или ИБС [234]. В отличие от этих данных, в исследовании N.M. Hawkins et al. (2009) бисопролол не влиял на частоту обострений ХОБЛ у пожилых больных, но ухудшал показатели спирометрии [235]. Представляются интерес и результаты исследования влияния приема ББ у больных ХОБЛ и сопутствующими ССЗ в период госпитализации по поводу обострения ХОБЛ. Показано, что ББ не влияют на госпитальную летальность и частоту повторных госпитализаций в течение 30 дней после выписки из стационара, однако при анализе данных в зависимости от селективности препаратов оказалось, что прием неселективных ББ чаще приводит к повторным госпитализациям [220].
В ряде клинических исследований показано снижение смертности в общей популяции пациентов с ХСН, получавших метопролола сукцинат, карведилол, небиволол или бисопролол в комбинации с ИАПФ. ББ предотвращают развитие эффектов, связанных с избыточной адренергической стимуляцией, улучшают систолическую и диастолическую функцию ЛЖ, снижают риск внезапной сердечной смерти. Применение ББ при ХСН со сниженной ФВ в настоящее время признано «золотым стандартом» терапии, приводящей к улучшению прогноза [2].
При сравнительной оценке безопасности неселективных и кардиоселективных ББ в исследовании эффективности и безопасности метопролола, бисопролола и карведилола у больных ХОБЛ и ХСН было показано, что наиболее выраженное угнетение функции внешнего дыхания вызывает карведилол [236]. В исследованиях у пожилых больных ХОБЛ и ХСН также зафиксирована большая частота неблагоприятных побочных реакций, таких как снижение ОФВ1 и бронхоспазм, при применении карведилола по сравнению с бисопрололом. Прием бисопролола в этих исследованиях сопровождался не только меньшей частотой неблагоприятных побочных реакций, но и значимым повышением ОФВ1 [237].
В конце 2018 г. были опубликованы результаты популяционного когортного исследования, проведенного в Италии. В это исследование было включено 51 214 больных с ХСН и обструктивными заболеваниями легких, из которых 11 844 больных (23,1%) получали карведилол и 39 370 (76,9%) – один из кардиоселективных ББ (метопролол/бисопролол/небиволол). Период наблюдения составил 5 лет. Согласно полученным данным, в группе пациентов, получавших карведилол, было статистически достоверно выше число госпитализаций в связи с декомпенсацией ХСН и случаев отмены ББ в сравнении с группой больных, получавших метопролол/бисопролол/ небиволол [238].
В исследовании CHARM (Кандесартан при сердечной недостаточности: оценка снижения смертности и заболеваемости), в котором были рандомизированы 7599 пациентов, выживаемость была значительно выше у больных, получающих ББ, независимо от проводимой бронхолитической терапии [239].
Согласно современным клиническим рекомендациям, ББ можно рекомендовать большинству пациентов с ХСН и сопутствующей ХОБЛ. На наш взгляд, с учетом фактора отягощенного течения и повышения риска смертности у этой категории коморбидных пациентов ББ должны быть рекомендованы всем больным в отсутствие абсолютных противопоказаний к их применению, однако предпочтение следует отдавать препаратам с максимально выраженной β1-селективностью.
Во время инициации терапии ББ у пациентов ХОБЛ необходимо мониторировать симптомы (диспноэ, снижение толерантности к физическим нагрузкам, кашель), изменения в дозах принимаемых препаратов (бронходилататоры). Безопасность инициации терапии ББ у пациентов с ХОБЛ во время обострения не известна, однако здравый смысл предостерегает от такой терапии или диктует необходимость тщательного клинического и спирометрического контроля.
Принципы использования ББ при ХОБЛ:
- селективные β1-блокаторы (метопролол, бисопролол, небиволол) демонстрируют дозозависимую способность блокировать β2 рецепторы;
- неселективный β1-блокатор карведилол чаще вызывает бронхоспазм, чем селективные β1-блокаторы;
- медленная титрация дозы β1-блокаторов с 1–2-недельным интервалом до достижения поддерживающей дозы;
- медленный темп титрациии с мониторированием потенциальных побочных эффектов особенно актуален для пожилых пациентов с коморбидной патологией и во время обострений;
- ДДАХ могут предупреждать потенциальные бронхоспастические реакции.
5.3.4. Сочетанное применение β1-адреноблокаторов и β2-агонистов
Именно проблема сочетанного применения препаратов с заведомо противоположными эффектами у одного и того же пациента и представляла до последнего времени камень преткновения для широкого использования ББ у больных ХОБЛ. Представляется важным вопрос о влиянии одновременного применения ББ и β2-агонистов на течение как ХОБЛ, так и ССЗ.
В метаанализе, проведенном V. Petta et al. (2017), показано, что применение кардиоселективных ББ и ДДБА у больных ХОБЛ и ССЗ снижает смертность и частоту обострений у данной категории больных [240].
Согласно M.T. Dransfield et al. (2018), при анализе данных 16 485 пациентов из исследования SUMMIT, получавших ББ и ингаляции флутиказона фуроата, вилантерола, комбинацию флутиказона фуроата и вилантерола или плацебо, были получены результаты, позволяющие говорить об отсутствии неблагоприятного влияния на течение ХОБЛ или повышения сердечно-сосудистых рисков у пациентов, получавших одновременно ББ и ДДБА [241].
В работе B. Rinaldi et al. на модели мышей с СН показано, что повышенные уровни плазменного адреналина стимулируют десенсибилизацию β2-адренорецепторов через GPRK2 (G-белок, связывающий рецептор киназы 2 путем фосфорилирования), что ведет к аресту и интернализации β2-адренорецептора и значительному ослаблению релаксации дыхательных путей – эффекту, который восстанавливался при лечении метопрололом [242]. Те же исследователи подтвердили, что совместное введение β2-агониста и ББ может влиять на ремоделирование сердца. Они показали, что лечение индакатеролом или метопрололом значительно уменьшало размер инфаркта у крыс с СН по сравнению с нелеченой контрольной группой. Комбинация индакатерола и метопролола приводила к снижению АД, ЧСС, улучшала ФВ, нормализовала систолический и диастолический размеры ЛЖ [243].
Эти данные хорошо вписываются в гипотезу M. Khan et al., согласно которой одновременная синергетическая стимуляция β2-адреноцептора и блокада β1-адреноцептора может быть эффективной для увеличения прогениторных клеток сердца при пораженном сердце. Это потенциально открывает путь для нового терапевтического подхода к лечению ХСН [244].
Также высказывается предположение о том, что снижение симпатического тонуса и up-регуляция β2-адренорецепторов в легких могут служить возможными механизмами, с помощью которых β-адреноблокаторы проявляют положительные легочные эффекты у больных ХОБЛ в долгосрочной перспективе [245]. Длительное применение ББ позволяет увеличить количество β2-адренорецепторов в легких и тем самым снизить потребность в β2-агонистах [246].
Метаанализ S. Salpeter et al. (2005) показал, что неселективные ББ уменьшают, а кардиоселективные улучшают эффект бронходилатации β2-агонистов вследствие сверхрегуляции β2-рецепторов [247]. Постоянное использование ББ повышает чувствительность β2-адренорецепторов к дальнейшей стимуляции посредством увеличения их плотности в целевых тканях. В результате ББ могут даже улучшать эффективность β2-агонистов во время обострения посредством потенцирования бронходилатационных эффектов. Этот парадоксальный терапевтический механизм еще широко не исследован [240, 248].
Таким образом, баланс положительных и отрицательных эффектов ББ у больных ХОБЛ явно смещается в пользу применения препаратов этой группы. Однако до настоящего времени большой проблемой является недостаточное число данных, полученных из проспективных РКИ – в большинстве случаев это непродолжительные исследования с использование малой выборки.
Ключевые положения, блок 8:
- Гиперактивация симпатоадреналовой системой является основной патогенетической характеристикой и ХСН и ХОБЛ.
- Показано, что назначение высокоселективных ББ при ХОБЛ не способно значительно влиять на показатели бронхиальной проходимости (ОФВ1), ответ на β2-агонисты или респираторные симптомы.
- Кардиоселективные ББ, такие как метопролол, бисопролол и небиволол, могут с успехом применяться при ХОБЛ и сердечно-сосудистой патологии. Неселективные ББ в этом случае противопоказаны.
- Доказаны положительные эффекты ББ при ХОБЛ: снижение риска смерти, уменьшение частоты обострений.
- Во время инициации терапии ББ у пациентов с ХОБЛ необходимо мониторировать симптомы (диспноэ, снижение толерантности к физическим нагрузкам, кашель), изменения в дозах принимаемых препаратов (бронходилататоров).
- Принципы использования ББ при ХОБЛ:
- применение высокоселективных препаратов;
- медленная титрация дозы β1-блокаторов с 1–2-недельным интервалом до достижения поддерживающей дозы, особенно при обострении ХОБЛ;
- использование длительно действующих М-холинолитиков с целью предупреждения потенциальных бронхоспастических реакций.
- Показано, что длительное использование БАБ повышает чувствительность β2-адренорецепторов к дальнейшей стимуляции посредством увеличения их плотности в целевых тканях. В результате ББ могут улучшать эффективность β2-агонистов с уменьшением дозы последних. Это открывает возможности для нового терапевтического подхода к терапии ХОБЛ и ХСН.
6. ЗАКЛЮЧЕНИЕ
ХСНи ХОБЛ– дваобщихгетерогенных, длительно текущих заболевания со значительной заболеваемостью и смертностью. Кардиореспираторная коморбидность, в частности, ХОБЛ и СН, относится к состояниям высокого сердечно-сосудистого риска и риска смертности. Показана высокая распространенность этого коморбидного состояния.
Существует проблема гиподиагностики СН на фоне ХОБЛ, и наоборот. Диагноз как ХОБЛ, так и ХСН первоначально клинический, основанный на анализе симптомов (в основном это одышка при физической нагрузке или утомляемость) и признаков (периферические отеки или повышение давления в яремных венах). В дальнейшем требуется грамотное применение и интерпретация специфических методов обследования (спирометрия, бодиплетизмография, ЭхоКГ, натрийуретические пептиды). Дифференцировка между ХОБЛ и ХСН может быть сложна, но является очень важной для определения дальнейшей тактики ведения.
Необходимо использовать комплекс вмешательств, направленных на уменьшение ССР в этой категории больных. Грамотное применение комбинированных терапевтических стратегий при ХОБЛ и СН с учетом потенциальных побочных эффектов препаратов и межлекарственных взаимодействий способно оптимизировать качество жизни, уменьшить риск госпитализаций и улучшить прогноз (рис. 7).

7. ПРИЛОЖЕНИЕ






