СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
- 6-МТ – 6-минутный внелабораторный тест с нагрузкой
- Bi-PHASIC – 2-уровневый режим вентиляционной поддержки FiО2 – индекс Фика (содержание кислорода в газовой смеси) IMV – перемежающаяся принудительная вентиляция
- PaCO2 – парциальное давление углекислого газа в артериальной крови PaO2 – парциальное давление кислорода в артериальной крови
- PCV – вентиляция легких с контролируемым давлением PEEP – положительное давление в конце выдоха
- PSV – вентиляция с поддерживающим давлением IPAP – положительное давление на вдохе
- SaO2 – сатурация кислорода
- ВИВЛ (ACV) – вспомогательная искусственная вентиляция
- ВчОГК – высокочастотная осцилляторная вентиляция грудной клетки ДП – дыхательные пути
- ДН – дыхательная недостаточность ДО – дыхательный объем
- ИВЛ – искусственная вентиляция легких
- IRV – вентиляция с инвертированным отношением вдоха и выдоха ИПВЛ – интрапульмональная перкуссионная вентиляция легких КОС – кислотно-основное состояние крови
- МЦК – минутная циркуляция крови
- НВЛ – неинвазивная вентиляция легких ОДН – острая дыхательная недостаточность
- ОРДС – острый респираторный дистресс-синдром ПДКВ – положительное давление в конце выдоха
- ППВЛ – перемежающая принудительная вентиляция легких CPAP – постоянное положительное воздухоносное давление ХОБЛ – хроническая обструктивная болезнь легких
- ЦВД – центральное венозное давление ЧД – частота дыхания
1. ВВЕДЕНИЕ
Современные потребности, связанные с попытками реформировать систему здравоохранения в стране, диктуют необходимость по возможности систематизировать сведения о возможностях медицинской реабилитации больных с заболеваниями органов дыхания с целью их разумного применения в практике врачей.
С одной стороны, в России (ранее в СССР) разработано и научно обосновано едва ли не большинство реабилитационных методик, хотя, конечно, следует признать, что многие сведения, полученные в результате этих разработок, нуждаются в уточнении с современных методологических позиций. С другой стороны, практикующие врачи, по сути дела, не имеют возможности полноценно пользоваться этими данными.
Во-первых, это связано с тем, что у них зачастую нет адекватных первичных знаний либо в области механизмов действия немедикаментозных лечебных факторов, либо в области современных представлений о патофизиологических особенностях течения пульмонологических заболеваний и реакциях системы дыхания при сопутствующей патологии.
Во-вторых, сведения о возможности полноценной медицинской респираторной реабилитации опубликованы отрывочно в различных изданиях, зачастую устарели или не имеют достаточного научного обоснования с позиций доказательной медицины. В международных документах, отражающих современные представления о диагностике, лечении и профилактике основных пульмонологических заболеваний, сведения о реабилитации больных представлены достаточно скудно.
Так, практически отсутствуют данные о возможностях эффективного использования физических факторов. Подобная «ригидность» представлений может быть преодолена только накоплением убедительного научного и практического материала и его неоднократной публичной презентацией.
В зарубежных источниках медицинская реабилитация пульмонологических больных акцентирована почти исключительно на физических тренировках притом что зарубежные фирмы достаточно активно работают в области производства многих приборов, предназначенных именно для реабилитации.
Кроме того, несомненно, агрессивная политика фармацевтических компаний нередко создает ложное представление о возможности решить все проблемы при заболеваниях легких исключительно при помощи медикаментов и о противопоставлении лекарственной терапии возможному и необходимому применению немедикаментозных методик.
Вместе с тем практикующий врач нередко сталкивается с клиническими ситуациями, когда применение только медикаментов не позволяет достичь требуемого эффекта, а применение различных устройств, постурального дренажа или определенных видов дыхательной гимнастики, в том числе при разумном сочетании с медикаментозной терапией, повышает клиническую эффективность при минимальных экономических затратах (Малявин А.Г. 2006; Малявин А.Г., с соавт., 2010).
Респираторная система напрямую связана с внешней средой, поэтому неудивительно, что именно физические воздействия могут быть чрезвычайно эффективными. В первую очередь это касается возможностей стимуляции эвакуации мокроты, имеющей важное, а иногда и решающее значение при многих респираторных, сердечнососудистых и неврологических заболеваниях, а также в послеоперационном периоде.
Серьезные технологические решения последних лет и накопление убедительной доказательной базы создали весомые предпосылки для своеобразного «ренессанса» эффективных респираторных физиотерапевтических методик.
Мы надеемся, что представленные в этом материале сведения окажутся полезными для терапевтов, торакальных хирургов, пульмонологов, специалистов в области паллиативной медицины, медицинской реабилитации и других врачей.
2. НОРМАЛЬНЫЕ МЕХАНИЗМЫ МУКОЦИЛИАРНОГО ТРАНСПОРТА
Барьерная функция
Эффективным барьером, препятствующим попаданию в организм возбудителей инфекции, служит слизистая оболочка дыхательных путей (ДП). Она обладает весьма совершенными и сложно организованными механизмами защиты от неблагоприятного внешнего воздействия. Среди этих механизмов ведущими являются мукоцилиарный клиренс (МЦК; мукоцилиарный – «слизисто-реснитчатый»; клиренс – «очищение») и иммунная защита. Дыхательные рефлексы, такие как кашель, чиханье и сужение бронхов, препятствуют прилипанию слизи и обеспечивают удаление микроорганизмов и инородных частиц с поверхности ДП. Важным защитным фактором является слизь, выделяемая бокаловидными клетками и эпителиоцитами. В ее состав входят лизоцим, лактоферрин, секреторный иммуноглобулин, обладающие антибактериальной активностью. Принято также выделять внешние и внутренние факторы нарушения барьерных функций, способствующие проникновению возбудителя в ДП. К внешним факторам относят различные типы воздушных поллютантов (вредные вещества/ газы), высокую влажность, холод. Этим частично объясняется высокая частота острых респираторных вирусных инфекций (ОРВИ) в холодное время года. Под внутренними факторами понимают поражение слизистой оболочки с частичной/ полной утратой ее структуры при часто повторяющихся воспалительных процессах. Например, у детей причиной частых респираторных инфекций признается нарушение моторной активности реснитчатого эпителия по причине структурного дефекта слизистой оболочки на фоне частых острых бронхитов.
Дренажная функция
Респираторный тракт от кончика носа до мельчайших альвеол покрыт слизистой (мукозной) мембраной. Она очищает и увлажняет поступающий воздух. Образование компонентов секрета начинается с продукции легочного сурфактанта альвеолоцитами II порядка (сурфактант – от английского surface active agent – поверхностноактивное вещество). Он представляет собою смесь поверхностно-активных веществ: преимущественно это дипальмитоловый лецитин, выстилающий легочные альвеолы изнутри. Именно легочный сурфактант препятствует спаданию/слипанию стенок альвеол при дыхании за счет снижения поверхностного натяжения пленки тканевой жидкости, покрывающей альвеолярный эпителий (рис. 1).
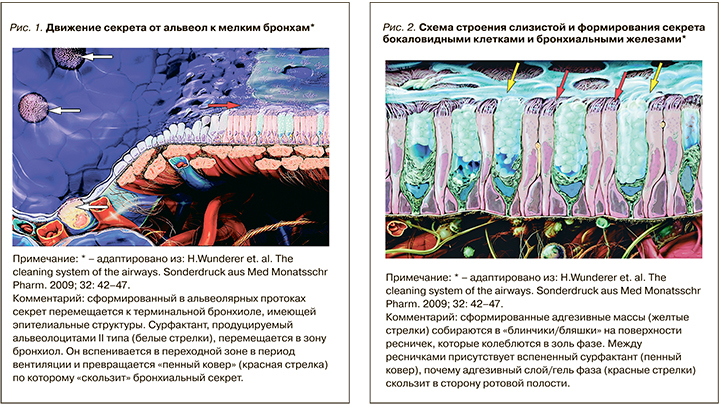
От характера продукции сурфактанта в альвеолярных протоках и его поверхностно-активных свойств во многом зависит способность альвеол к газообмену, а значит, поддержание легкими своей основной функции – доставки кислорода к тканям (рис. 2).
Сурфактант в значительной мере обеспечивает равномерность вентиляции различных отделов легких и рекрутирование в процесс газообмена плохо вентилируемых или частично заполненных секретом альвеол. В формировании защиты и секрета принимают участие клетки Клара (выпуклые клетки с короткими микроворсинками, описанные Максом Клара в 1937 г.). Они добавляют в секрет гликозаминогликаны, секреторный белок CCSP (Clara Cell Secretory Protein), цитохром Р450 для снижения токсичности и защиты эпителия от вредных веществ. В момент вдоха и выдо ха смесь альвеолярного сурфактанта с секретом клеток Клара вспенивается с образованием мелко пузырчатого «пенного ковра».
Именно он заполняет все промежутки между ворсинками и ресничками, формирует устойчивое покрытие эпителия, по которому в дальнейшем будет скользить слизь.
В зоне мелких бронхов эстафета принимается бокаловидными клетками и перибронхиальными железами (рис. 3). Важно, что бронхиальная подслизистая железа формирует основной состав трахеобронхиального секрета под названием «респираторные муцины».

Респираторные муцины – сложные белки (гликопротеиды) с огромной молекулярной массой (десятки тысячи дальтон), с высоким содержанием углеводов (50–80% от массы молекулы), с разветвленными олигосахаридными цепочками и большим количеством тандемных повторов.
Известно 19 основных генов, отвечающих за синтез муцинов у человека, почему выделяют MUC1, MUC2, MUC3A, MUC3B, MUC4, MUC5AC, MUC5B, MUC6, MUC7, MUC8, MUC12, MUC13, MUC15, MUC16, MUC17, MUC19 и MUC20.
Восемь из них признаются основными респираторными муцинами (рис. 4).
Интересно, что состав респираторных муцинов резко изменяется в период болезни. Так, при бронхиальной астме доминирует секреция MUC5B, почему мокрота содержит избыток белка и является очень вязкой. Необходимо отметить, что существуют серьезные различия между составом нормальной слизи (трахеобронхиальным секретом) и патологической слизью (мокротой).
Трахеобронхиальный секрет представляет смесь гидрофильных сиаломуцинов с клеточными элементами (альвеолярные макрофаги и лимфоциты). Она легко вбирает в себя воду и легко разжижается под действием муколитических агентов. В отличие от нормальной слизи, мокрота представляет собою экспекторируемый секрет трахеобронхиального дерева с примесью слюны и секрета слизистой оболочки полости носа и придаточных пазух, содержащий гидрофобные фукомуцины (см. рис. 3). Для ее разжижения требуются агенты, воздействующие на устойчивые к воде фукомуцины. За исключением альвеолярной части, слизистая представлена двумя строго разделенными зонами с различной реологией.
Принято выделять «серозную золь фазу» с низкой вязкостью и «адгезивную гель фазу» с высокой вязкостью. Большая и протяженная слизистая мембрана за счет адгезии собирает на своей поверхности мелкие частицы и микроорганизмы.
Вместе со слизью весь адгезированный материал удаляется при помощи постоянного движения реснитчатого эпителия («cilia» – цилия), покрывающей большую часть респираторного тракта. Приблизительно на каждые 5 мкм длины мембраны приходится 200 ресничек диаметром 0,3 мкм. Несколько сотен миллионов ресничек, образующих толстый ковер/барьер, располагаются в зольфазе (рис. 5).

3. МЕХАНИЗМЫ НАРУШЕНИЙ МУКОЦИЛИАРНОГО ТРАНСПОРТА
Три основных состояния происходят из нарушений проходимости воздуха по дыхательным путям: 1) воспаление; 2) скопление секрета; 3) бронхоспазм. Они приводят к формированию: а) нарушений легочной функции; б) уменьшению «защиты» легких; в) повышению риска инфекционных осложнений.
Когда дыхательные пути пациента содержат избыток слизи, вентиляция легких претерпевает значительные изменения. Они затрагивают как нижний, так и в верхний отдел ДП (бифуркация трахеи). Изменение вентиляции затрагивает и альвеолы легких, вызывая их коллапс (ателектаз), и приводит к нарушениям газообмена.
Отсутствие возможности полноценной диффузии кислорода и углекислого газа приводит к формированию интрапульмонального шунтирования крови. Результатом нарушений будет гипоксемия, плохо корригируемая кислородотерапией. Интересно, что в таких случаях правильная терапия основана на мобилизации секрета и его правильной экспекторации.
3.1. Краниальное воздухоносное смещение
Краниальным воздухоносным смещением (КВС) называют изменение в движении слизи по мелким дыхательным путям (диаметр <2 мм) в период нормального дыхательного цикла. Диаметр «изменчивых» воздухоносных путей увеличивается на вдохе и сужается во время выдоха (рис. 6). В норме время и объемы воздуха в период вдоха (инспирация) и выдоха (экспирация) одинаковы. Однако сужение просвета дыхательных путей на выдохе увеличивает линейную скорость потока и силу дренажа в краниальном направлении (в сторону головы), создавая эффект КВС. Оно также зависит от глубины дыхания. Аналогичный эффект существует и в более крупных отделах дыхательных путей (ДП), особенно в период интенсивного кашля.

Принцип очищения дыхательных путей от слизи базируется на главном принципе – создании «воздушного валика» позади слизи. При этом скорость потока выше 1,0–2,5 м/с без коллапса ДП считается идеальной. Создание «воздушного валика» позади секрета для формирования эффективного кашля и экспекторации слизи образует «коллатеральные вентиляционные каналы».
3.2. Кашель и его клиническое значение
У здоровых лиц основным механизмом очистки мелких дистальных дыхательных путей от слизи являются мукоцилиарный эскалатор (реснитчатый клиренс) и воздушный валик в результате краниального воздухоносного смещения. У пациентов с патологией из-за функциональных нарушений основным методом очистки проксимального отдела ДП становится кашель.
КАШЕЛЬ – произвольный или непроизвольный (рефлекторный) толчкообразный форсированный звучный выдох при спастически сомкнутых голосовых складках (рис. 7).
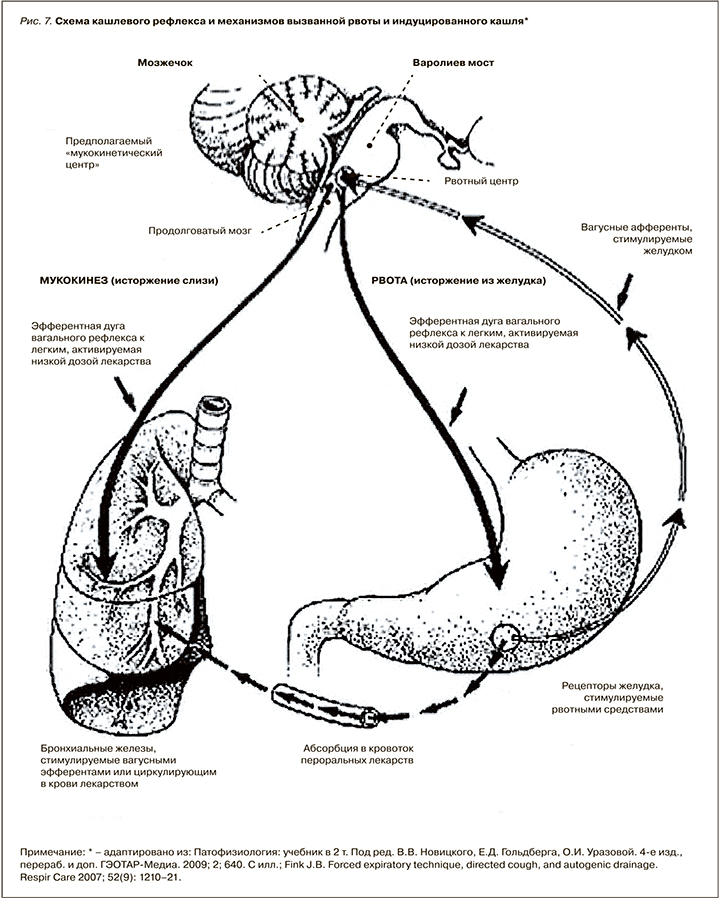
Очень важно, что кашель по своей сути является защитным рефлексом, необходимым для исторжения из организма чужеродного агента. Подавление кашля любыми средствами является вынужденной необходимостью в тех случаях, когда он приводит к нарушению вентиляции легких из-за повторяющихся пароксизмов (симптом репризы).
Во время обычного кашля скорость движения воздушного потока изменяется обратно пропорционально площади поперечного сечения дыхательных путей, создавая высокую линейную скорость с повышенной турбулентностью и высокой силой воздухоносного смещения. Эти силы выталкивают пристеночный секрет и «дыхательный мусор» из мелких ДП в крупные бронхи и трахею. При хронических заболеваниях легких, особенно сопровождающихся «воздушной ловушкой», преждевременное сужение податливых дыхательных путей вызывает захват воздуха, снижает экспираторный поток и ограничивает эффективность кашля.
3.3. Физиологическая роль гравитации
Гравитация (от лат. gravitas – «тяжесть») – универсальное фундаментальное взаимодействие между всеми материальными телами. В рамках классической механики гравитационное притяжение описывается законом всемирного тяготения Ньютона, который гласит, что сила гравитационного притяжения между двумя материальными точками массы, разделенными расстоянием, пропорциональна обеим массам и обратно пропорциональна квадрату расстояния.
Гравитация не является первичным механизмом нормального транспорта слизи в легких. Если бы существовал механизм миграции секрета в зависимые от гравитации зоны легких (периферические и базальные отделы), изгнание слизи из этих участков в центральные зоны легких представляло бы существенную проблему. Только при недостаточности мукоцилиарного клиренса и низкой эффективности кашля «гравитационные методики» оказывают положительное воздействие в очистке дыхательных путей от чрезмерного скопления слизи. С 1930-х гг. клиницисты активно использовали гравитацию (постуральный дренаж или опрокидывания) для мобилизации секрета у пациентов. Несмотря на то что поразительные результаты мобилизации секрета в результате постурального дренажа наблюдаются у пациентов с бронхоэктазами, значение данной методики для пациентов с хроническим бронхитом и муковисцидозом оказались скромными и клинически мало значимыми.
Такие методы терапии, как «прямой кашель», «дыхательные маневры», аппаратные методы положительного давления в дыхательных путях (PEP-терапия), высокочастотной осцилляции внутри дыхательных путей (интрапульмональная перкуссия – ИПВЛ) и грудной клетки (экстрапульмональная перкуссия – ЭПВЛ), оказывают прямое, более эффективное воздействие на механизмы нормализации транспорта слизи, чем «постуральный дренаж», который теоретически более удобен для пациента в мобилизации трахеобронхиального секрета.
3.4. Физиологическая роль глубокого дыхания и кашля
Нормальным механизмом расправления легких и бронхиальной гигиены является метод «глубокого спонтанного дыхания» (зевота и вздохи) и продуктивный кашель. Одной из самых безопасных, эффективных и наименее затратных стратегий расправления легких и мобилизации секрета служит методика инструктирования и поощрения пациента к осуществлению последовательных глубоких вдохов и выдохов. Парадоксально, но именно «глубокое эффективное дыхание» является ключевым компонентом продуктивного кашля. Отрицательное внутригрудное давление, создаваемое при спонтанном глубоком дыхании пациента, как правило, лучше расправляет (инфлатирует) менее податливые гравитационно-зависимые зоны легких, чем методы PEP-терапии. Эффективный кашель является жизненно важным компонентом бронхиальной гигиены легких. Физиологический кашель (рис. 8) предполагает последовательность действий: 1) глубокий вдох (расправление); 2) закрытие голосовой щели; 3) активация брюшных и грудных мышц для создания компрессии (сжатия) с формированием положительного давления >80 мм. рт. ст.; 4) резкий (взрывной) выдох через открытую голосовую щель. В дополнение к мобилизации секрета высокое положительное давление, создаваемое в результате кашля, является важным фактором повторного расширения ткани легкого. В сравнении с PEPтерапией, когда высокое положительное давление может вызывать баротравму легких, повреждение легких невозможно при контролируемом кашлевом маневре.

У пациентов с нестабильностью дыхательных путей, высокое положительное давление и большая скорость воздушного потока в период обычного кашлевого маневра сопровождается динамической компрессией воздухоносных путей, что приводит к захвату воздуха и слизи внутри бронхиального дерева. Это делает кашель неэффективным. Для таких пациентов разработаны различные дыхательные техники, существенно повышающие краниальное воздухоносное смещение.
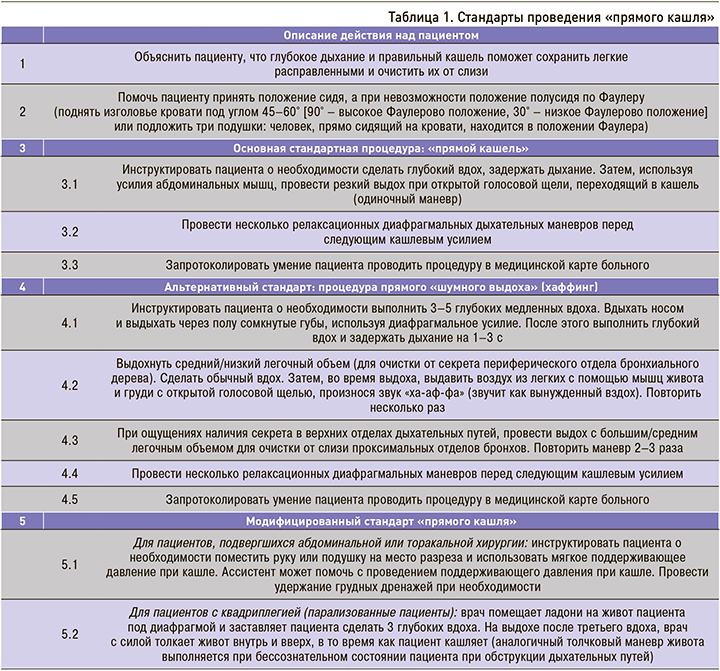
Примером такой техники является «прямой кашель», предусматривающий обучение пациента глубокому дыханию перед кашлем, одновременно с созданием абдоминальной и торакальной компрессии в период резкого выдоха (табл. 1).
Чаще всего метод прямого кашля включен как элемент в более эффективные техники, такие как «форсированный экспираторный маневр» (ФЭМ) и метод «активного циклического дыхания» (АЦД).
4. БРОНХИАЛЬНАЯ ГИГИЕНА И ДЫХАТЕЛЬНЫЕ ТЕХНИКИ
4.1. Форсированный экспираторный маневр с хаффингом
Форсированный экспираторный маневр (ФЭМ) впервые описан в 1968 г. врачом Thompson и физиотерапевтом Thompson из Новой Зеландии в ходе терапии пациентов с астмой. Они описали использование 1–2 хаффингов уровнем среднего/ малого легочного объема с открытой голосовой щелью после периода релаксации и с контролируемым диафрагмальным дыханием и медленным глубоким вдохом. После мобилизации секрета из нижних отделов бронхиального дерева и его экспекторации пациентом в период кашля, маневр повторялся (табл. 2).

Как это часто бывает, многие клиницисты приняли на вооружение только часть методики форсированного экспираторного маневра с хаффингом (ФЭМ-Х), придя к выводу, что именно хаффинг служит наиболее важной ее составляющей, чем вызвали серьезную обеспокоенность сторонников дыхательных техник очистки легких. Это напоминает историю перкуссионной и вибрационной терапии, которые в свое время посчитали наиболее важными для физиотерапии грудной клетки (ФГК), что ошибочно вызвало исключение из клинической практики техники «постурального дренажа». Необходимо отметить, что хаффинг не является самостоятельной методикой. Он является одним из 3 основных компонентов метода АЦД.
Показания к проведению ФЭМ-Х:
- непродуктивный кашель (без экспекторации мокроты);
- пациент нуждается в дополнительной помощи для мобилизации секрета;
- ателектазы, происходящие от неэффективного кашля;
- ведение пациентов после выполнения абдоминальной и грудной хирургии (послеоперационное);
- хроническая гиперсекреция слизи;
- отсутствие кашлевого рефлекса.
Противопоказания к проведению ФЭМ-Х носят относительный характер и не являются клинически значимыми.
С осторожностью следует применять ФЭМ-Х при:
- парестезии или онемение конечностей;
- снижении коронарной перфузии;
- снижении церебральной перфузии;
- недержании мочи;
- усталости (различного генеза);
- головных болях (различного генеза);
- бронхоспазме;
- мышечных повреждениях или мышечном дискомфорте;
- спонтанном пневмотораксе, пневмомедиастинуме, подкожной эмфиземе;
- пароксизмах кашля;
- болях в груди;
- острых реберных или реберно-хрящевых переломах;
- послеоперационных болях или незаживших раневых поверхностях брюшной стенки и грудной клетки;
- анорексии, рвоте и рвотных позывах;
- рительных расстройствах, включая кровоизлияние в сетчатку;
- смещении центральной линии живота;
- гастроэзофагеальной рефлюксной болезни.
Хаффинг имеет огромное значение для объема экспекторируемого секрета, но какой «энергетической ценой» это достигается? В исследовании Pontifex et al. оценили энергию на хаффинг и прямой кашель, затраченную 24 асимптоматичными некурящими пациентами ХОБЛ. Расход энергии был одинаков при хаффинге и прямом кашле. Однако в обоих случаях требовалось достоверно больше энергии, чем в период отдыха. Главной практической рекомендацией явилось утверждение, что при необходимости мобилизации секрета наиболее эффективной и энергетически оправданной методикой является «форсированный экспираторный маневр с хаффингом» (ФЭМ-Х).
4.2. Метод «активного циклического дыхания»
АЦД представляет собою сочетание трех основных дыхательных техник: «дыхательный контроль», «контроль расширения грудной клетки», ФЭМ-Х (рис. 9).

Дыхательным контролем (ДК) называют диафрагмальное дыхание, или «нежное расслабленное дыхание» в нормальном темпе для расслабления дыхательных путей и мышц. При осуществлении ДК пациент контролирует верхнюю часть грудной клетки, его плечи должны быть расслаблены. Он дышит обычным для него дыхательным объемом с обычной частотой. При этом пациент должен ощущать «разбухание» вокруг талии при вдохе, связанное с опускающейся диафрагмой, вытесняющей содержимое брюшной полости.
«Разбухание» исчезнет при выдохе. Дыхательный контроль, по существу, является основой релаксационного дыхательного маневра между циклами активных дыхательных техник АЦД.
Контролем расширения грудной клетки (КРГК) называют активные вдохи, значительно большие, чем при обычном дыхании, следующие за релаксационным дыхательным маневром ДК. Техника КРГК – глубокий, медленный, полный вдох с незначительной задержкой дыхания, а затем медленный, спокойный, неглубокий выдох. Это позволяет воздуху пройти в самые дистальные отделы бронхиального дерева. Более того, большие легочные объемы повышают воздухоносный поток через периферические дыхательные пути и коллатеральные вентиляционные каналы, что увеличивает объем воздуха, способного мобилизовать секрет в период выдоха. Проведение КРГК, как правило, ограничено 3–4 циклами глубоких вдохов. Это позволяет избежать усталости и гипервентиляции.
Техника ФЭМ-Х состоит из 1–2 форсированных выдохов (хаффингов), комбинированных с периодом ДК (табл. 3). Выполняется обычный вдох с задержкой или без задержки дыхания на 1–3 с. После этого выполнить резкий выдох, используя мышцы живота и груди, с открытым ртом и открытой голосовой щелью.

Хаффинг должен выполняться активно, но без агрессивного, взрывного выдоха. Он выполняется с большими объемом вдоха (РОвдох), после которого следует обычный объем выдоха (РОвыд).
 Маневр начинается при равных точках давления и среднем легочном объеме. Затем динамическая точка сжатия перемещается на периферию. Это вызывает соответствующие изменения линейной скорости воздушного потока и создает краниальное воздухоносное смещение слизи. При последующих хаффингах, маневр начинается при равных точках давления, но при значительно большем легочном объеме. После смещения динамической точки сжатия на периферию это создаст условие для более выраженного краниального воздухоносного смещения слизи. Такой цикл может быть визуализирован как «доение коровы» (аналогично движению рук доярки в момент дойки коровы). Именно он заставляет слизь двигаться в сторону центральных воздухоносных путей, для легкой ее экспекторации. Механическая компрессия грудной клетки в период выдоха может быть использована для оптимизации экспираторных усилий при хаффинге и кашле. Однако такие эффекты не были до конца изучены.
Маневр начинается при равных точках давления и среднем легочном объеме. Затем динамическая точка сжатия перемещается на периферию. Это вызывает соответствующие изменения линейной скорости воздушного потока и создает краниальное воздухоносное смещение слизи. При последующих хаффингах, маневр начинается при равных точках давления, но при значительно большем легочном объеме. После смещения динамической точки сжатия на периферию это создаст условие для более выраженного краниального воздухоносного смещения слизи. Такой цикл может быть визуализирован как «доение коровы» (аналогично движению рук доярки в момент дойки коровы). Именно он заставляет слизь двигаться в сторону центральных воздухоносных путей, для легкой ее экспекторации. Механическая компрессия грудной клетки в период выдоха может быть использована для оптимизации экспираторных усилий при хаффинге и кашле. Однако такие эффекты не были до конца изучены.
Процедуре АЦД можно научить широкий круг больных и легко адаптировать ее для пациентов с различными заболеваниями. АЦД можно скорректировать индивидуально для каждого пациента. Например, пациенты с продукцией большого объема слизи, но без выраженной гиперреактивности бронхов, ателектазов, множественных «слизистых пробок» или закупорки мелких дыхательных путей могут использовать АЦД, состоящую из (ДК) + (КРГК) + (ДК) + (ФЭМ-Х) (рис. 10).
У пациентов с бронхоспазмом и обструкцией ДП целесообразнее использовать продолжительные эпизоды дыхательного контроля (рис. 11).
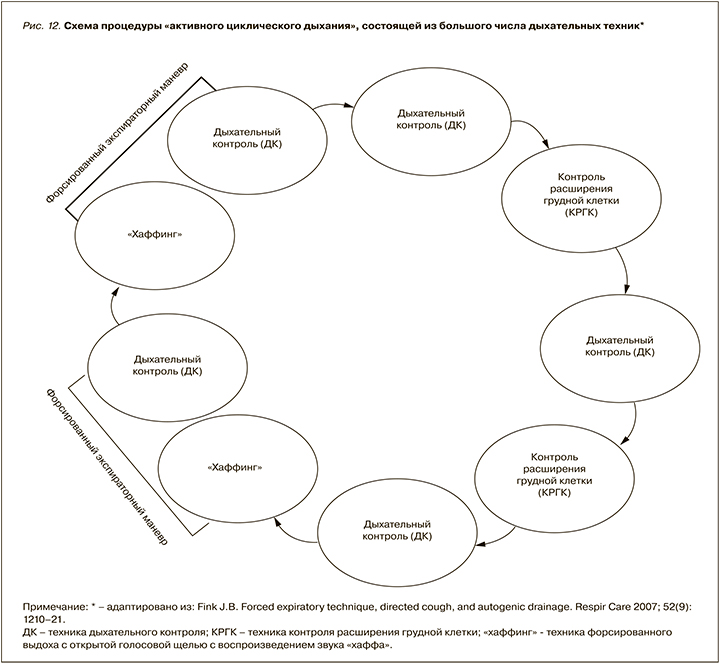
У пациентов с закупоркой дыхательных путей слизью, ателектазами, некоторыми рестриктивными заболеваниями легких особенно полезными признаются длинные циклы с многократно повторяющимися техниками (рис. 12). Несмотря на то, что клинической эффективностью проводимой терапии является очевидное изменение аускультативной картины легких, на сегодняшний день не хватает рандомизированных клинических исследований с доказательствами преимуществ данных стратегий у различных групп пациентов.
Метод АЦД должен быть комфортным и не изнуряющим. Его можно применять в любой позиции тела в зависимости от потребностей терапии. Терапия в положении сидя более эффективна по сравнению с другими позициями. У ряда пациентов могут применяться другие позиции. Доказано, что горизонтальное положение, положение лежа на боку, положение вниз головой одинаково эффективны при проведении процедуры АЦД (Cecins et. al., 1999). Гибкость схемы (количество хаффинга, продолжительность периодов контроля дыхания, количество циклов контроля за расширением грудной клетки) позволяет индивидуализировать объем и эффективность процедуры. АЦД повторяется, пока хаффинг не становится «сухим» или непродуктивным.
Общее время терапии составляет от 10 до 30 мин. Врач или пациент самостоятельно могут подобрать наиболее подходящий режим, позицию, продолжительность и количество процедур в день, необходимые для эффективной терапии. Режим АЦД может гибко меняться: от процедуры к процедуре, а также во время обострений легочного заболевания.
Исследования метода АЦД установили, что он является эффективной техникой очистки дыхательных путей (Pryor et al., 1979; Wilson et al., 1995). Интересно, что его эффективность не увеличивалась при добавлении положительного давления на выдохе (PEP-терапия) (Hofmeyr et. al., 1986), флаттера (Flutter®) (Pryor et al., 1994; Pike et al., 1999), механической перкуссии (Pryor et al., 1981) или высокочастотной вибрации грудной клетки (Osman et al., 2008). Было показано улучшение функции легких (ОФВ1) при использовании метода АЦД (Webber et al., 1986), без наступления или увеличения гипоксемии (Pryor et al, 1990). При годичном применении метода АЦД, волновой PEP-терапии и осцилляционной PEP-терапии были достигнуты одинаковые результаты мобилизации мокроты и очистки дыхательных путей (Pryor et. al., 2006).
Показания к проведению метода АЦД:
- непродуктивный кашель (без экспекторации мокроты);
- пациент нуждается в дополнительной помощи для мобилизации секрета;
- ателектазы, происходящие от неэффективного кашля;
- ведение пациентов после выполнения абдоминальной и грудной хирургии (послеоперационное);
- хроническая гиперсекреция слизи;
- отсутствие кашлевого рефлекса.
Противопоказания к проведению метода АЦД носят относительный характер и не являются клинически значимыми.
С осторожностью следует применять метода АЦД при:
- парестезии или онемение конечностей;
- снижении коронарной перфузии;
- снижении церебральной перфузии;
- недержании мочи;
- усталости (различного генеза);
- головных болях (различного генеза);
- бронхоспазме;
- мышечных повреждениях или мышечном дискомфорте;
- спонтанном пневмотораксе, пневмомедиастинуме, подкожной эмфиземе;
- пароксизмах кашля;
- боли в груди;
- острых реберных или реберно-хрящевых переломах;
- послеоперационных болях или незаживших раневых поверхностях брюшной стенки и грудной клетки;
- анорексии, рвоте и рвотных позывах;
- зрительных расстройствах, включая кровоизлияние в сетчатку;
- смещении центральной линии живота;
- гастроэзофагеальной рефлюксной болезни.
4.3. Респираторные гимнастики и постуральный дренаж
Различают различные типы респираторных упражнений и постуральный дренаж. Характер таких упражнений определяется локализацией нагноительного процесса. При выполнении дренажных упражнений зона поражения должна располагаться выше бифуркации трахеи, что создает оптимальные условия для оттока, отделяемого из пораженных бронхов и полостей. Принято выделять:
- статическое дыхание – выполняют в различных исходных положениях без движения ног, рук и туловища, под их влиянием происходит урежение дыхания, нормализуется его ритмичность;
- динамическое дыхание – дыхательные упражнения в сочетании с движениями, на вдохе – разведение или поднятие рук вверх, разгибание позвоночника, выпрямление ног, на выдохе – приведение и опускание рук, наклоны туловища, сгибание ног, приседания. Упражнения увеличивают объем вентилируемой поверхности легких;
- статическое диафрагмальное дыхание – «дыхание животом», наиболее интенсивно работает диафрагма, и помогают ей мышцы брюшного пресса (для контроля правильности выполнения упражнения одна рука кладется на грудь, другая на живот);
- произвольно управляемое или локализованное дыхание – на вдохе нужно стараться направить вдыхаемый воздух в определенные доли легких, в одну или обе верхние доли при верхнем грудном дыхании, при этом плечи и верхняя часть грудной клетки поднимаются, а на выдохе опускаются. При выполнении нижнего грудного дыхания руки кладутся на нижние ребра, на вдохе следует направить вдыхаемый воздух в нижние доли легких, кисти рук при этом активно выталкиваются работающими межреберными мышцами;
- специальные дыхательные упражнения – усиливают вентиляцию отдельных долей или всего легкого для нормализации функции внешнего дыхания. Это достигается посредством механического сдавления грудной клетки на стороне тренируемого легкого или в положении лежа на противоположном тренируемому боку с подложенным валиком. При локализации процесса в нижней доле тренируют дыхание в верхних средних отделах путем ограничения экскурсии (сдавления) нижней доли легкого. Вентиляция нижних отделов достигается снижением экскурсии верхних и средних отделов легких, для этого выполняется статическое напряжение мышц плеча и руки;
- дыхательные упражнения с дозированным сопротивлением – основное внимание уделяется стимуляции выдоха, что способствует более равномерной вентиляции при последующем вдохе. Для этого во время выдоха руками производятся вибрирующие сдавления грудной клетки, с каждым вдохом степень воздействия на грудную клетку усиливается, достигая оптимальной величины. Место приложения рук рекомендуется менять каждые 2–3 дыхательных движения, располагая их на различных участках грудной клетки, области реберной дуги и живота, что способствует усилению рецепции дыхательного аппарата.
Дренажные упражнения (статического и динамического характера), т.е. активный дренаж направлен в основном на улучшение выведения мокроты, для этого выполняют упражнения для различных групп мышц, используя частую смену исходных положений и приемы постурального дренажа:
- при локализации процесса в верхней доле легкого – наиболее полное опорожнение полости достигается при выполнении упражнений в исходных положениях сидя и стоя;
- при локализации процесса в средней доле или язычковом сегменте – в исходном положении лежа на «здоровом» боку или на спине с подложенным под грудь валиком, ноги согнуты в коленных суставах и руками прижаты к животу;
- при локализации процесса в нижних долях – в исходном положении лежа на животе, «здоровом» боку, с поднятым ножным концом, свесившись с кушетки, стоя в глубоком наклоне на выпрямленных ногах;
- дренажу нижних отделов легких наиболее способствуют физические упражнения, связанные с напряжением мышц брюшного пресса: сгибание ног в коленях и тазобедренных суставах при одновременном надавливании на живот; разведение и перекрестное сведение выпрямленных приподнятых ног в положении лежа на спине, движение обеими ногами «велосипед».
Частая смена исходных положений, активные движения, связанные с поворотами туловища, являются благоприятными факторами, улучшающие опорожнение гнойных полостей. После каждого упражнения надо откашливать мокроту!
Метод постурального (позиционного) дренажа заключается в приеме специально заданного исходного положения тела, направленного на отток экссудата по дыхательным путям по принципу «желоба», зона поражения легких находится также выше места бифуркации трахеи. Мокрота при этом продвигается под воздействием силы тяжести к месту разветвления трахеи, где наиболее высокая чувствительность кашлевого рефлекса, и в результате возникновения непроизвольного рефлекторного кашля выводится из дыхательных путей, повышается продуктивность кашля.
В начале лечения дренажное положение принимается на 5–10 мин, время пребывания в этом положении нужно увеличивать постепенно. Если отделяемого много и больной привык к дренажному положению, дренирование можно продолжать до 30–40 мин. Чтобы избежать затекания, отделяемого в здоровое легкое, процедуру дренирования нужно заканчивать дренажом здорового легкого. Постуральный дренаж должен быть прерван, если во время процедуры возникает значительная одышка или удушье. Принято выделять постуральный дренаж правого и левого легкого (рис 13).
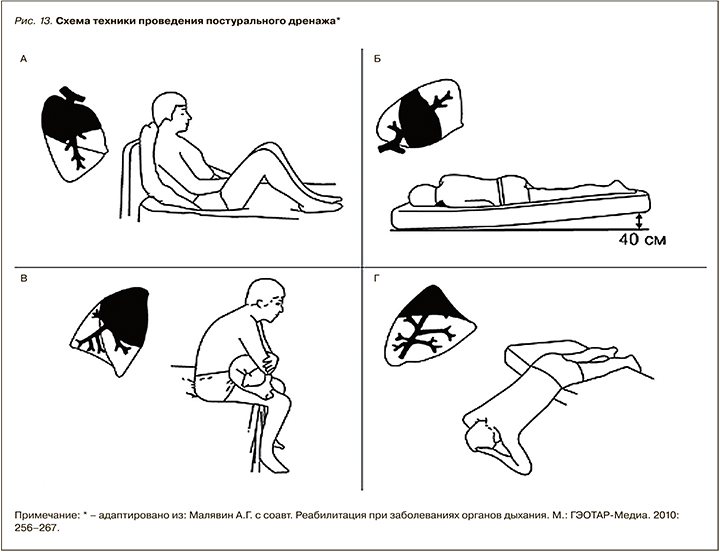
Постуральный дренаж правого легкого:
- дренирование переднего сегмента верхней доли легкого – в положении сидя, отклонившись назад;
- дренирование заднего сегмента – в положении сидя, наклонившись вперед;
- дренирование верхушечного сегмента – в положении сидя, наклон влево;
- дренирование средней доли – в положении лежа на спине, подтянув ноги к груди и откинув голову назад, или в положении на левом боку при поднятом ножном конце кушетки и опущенном правом плече;
- дренирование правой нижней доли легкого – в положении на левом боку, с прижатой к груди левой рукой, ножной конец кушетки поднят на 40 см. Постуральный дренаж левого легкого:
- дренирование переднего сегмента верхней доли – в положении сидя с наклоном назад;
- дренирование заднего сегмента – в положении сидя с наклоном вперед;
- дренирование верхушечного сегмента – в положении сидя, наклон вправо;
- дренирование нижних сегментов верхней доли – в положении на правом боку с опущенным левым плечом, согнутая правая рука прижата к груди, левая нога согнута в коленном суставе;
- дренирование нижних сегментов левой нижней доли – в положении на правом боку, рука прижата к груди, ножной конец кушетки приподнят на 40 см, при повороте вперед отток осуществляется из заднего сегмента. Положение на боку способствует дренированию бокового сегмента.
Обязательное условие для отделения мокроты во время процедуры постурального дренажа – удлиненный форсированный выдох, чтобы создать мощный воздушный поток, который увлекает за собой бронхиальный секрет. Вибрационный массаж или легкое поколачивание во время выдоха способствуют отхождению мокроты.
Повысить эффективность постурального дренажа могут предварительные аппликации теплоносителей (лечебные грязи, парафин, озокерит) и облучение значимой зоны легкого электромагнитными волнами дециметрового диапазона за счет теплового разжижения мокроты и стимуляции локальной гемодинамики.
Показания к постуральному дренажу и респираторной гимнастике:
- заболевания, при которых образуется мокрота;
- ХОБЛ;
- хронический обструктивный бронхит;
- пневмония в стадии разрешения;
- бронхоэктазы;
- абсцессы легких.
Постуральный дренаж и респираторная гимнастика противопоказаны при:
- легочном кровотечении (но не при кровохаркании);
- остром инфаркте миокарда;
- выраженной сердечно-сосудистой недостаточности;
- инфаркте легкого;
- тромбоэмболии легочной артерии;
- гипертоническом кризе;
- гипертонической болезни 2–3 стадии;
- любых заболеваниях и состояниях, при которых следует ограничить или исключить положение тела с опущенной головой и верхней частью туловища (глаукома, катаракта, головокружения, ожирение 3–4 степени, цереброваскулярная болезнь и т.п.).
Звуковая гимнастика
Звуковая респираторная гимнастика – это специальные упражнения, заключающиеся в произнесении определенных звуков и их сочетаний строго определенным способом, при этом вибрация голосовых связок передается на гладкую мускулатуру бронхов, легкие, грудную клетку, расслабляя спазмированные бронхи и бронхиолы. Сила вибрации зависит от силы воздушной струи, возникающей при произнесении тех или иных звуков, этот факт используется для тренировки дыхательных мышц, и более всего – диафрагмы. По силе воздушной струи и вибрации все согласные звуки подразделяются на три группы:
- максимальная сила возникает при произнесении глухих согласных (П, Т, К, Ф, С), соответственно требуется и наибольшее напряжение мышц грудной клетки и диафрагмы;
- среднее по силе напряжение развивается при произнесении звонких согласных (Б, Д, Г, В, З);
- наименьшая сила воздушной струи при произнесении так называемых сонант (М, Н, Л, Р);
- специальные согласные звуки:
- жужжащие (Ж, З);
- свистящие и шипящие (С, Ф, Ц, Ч, Ш);
- рычащий (Р).
Основная цель звуковой гимнастики – выработать соотношение вдоха и выдоха 1:2.
Показания к звуковой гимнастике – заболевания дыхательных путей, сопровождающиеся бронхоспазмом.
Правильная техника звуковой гимнастики:
- вдох через нос, продолжительностью 1–2 с, пауза – 1 с, активный выдох через рот 2–4 с, снова пауза 4–6 с. Выдох должен быть в два раза больше вдоха. При таком соотношении дыхательных движений происходит наиболее полный газообмен в альвеолах и полное смешение вдыхаемого воздуха с альвеолярным;
- все звуки следует произносить строго определенным образом в зависимости от цели гимнастики;
- при бронхиальной астме жужжащие, рычащие, шипящие звуки произносятся громко, энергично, «возбуждающе»;
- при ХОБЛ и хроническом обструктивном бронхите с выраженной дыхательной недостаточностью те же звуки произносятся мягко, тихо, можно шепотом – «успокаивающе»;
- занятие начинают с «очистительного выдоха» – ПФФ – произносят через губы, сложенные в трубочку;
- «очистительный выдох» производят до и после каждого звукового упражнения;
- второе обязательное упражнение – «закрытый стон» – МММ – выполняют сидя, наклонившись вперед, положив кисти на колени ладонями вниз;
- при выполнении комплексов звуковых упражнений через 2–3 занятия следует вводить постепенно гимнастические упражнения;
- продолжительность занятий – начиная с 5–6 мин, в дальнейшем постепенно увеличивая время занятия, но не превышая 25–30 мин 2–3 раза в день;
- проводить занятия желательно до приема пищи или через 1,5–2 ч после еды.
Респираторная гимнастика (пранаяма)
К традиционным методикам респираторной гимнастики, создающей навыки полного дыхания в сочетании с формированием правильного дыхательного стереотипа, относят йоговское упражнение пранаяма, в основе которого лежит последовательная и максимально полная вентиляция различных участков легких с возможной нормализацией вентиляционно-перфузионных отношений.
Методика проведения пранаямы:
- исходное положение – сидя на стуле с прямой и опирающейся на спинку стула спиной, руки на коленях, голова не наклонена (горделивая осанка);
- перед началом упражнений необходимо расслабить грудную клетку, подняв плечи и затем расслабленно опустив их кзади и назад;
- вдох через нос при слегка напряженной носоглотке (втягивание воздуха как при принюхивании);
- в первую фазу вдоха вентилируются нижние отделы легких. Для этого при сокращении и опущении диафрагмы передняя брюшная стенка выдвигается вперед;
- затем плавно без задержки вентилируются верхние отделы легкого. Для этого во вторую фазу вдоха за счет работы межреберных мышц расширятся грудная клетка. Максимальный вдох по возможности осуществляется без заметных усилий со стороны дополнительной дыхательной мускулатуры;
- выдох осуществляется не форсировано, пассивно под тяжестью грудной клетки через неплотно сомкнутые или вытянутые в трубочку губы (эффект «проколотой шины»);
- необходимо совершать по 20–30 вдохов 3 раза в день.
На этапе обучения респираторную гимнастику целесообразно проводить перед зеркалом. При этом одну руку следует располагать в области грудины, а другую – на поверхности верхней части живота.
Ошибочной следует признать стремление отдельных энтузиастов абсолютизировать возможности методики пранаямы, а также ряда других «авторских» методик респираторной гимнастики сделать ее монопольной реабилитационной методикой при респираторных заболеваниях (Малявин А.Г., 2006; Малявин А.Г., Епифанов В.А., Глазкова О.И., 2010)
5. ГИПЕРИНФЛЯЦИОННАЯ ИЛИ ОБЪЕМ-РАСШИРЯЮЩАЯ ТЕРАПИЯ
5.1. Инспираторная терапия с перемежающимся давлением
Инспираторная терапия (терапия вдоха) с перемежающимся давлением (ИТПД) представляет собою вариант физиотерапии с избыточным давлением у пациентов с сохраненным дыхательным контролем, проводимой коротким сеансом для тренировки «вдоха» пациента (контроль дыхательного объема и потока) и расправления легочной ткани.
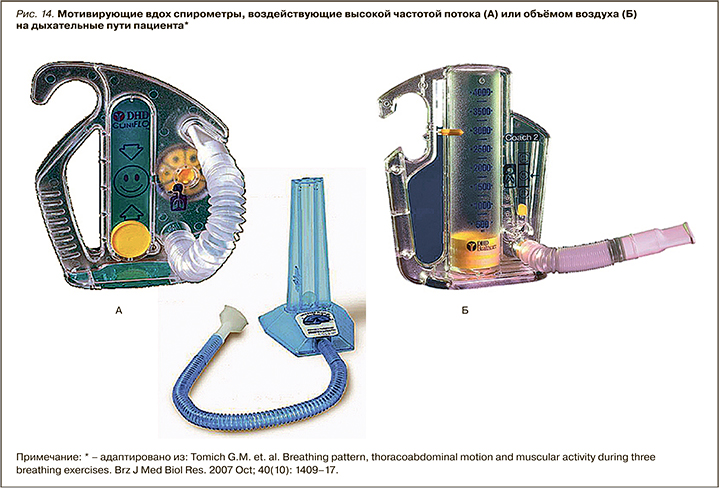
ИТПД-терапия осуществляется с помощью 2 типов респираторных устройств, называемых «мотивирующие вдох спирометры» (МВС), воздействующих высокой частотой потока или объемом воздуха на дистальные дыхательные пути пациента в период вдоха (рис. 14):
- потоковые спирометры (CliniFlo, Portex, Tri-Flo);
- объемные спирометры (Coach, Voldyne). Мотивирующие вдох спирометры (МВС) помогают поддерживать дыхательные пути пациента открытыми в период вентиляции легких. У пациентов с суженными или закупоренными дыхательными путями они позволяют: а) устранить воздушную ловушку; б) предотвратить или устранить ателектаз; в) мобилизовать накопившийся секрет. Главные физиологические эффекты МВС связаны с усилением коллатеральной вентиляции, снижением альвеолярных коллапсов, увеличением времени постоянства «альвеолярной открытости». В соответствии с клиническим руководством по проведению ИТПД-терапии с помощью МВС (AARC clinical practice guideline: incentive spirometry: 2011. Respir Care 2011 Oct; 56(10): 1600-04) принято выделять четкие показания и противопоказания к проведению метода.
Показания для проведения метода:
- предоперационный скрининг пациентов с высоким риском послеоперационных осложнений для установления базовых значений воздушного потока и/или объема (Agostini et al., 2008; Kips, 1997; Larson et al., 2009);
- для уменьшения случаев послеоперационных легочных осложнений, когда эффективно сочетать ежедневные сеансы ИТПД-терапии с упражнениями по глубокому дыханию, процедурами АЦД, методом ранней активации пациента и оптимальным обезболиванием;
- наличие ателектаза легких или клинического состояния, предрасполагающего к развитию легочного ателектаза:
- верхняя абдоминальная и/или торакальная хирургия (Westwood et al., 2007);
- нижняя абдоминальная хирургия (Pappachen et al., 2006);
- длительный постельный режим;
- хирургическое вмешательство у пациентов с ХОБЛ;
- плохой контроль болевого синдрома (Bellet et al., 1995);
- наличие торакальных или абдоминальных послеоперационных швов или повязок;
- рестриктивные легочные нарушения ассоциированные с дисфункцией диафрагмы или респираторной мускулатуры;
- пациенты с инспираторной емкостью ≤2,5 литра (Weindler & Kiefer, 2001);
- пациенты с нейромышечными заболеваниями;
- пациенты с повреждением спинного мозга (Chureemas & Kovindha, 1992);
- ИТПД-терапия с использованием МВС может предотвратить ателектаз, связанный с «острым грудным синдромом» (острыми болями в грудной клетке, связанными с инфарктом легкого на почве пневмонии (чаще всего хламидийной) или серповидно клеточной анемией) (Bellet et al., 1995; Hsu, Batts, & Rau, 2005);
- у пациентов, перенесших аортокоронарное шунтирование (Yánez-Brage et al., 2009): использование метода МВС и PEP-терапии может значительно улучшить легочную функцию и результаты 6-ти минутного нагрузочного теста, уменьшить случаи послеоперационных осложнений (Haeffener et al., 2008; Ferreira et al., 2010). Противопоказания для проведения метода:
- лица не подверженные обучению (возраст, память, движение) или неправильно использующие технические устройства;
- пациенты плохого взаимодействия с врачом (не могут понять или правильно использовать устройства МВС):
- очень молодые пациенты или пациенты с задержкой развития;
- пациенты с нарушением сознания или делирием;
- пациенты с сильной седацией или находящиеся в коме.
- пациенты, неспособные сделать глубокий вдох из-за боли, мышечной дисфункции, или аналгезии опиатами (Wilkins, 2005);
- пациенты, неспособные развить адекватную жизненную емкость легких (ЖЕЛ <10 мл/кг) или имеющие низкую емкость вдоха (Евд <33% от должных величин) (Wilkins, 2005).
С осторожностью следует применять метод у пациентов при:
- гипервентиляции и/или респираторном алкалозе;
- вторичной гипоксемии, плохо контролируемой кислородотерапией;
- усталости скелетной и дыхательной мускулатуры;
- болях различного генеза (особенно хронического характера).
Ожидаемыми результатами являются:
- разрешение или клинические признаки расправления ателектаза:
- уменьшение частоты дыхания;
- отсутствие лихорадки;
- нормальная частота пульса;
- улучшение ослабленного или отсутствующего дыхания;
- улучшение рентгенологической картины;
- улучшение напряжения артериальной крови кислородом (PaO2), сатурации крови (SpO2), уменьшение потребности в терапии с повышенной кислородной фракцией (FiO2 >40%);
- повышение дыхательного объема на 25% от исходных величин, значений ОФВ1 и максимальной объемной скорости выдоха (МОСвыд);
- повышение эффективности кашля и улучшение дренажа мокроты.
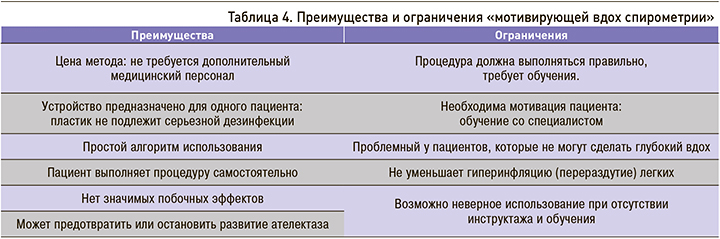
Как любой метод физиотерапии, МВС имеет свои преимущества и ограничения (табл. 4).
Как уже говорилось выше, основные физиологические эффекты МВС связаны с усилением коллатеральной вентиляции, уменьшением альвеолярных коллапсов, увеличением времени постоянства «альвеолярной открытости». Рассмотрим эти механизмы детальнее.
Усиление коллатеральной вентиляции
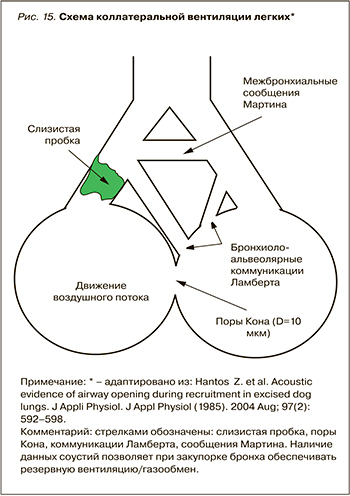 В легких существует так называемая коллатеральная вентиляция, которая позволяет в случае закупорки бронхов осуществлять дыхание за счет наличия в легких дополнительных, запасных путей между долями, сегментами, ацинусами. До 30–40% воздуха может поступать в альвеолы за счет коллатеральной вентиляции.
В легких существует так называемая коллатеральная вентиляция, которая позволяет в случае закупорки бронхов осуществлять дыхание за счет наличия в легких дополнительных, запасных путей между долями, сегментами, ацинусами. До 30–40% воздуха может поступать в альвеолы за счет коллатеральной вентиляции.
В альвеолярной стенке имеются поры Кона (D=10 мкм). Между отдельными ацинусами есть сообщения, которые начинаются от альвеолярных ходов одного ацинуса и заканчиваются в альвеолярном мешке другого ацинуса. Инспираторные бронхиолы одного сегмента могут соединяться с терминальными бронхиолами соседнего сегмента (бронхиолоальвеолярные коммуникации Ламберта, межбронхиальные сообщения Мартина) (рис. 15). В целом считается, что респираторные бронхиолы являются основой коллатеральной вентиляции легких.
Газообмен наиболее эффективен, если альвеолярная вентиляция и капиллярная перфузия распределены равномерно по отношению друг к другу. Но альвеолы не всегда вентилируются равномерно, даже в здоровом легком. В норме вентиляция обычно осуществляется преимущественно в верхних отделах легких, в то время как перфузия — преимущественно в нижних. Таким образом, незначительная степень вентиляционно-перфузионной неравномерности может быть зарегистрирована у здорового человека на высоте уровня моря. Вентиляционно-перфузионное распределение становится более равномерным при физической нагрузке.
Размеры альвеолярного пространства таковы, что смешивание газа в альвеолярной единице происходит практически мгновенно как при нагрузке, так и в покое вследствие дыхательных движений, кровотока и движения молекул (диффузии). В норме региональные различия в размерах альвеол сравнительно малы. Изменения объема альвеолы в 3 раза вызывает изменение ее радиуса в 1,5 раза. При эмфиземе же альвеолы могут увеличиваться в объеме до 10 раз.
Неравномерность альвеолярной вентиляции обусловлена и гравитационным фактором – разницей транспульмонального давления в верхних и нижних отделах грудной клетки (апикобазальным градиентом). В вертикальном положении в нижних отделах это давление выше примерно на 8 см H2O (8 мбар). Апикобазальный градиент всегда присутствует независимо от степени воздухо наполненности легких и, в свою очередь, определяет наполнение воздухом альвеол в разных отделах легких.
Проведение процедур ИТПД – терапии с использованием МВС – устройств связано с физическим усилием, расправляющим и перераспределяющим объем поступающего воздуха в дыхательные пути и альвеолы. Нагрузка стимулирует альвеолярное смешивание путем повышения потока вдыхаемого воздуха и возрастания кровотока. Так, при физической нагрузке, повышение транспорта O2 и CO2 приводит к повышению их градиентов концентраций, которые способствуют «альвеолярной стратификации» (затрудняют газообмен и формируют дополнительное препятствие диффузии между газовой фазой и кровью).
Таким образом, применение МВС позволяет существенно усиливать коллатеральную вентиляцию и кровоток, что клинически выражается в расправлении ателектазов легких и нормализации газообменной функции.
Уменьшение альвеолярных коллапсов и увеличение времени постоянства «альвеолярной открытости». Феномен коллатеральной вентиляции, впервые описанный Алленом и Юнгом в 1931 г., очень важен для нормального функционирования легких, особенно когда поражены мелкие дыхательные пути вследствие болезни бронхов. В таких случаях функция альвеол при окклюзии дыхательных путей поддерживается с помощью коллатеральной вентиляции. Усиление коллатеральной вентиляции уменьшает альвеолярные коллапсы, расправляет легкое и нормализует вентиляционно-перфузионное соотношение (рис. 16). Такое воздействие называют «маневром рекрутмента» – преднамеренным динамическим процессом повышения транспульмонального давления, целью которого является полное открытие нестабильных безвоздушных (коллапсированных) альвеол.
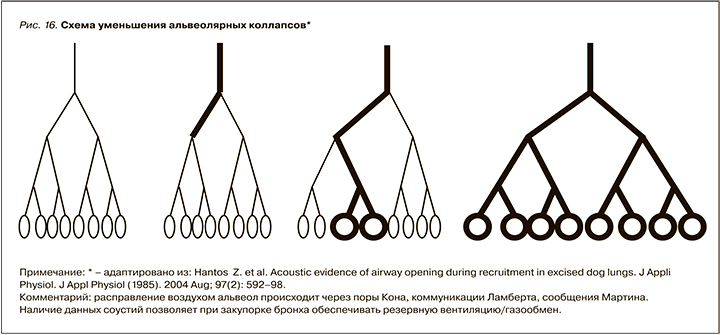
Транспульмональное давление (Pl), необходимое для возникновения воздушного потока и расправления альвеол, может быть рассчитано как разница между альвеолярным давлением (Pальвеол) и плевральным давлением (Pплеврал). Следовательно, повышение альвеолярного давления или снижение плеврального приведет к повышению транспульмонального давления, необходимого для открытия спавшихся альвеол.
Таким образом, применение МВС позволяет существенно увеличить рекрутирование альвеол (увеличить время альвеолярной открытости и уменьшить коллапсируемость), что клинически выражается в расправлении ателектазов легких и восстановлении газообмена в легких.
Изучение респираторной функции при назначении различного рода дыхательных техник и устройств было исследовано в работе Tomich с соавт. (Brazilian Journal of Medical and Biological Research (2007) 40: 1409–17) на примере сравнения процедуры АЦД и 2 видов МВС-устройств (TriFlo
- потоковый МВС; Coach – объемный МВС) у 26 здоровых добровольцев. Респираторная функция оценивалась по следующим параметрам: Vt (ДО)
- дыхательный объем (мл); RF (ЧДД) – частота дыхательных движений (дых/мин); VE (МОД)
- минутный объем дыхания (л/мин); Ti (ВВ) – время вдоха (с); Vt/Ti (ЦД) – оценка активности дыхательного центра (центрального драйва) (мл/с) (табл. 5).

 Открытие ателектазированных альвеол приводило к увеличению функционального остаточного объема легких, улучшая газообмен и ослабляя повреждение легких. Важным компонентом в оценке «маневра рекрутмента» являлось увеличение времени постоянства «альвеолярной открытости» (рис. 17).
Открытие ателектазированных альвеол приводило к увеличению функционального остаточного объема легких, улучшая газообмен и ослабляя повреждение легких. Важным компонентом в оценке «маневра рекрутмента» являлось увеличение времени постоянства «альвеолярной открытости» (рис. 17).
Было установлено, что имеются достоверные различия в результатах проведения методик МВС на разных устройствах. Следует обратить внимание на то, что потоковые устройства (TriFlo) имеют достоверные (p <0,05) различия от объемных устройств (Coach), а именно:
- для эффективной работы потоковые устройства требуют низкого дыхательного объема, повышенной частоты дыхания и быстрого вдоха (в сравнении с АЦД). При этом активность дыхательного центра является высокой, что связано с гиперкапническим типом дыхательного паттерна;
- для эффективной работы объемные устройства требуют большого дыхательного объема, нормальной частоты дыхания и обычного вдоха (в сравнении с АЦД). При этом активность дыхательного центра является умеренной, сопоставимой с таковой при АЦД, что говорит о нормокапническом типе дыхательного паттерна.
Возможно сделать несколько простых выводов об целесообразности назначения различных типов МВС-устройств. Так, МВС «потокового типа» (CliniFlo, Portex, Tri-Flo), уместно назначать у пациентов с ослабленным дыхательным драйвом и склонных к редкой ЧДД (рестриктивный тип ДН с нормокапническим рисунком дыхания, пациенты с нейромышечными заболеваниями, послеоперационные пациенты без обструктивной легочной патологии). В отличие от первых, МВС «объемного типа» (Coach, Voldyne), будут эффективными у пациентов с обструктивными заболеваниями легких в тех случаях, когда требуется контроль за дыхательным объемом, дыхательной частотой, минутным объемом дыхания. Это важно знать, чтобы не создавать у склонных к гиперкапнии и воздушной ловушке пациентов условия для гиперкапнического типа дыхательных нарушений (ХОБЛ, эмфизема легких, хронический обструктивный бронхит).
6. ТЕРАПИЯ С ПОЛОЖИТЕЛЬНЫМ ДАВЛЕНИЕМ (PAP-ТЕРАПИЯ)
6.1. Устройства для создания экспираторного давления (PEP-терапия)
Впервые PEP-терапия была использована в Дании в 1970-х гг. как система низкого положительного давления конца выдоха. PEP-терапия высокого давления впервые была разработана в Австрии в качестве основной терапии или дополнения к традиционным методам очистки дыхательных путей через обычный интерфейс – лицевую маску. Преимущества обоих видов PEP-терапии заключались в мобилизации секрета и создании условий для его эвакуации посредством повышения внутригрудного давления в дистальных отделах, усиления коллатеральной вентиляции. Это повышало функциональную остаточную емкость легких (ФОЕ), предотвращало коллапсы ДП и выполняло «воздухоносное стентирование» мелких бронхов.
К основным типам устройств для PEP-терапии относятся:
- PEP-устройства низкого давления (PEP-маски, Thera PEP-насадки);
- PEP-устройства для мышечной тренировки (Threshold – MEP);
- PEP-устройства высокого давления или изменяющие отношение «давление – объем» (EzPAP).
Основными физиологическими эффектами таких устройств являются: 1) снижение альвеолярных коллапсов; 2) увеличение времени постоянства «альвеолярной открытости»; 3) повышение коллатеральной вентиляции. Действие PEP-устройств низкого давления и для мышечной тренировки основано на преодоление порогового сопротивления, создаваемого на выдохе (рис. 18, 19, 20).


 Показания для проведения метода:
Показания для проведения метода:
- «возвратная» мокрота, не реагирующая на спонтанный кашель;
- история легочных заболеваний с накоплением слизи, ранее успешно леченых методом постурального дренажа (включая манипуляции на грудной клетке);
- доказательства накопления секрета;
- уменьшение «воздушной ловушки»;
- прекращение или уменьшение ателектазов легких;
- оптимизация распределения аэрозоля при бронхорасширяющей терапии.
Отбор пациентов для PEP-терапии:
- пациенты с муковисцидозом;
- пациенты с бронхоэктатической болезнью и бронхоэктазами легких;
- пациенты с бронхиальной астмой;
- пациенты до и после трансплантации легких;
- пациенты с хроническим бронхитом, воздушной ловушкой и гиперсекрецией слизи (мокроты);
- пациенты после верхнего абдоминального хирургического вмешательства;
- пациенты с ателектазами легких.
Абсолютных противопоказаний к PEP-терапии нет.
Относительные противопоказания:
- непереносимость повышенной «работы дыхания»;
- повышенное внутричерепное давление;
- гемодинамическая нестабильность пациента;
- оперативное вмешательство или травма ротолицевой зоны.
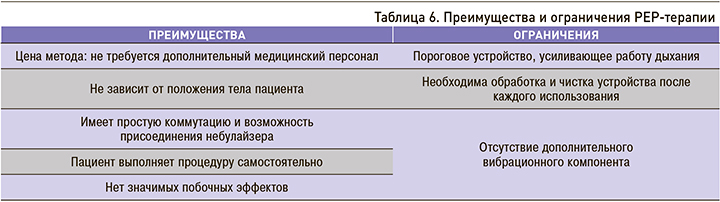
Преимущества и ограничения PEP-терапии отражены в таблице 6.
 Аналогичными свойствами обладают специальные насадки для небулайзеров, создающие условия для PEP-терапии одновременно с сеансом ингаляционной терапии через небулайзер (рис. 21). Насадка для PEP-терапии создает положительное экспираторное давление 20–90 см. вод. ст. Она предназначена для использования с приборами PARI LC® Plus и LC® Sprint (небулайзер малого объема), такая комбинация позволяет одновременно проводить PEP-терапию и доставлять необходимые аэрозоли (доказано клинически).
Аналогичными свойствами обладают специальные насадки для небулайзеров, создающие условия для PEP-терапии одновременно с сеансом ингаляционной терапии через небулайзер (рис. 21). Насадка для PEP-терапии создает положительное экспираторное давление 20–90 см. вод. ст. Она предназначена для использования с приборами PARI LC® Plus и LC® Sprint (небулайзер малого объема), такая комбинация позволяет одновременно проводить PEP-терапию и доставлять необходимые аэрозоли (доказано клинически).
6.2. PEP-устройства, изменяющие отношение «давление – объем» (EZPAP)
Отдельную нишу занимают устройства, основанные на одновременном изменении давления и объема в процессе проведения терапии, основанные на эффекте Коанда и законе Бернулли. К таковым относится EzPAP-устройство (рис. 22).
Эффект Коанда (иногда – эффект чайника) – физическое явление, названное в честь румынского ученого Анри Коанда (название предложил его французский коллега Альбер Метраль). А. Коанда в 1932 г. обнаружил, что струя жидкости, вытекающая из сопла, стремится отклониться по направлению к боковой стенке и при определенных условиях прилипает к ней. Это объясняется тем, что в боковой зоне возникает турбуленция и зона пониженного давления. Аналогично и поведение струи газа. На основе этого эффекта строится одна из ветвей пневмоники (струйной автоматики). Используя разницу в давлении, также возможно резко увеличить скорость газа, прошедшего зону турбуленции.
В соответствии с законом Бернулли, падение давления в трубке обратно пропорционально скорости движения воздушного потока. Аналогом тому является сопоставление горной реки с быстрым течением и равнинной реки с медленным течением (например, река Волга). Так, горная речка всегда не широкая, поскольку давление воды на берега небольшое (течение быстрое), в то время как Волга имеет бескрайние берега, поскольку давление воды большое (медленное течение). Сочетание в одной системе различных по размеру трубок для движения газа вызывает эффект «падения давления» в узкой части.
Этим можно воспользоваться, если организовать поступление воздуха (или кислорода) извне через калиброванное отверстие. Дополнительное поступление воздуха в зону низкого давления вызывает повышение общего потока в зоне выхода в 4–6 раз (ротовая часть системы), без существенного изменения давления (ширина трубки на выходе снова увеличивается для создания положительного давления).
Таким образом, достигается двойной эффект: 1) пациент вдыхает большой дыхательный объем (глубокое дыхание); 2) положительное давление расклинивает мелкие дыхательные пути и снимает воздушную ловушку (рис. 23).
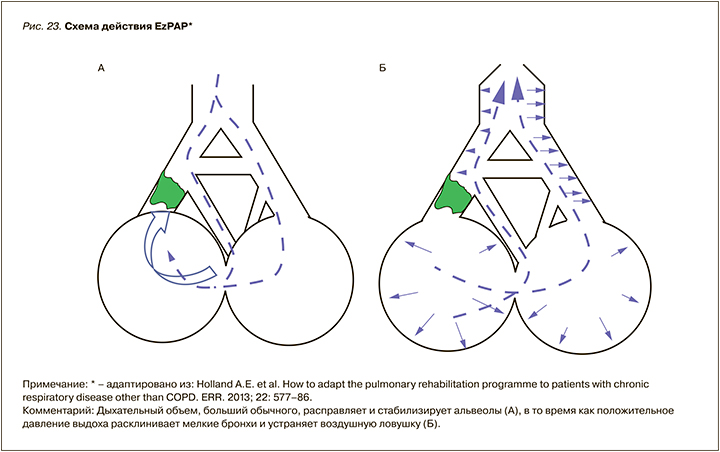
Сочетать 2 таких эффекта, как Коанда и Бернулли, в одном устройстве крайне необходимо, если стоит клиническая задача расправления легких и создания большого дыхательного объема для поддержания газообменной функции. Наиболее часто с такой задачей сталкиваются врачи отделений реанимации и интенсивной терапии у пациентов с выраженной дыхательной недостаточностью (послеоперационные пациенты и с обострение ХОБЛ), врачи пульмонологи в условиях палат интенсивной терапии (хронические заболевания легких с обструкцией и нарушением трахеобронхиального клиренса), а также врачи паллиативной медицины (ведение онкологических пациентов) (рис. 24).

Попробуем сделать несколько выводов об уместности различных вариантов РАР-терапии. Так, устройства для PEP-терапии с низким давлением (PEP-маски, Thera PEP, Threshold PEP) уместно назначать у пациентов с ослабленным дыхательным драйвом и сохранным мышечным усилием (обструктивный или рестриктивный тип ДН с нормокапническим рисунком дыхания, послеоперационные пациенты без обструктивной легочной патологии).
Устройства для EzPAP-терапии с высоким давлением эффективны, когда необходим контроль за дыхательным объемом, дыхательной частотой, минутным объемом дыхания. Такая терапия особенно важна для исключения возможности гиперкапнического типа дыхательных нарушений (пневмонии, ателектазы, ХОБЛ, эмфизема легких, хронический обструктивный бронхит, послеоперационные пациенты: торакальные, хирургия сердца, брюшная хирургия, деформации позвоночника).
6.3. Устройства осцилляционного экспираторного давления (oPEP-терапия)
Осцилляционная терапия с положительным давлением выдоха (oPEP-терапия) впервые была разработана и описана в Швейцарии в качестве дополнения к «традиционным методам» очищения дыхательных путей. oPEP-терапия предусматривает сочетание положительного давления на выдохе с определенной частотой колебаний (резонансная частота). Она основана на выдохе с усилием против быстро меняющегося (осциллирующего) сопротивления в устройстве для осуществления:
- открытия периферических дыхательных путей (давление расклинивания);
- устранения воздушной ловушки (давление расклинивания);
- повышения мобилизации трахеобронхиального секрета (тиксотропный эффект);
- оптимизации экспекторации секрета в ходе терапии (резонансная частота).
Почему же осцилляторные технологии по очистке дыхательных путей вдвое сильнее, чем таковые при «традиционной терапии»?
Ответ №1: давление расклинивания (рис. 23). Создание положительного давления в конце выдоха позволяет расправить, стабилизировать мелкие бронхиолы и альвеолы. Кроме того, эти зоны легких наполняются воздухом путем частых осцилляций небольшими порциями воздуха, что значительно повышает газообмен. Это безопасно, поскольку маленькие порции воздуха не создают резкого повышения давления в системе и не способствуют баротравме легких. Оптимальное давление находится в диапазоне 15–20 мбар.
Ответ №2: тиксотропный эффект. Тиксотропия (тиксотропность) – способность субстанции уменьшать вязкость (разжижаться) от механического воздействия и увеличивать вязкость (сгущаться) в состоянии покоя. Осцилляции воздушного потока внутри бронхиального дерева оказывают специфичное воздействие на трахеобронхиальный секрет – эффект «встряски» и эффект «движение – остановка» (англ. stop and go). Встряска трахеобронхиальной слизи вызывает уменьшение вязкости муцинов слизи, а «движениеостановка» провоцирует незначительную компрессию секрета, обеспечивающую поступательное его движение в каудальном направлении в сторону крупных бронхов. Особенно выражен такой эффект при частоте осцилляций от 12 до 30 Гц.
Ответ №3: резонансная частота. Резонанс – явление, при котором амплитуда вынужденных колебаний имеет максимум при некотором значении частоты вынуждающей силы. Хорошо известно, что ресничка (цилия) совершает от 12 до 16 колебаний в секунду (12–16 Гц). Эта частота колебаний реснитчатого эпителия обеспечивает трахеобронхиальному секрету поступательное движение из мелких бронхов в крупные. Если частота осцилляций воздушного потока станет равной частоте колебаний ресничек, наступает резонанс – усиление колебаний с ускорением движения трахеобронхиального секрета. Такой эффект наиболее выражен при частоте осцилляций от 12 до 16 Гц.
В исследовании McIlwaine M. et al. (McIlwaine M. Paediatr Respir Rev 2006; 7 (Suppl): S220–S222) было описано устойчивое снижение вязкости мокроты, усиление ее мобилизации под действием осцилляторного потока выдоха. Экспекторации мокроты особенно эффективна при сочетании методов АЦД (маневр ФЭВ-Х) с oPEP-терапией.
Показания для проведения метода:
- «возвратная» мокрота, не реагирующая на спонтанный кашель;
- история легочных заболеваний с накоплением слизи, ранее успешно леченных методом постурального дренажа (включая манипуляции на грудной клетке);
- доказательства накопления секрета;
- уменьшение «воздушной ловушки»;
- прекращение или уменьшение ателектазов легких;
- оптимизация распределения аэрозоля при бронхорасширяющей терапии.
Отбор пациентов для OPEP-терапии:
- пациенты с муковисцидозом;
- пациенты с бронхоэктатической болезнью и бронхоэктазами легких;
- пациенты с бронхиальной астмой;
- пациенты до и после трансплантации легких;
- пациенты с хроническим бронхитом, воздушной ловушкой и гиперсекрецией слизи (мокроты);
- послеоперационные пациенты с хирургическим вмешательством в верхней абдоминальной зоне;
- пациенты с ателектазами легких.
Абсолютных противопоказаний для OPEPтерапии нет.
С осторожностью следует назначать ОPEPтерапию:
- пациентам с дренированным или не дренированным пневмотораксом из-за опасности воздушной утечки;
- пациентам, перенесшим лобэктомию или трансплантацию легких из-за риска пневмотораксов или несостоятельности анастомозов;
- пациентам с сердечно-сосудистыми заболеваниями и нестабильной гемодинамикой из-за риска уменьшения эффективности кашля по причине повышения давления внутри грудной клетки;
- пациентам с не дренированной эмпиемой или абсцессом легких из-за риска одномоментной эвакуации большого объема гноя;
- пациентам с активным кровохарканьем из-за риска легочного кровотечения;
- пациентам с плохой переносимостью усиленной «дыхательной нагрузки»;
- пациентам с активным риносинуситом;
- пациентам со среднетяжелыми инфекциями уха из-за риска повышения давления в евстахиевых трубах в процессе терапии;
- пациентам с гиперреактивностью бронхов из-за риска раннего и неконтролируемого кашля. Основные устройства для проведения oPEP-терапии:
- гравитационный флаттер (PARI O-PEP®, Flutter®) (рис. 25);
- oPEP-устройство с управляемым сопротивлением и коммутацией с небулайзером (Aerobika®, Acapella®) (рис.26, 27);
- oPEP-устройство с сопротивлением «рожок» (RC-Cornet®) (рис. 28);
- oPEP-устройство с сопротивлением «флейта» (Lung Flute®) (рис. 29).


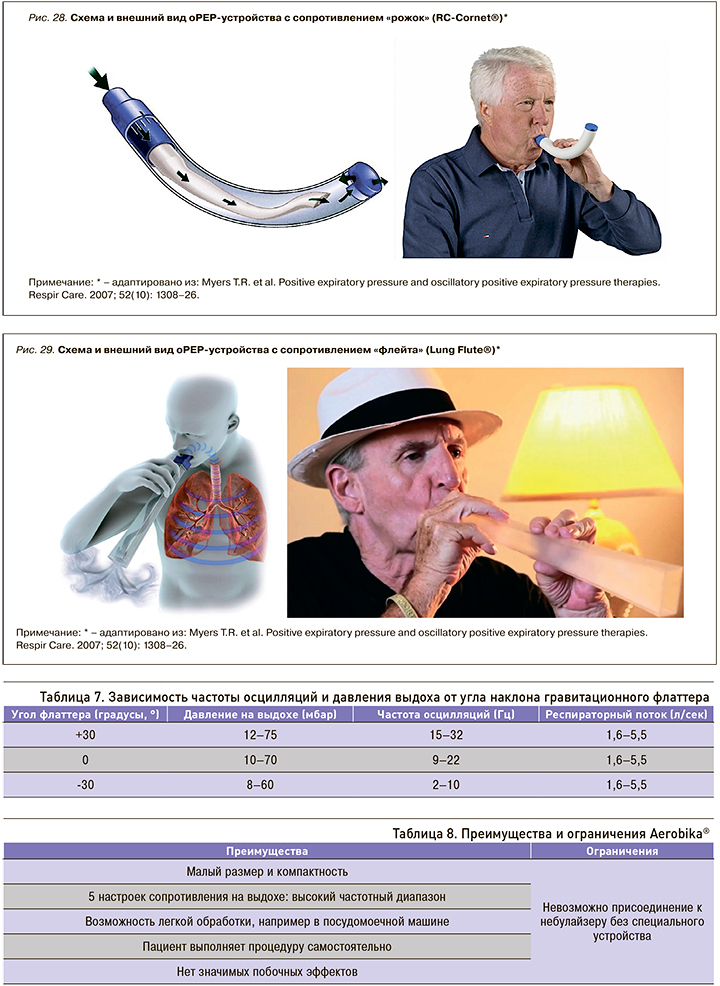
Необходимо отметить, что в зависимости от угла наклона может существенно изменяться как давление выдоха, так и частота осцилляций воздушного потока в бронхиальном дереве (табл. 7). Это правило особенно важно в случае использования гравитационных флаттеров.
Система Aerobika® имеет свои преимущества и ограничения (табл. 8).
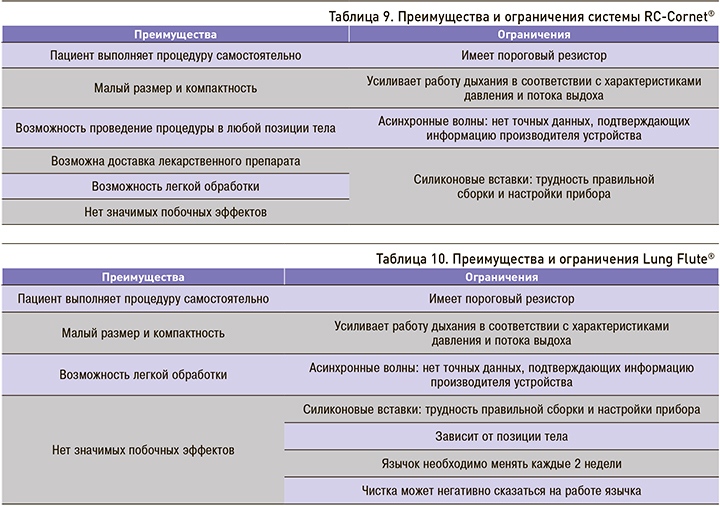
Преимущества и ограничения систем RC-Cornet® и Lung Flute® указаны в табл. 9 и 10.
Для эффективности oPEP-терапии важным является упорядоченная последовательность действий пациента (табл. 11).

Необходимо отметить, что максимальная эффективность оPEP-терапии достигается при соблюдении следующих простых физических требований:
- пиковой скорости выдоха (ПСВ, PEF) в границах 0,5–1,2 л/с;
- осцилляции потока в бронхиальном дереве: в границах 5–30 Гц;
- пиковом давлении выдоха (ПДВ, PEP) в границах 10–70 мбар.
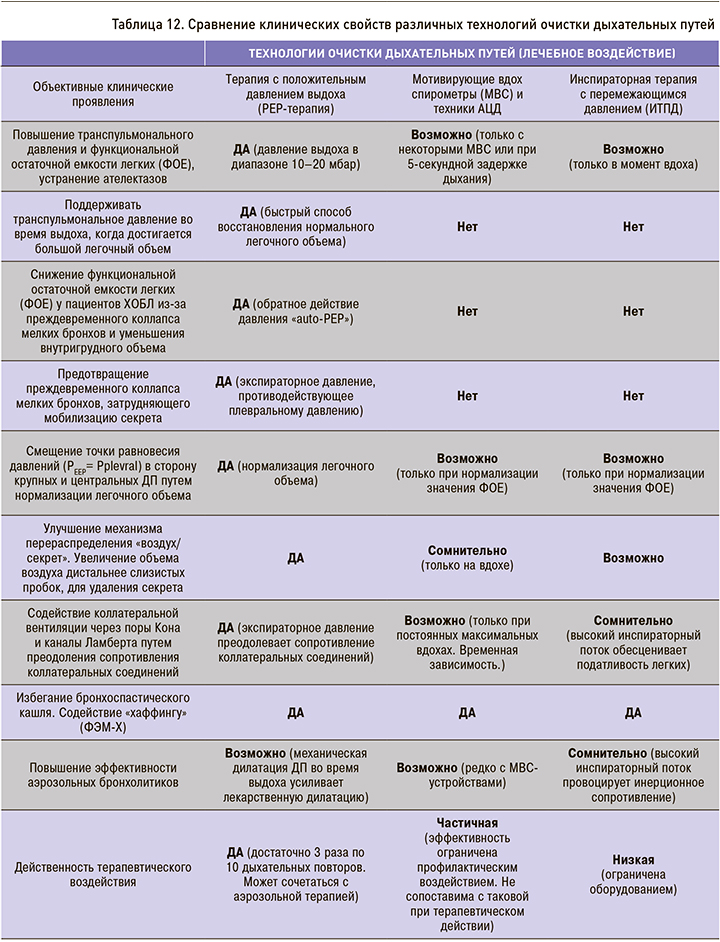
Системы для PEP-терапии обычно хорошо переносятся большинством пациентов. Их можно использовать самостоятельно или в комплексной терапии, особенно в случае пациентов, переведенных из отделений интенсивной терапии. В отличие от традиционной физиотерапии грудной клетки, PEP-терапия является экономичным и эффективным методом удаления секрета. Независимость от необходимости ежедневного привлечения ассистирующего персонала не только повышает показатели эффективности, но и является важным фактором сокращения расходов медицинского учреждения на данный вид терапии. Основные преимущества PEP-терапии приведены в таблице 12.
6.4. Клинический протокол физиотерапии для мобилизации и дренажа секрета
Наиболее интересным представляется опыт применения различных техник дренажа слизи у стационарных пациентов различных групп, опубликованный Harbrecht B.G. et al. в 2009 г. Он получил название «Питтсбургского алгоритма». Его эффективность была проанализирована в рандомизированном клиническом исследовании (РКИ) с участием 2805 пациентов Питтсбургского Медицинского Центра, получающих респираторную физиотерапию методами PEP-терапии, МВС, ИТПД-терапии и аэрозольной бронходилатации (небулайзерные устройства).
Исследователями были сделаны выводы:
- предлагаемый протокол респираторной физиотерапии (ПРФизио) достоверно (p <0,05) уменьшал риск повторных поступлений пациентов с обострением легочного заболевания в отделение реанимации и интенсивной терапии (ОРИТ);
- разработанный ПРФизио достоверно (p <0,05) уменьшал стоимость стационарного и амбулаторного лечения пациентов с хроническими легочными заболеваниями;
- установлено, что эффективный ПРФизио не может быть выполнен с помощью одного устройства для улучшения мобилизации секрета и улучшения дренажа слизи, а должен включать в себя структурированный алгоритм использования различных дыхательных техник и аппаратных комплексов в зависимости от клинического состояния пациента и нужд базовой терапии.
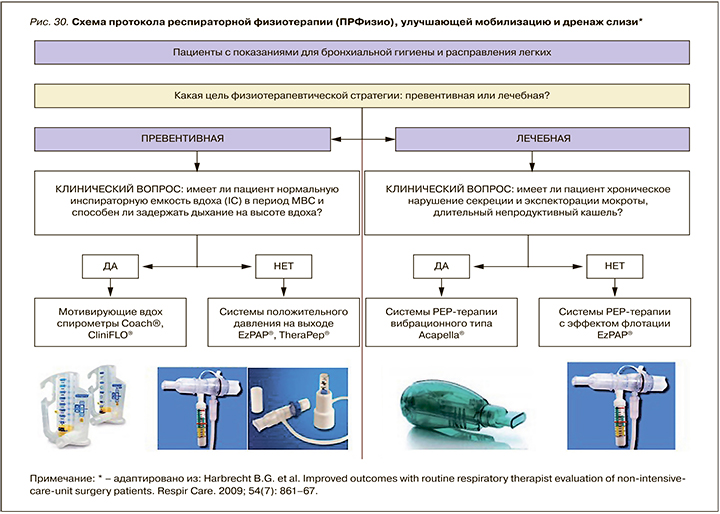
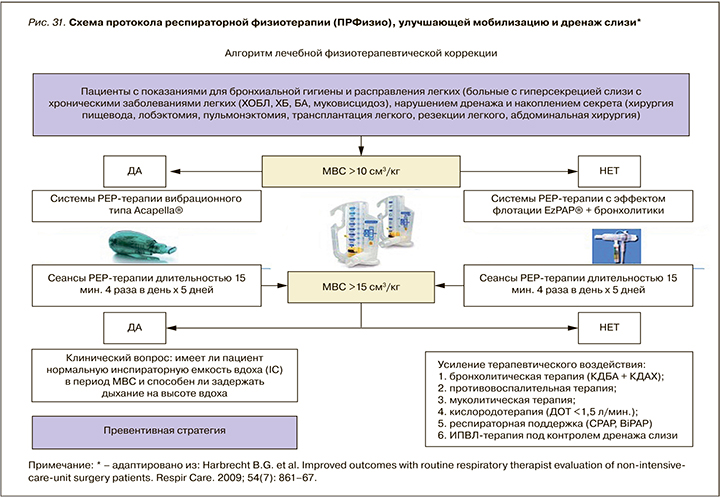
Руководствуясь результатами проведенного исследования Harbrecht B.G. et al., а также собственным опытом применения указанных устройств и дыхательных техник, мы адаптировали протокол респираторной физиотерапии (ПРФизио) для нужд пациентов с нарушением дренажа и мобилизации секрета. Предложен отдельный адаптированный в клинических условиях алгоритм физиотерапии для пациентов, находящихся на стационарном и амбулаторном этапе оказания лечебного пособия, имеющих, и не имеющих хронического легочного заболевания (рис. 30, 31).
7. ИНТРАПУЛЬМОНАЛЬНАЯ ПЕРКУССИОННАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ
В настоящее время существует метод осцилляторной терапии с положительным давлением (oPEP-терапия), совмещенный с респираторной поддержкой, создающий условия для мобилизации секрета и способствующий адекватной вентиляции легких (высокочастотной вентиляция легких – ВчВЛ).
 Интрапульмональная перкуссионная вентиляция легких (ИПВЛ) – это метод респираторной терапии, при котором посредством воздушного потока с высокой скоростью, через специальный открытый дыхательный контур, пациенту подаются маленькие объемы воздуха (по автору – «перкуссии») с высокой регулируемой частотой и низким уровнем давления, которые накладываются на самостоятельное дыхание пациента.
Интрапульмональная перкуссионная вентиляция легких (ИПВЛ) – это метод респираторной терапии, при котором посредством воздушного потока с высокой скоростью, через специальный открытый дыхательный контур, пациенту подаются маленькие объемы воздуха (по автору – «перкуссии») с высокой регулируемой частотой и низким уровнем давления, которые накладываются на самостоятельное дыхание пациента.
Разработчиком является доктор Форест Берд, известный как создатель первых коммерчески реализуемых приборов для вентиляции легких. В 1991 г. ИПВЛ была одобрена американской системой FDA, в 1997 г. ИПВЛ сертифицирована для применения в странах Европы, в 2003 г. ИПВЛ сертифицирована Минздравом РФ. «Сердцем» прибора является открытый дыхательный интерфейс, соединяющий пациента с аппаратом, названный по автору «ФАЗИТРОН». В конструкции фазитрона использованы закон Бернулли и эффект Вентури.
Закон Бернулли является следствием закона сохранения энергии для стационарного потока несжимаемой жидкости или газа. В соответствии с законом сохранения энергии увеличение одного вида энергии сопровождается снижением другого. Поэтому давление жидкости больше в тех частях трубы, где скорость ее движения меньше, и наоборот, где скорость больше, давление меньше (рис. 32). Таки образом, манипулируя диаметром трубки, можно изменять и достигать желаемых уровней давления и скорости движения газа.
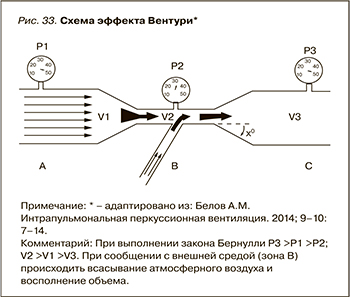 Эффект Вентури заключается в падении давления, когда поток жидкости или газа протекает через суженную часть трубы. Манипулируя диаметром трубы и соответственно скоростью потока газа можно создать в зоне сужения уровень давления ниже атмосферного. При наличии сообщения с внешней средой в данной зоне будет происходить всасывание атмосферного воздуха и восполнение объема (рис. 33).
Эффект Вентури заключается в падении давления, когда поток жидкости или газа протекает через суженную часть трубы. Манипулируя диаметром трубы и соответственно скоростью потока газа можно создать в зоне сужения уровень давления ниже атмосферного. При наличии сообщения с внешней средой в данной зоне будет происходить всасывание атмосферного воздуха и восполнение объема (рис. 33).
Рассмотрим подробнее перкуссионный интерфейс – ФАЗИТРОН. Для своей работы фазитрон использует энергию сжатого воздуха, поступающего на распределительную диафрагму под давлением в 4-6 атмосферы из баллона (транспортный вариант) или стационарного порта высокого давления (реанимационная консоль). Совершая возвратно-поступательное движение (возможно регулировать частоту этих движений) диафрагма «нарезает» воздушный поток на «пневматические диффузионные конвективные толчки» – «перкуссии», которые при работе возвратно-поступательного «скользящего поршня» приобретают определенную высокую частоту (регулируемую по обратной связи) и полностью теряют давление, сохраняя при этом скорость движения, что обеспечивает поступление воздуха в дыхательные пути пациента. Выдох пациента происходит через отверстие выдоха, расположенное до зоны возвратно-поступательного движения поршня, что обеспечивает эффект вентиляции с «открытым контуром» (рис. 34).

Оригинальным техническим решением явилась идея «открыть» контур и перед рабочей частью поршня, создав тем самым возможность «присасывать», в соответствии с законом Вентури, порцию воздуха извне (вне контура пациента), поддерживая необходимое значение уровня FiO2 (уровень кислорода) во вдыхаемой смеси. Это оригинальное решение создает условие для увлажнения воздуха, резко уменьшает расход «рабочего газа», позволяет совместить эту зону с небулайзером для своевременной доставки лекарственного вещества.
 В соответствии с третьим законом Ньютона (сила действия равна силе противодействия) поступательные пневматические диффузионные конвективные толчки вызывают обратные пневматические толчки, активируя слизь и систему мукоцилиарного бронхоальвеолярного клиренса, что является крайне важным у большинства вентилируемых пациентов.
В соответствии с третьим законом Ньютона (сила действия равна силе противодействия) поступательные пневматические диффузионные конвективные толчки вызывают обратные пневматические толчки, активируя слизь и систему мукоцилиарного бронхоальвеолярного клиренса, что является крайне важным у большинства вентилируемых пациентов.
Необходимо отметить, что длина ФАЗИТРОНА не превышает 12 см. Это обеспечивает его высокую мобильность, транспортабельность, легкость в обработке известными методами стерилизации инструмента (рис. 35).
Необходимо остановиться на уникальном свойстве ФАЗИТРОНА – обратной связи по сопротивлению с легкими пациента. Имея давление в зоне высокочастотного дыхания, как проявление сопротивления дыхательных путей, система автономно регулирует соотношение поток/давление, исключая потенциальную возможность баротравмы. Можно с уверенностью говорить, что из всех существующих вентиляционных устройств ФАЗИТРОН является самым безопасным на сегодняшний день.
В настоящих рекомендациях устройство ИПВЛ рассматривается только с позиции респираторной физиотерапии, когда основным действием на бронхиальное дерево пациента будет являться мобилизация секрета, улучшение его дренажа и создание условий для устранения воздушных ловушек и ателектазов легких. Это важно, поскольку комплекты устройств для осуществления ИПВЛ-терапии существенно отличаются друг от друга в зависимости от предполагаемых задач. Именно поэтому, здесь и дальше, речь пойдет об устройстве Universal Bi-phasic Home Therapy (HC) IMPULSATOR® являющимся по сути оригинальным физиотерапевтическим устройством для домашнего и стационарного использования (рис. 36).
В настоящее время экспериментальные и клинические исследования подтверждают следующие механизмы действия ИПВЛ-терапии:
- вовлечение легочных структур или «рекрутирование легких»;
- мобилизация и удаление трахеобронхиального секрета;
- усиление процессов диффузии;
- улучшение бронхиального кровотока и микроциркуляции;
- устранение ограничений воздушного потока и «воздушных ловушек».
Вовлечение легочных структур или «рекрутирование легких»
При ряде хронических легочных заболеваний появляется патологическая гетерогенность, которая особенно выражена и разнообразна при наличии воздушной ловушки и/или ателектазах легких (например, ХОБЛ). В таких случаях при самостоятельном дыхании пациента воздушные потоки и газообмен будут оптимальны только в доступных, открытых для прохождения воздуха зонах. Закрытые участки существенно повлияют на вентиляционно-перфузионные соотношения и газообмен (рис. 37).
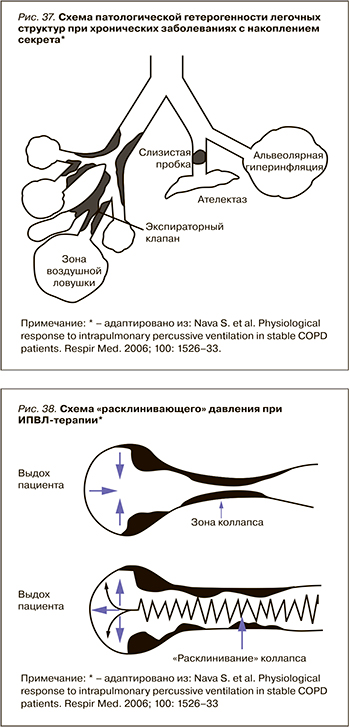 При такой гетерогенности поражения, чтобы включить в газообмен («рекрутировать») все зоны легких, рационально использовать:
При такой гетерогенности поражения, чтобы включить в газообмен («рекрутировать») все зоны легких, рационально использовать:
- маленькие объемы, способные проникнуть в узкие просветы дыхательных путей;
- высокую частоту потока (для предупреждения резких повышений давления) и волновые колебания (для преодоления сопротивления);
- высокую скорость потока (для достижения периферических зон бронхиального дерева вплоть до альвеол);
- низкое давление потока (для предупреждения баротравмы);
- наличие обратной связи по сопротивлению, т.е. способности вентилирующей системы реагировать на изменения состояния легких.
Все перечисленное реализуется при использовании ИПВЛ-терапии.
Мобилизация секрета с помощью «расклинивающего» давления
Пульсирующий быстрый поток воздуха при ИПВЛ-терапии создает в дыхательных путях колебательные движения, способствующие мобилизации бронхиального секрета. В соответствии с третьим законом Ньютона высокоскоростной воздушный поток, достигая препятствия или узких периферических зон легких, производит силу, действующую в противоположном направлении. Возникает противофазный поток, перемещающий секрет в проксимальном направлении, откуда пациент может его самостоятельно удалить посредством кашля. Интенсивность противофазного потока зависит от эластичности легочной ткани и эффекта «рикошета». Для улучшения дренажа слизи в ряде случаев целесообразно использовать специальные эластичные пояса, накладываемые на грудную клетку для усиления «рикошетных сил».
Особым фактором, способствующим движению мокроты из дистальных отделов при ИПВЛтерапии, является «PEEP-эффект» или сохранение положительного давления после каждого перкуссионного цикла. Оно поддерживает периферические дыхательные пути в открытом состоянии и стабилизирует их (так называемое расклинивающее давление). РЕЕР-эффект значимо уменьшает легочную гиперинфляцию, особенно в случае раннего экспираторного коллапса с формированием феномена «воздушной ловушки». Различные экспериментальные и клинические исследования подтверждают наличие эффективной дренажной функции при ИПВЛ-терапии (рис. 38).
Преимущества и ограничения ИПВЛ-терапии отражены в табл. 13.
Показания для проведения метода: любые заболевания с наличием обструкции бронхов, нарушением вентиляции и дренажа мокроты независимо от возраста, веса и способности пациента к кооперации, в условиях стационара и на дому.
Противопоказания: не дренированный пневмоторакс.
Повышенный контроль:
- неэффективный кашель (пиковая скорость выдоха <180 л/мин);
- синдром Лайелла;
- выраженное кровохарканье.
Протокол проведения ИПВЛ-терапии: для эффективности ИПВЛ-терапии важным является упорядоченная последовательность действий пациента (табл. 14).
8. ЭКСТРАПУЛЬМОНАЛЬНАЯ ВЫСОКОЧАСТОТНАЯ ОСЦИЛЛЯЦИЯ ИЛИ ТЕХНОЛОГИЯ VEST-ЖИЛЕТА
Сущность методики заключается в создании неинвазивным путем высокочастотных осцилляций грудной клетки (ВчОГК), которые, передаваясь бронхам и бронхиолам (дыхательным путям) и проходящему по ним воздушному потоку (воздух, газ) способствуют улучшению мобилизации слизи, легочному газообмену и трахеобронхиальному клиренсу (рис. 39).

Система высокочастотной осцилляции грудной клетки
 В настоящий момент в России зарегистрирован и используется аппарат для проведения ВЧОГК The Vest Airway Clearance System (Hill-Rom Services, Inc., США, 2011), который представляет собой систему очистки дыхательных путей 5-го поколения (рис. 40). Система состоит из: 1) надувного жилета; 2) двух трубок, соединенных с жилетом и с дистанционным генератором воздушного давления.
В настоящий момент в России зарегистрирован и используется аппарат для проведения ВЧОГК The Vest Airway Clearance System (Hill-Rom Services, Inc., США, 2011), который представляет собой систему очистки дыхательных путей 5-го поколения (рис. 40). Система состоит из: 1) надувного жилета; 2) двух трубок, соединенных с жилетом и с дистанционным генератором воздушного давления.
Показания к проведению ВЧОГК:
- заболевания бронхолегочной системы, сопровождающиеся изменениями легочной вентиляции, механики дыхания, гиперпродукцией мокроты:
- хронические заболевания легких (ХОБЛ, муковисцидоз, бронхоэктатическая болезнь, пороки развития);
- сегментарные и долевые ателектазы на фоне респираторных инфекций нижних дыхательных путей;
- пневмонии с нарушением дренажной функции бронхов;
- ухудшение дренажа мокроты у пациентов с нейромышечными заболеваниями и неэффективностью кашлевого клиренса, при тяжелых торакальных травмах, а также у больных после хирургических вмешательств на грудной клетке. Противопоказания к проведению ВЧОГК:
- высокая лихорадка (температура тела >38°С);
- буллы в легких, особенно дистального расположения;
- кровохарканье и тромбоэмболия легочной артерии;
- тяжелые нарушения ритма сердца и имплантированный электрокардиостимулятор;
- нестабильная гемодинамика острого инфаркта миокарда, острое нарушение мозгового кровообращения, нарушения ритма сердца, кардиостимулятор, хроническое легочное сердце 2–3 ст., застойная сердечная недостаточность;
- острое повреждение головы и шеи, нарушение сознания;
- PaO2 <40 мм. рт. ст., PaCO2 >75 мм. рт. ст., pH <7,25;
- злокачественные опухоли любой локализации;
- наличие кожных повреждений в зоне воздействия;
- беременность и лактация.
Методика ВЧОГК: процедура на аппарате ВчОГК Vest проводится до еды или через несколько часов после еды. Под жилет одевается хлопчатобумажная футболка. Не требуется принятия какого-либо специального положения во время процедуры, аппарат воздействует равномерно на все легочные поля. Широкий диапазон регулировок параметров вентиляции позволяет оптимизировать режим строго индивидуально. Генератор воздушного давления быстро нагнетает и выпускает воздух из жилета, надувая и сдувая его. Создается насильственное движение грудной клетки за счет сжатия и расслабления. Частота вибрации и давления грудной клетки регулируется с помощью настройки прибора. Высокочастотные колебания передаются на стенки бронхов, мобилизуя секрет, способствуя его эвакуации в бронхи более крупного калибра, что облегчает откашливание мокроты.
Необходима следующая последовательность установок:
- частота от 1–20 Гц;
- давление от 1–12 Бар (зависит от фасона комплекта);
- время процедуры от 1–30 мин.;
- количество процедур ВчОГК в день:
- 2–3 раза в домашних условиях;
- 3–4 в условиях стационара;
- пациенту рекомендуется прерывать процедуру каждые 5 мин. для того, чтобы сделать сильный выдох, глубокий вдох, а затем откашлять образовавшийся секрет (метод ФЭМ-Х);
- возможно проведение ВЧОГК при наличии дренажных трубок, катетеров, если:
- обеспечить правильное положение и безопасность катетеров, дренажных трубок и т.д. до начала процедуры;
- избегать давления или действия осцилляций, а места рядом с точками выведения дренажей проложить полотенцем;
- до начала сеанса и по его окончанию проверить правильное расположение и состоятельность всех дренажей, трубок, инвазивных устройств. Для выбора правильной комплектации устройств для ВчОГК-терапии системы VEST (Hill-Rom Services, Inc., США, 2011) можно воспользоваться таблицей 15.

Критерии оценки эффективности лечения:
- клинические (физикальный осмотр, бальная оценка одышки, кашля, характера и количества мокроты);
- функциональные (спирометрия, бодиплетизмография, 6-МТ);
- лабораторные параметры.
Лечебные эффекты:
- уменьшение выраженности клинических симптомов заболевания, усиление дренажа секрета, улучшение мукоцилиарного клиренса, увеличение переносимости физической нагрузки и улучшение качества жизни;
- улучшение и повышение равномерности легочной вентиляции, и улучшение работы дыхательной мускулатуры, положительное влияние на механику дыхания;
- уменьшение гиперинфляции легких за счет компрессионного компонента и разрешение инфильтрированных и ателектатических изменений в легких.
Преимущества и ограничения ВчОГК-терапии указаны в таблице 16.
9. АППАРАТНАЯ ИНСУФФЛЯЦИЯ/ ЭКСУФФЛЯЦИЯ С ВЫСОКОЧАСТОТНЫМИ ОСЦИЛЯЦИЯМИ
 Методика «помощи кашлю» путем аппаратного ассистента (помощника) осуществляется через специальные «откашливатели», представляющие собой эффективный инсуффлятор/эксуффлятор (вдуватель/выдуватель воздуха), используемый для неинвазивного удаления мокроты посредством наращивания положительного давления в дыхательных путях пациента с последующим быстрым переключением на отрицательное. Благодаря резкому перепаду давления провоцируется глубокий естественный кашель с отделяемым секретом. Одним из наиболее интересных устройств является откашливатель Cough Assist E70 (Philips Respironics, США) (рис. 41).
Методика «помощи кашлю» путем аппаратного ассистента (помощника) осуществляется через специальные «откашливатели», представляющие собой эффективный инсуффлятор/эксуффлятор (вдуватель/выдуватель воздуха), используемый для неинвазивного удаления мокроты посредством наращивания положительного давления в дыхательных путях пациента с последующим быстрым переключением на отрицательное. Благодаря резкому перепаду давления провоцируется глубокий естественный кашель с отделяемым секретом. Одним из наиболее интересных устройств является откашливатель Cough Assist E70 (Philips Respironics, США) (рис. 41).
Как показывает практика, использования откашливателя Cough Assist E70 позволяет добиться более продолжительного терапевтического эффекта, чем при традиционной трахеальной аспирации. При этом удается сократить число возможных осложнений.
Применение Cough Assist Е70 позволяет снизить интенсивность и сократить частоту появления респираторных инфекций рецидивирующего характера. Специальный алгоритм Cough-Trak (метод направленного кашля) обеспечивает автоматическую синхронизацию работы Cough Assist Е70 с дыханием пациента, что снижает нагрузку на его дыхательную систему и улучшает переносимость процедуры. Интуитивный интерфейс и три настраиваемых шаблона терапии (рассчитанные на низкую, среднюю и высокую скорость вдоха) позволяют быстро адаптировать интенсивность процедуры под текущее состояние пациента. Компактные размеры, небольшой вес и возможность питания откашливателя Cough Assist E70 от аккумулятора (до 24 ч) обеспечивают его простую транспортировку и мобильность применения (рис. 42).

Особенностью Cough Assist E70, как устройства для инсуффляции/эксуффляции, является создание в момент вдоха/выдоха пациента высокочастотных осцилляций, поддерживающих дыхательные пути открытыми, даже у пациентов с существенным нарушением мышечного тонуса. Поскольку снижение показателя пиковой скорости кашля (ПСК=PCF) в диапазоне 160–270 л/ мин вызывает умеренный риск нарушений дренажа слизи, а значение <160 л/мин создает условие невозможности такового дренажа, использование других техник кроме «аппаратных помощников кашля» становится проблематичной. Знание того, что дыхательные пути при ослабленной мускулатуре способны коллапсировать как в момент вдоха, так и в момент выдоха, простое нагнетание/разрежение в цикле вдох/выдох могут вызвать серьезные механические повреждения или баротравму.
Для исключения такой возможности в устройстве Cough Assist E70 используется высокочастотная настраиваемая осцилляция вдоха/выдоха, не создающая никакого дополнительного сопротивления к движению воздушного потока (рис. 43).

Показания для проведения метода:
- пациенты с неэффективным кашлем по причине:
- мышечная слабость, дистрофии, миастении;
- полиомиелит, или другие неврологические расстройства с параличом дыхательных мышц (травмы спинного мозга);
- бронхолегочные заболевания, такие как эмфизема, кистозный фиброз (муковисцидоз) и бронхоэктазы;
- неэффективности маневра выдоха (пиковая скорость выдоха (ПСВ) менее 50% от должных величин) или падение пиковой скорости кашля (ПСК=PCF) < 270 л/мин у любых пациентов с нарушением мобилизации и экспекторации секрета.
Абсолютные противопоказания:
- буллезная эмфизема легких;
- пневмоторакс;
- повторяющиеся баротравмы или баротравма в анамнезе;
- не контролируемый приступ удушья при бронхиальной астме;
- тяжелая гипотензия;
- клинически значимое легочное кровотечение;
- коллапс верхних воздухоносных путей.
Повышенный контроль:
- проведение процедуры после приема пищи;
- гастроэзофагеальный рефлюкс;
- резкое учащение дыхательных движений (повышение ЧД);
- гемодинамическая нестабильность;
- тяжелый бронхоспазм в период процедуры;
- выраженные боли грудной клетки в период процедуры.
Протокол проведения Coughassist-E70-Терапии: для эффективности CoughAssist-E70-терапии важным является упорядоченная последовательность действий пациента (табл. 17).

10. ДЛИТЕЛЬНАЯ ОКСИГЕНОТЕРАПИЯ
Длительная малопоточная оксигенотерапия (ДОТ) может быть определена как кислородотерапия, используемая более 15 ч/сутки у хронических пациентов с дыхательной недостаточностью. Хроническая гипоксемия у таких пациентов определяется как парциальное напряжение артериальной крови кислородом (PaO2) ≤7,3 kPa (1 kPa=7,5 мм рт. ст. и 1 мм рт. ст. = 0,133 kPa), а в конкретной клинической ситуации PaO2 ≤8,0 kPa (60 мм рт. ст.). Фактически, практикующий специалист может ориентироваться на показатель насыщения артериальной крови кислородом у своего пациента (SpO2): при условии сохраненной циркуляции крови и уровня гемоглобина показатель SpO2 в покое менее 88% является аргументом в пользу проведения длительной кислородотерапии. Кислород в медицинской практике следует рассматривать как лекарственное вещество – с точки зрения его применения для терапии заболеваний. С этой позиции следует говорить о кислородотерапии (оксигенотерапии) как о медицинской технологии. Согласно приказу Минздравсоцразвития России от 20.07.2007 № 488 (зарегистрировано в Минюсте России 01.08.2007 № 9938) к медицинским технологиям относят «…предлагаемые к использованию на территории Российской Федерации совокупности методов (приемов, способов) лечения, диагностики, профилактики, реабилитации (далее – метод), средств, с помощью которых данные методы осуществляются, а в некоторых случаях и способ получения средства, применяемого в данной технологии…». С практической точки зрения это означает, что лица, допущенные к использованию ксилорода в качестве немедикаментозной терапии, должны иметь специальные навыки и обладать знаниями к его применению. Возникает закономерный вопрос: может ли кислород навредить пациенту?
Воздействие высоких уровней кислорода (выше 40% или с FiO2 >40%) в течение длительного периода времени, создает серьезные и опасные для жизни проблемы со здоровьем: происходит кислородное отравление мозга. Хотя отравление кислородом не входит в международную классификацию болезней 10-го пересмотра (код МКБ10), при таких отравлениях возможны симптомы, схожие с передозировкой лекарственных средств. Кислородное отравление случается:
- при вдыхании кислородных смесей с составом, резко отличающимся от состава обычного воздуха;
- при периодическом наступлении кислородного голодания;
- при несоответствии значений парциального давления кислорода в окружающей среде общепринятым нормам (в норме FiO2=21%);
- при нарушении правил приема некоторых лечебных и профилактических процедур (чаще в результате изменения давления в декомпрессионных камерах).
Кислородное отравление характерно для ряда профессий: аквалангисты/водолазы, космонавты, летчики стратегической авиации, операторы установок кислородной резки металлов. Для таких случаев у лиц, подвергающихся риску кислородного отравления при выполнении профессиональных обязанностей, существуют инструкции, неукоснительное исполнение которых практически исключает опасность. Несмотря на это, в ряде случаев риск невозможно уменьшить. Так, высокий риск отравления O2 существует у глубоководных дайверов/водолазов, из-за необходимости использовать высокие концентрациями кислорода при высоком внешнем давлении (глубина погружения). В редких случаях, у здоровых лиц возможно отравление кислородом, особенно в случае предшествующей кратковременной гипоксии (альпинисты, подъем в горы, горожане при длительном времени нахождения в хвойном лесу). Риску отравления подвержены стационарные пациенты, недоношенные дети, длительно получающие оксигенотерапию, а также лица получающие гипербарическую оксигенотерапию для лечения отравления моноксидом углерода (СО) или цианидом (CKN).
Различают два типа токсичности кислорода: кислородное отравление и кислородная интоксикация. Каждый вариант имеет характерные особенности в клинической картине. Кислородное отравление воздействует на легкие, а кислородная интоксикация распространяется на всю центральную нервную систему.
Кислородное отравление чаще развивается у лиц пожилого возраста, особенно с патологией сердечно-сосудистой системы и легочными заболеваниями. Отравление O2 проявляется легочными симптомами (трудности с дыханием, кашель, одышка) с распространением их сверху вниз, болями за грудиной. Болевой компонент имеет тенденцию к нарастанию по интенсивности и площади. Постепенно к ним присоединяется головокружение, дрожание губ, головная боль и моторное возбуждение. Наиболее простой способ прекращения кислородного отравления – вывести пораженного за пределы опасной зоны (зоны поражения). Например, для предотвращения кислородного отравления у ныряльщиков при возникновении чувства опьянения, им необходимо уменьшить глубину погружения, и в дальнейшем не нарушать правила погружения.
Кислородная интоксикация воздействует на центральную нервную систему (ЦНС) и способна вызвать летальный исход. Основными симптомами интоксикации являются потеря остроты зрения и слуха, раздражительность, тошнота, рвота, обмороки, головокружение, потеря сознания и судороги. Состояние пораженного человека стремительно ухудшается, он становится неспособным самостоятельно обратиться за помощью. При несвоевременно оказанной первой помощи наступает смерть. В экстремальных случаях у пациентов с кислородной интоксикацией возникает поражение легких (рубцевание легочной ткани) и многочисленные кровоизлияния на коже.
Системы доставки медицинского кислорода
Для проведения оксигенотерапии используют автономные и портативные источники кислорода: концентраторы кислорода, баллоны с сжатым газом и резервуары с жидким кислородом. На сегодняшний день чаще всего используются концентраторы кислорода.
Кислородный концентратор – аппарат для выделения молекул кислорода из окружающего воздуха, их концентрирование и подача в виде потока чистого кислорода. Принцип работы кислородного концентратора таков: обыкновенный воздух (FiO2=21%) компрессором нагнетается в цилиндр, содержащий шарики цеолита (молекулярное решето), где под действием давления и цеолита происходит его разделение на фракцию азота (N2) и кислорода (O2). Кислород концентрируется с одной стороны (порт пациента), а с другой стороны азот. Далее 95 % кислородная смесь направляется по системе воздуховодов к дыхательным путям пациента, а азот сбрасывается в атмосферу комнаты (рис. 44).

Аппарат имеет 2 цилиндра, наполненных цеолитом. Специальный дроссель (заглушка) с периодичностью пропускает воздух то в один цилиндр, то в другой. При работе одного цилиндра (концентрация кислорода и накопление азота) второй автоматически «промывается» (выход азота в атмосферу). Срок годности цеолита зависит от интенсивности использования концентратора. Современные аппараты в среднем рассчитаны на 45.000–50.000 ч работы, работают от электросети, просты в эксплуатации, требуют минимального технического ухода (рис. 45).

Баллоны со сжатым газом в последнее время как постоянный источник О2 практически не используются, так как требуется частая их заправка (стандартные 40-литровые баллоны содержат О2 под давлением 150 Бар, такого количества кислорода хватает на 2 сут. при потоке 2 л/мин). Однако небольшие баллоны (1–2 л) могут быть использованы как источник кислорода во время прогулок, поездок и т.д. (амбулаторный источник кислорода). При потоке 2 л/мин таких баллонов хватает на 1–3 ч. Основным недостатком таких портативных систем являются сложности их заправки (рис. 46).
 Резервуары с жидким кислородом представляют собой контейнеры с двойными стенками, содержащие сжиженный О2 при температуре 183°С. Существуют стационарные (20, 30 и 45 л) и портативные переносные (1,14 л) резервуары, последние легко заправляются из стационарных резервуаров в домашних условиях. Портативные системы с жидким О2 особенно показаны больным, ведущим активный образ жизни, позволяя им большее время находиться вне дома, и приводят к достоверному повышению качества жизни пациентов по сравнению с концентраторами кислорода. Портативные переносные (1,14 л) цилиндры обеспечивают выход кислорода в течение 7,5 ч при потоке 2 л/мин. Цилиндры довольно легко заправляются, однако требуют большего технического обслуживания, чем остальные системы. Недостатками этих систем является также испарение кислорода при редком использовании и их довольно высокая стоимость (рис. 47).
Резервуары с жидким кислородом представляют собой контейнеры с двойными стенками, содержащие сжиженный О2 при температуре 183°С. Существуют стационарные (20, 30 и 45 л) и портативные переносные (1,14 л) резервуары, последние легко заправляются из стационарных резервуаров в домашних условиях. Портативные системы с жидким О2 особенно показаны больным, ведущим активный образ жизни, позволяя им большее время находиться вне дома, и приводят к достоверному повышению качества жизни пациентов по сравнению с концентраторами кислорода. Портативные переносные (1,14 л) цилиндры обеспечивают выход кислорода в течение 7,5 ч при потоке 2 л/мин. Цилиндры довольно легко заправляются, однако требуют большего технического обслуживания, чем остальные системы. Недостатками этих систем является также испарение кислорода при редком использовании и их довольно высокая стоимость (рис. 47).
Сравнительная таблица преимуществ и недостатков различных источников кислорода представлена ниже (табл. 18).
Системы доставки кислорода пациенту (кислородный интерфейс)
Существует различные кислородные интерфейсы для доставки O2 в дыхательные пути пациента. В домашних условиях чаще всего используются носовые канюли. Они довольно удобные, недорогие и хорошо воспринимаются большинством больных (рис. 48).
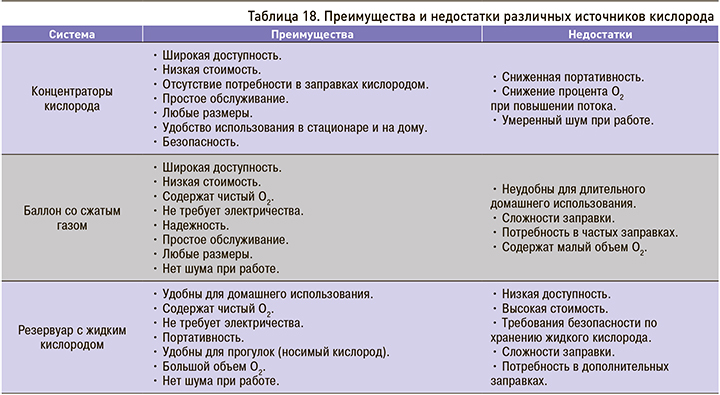
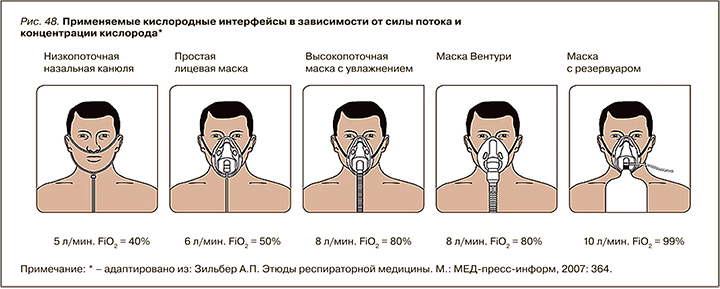
Канюли позволяют создавать кислородно-воздушную смесь с содержанием кислорода (FiO2) до 24–40 % при потоке О2 до 5 литров в минуту (FiO2, % = 20 + 4x(поток О2, л/мин)). Однако, реальная фракция вдыхаемого кислорода зависит кроме потока О2 от многих факторов: геометрии носоглотки, ротового дыхания, минутной вентиляции, дыхательного паттерна. Уменьшение дыхательного объема и минутной вентиляции приводит к повышению FiO2. Однако доставка кислорода в альвеолы происходит только во время ранней фазы вдоха (примерно 1/6 часть дыхательного цикла), в то время как остальной О2 расходуется «вхолостую». Для осуществления более эффективной доставки О2 предложено несколько типов кислород сберегающих устройств: резервуарные канюли, пульсирующие устройства доставки кислорода и транс трахеальные катетеры; при их использовании достигается экономия О2 в 2–4 раза, т.е. возможно снижение потока О2 на такую величину, и, следовательно, увеличить время использования источников О2, что особенно важно для портативных систем.
Показания к ДОТ: перед назначением больным ДОТ необходимо также убедиться, что возможности медикаментозной терапии исчерпаны и максимально возможная терапия не приводит к повышению О2 выше пограничных значений (табл. 19). Параметры газообмена, на которых основываются показания к ДОТ, должны оцениваться только во время стабильного состояния больных, т.е. через 3–4 недели после обострения, так как именно такое время требуется для восстановления газообмена и кислородного транспорта после периода острой дыхательной недостаточности (ОДН). Назначение ДОТ должно основываться на показателях газового состава артериальной крови, данных пульсоксиметрии в данном случае недостаточно, так как, при наличии повышенных уровней карбоксигемоглобина и метгемоглобина, значения насыщения крови кислородом будут завышены. Кроме того, ошибка метода пульсоксиметрии (аккуратность ± 2–3%) в области значений, соответствующих РаО2 около 60 мм рт. ст., может сделать данный метод неадекватным для выявления гипоксемии. Задачей кислородотерапии является коррекция гипоксемии и достижение значений РаО2 >60 мм рт. ст. и SaO2 >90%. Считается оптимальным поддержание РаО2 в пределах 60–65 мм рт. ст. Благодаря сигмовидной форме кривой диссоциации оксигемоглобина, повышение РаО2 более 60 мм рт. ст. приводит лишь к незначительному увеличению SaO2 и содержанию О2 артериальной крови (СаО2), однако может приводить к ретенции углекислоты.

В соответствии с клиническими рекомендациями Британского Торакального Общества от 2015 г. можно выделить несколько целевых групп пациентов, для которых кислородотерапия имеет ключевое и жизнь сберегающее значение. На сегодняшний день такие рекомендации основаны на достаточной доказательной базе, позволяющей выполнить процедуру кислородотерапии в соответствии со стандартами «добросовестной клинической практики». Ниже приведен русскоязычный адаптированный перевод, выполненный нашей рабочей группой в ходе подготовки указанных национальных рекомендаций.
Группы пациентов длительной малопоточной оксигенотерапии ДОТ у пациентов ХОБЛ:
- пациенты ХОБЛ с показателями покоя PaO2 ≤7,3 kPa (55 мм рт. ст.) должны рассматриваться как лица обязательного проведения ДОТ с целью сохранения легочной гемодинамики (уровень «А»);
- ДОТ показана стабильным пациентам ХОБЛ с показателями покоя PaO2 ≤8,0 kPa (60 мм рт. ст.) и явлениями периферических отеков, полицитемии (гематокрит ≥55%) или легочной гипертензии (уровень «А»);
- длительная кислородотерапия показана всем пациентам с гиперкапнией покоя, если они имеют все остальные обязательные критерии ДОТ (уровень «B»).
ДОТ у пациентов с другими респираторными заболеваниями или сердечной патологией:
- ДОТ показана пациентам с интерстициальным заболеванием легких (ИЗЛ) и показателями покоя PaO2 ≤7,3 kPa (55 мм рт. ст.) (уровень «D»);
- ДОТ показана пациентам ИЗЛ с показателями покоя PaO2 ≤8,0 kPa (60 мм рт. ст.) и явлениями периферических отеков, полицитемии (гематокрит ≥55%) или легочной гипертензии (уровень «D»).
ДОТ у пациентов с муковисцидозом:
- ДОТ показана пациентам с муковисцидозом и показателями покоя PaO2 ≤7,3 kPa (55 мм рт. ст.) (уровень «D»);
- ДОТ показана пациентам с муковисцидозом и показателями покоя PaO2 ≤8,0 kPa (60 мм рт. ст.) и явлениями периферических отеков, полицитемии (гематокрит ≥55%) или легочной гипертензии (уровень «D»).
ДОТ у пациентов с легочной гипертензией: показана пациентам с легочной гипертензией, включая идиопатическую, при показателях PaO2 ≤8,0 kPa (60 мм рт. ст.) (уровень «D»);
ДОТ у пациентов с нейромышечными заболеваниями и патологией грудной клетки:
- неинвазивная вентиляция легких (НВЛ) может служить вариантом лечения для пациентов нейромышечными заболеваниями и патологией грудной клетки с дыхательной недостаточностью 2 типа (гиперкапнической). Дополнительная ДОТ потребуется в случае гипоксемии, не контролируемой НВЛ (уровень «D»).
ДОТ у пациентов с сердечной недостаточностью:
- ДОТ показана пациентам с сердечной недостаточностью и показателями покоя PaO2 ≤7,3 kPa (55 мм рт. ст.) (уровень «D»);
- ДОТ показана пациентам с сердечной недостаточностью и показателями покоя PaO2 ≤8,0 kPa (60 мм рт. ст.) при явлениях периферических отеков, полицитемии (гематокрит ≥55%) или ЭКГ и Эхо-КГ доказательствами легочной гипертензии (уровень «D»);
Особенности выполнения ДОТ
Длительность проведения ДОТ: необходимо выполнять с минимальной длительностью от 15 ч/сутки. Проведение ДОТ в течение 24 ч может иметь дополнительные преимущества (уровень «С»).
Сила воздушного потока для проведения ДОТ:
- инициация ДОТ у пациентов, соответствующих критериям, производиться воздушным потоком в 1 л/мин. и титруется с повышением на 1 л/мин. до тех пор, пока SpO2 > 90%. При проведении газового анализа артериальной крови необходимо убедиться, что в покое PaO2 ≥8,0 kPa (60 мм рт. ст.) (уровень «B»);
- инициация ДОТ у не гиперкапнических пациентов возможно проводить в период сна повышением на 1 л/мин. при условии отсутствия любых противопоказаний к ДОТ (уровень «B»);
- пациенты с достаточной амбулаторной активностью, получающие ДОТ, должны получать дополнительный кислород в связи с возрастающей потребностью в нем при выполнении ими физической нагрузки (уровень «B»).
Контроль за проведением ДОТ:
- пациенты ДОТ должны через 3 мес. пройти обязательную процедуру оценки газов крови и скорости кислородного потока для понимания необходимости дальнейшего проведения ДОТ и ее терапевтической эффективности (уровень «А»);
- пациенты ДОТ должны пройти обязательную контроль на дому или в стационаре на 6-м и 12-м месяце от выполненной оценки на 3-м месяце (уровень «D»);
- визиты контроля за выполнением ДОТ проводит специалист, имеющий необходимую подготовку и знания в области проведения домашней кислородотерапии (уровень «D»).


