11 марта 2020 г. Всемирной организацией здравоохранения (ВОЗ) было официально объявлено о пандемии новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2. За месяц до этого, 11 февраля 2020 г., ВОЗ было предложено официальное название новой коронавирусной инфекции – COVID-19 («CОronaVIrus Disease 2019»). В тот же день Международный комитет по таксономии вирусов присвоил название SARS-CoV-2 коронавирусу, возбудителю этого заболевания [1–4].
SARS-CoV-2 – это РНК-содержащий вирус из семейства Coronaviridae. Его генетическое сходство достигает 79% с коронавирусом SARS-CoV и 50% – с коронавирусом MERS-CoV, которые ранее вызывали эпидемии тяжелого острого респираторного синдрома (ТОРС, или SARS) [5–7].
Вирус SARS-CoV-2, благодаря своему специфическому S-белку, может связываться с клеточным рецептором ангиотензинпревращающего фермента 2 (АПФ2). Его аффинность к этому рецептору в 10–20 раз выше, чем у других коронавирусов [5–9].
Рецепторы АПФ2 имеются у эпителиальных клеток дыхательных путей, желудочно-кишечного тракта, мочевых путей, эндотелия сосудов, макрофагов, а также у других органов и тканей, включая миокард и некоторые отделы ЦНС. Однако тропизм SARS-CoV-2 максимально выражен к эпителиальным клеткам верхних дыхательных путей и альвеолоцитам II типа, где происходит его более активная репликация. При этом полагают, что он не менее активно поражает эндотелий сосудов, а возможно, и другие клетки с рецептором АПФ2 [5–9].
Доказано развитие синдрома системной воспалительной реакции – ССВР («цитокинового шторма») – у части больных в ответ на SARS-CoV-2. Именно ССВР лежит в основе тяжелых поражений легких и других органов, сосудистого русла, синдрома гиперкоагуляции (триггером выступает интерлейкин-6), вплоть до развития шока, сходного с септическим. Появление антифосфолипидных антител может усиливать коагулопатию. Некоторые исследователи не исключают развития вторичных аутоиммунных реакций. Гипотеза о вирусном повреждении гемоглобина эритроцитов с развитием химического пневмонита, вызванного продуктами распада гема, не подтвердилась морфологическими исследованиями [10–20].
В настоящее время во многих странах мира активно изучается патологическая анатомия поражений легких при COVID-19, причем прежде всего на материале аутопсий [21–33]. Однако не в последнюю очередь из-за ограниченного числа аутопсий в большинстве стран морфология поражения легких (как и других органов) при COVID-19 остается пока недостаточно изученной [21–33]. Именно это и стало целью нашего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование основано на анализе результатов 2000 аутопсий, уникального для COVID-19 числа патологоанатомических вскрытий, проведенных в Москве с 20 марта по 22 мая 2020 г. Применялись гистологические и гистохимические методы исследования аутопсийного материала, а также иммуногистохимический метод (с использованием антител к моноцитам и макрофагам – CD163). Во всех наблюдениях наличие SARS-CoV-2 было подтверждено методом полимеразной цепной реакции (ПЦР) на аутопсийном материале (до этого у большинства умерших – прижизненно).
Соотношение мужчин и женщин было равно 1,54:1 (1212 и 788 соответственно). Средний возраст умерших составил 68,5±15,63 лет (от 20 до 99 лет, в среднем 72,1±13,71 у женщин и 66,3±14,58 лет у мужчин). Тромботические и тромбоэмболические осложнения (не только ставшие причиной смерти) выявлены у 7,6% пациентов, а выраженные признаки синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома) – у 12% умерших. Среди коморбидных заболеваний отмечена высокая частота ожирения (19,3%) и сахарного диабета (21,9%), что значительно выше, чем на вскрытиях больных, скончавшихся от других заболеваний. 59% умерших имели гипертоническую болезнь, 28% – хронические формы ишемической болезни сердца (ИБС).
Среди смертельных осложнений значительно преобладал острый респираторный дистресс-синдром (ОРДС) (90%), на втором месте оказалась тромбоэмболия легочной артерии (6%) и сепсис (1,5%). В отдельных случаях смертельными осложнениями COVID-19 с синдромом гиперкоагуляции и тромбозами артерий органов стали острый инфаркт миокарда (1,1%) или ишемический инфаркт головного мозга (0,1%).
РЕЗУЛЬТАТЫ
Характерные для COVID-19 патологические изменения легких, различные по своей распространенности, были выявлены у всех умерших и заключались в развитии диффузного альвеолярного повреждения (ДАП) в сочетании с поражением сосудистого русла легких (микроангиопатией, тромбозами, в отдельных наблюдениях деструктивно-продуктивным васкулитом) и альвеолярно-геморрагическим синдромом, преимущественно в первую, экссудативную, фазу ДАП. Такая вирусная интерстициальная пневмония с сосудистым и геморрагическим компонентом и являлась морфологическим субстратом ОРДС.
На вскрытиях была выявлена важная особенность поражения верхних дыхательных путей при COVID-19. Для этого заболевания не характерен трахеобронхит с яркой воспалительной гиперемией, типичной, например, для гриппа [34–36]. Слизистая оболочка трахеи и бронхов была бледной, без явных повреждений, с точечными кровоизлияниями при ДВС-синдроме (рис. 1). Исключением явились умершие, находившиеся на искусственной вентиляции легких (ИВЛ) с развитием бактериальных трахеитов и бронхитов.
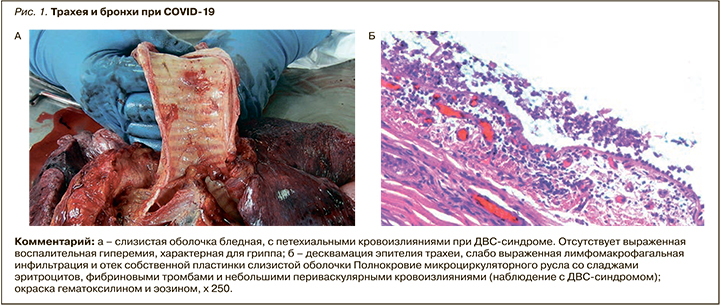
Макроскопически в легких выявлялась типичная картина «шоковых легких», которая, однако, не является специфической для COVID-19 и описана при шоке любой этиологии [34–36]. Для COVID-19 оказалось типичным более раннее и преимущественное поражение заднебазальных отделов легких. Легкие были увеличены в размерах, с поверхностью темно-вишневого цвета, характерного «лакового вида». На разрезе ткань легких диффузно уплотнена, на большом протяжении безвоздушна, темно-вишневого или красно-бурого цвета, с выраженным отеком, участками ателектазов, кровоизлияний и часто геморрагическими инфарктами. Типичны множественные тромбы ветвей легочных артерий и вен разного калибра. В единичных наблюдениях тромбоз легочных артерий распространялся на правые отделы сердца (рис. 2, 3).
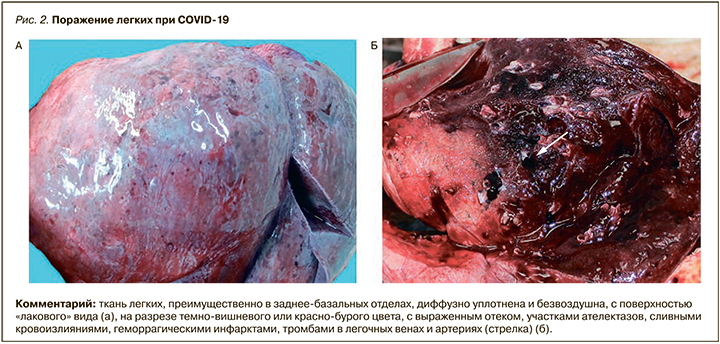
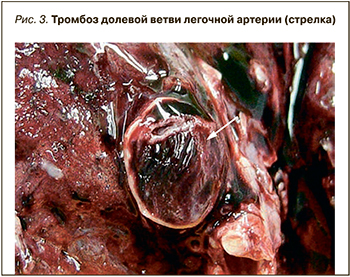 Тромбы ветвей легочной артерии следует дифференцировать с тромбоэмболами, которые также были выявлены в части наблюдений, а их источником были глубокие вены нижних конечностей, реже вены малого таза или правые отделы сердца.
Тромбы ветвей легочной артерии следует дифференцировать с тромбоэмболами, которые также были выявлены в части наблюдений, а их источником были глубокие вены нижних конечностей, реже вены малого таза или правые отделы сердца.
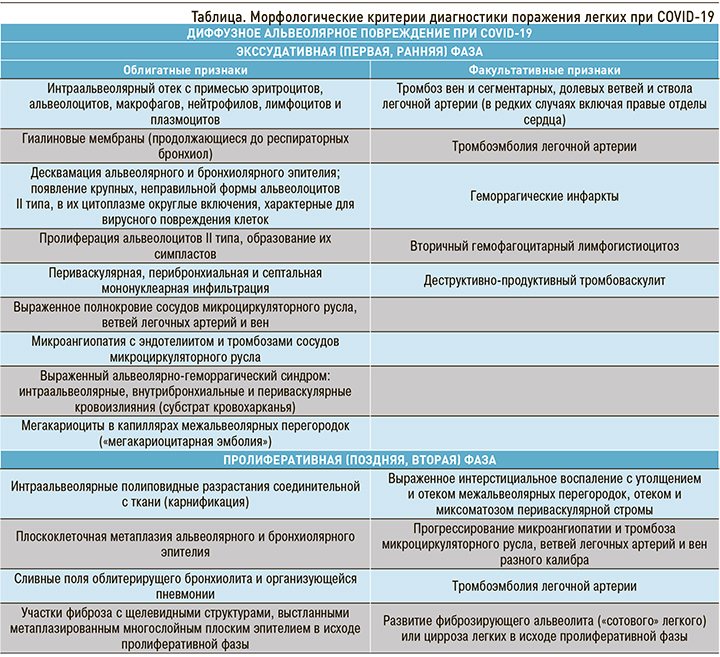
При гистологическом исследовании легких выявлены изменения, которые соответствовали двум фазам ДАП – экссудативной (первой, ранней) и пролиферативной (второй, поздней) [34–36]. Экссудативная фаза ДАП обычно характерна для первых 7–8 сут, реже 14 сут вирусного поражения легких разной этиологии. Однако при COVID-19 выявлено несоответствие сроков классических фаз ДАП длительности заболевания. У значительной части умерших экссудативная фаза ДАП была обнаружена в сроки после 14 сут от начала заболевания (по данным истории болезни), соответственно значительно позже развивалась и вторая, пролиферативная, фаза. Нередко обнаруживалось сочетание двух фаз ДАП, что указывает на затяжное волнообразное течение инфекции.
Экссудативная фаза ДАП проявлялась морфологически интраальвеолярным отеком с примесью в отечной жидкости эритроцитов, слущенных альвеолоцитов (в виде отдельных клеток и их пластов), макрофагов, лимфоцитов и нейтрофилов и формированием гиалиновых мембран, которые иногда распространялись до респираторных бронхиол. Выявлялись крупные, неправильной формы альвеолоциты II типа, в части из них в цитоплазме встречались базофильные или эозинофильные включения, характерные для вирусного повреждения клеток. Наряду с альтерацией характерна пролиферация альвеолоцитов II типа, часто с образованием симпластов. Ярким проявлением экссудативной фазы ДАП при COVID-19 была микроангиопатия с повреждением эндотелия (в зарубежной литературе получил распространение термин «эндотелиит»), выраженным полнокровием, тромбозами, периваскулярной лимфомакрофагальной инфильтрацией, в отдельных случаях с развитием деструктивно-продуктивного тромбоваскулита. Характерен выраженный альвеолярно-геморрагический синдром с интраальвеолярными, внутрибронхиальными, внутрибронхиолярными и периваскулярными кровоизлияниями (морфологический субстрат кровохарканья), который усугубляли геморрагические инфаркты легких, вызванные тромбозами и тромбоэмболиями ветвей легочной артерии разного калибра. Лимфомакрофагальная инфильтрация межальвеолярных перегородок была слабо выражена, в большей степени инфильтрат локализовался периваскулярно и перибронхиально (рис. 4, 5).
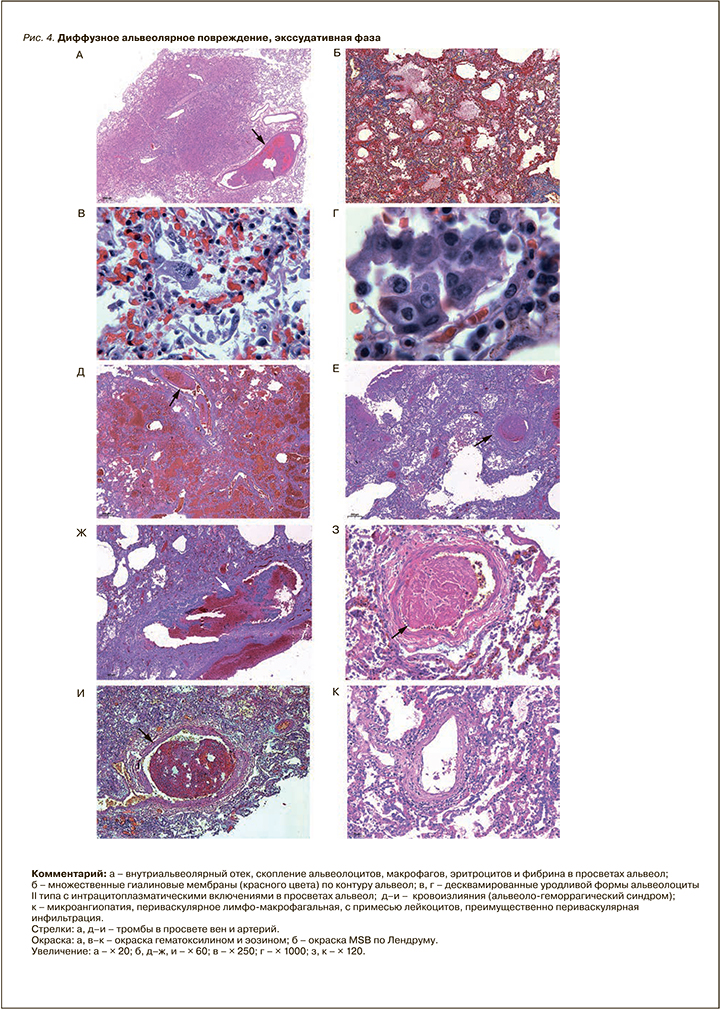
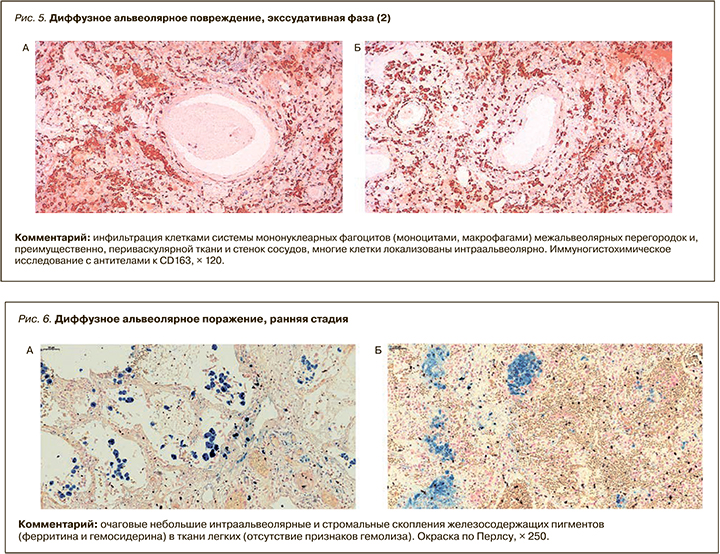
Вторичный интраальвеолярный и периваскулярный гемосидероз был выражен минимально, что позволяет отклонить гипотезу о химическом пневмоните, вызванном вирусным повреждением гема эритроцитов (рис. 6).
В капиллярах межальвеолярных перегородок постоянно выявлялись мегакариоциты (так называемая мегакариоцитарная эмболия). Это типично для «шоковых легких» любой этиологии.
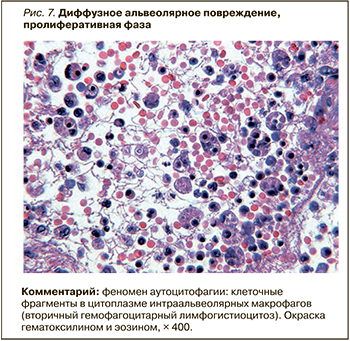 В части наблюдений в экссудативную и пролиферативную фазы ДАП обнаружен ранее не описанный при вирусных поражениях легких феномен аутоцитофагии. В просветах альвеол наблюдались макрофаги, содержащие в своей цитоплазме фрагменты различных клеток и их ядер, вероятно, лимфоцитов (апоптотические тельца), а также эритроциты (рис. 7). Этот феномен близок ко вторичному гемофагоцитарному лимфогистиоцитозу, который наблюдается при некоторых тяжелых инфекционных заболеваниях. Возможно, он связан с выявленным вирус-ассоциированным поражением лимфоцитов, клинически проявляющимся лимфопенией (неблагоприятным прогностическим признаком) и их апоптозом и пироптозом.
В части наблюдений в экссудативную и пролиферативную фазы ДАП обнаружен ранее не описанный при вирусных поражениях легких феномен аутоцитофагии. В просветах альвеол наблюдались макрофаги, содержащие в своей цитоплазме фрагменты различных клеток и их ядер, вероятно, лимфоцитов (апоптотические тельца), а также эритроциты (рис. 7). Этот феномен близок ко вторичному гемофагоцитарному лимфогистиоцитозу, который наблюдается при некоторых тяжелых инфекционных заболеваниях. Возможно, он связан с выявленным вирус-ассоциированным поражением лимфоцитов, клинически проявляющимся лимфопенией (неблагоприятным прогностическим признаком) и их апоптозом и пироптозом.
Для пролиферативной фазы ДАП, которая развивается обычно после 7–8 сут и более от начала болезни, а при COVID-19 нередко значительно отсрочена, было свойственно накопление фибрина в просветах альвеол с полиповидными разрастаниями соединительной ткани. Типичны сливные поля облитерирущего бронхиолита и организующейся пневмонии или участки рыхлого фиброза с щелевидными структурами, выстланными метаплазированным плоским эпителием. В части наблюдений обнаружено выраженное интерстициальное воспаление с утолщением и отеком межальвеолярных перегородок, отеком и миксоматозом периваскулярной стромы. Нередко имело место прогрессирование микроангиопатии и тромбоза сосудистого русла, ветвей легочных артерий и вен разного калибра. Обращало на себя внимание и обилие полнокровных сосудов микроциркуляторного русла, что можно объяснить не только раскрытием всех коллатералей, но и, возможно, их новообразованием уже в эту позднюю фазу ДАП (рис. 8).
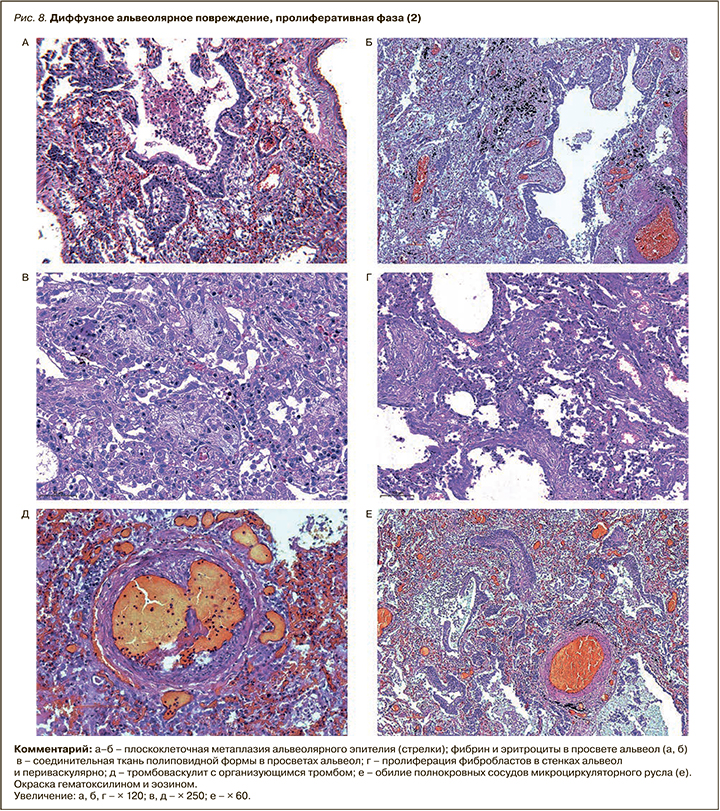
Присоединение бактериальной или микотической инфекции (вирусно-бактериальная и микотическая пневмония, сепсис), за редким исключением, было характерно у больных, более недели находившихся на ИВЛ, и выявлено у 37% умерших (746 из 2000 аутопсий). Этот показатель несколько выше значений, характерных, например, для гриппа А (H1N1) (около 30%) [34–36].
В более позднюю стадию пролиферативной фазы ДАП, преимущественно в нижних долях легких, развиваются организующаяся пневмония и изменения, характерные для фиброзирующего альвеолита (макроскопически – с формированием «сотового легкого»).
Суммируя эти поздние изменения в виде патологической регенерации с метаплазией эпителия, коллапса и склероза ткани легких, стенок сосудов, их реканализацией после тромбозов, неоангиогенезом и персистирующим васкулитом, не будет преувеличением назвать их циррозом легких (различным по площади поражения), с позиций общей патологии, близкой к вирусному циррозу печени (рис. 9, А–Б).
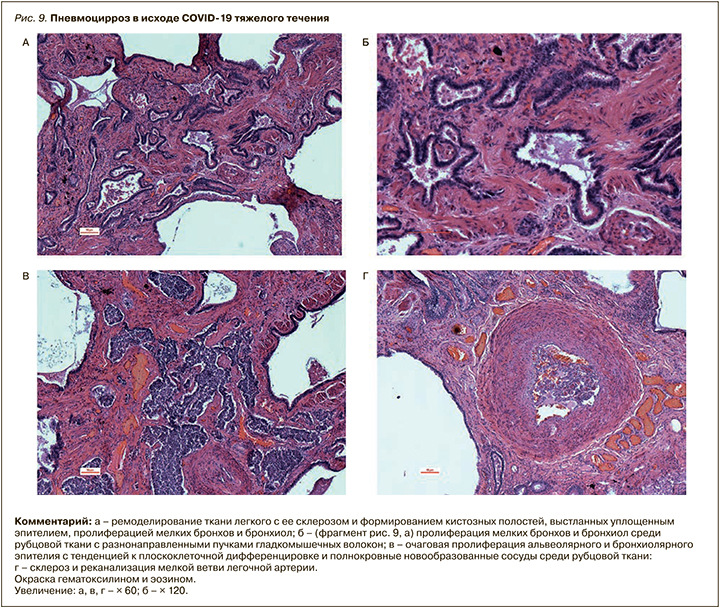
Такие последствия COVID-19, как это иногда наблюдалось после других тяжелых вирусных поражений легких, в дальнейшем могут приводить к прогрессированию хронической дыхательной недостаточности, вторичной легочной гипертензии и легочного сердца [34–36].
Приведенная таблица позволяет дифференцировать виды поражения легких в зависимости от фазы воспалительного процесса.
На вскрытиях, помимо изменений легких, отмечены разнообразные поражения других органов, патогенез которых, безусловно, многофакторный. Среди основных факторов – специфическая альтерация, вызванная непосредственно SARS-CoV-2, гипоксия, микроангиопатия с эндотелиитом, синдромы гиперкоагуляции с тромбозами и тромбоэмболиями, системная воспалительная реакция в виде «цитокинового шторма». Нельзя исключить роль возможных аутоиммунных нарушений и ятрогенных лекарственных повреждений. Следует подчеркнуть, что различные изменения органов связаны также с коморбидными заболеваниями и их осложнениями, что характерно для COVID-19, так как летальные исходы от этого инфекционного заболевания в подавляющем большинстве случаев наблюдаются у больных старших возрастных групп.
Полученные материалы позволяют провести клинико-патоморфологические параллели и в определенной мере обосновать терапевтические подходы к лечению больных COVID-19.
Относительно позднее развитие экссудативной фазы воспаления во многом объясняет нередко наблюдаемое несоответствие выраженности клинической картины рентгенологически выявленному объему поражения легких, а также увеличение этого объема на более поздних этапах болезни.
Наблюдаемый рентгенологический феномен консолидации легочной ткани (инфильтрация) на фоне характерного феномена «матового стекла» ни в коей мере не свидетельствует о бактериальном поражении, а отражает комплекс характерных морфологических процессов вирусного повреждения (альвеолярное «затопление», множественные тромбозы, раскрытие коллатералей, неоангиогенез, отложение гиалиновых мембран и ремоделирование ткани легкого с формированием пневмосклероза и др.).
Ключевым патогенетическим моментом вирусного поражения становится повреждение эндотелия сосудов с образованием микро- и макротромбозов, что в дальнейшем становится причиной отягощающей и пролонгирующей диффузное альвеолярное повреждение. Весьма вероятно, что в более поздние сроки начинают превалировать аутоиммунные поражения ткани легких и сосудов.
Феномен дыхательной недостаточности возникает вследствие нескольких взаимосвязанных механизмов:
- ограничения площади диффузии из-за выключения значительной доли альвеол из процесса газообмена вследствие альвеолярного «затопления» и на поздних этапах из-за отложения гиалиновых мембран и фибрина, а также эндотелиита;
- редукции сосудистого русла вследствие тромбоза;
- увеличения расстояния диффузии в альвеолокапиллярном сегменте вследствие интерстициального отека;
- грубого нарушения вентиляционно-перфузионного отношения и равномерности вентиляции.
Комбинация этих механизмов в сочетании с нередко возникающей мышечной слабостью, ограничивающей работу вспомогательной дыхательной мускулатуры, предопределяет тяжесть дыхательной недостаточности.
Исходя из этого представляются вполне обоснованными следующие терапевтические стратегии:
- раннее применение прямых антикоагулянтов в терапевтических дозировках;
- использование кортикостероидов для подавления «цитокинового шторма», возможных аутоиммунных реакций и прогрессирования диффузного альвеолярного повреждения;
- при высоком риске развития или уже развившемся ОРДС для подавления «цитокинового шторма» и прогрессирования диффузного альвеолярного повреждения оправдано введение моноклональных антицитокиновых антител;
- использование прон-позиции для облегчения вентиляции наиболее пострадавших заднебазальных участков легких;
- длительная кислородотерапия и гипербарическая оксигенация, компенсирующие нарушения диффузии;
- неинвазивная вентиляция легких, рекрутирующая плохо вентилируемые участки легких, обеспечивающая большую равномерность вентиляции и снимающая нагрузку на дополнительную дыхательную мускулатуру [38];
- применение мотивирующих вдох-спирометров, оРЕР-тренажеров и интрапульмональной перкуссионной вентиляции, рекрутирующих плохо вентилируемые участки легких [38].
Также следует помнить:
- инвазивная вентиляция легких по возможности должна быть максимально отсрочена, так как может способствовать усугублению диффузного альвеолярного повреждения и бактериальной контаминации;
- применение прямых антивирусных препаратов (существующих и перспективных) может быть эффективно только при максимально раннем их назначении;
- использование индукторов интерферонов сопряжено с высоким риском усугубления «цитокинового шторма»;
- антибактериальная терапия патогенетически не оправдана за исключением случаев уже имеющейся активной бактериальной инфекции и применения инвазивной вентиляции легких.
ЗАКЛЮЧЕНИЕ
Выявленные особенности воспалительного процесса при COVID-19 (приоритет эндотелиального повреждения с микро- и макротромбообразованием, относительно позднее развитие экссудативной фазы воспаления и склонность к развитию пневмофиброза), с одной стороны, предопределяют большую длительность терапии и необходимость респираторной реабилитации, главным образом направленной на легочный рекрутмент. С другой стороны, остаются открытыми вопросы:
- о возможности и целесообразности применения антифибротических препаратов (пирфенидон, нинтеданиб) у лиц с признаками развития выраженного пневмофиброза;
- длительности и дозировке стероидной терапии;
- длительности применения прямых антикоагулянтов;
- возможности длительного применения непрямых антикоагулянтов.


