Диагностика
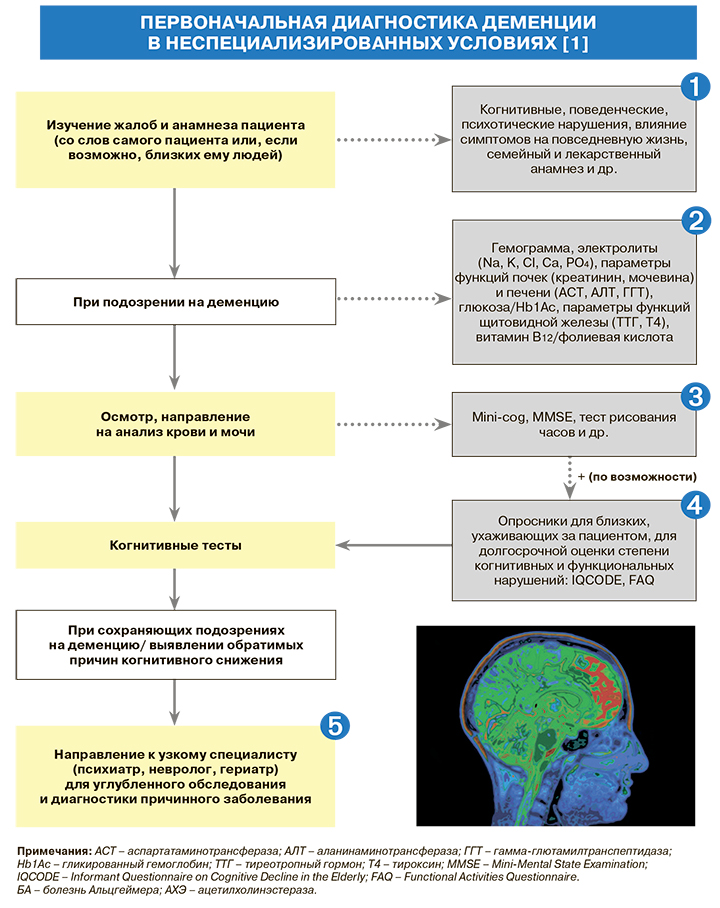
1.
• К критериям диагностики синдрома деменции по МКБ-10 относятся [2]:
– нарушения памяти + нарушение хотя бы одной из следующих когнитивных функций: речи/праксиса (исполнительной деятельности)/гнозиса (оптико-пространственной деятельности)/мышления;
– ухудшение профессионального или социального функционирования;
– длительность симптомов не менее 6 мес;
– обычно хроническое или прогрессирующее течение;
– наличие среди причин церебрального заболевания или общего состояния (соматического заболевания, интоксикации, в том числе медикаментозной), вторично влияющих на мозговую деятельность.
• В ряду возможных обратимых анамнестических причин когнитивного дефицита NICE рекомендует обращать внимание на делириум, депрессию, сенсорные нарушения (например, расстройства зрения и слуха), длительный прием препаратов с антихолинергическими эффектами [1].
• На разных этапах течения болезни Альцгеймера, кроме когнитивных нарушений (табл. 1), отмечаются некогнитивные психические расстройства, которые представляют гораздо больший фактор риска для госпитализации больных. Поведенческие симптомы обычно выявляются при наблюдении за пациентом и включают физическую агрессию, крики, беспокойство, возбуждение, блуждания, нарушение общепринятых норм поведения, сексуальную расторможенность, проклятия и т.п. Психические симптомы, как правило, оцениваются на основе беседы с пациентом и его родственниками и проявляются тревогой, депрессией, галлюцинациями, бредовыми расстройствами [3].

2.
• Лабораторный скрининг наиболее частых дисметаболических энцефалопатий позволяет исключить или заподозрить вторичную церебральную дисфункцию на фоне декомпенсации соматического заболевания, экзогенной интоксикации, дефицитарного состояния [1, 4].
3.
• Список когнитивных тестов, рекомендуемых Национальным институтом здравоохранения и совершенства медицинской помощи Великобритании (NICE) предварительной диагностики деменции, включает Mini-cog (табл. 2) [1]. Преимущества этого метода – высокая информативность в плане выявления деменции, а также простота и быстрота, что важно для непрофильных специалистов. Кроме того, Mini-cog может применяться для предварительной диагностики как сосудистых, так и первичных дегенеративных когнитивных расстройств. Сравнительный недостаток этого метода – низкая информативность в отношении легких и умеренных когнитивных расстройств [5].

• Принципы оценки общего результата теста по шкале психического статуса (MMSE; максимально возможное число баллов – 30) [5]:
– 24–27 баллов свидетельствуют о преддементивных когнитивных нарушениях;
– 20–23 балла – легкая деменция;
– 11–19 баллов – умеренная деменция;
– 0–10 баллов – тяжелая деменция.
В отличие от Mini-Cog, MMSE требует больше времени для проведения. Для него характерна низкая чувствительность в отношении легких форм деменции, поскольку при ее наличии результат может находится в пределах нормы (>27). В этом случае судить о деменции врач может лишь при динамическом ухудшении результатов теста, проведенного неоднократно с интервалом в несколько месяцев. При отсутствии деменции результат будет оставаться стабильным [5].
• При проведении теста рисования часов к критериям выраженных когнитивных нарушений (в порядке возрастания степени этих нарушений) относят следующие результаты:
– явные ошибки в расположении стрелок;
– обе стрелки показывают неправильное время или вовсе не показывают его;
– неправильное расположение цифр на циферблате;
– отсутствие ряда чисел на циферблате, частичное их нахождение за пределами круга, отсутствие цельности часов;
– отсутствие связи между числами и циферблатом;
– безуспешные попытки пациента выполнить тест или отсутствие таких попыток [5].
• Тест рисования хорошо зарекомендовал себя для выявления атрофических процессов мозга, но менее надежен в диагностике легких и умеренных когнитивных нарушений [5].
4.
Структура Опросника родственника о когнитивном снижении у пожилого человека (IQCODE), рекомендованного NICE для сторонней оценки интеллектуально-мнестических нарушений за последние 10 лет у пациента с подозрением на деменцию, приведена в таблице 3. Опросник функциональной активности (FAQ), включающий 10 вопросов насчет изменения социальных навыков, «инструментальной активности», самообслуживания и зависимости пациента от посторонней помощи, помогает оценить нарушения активности повседневной жизни, которые являются ключевой особенностью деменции [7].

5.
Углубленное обследование пациента с сохраняющимися подозрениями на деменцию (предварительно диагностированную деменцию), включая нейровизуализацию, дифференциальную диагностику причинных заболеваний, проводится узким специалистом (невролог, психиатр, гериатр) [1]. Основные сходства и различий распространенных причин деменции отражены в таблице 4.

Лечение


1.
В России в компетенцию специалистов первичного медико-санитарного звена (участковых терапевтов, врачей общей практики, семейных врачей) входят выявление и коррекция факторов риска когнитивных нарушений, скрининг когнитивных расстройств, наблюдение за пациентами. Окончательная диагностика и лечение деменции проводятся специализированными службами (кабинеты нарушений памяти в первичной медицинской сети, нейрогериатрические центры, психогериатрические подразделения в территориальных психоневрологических диспансерах и психиатрических стационарах, гериатрические психоневрологические центры) [9]. При этом, как отмечает Всемирная организация здравоохранения (ВОЗ), с учетом важной роли, которую играет первичная медико-санитарная помощь, даже обеспеченным ресурсами странам с высоким уровнем дохода трудно восполнить пробелы в лечении деменции без эффективной координации между службами первичной и специализированной медицинской помощи. Что же касается стран с низким и средним уровнем дохода, где нет достаточного количества специалистов, то здесь специалисты первичной и неспециализированной медицинской помощи играют гораздо более важную роль в диагностике и лечении деменции [10].
2.
• Рекомендации NICE относительно монотерапии деменции базируются на данных рандомизированных клинических исследований (РКИ) 2004–2018 гг., в которых перечисленные ингибиторы ацетилхолинэстеразы (АХЭ) доказали значимое и достоверное превосходство в эффективности над плацебо при легкой и средней степени болезни Альцгеймера, а неконкурентный антагонист NDMA-рецепторов мемантин – при средней и выраженной степени этого заболевания [11].
• Как подчеркивается в рекомендациях NICE, первичное назначение фармакотерапии пациентам с деменцией должен осуществлять только специалист, имеющий необходимые знания и опыт ведения соответствующих больных. Это может быть психиатр, гериатр, невролог, а также врач общей практики, обладающий специальными знаниями и компетенциями в диагностике и лечении болезни Альцгеймера. После того как принято решение о начале лечения ингибитором АХЭ или мемантином, лечение может проводиться в системе первичной медико-санитарной помощи [1].
3.
• При использовании когнитивных шкал для определения степени тяжести деменции, выбора терапии и оценки ее эффективности следует учитывать возможные «искажающие факторы» (физические, сенсорные расстройства пациента, нарушения обучаемости, трудности коммуникации из-за низкого уровня образования больного или плохого знания языка), которые могут привести к некорректным результатам или вовсе сделать такие шкалы малопригодным индикатором состояния больного. В таких случаях необходимость начала или продолжение лечения следует определять с применением других подходящих методов [1].
4.
• При легкой и средней деменции на фоне болезни Альцгеймера прием ингибитора АХЭ донепезила начинают с дозировки 5 мг/сут перед сном. Через месяц после оценки эффекта терапии дозировка препарата может быть увеличена до 10 мг/сут [11].
• Нежелательные эффекты донепезила могут включать диарею, мышечные судороги, усталость, тошноту, рвоту и бессонницу [11].
• Лечение другим ингибитором АХЭ – галантамином – обычно начинают с дозировки 8 мг/сут курсом 4 нед, после чего повышают ее до 16 мг/сут сроком еще на 4 нед. Дальнейшая поддерживающая доза составляет 16–24 мг/сут в зависимости от соотношения клинической эффективности и переносимости препарата [11].
• К побочным явлениям, которые могут возникать при приеме галантамина, относятся тошнота и рвота [11].
• У еще одного ингибитора АХЭ – ривастигмина – начальная доза при легкой и средней болезни Альцгеймера обычно составляет 1,5 мг 2 раза/сут. В дальнейшем с учетом переносимости разовая доза как минимум через каждые 2 нед может повышаться на 1,5 мг до максимально допустимой дозировки 6 мг/сут [11].
• Из нежелательных явлений ривастигмин может вызывать главным образом желудочно-кишечные нарушения, включая тошноту и рвоту [11].
5.
• Лечение мемантином рекомендовано начинать с дозировки 5 мг/сут, после чего ее еженедельно повышают на 5 мг до максимальной дозировки 20 мг/сут [11].
• В метаанализе 11 исследований, посвященных сравнению мемантина с плацебо, на фоне приема этого препарата было показано существенное и достоверное улучшение когнитивных и поведенческих показателей у пациентов со средней и выраженной степенью болезни Альцгеймера [12].
• Возможные побочные эффекты мемантина включают головокружение, головную боль, запор, сонливость, повышение давления [11].
6.
• В упомянутом выше метаанализе говорится, что в ряде клинических исследований добавление мемантина к ингибиторам АХЭ приводило к значимому улучшению поведенческих нарушений при болезни Альцгеймера по сравнению с монотерапией ингибиторами АХЭ [12].
• Как отмечается в рекомендациях NICE, если пациент с установленным диагнозом болезни Альцгеймера уже принимает ингибитор АХЭ, то назначение мемантина не требует дополнительной консультации узкого специалиста и может осуществляться врачом первичного медико-санитарного звена [1].


