Пандемия COVID-19 – болезни, вызванной новой коронавирусной инфекцией SARS-CoV-2 – продолжается уже более года [1]. По данным университета Джона Хопкинса, на 31 декабря 2020 г. (через 12 мес после сообщения ВОЗ о выявлении новой болезни) в мире было зафиксировано более 83,2 млн случаев COVID-19, причем более 1,8 млн случаев закончилось летальным исходом [2].
Важнейшим элементом борьбы с развитием пандемии служит эффективная профилактика, направленная на предупреждение заражения новых пациентов SARS-CoV-2 и снижение риска развития тяжелых форм болезни у тех, кто уже инфицирован этим вирусом. Программа профилактики включает изменение образа жизни и работы, максимальное уменьшение контактов между людьми, использование средств личной защиты, регулярный медицинский контроль в группах высокого риска. Кроме этого, в медицинском сообществе обсуждается необходимость ограничения использования лекарств, которые могут оказывать негативное влияние на инфицирование SARS-CoV-2, развитие тяжелых форм COVID-19 и осложнений этого заболевания. Так, дискутировались вопросы возможной опасности при применении нестероидных противовоспалительных препаратов (НПВП), ингибиторов ангиотензинпревращающего фермента, глюкокортикоидов (ГК), иммуносупрессивных средств [3–6].
В последние месяцы в свете проблемы COVID-19 ряд ученых обратили внимание на такой популярный класс лекарственных препаратов, как ингибиторы протонной помпы (ИПП). ИПП – незаменимые средства для лечения кислотозависимых гастроэнтерологических заболеваний, таких как язва желудка/двенадцатиперстной кишки и гастроэзофагеальная рефлюксная болезнь (ГЭРБ), центральный компонент антихеликобактерной терапии, на которой основано лечение хронического Helicobacter pylori (H. pylori) ассоциированного гастрита и предупреждение развития ряда форм рака желудка. Кроме этого, ИПП совершенно необходимы как наиболее эффективные препараты для профилактики осложнений со стороны верхних отделов желудочно-кишечного тракта (ЖКТ), вызываемых приемом НПВП, ГК и антитромботических средств (низких доз аспирина, варфарина, новых оральных антикоагулянтов и др.). Наконец, ИПП очень активно используются в амбулаторной практике (в том числе в режиме «по требованию») как удобное и действенное средство купирования эпизодов неязвенной диспепсии и основного симптома ГЭРБ – изжоги [7]. Это делает ИПП одним из самых широко применяемых классов лекарственных средств. Так, В США ИПП по назначению регулярно принимают более 7% взрослых людей [8]. Общий уровень продаж этой группы медикаментов в мире составляет более 25 млрд долл. в год [9].
К сожалению, ИПП не полностью безопасны: они могут вызывать разнообразные нежелательные реакции, ряд из которых представляет потенциальную угрозу для здоровья и жизни больных. К таковым относятся повышение риска кишечных инфекций и нарушений микробиоты (в том числе с развитием клостридиального колита), возможность прогрессирования остеопороза и развития остеопоретических переломов, миграция H. pylori в верхние отделы желудка с развитием гастрита тела желудка, негативное фармакологические взаимодействие с рядом препаратов (клопидогрел, метотрексат), аспирационные пневмонии при критических состояниях, патология почек, нарушение всасывания магния и повышение риска аритмий и др. [9–11].
Одним из возможных осложнений приема ИПП также считается риск возникновения внебольничных пневмоний (ВБП) [9–11]. Механизм развития этой нежелательной реакции до конца не ясен: обычно его связывают с возникающим под влиянием ИПП дисбиозом и значительным снижением внутрижелудочной рН+, что создает условия для микрорефлюкса содержимого желудка, содержащего патогенную флору, в верхние дыхательные пути. Вероятность рефлюкса содержимого желудка особенно велика при наличии ГЭРБ. Помимо этого, ИПП могут оказывать воздействие на неспецифический иммунитет, снижая функцию нейтрофилов и макрофагов. В частности, обсуждается роль блокады вакуолярной АТФ-азы (V-ATPase-a1V, a2V, a3V и a4V), принимающей участие в создании низкого уровня рН+ в фаголизосомах. Показано, что применение ИПП может подавлять хемотаксис, процесс фагоцитоза бактерий и снижать выработку моноцитами и нейтрофилами свободных радикалов, которые необходимы для разрушения чужеродных микроорганизмов [12–15].
В 2015 г. Lambert А. et al. [16] представили метаанализ 26 популяционных исследований, в которых оценивались факторы риска 226 769 случаев ВБП среди 6 351 656 обследованных лиц. Было показано, что прием ИПП достоверно увеличивал как вероятность возникновения ВБП (относительный риск (ОР) 1,49; 95% доверительный интервал (ДИ): 1,16–1,92), так и вероятность госпитализации из-за этой патологии (ОР 1,61; 95% ДИ 1,12–2,31). При этом угроза развития ВБП была существенно выше при использовании ИПП в первый месяц: ОР 2,10; 95% ДИ 1,39–3,16.
Повышение риска ВБП на фоне приема ИПП было продемонстрировано в более поздней работе Zirk-Sadowski J. et al. [17]. Исследуемую группу составили 75 050 пациентов 60 лет и старше, получавших ИПП, и аналогичная по возрасту и полу группа людей, не принимавших эти препараты. В течение 2 лет наблюдения риск развития ВБП на фоне приема ИПП оказался на 80% выше: ОР 1,82; 95% ДИ: 1,27–2,54.
С другой стороны, возможно предположить, что риск ВБП у лиц, получающих ИПП, обусловлен не столько действием этих препаратов, сколько факторами, ставшими причиной их назначения. Это демонстрирует работа ученых из Великобритании, оценивших причины развития ВПБ у 160 000 пациентов, использовавших ИПП. Риск ВПБ оказался достоверно выше на фоне терапии ИПП, чем в группе контроля (ОР 1,67; 95% ДИ: 1,55–1,79), однако дальнейший анализ показал, что этот риск был максимальным за 30 дней до назначения ИПП (ОР 1,92; 95% ДИ: 1,84–2,00) [18].
В 2017 г. были опубликованы данные Дельфийского обсуждения проблемы нежелательных реакций, связанных с использованием ИПП в амбулаторной практике. Девять международных экспертов (Johnson D. et al.), участвовавших в совещании, пришли к выводу, что прием ИПП «по требованию» не представляет серьезной опасности с точки зрения возможных лекарственных осложнений, в том числе риска развития ВБП. По их мнению, единственные нежелательные явления на фоне приема этой группы препаратов, которые могут иметь клиническое значение, – это небольшое повышение частоты инфекционной диареи и бактериального перитонита, связанного с циррозом печени [19].
ИНГИБИТОРЫ ПРОТОННОЙ ПОМПЫ И COVID-19
Потенциальное негативное влияние ИПП на развитие ВБП заставило многих экспертов обратить внимание и на роль этих препаратов в развитии COVID-19. Ведь именно пневмония – центральное проявление тяжелой формы COVID-19, а острый респираторный дистресс-синдром (ОРДС), связанный с «цитокиновым штормом», и вторичные бактериальные осложнения становятся основными причинами гибели пациентов с этим заболеванием.
Имеющиеся на сегодняшний день данные указывают на серьезность обсуждаемой проблемы. Так, Almario С. et al. [20] провели анализ инфицирования SARS-CoV-2 (выявления положительного теста) среди 53 130 жителей США. Тест на COVID-19 был положительным у 3386 пациентов (6,4%). Оказалось, что прием ИПП ассоциировался со значительным повышением риска инфицирования: так, при использовании средств этой группы 1 раз в день ОР составил 2,15 (95% ДИ: 1,90–2,44), 2 раза в день – 3,67 (95% ДИ: 2,93–4,60).
Корейские исследователи Lee S. et al. [21] наблюдали когорту из 132 316 пациентов, которым был проведен тест на COVID-19. 14 163 из них принимали ИПП на момент теста, еще 6242 получали эти препараты ранее. Было показано, что использование ИПП, текущее или анамнестическое, не влияло на риск заражения SARS-CoV-2. Однако текущий прием ИПП значительно (на 79%) увеличивал вероятность серьезного клинического исхода у людей с подтвержденным COVID-19. У лиц, которые принимали ИПП ранее (но не получали их на момент заражения), течение болезни не отличалось от пациентов, не использовавших данный класс лекарств.
В работе Luxenburger H. et al. [22] оценивалось течение COVID-19 у 62 больных, принимавших ИПП на момент подтверждения инфекции, и 90 больных, не получавших эти препараты. Было показано, что ОРДС достоверно чаще развивался у лиц, принимавших ИПП, чем в контроле: 18,4 и 12,2% соответственно (р=0,02). Аналогичные различия были отмечены также в отношении вторичных инфекций и индекса летальности: 31,6 и 20% (p <0,001) и 11,2 и 5,6% (p=0,01). Эти данные выглядят особенно тревожными в свете того, что, по мнению авторов этого исследования, 48,4% больных получали ИПП без наличия четких показаний.
В работе Ramachandran P. et al. [23], представляющей анализ течения COVID-19 у 295 госпитализированных больных, было продемонстрировано, что предшествовавший заболеванию прием ИПП (у 15,6% обследованных лиц) ассоциировался с повышением риска летального исхода в 2,3 раза.
Ученые из Великобритании McKeigue Р. et al. [24], используя национальную базу данных Шотландии REACT-SCOT, проследили когорту из 4272 больных с тяжелым течением COVID-19. Проведенный анализ показал, что развитие тяжелой формы этого заболевания ассоциировалось с предшествующим приемом ряда лекарств, включая ИПП: ОР 2,19 (95% ДИ: 1,70–2,80).
В конце 2020 г. Le G.-F. et al. [25] представили метаанализ 6 исследований (n=318 261), в которых также оценивалось влияние приема ИПП на течение COVID-19. Согласно проведенным расчетам, у лиц, получавших эту группу антисекреторных средств, риск инфицирования SARS-CoV-2 был недостоверно выше по сравнению с теми, кто не применял ИПП: ОР 1,33; 95% ДИ: 0,86–2,07; p=0,20. В то же время регулярное или текущее использование ИПП ассоциировалось с большим риском тяжелого течения COVID-19: ОР 1,67; 95% ДИ: 1,19–2,33; p=0,003.
Аналогичные результаты были получены Hariyanto Т. et al. [26], которые выполнили метаанализ 6 исследований (n=5884). Риск тяжелого течения COVID-19 был достоверно выше у лиц, принимавших ИПП: ОР 1,35; 95% ДИ: 1,11–1,63; p=0,003.
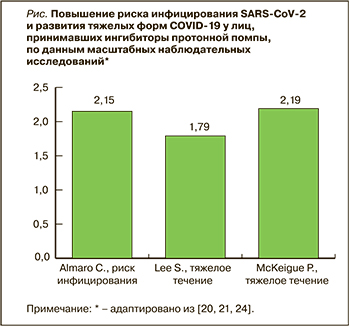 Таким образом, данные серии когортных наблюдательных исследований, выполненных в разных странах мира, демонстрируют ассоциацию между использованием ИПП и развитием COVID-19 (рис.). Тем не менее вопрос о причинно-следственной связи остается открытым: виноваты ли в повышении риска инфицирования SARS-CoV-2 и развития тяжелых форм COVID-19 сами ИПП или же это влияние той патологии, которая была причиной назначения данных препаратов? Следует также учесть, что все приведенные выше работы являются ретроспективными и гетерогенными, что в определенной степени снижает значимость их результатов [27].
Таким образом, данные серии когортных наблюдательных исследований, выполненных в разных странах мира, демонстрируют ассоциацию между использованием ИПП и развитием COVID-19 (рис.). Тем не менее вопрос о причинно-следственной связи остается открытым: виноваты ли в повышении риска инфицирования SARS-CoV-2 и развития тяжелых форм COVID-19 сами ИПП или же это влияние той патологии, которая была причиной назначения данных препаратов? Следует также учесть, что все приведенные выше работы являются ретроспективными и гетерогенными, что в определенной степени снижает значимость их результатов [27].
С другой стороны, следует учитывать, что использование ИПП жизненно необходимо для многих пациентов с COVID-19. При этой инфекции отмечается иммуноопосредованная коагулопатия, играющая центральную роль в развитии ОРДС и тромбоэмболических осложнений. Поэтому больные с тяжелым течением COVID-19 получают антикоагулянты, такие как низкомолекулярные гепарины и новые оральные антикоагулянты. Применение антикоагулянтов существенно повышает опасность развития кровотечений из желудочно-кишечного тракта (ЖКТ), особенно если пациенты имеют такие факторы риска, как пожилой возраст, язвенный анамнез, инфекция H. pylori, прием НПВП и ГК. В этом случае использование ИПП будет однозначно показано, поскольку позволит значительно уменьшить вероятность развития фатального кровотечения [28, 29].
Кроме этого, очевидно, что у многих больных прием ИПП не может быть прекращен даже во время пандемии COVID-19. Это касается пациентов, получающих данные препараты в связи с осложненными формами ГЭРБ, для лечения язвенной болезни, профилактики НПВП-гастропатии (при невозможности прервать прием НПВП), а также профилактики «больших» ЖКТ-кровотечений на фоне антитромботической и антикоагулянтной терапии (кардиологические пациенты, больные после серьезных травм, больших ортопедических операций и др.). Разумеется, необходимость профилактики конкретных, угрожающих жизни ЖКТ-осложнений в таких клинических ситуациях должна перевешивать соображения о вероятном негативном влиянии ИПП на развитие COVID-19 [30].
Безусловно, в настоящее время ИПП следует назначать только по четким показаниям. Это особенно важно в связи с тем, что многие пациенты (от 25 до 70%) получают эти антисекреторные средства без особой необходимости. Именно поэтому ИПП являются одним из объектов международных программ депрескрайбинга – планомерного, контролируемого врачом процесса уменьшения дозировки или полной отмены препаратов, которые не приносят конкретной пользы, но могут вызывать серьезные нежелательные реакции [31, 32].
ЗАКЛЮЧЕНИЕ
Прием ИПП может сопровождаться развитием ряда нежелательных явлений, в том числе ВБП. По последним данным, использование этих препаратов ассоциируется с повышенным риском развития тяжелых форм COVID-19. Тем не менее ИПП жизненно необходимы для лечения кислотозависимых заболеваний и профилактики ЖКТ-кровотечений, связанных с приемом НПВП, антитромботических и антикоагулянтных средств. Поэтому в период пандемии COVID-19 необходимо с особым вниманием относится к назначению ИПП, используя эти препараты по четким показаниям и избегая их рутинного нецелевого приема.


