Оказание медицинской помощи в период пандемии коронавирусной инфекции SARS-CoV-2 обнаружило новые задачи, связанные с дифференциальной диагностикой у больных сердечно-сосудистыми заболеваниями. Это связано с тем, что заражение коронавирусом может провоцировать декомпенсацию имеющейся у пациента болезни сердца, при этом наличие хронического сердечно-сосудистого заболевания значительно осложняет течение COVID-19. Типичные клинические проявления коронавирусной инфекции включают лихорадку, кашель, миалгию, одышку с частым прогрессированием в пневмонию [1]. Однако у ряда пациентов, госпитализируемых с COVID-19, определяются признаки поражения сердца – боли в грудной клетке, гипотензия, аритмия, признаки сердечной недостаточности, изменения на электрокардиограмме [2–4].
При заражении SARS-CoV-2 его белок S (spike glycoprotein) прикрепляется к рецепторам клетки-хозяина, которыми служат рецепторы ангиотензинпревращающего фермента 2, содержащиеся в легочной ткани, миокарде, эпителиоцитах почек, эндотелии сосудов, клетках пищевода, кишечника, мочевого пузыря, в центральной нервной системе [5]. Патогенез органных поражений при этом может быть обусловлен тремя группами факторов:
- непосредственным повреждающим действием вируса на тропные клетки;
- «цитокиновым штормом», обеспечивающим воспалительную реакцию тканей и коагулопатию;
- нарушением свертывания крови вследствие повреждения эндотелия сосудов и клеток печени с развитием тромбозов и кровоизлияний [6].
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент М., 56 лет, поступил в отделение кардиологии Клинической больницы № 6 им. Г.А. Захарьина (г. Москва) с жалобами на одышку в покое, общую слабость, тяжесть в области сердца. В анамнезе артериальная гипертензия (АГ) в около 10 лет. Ранее наблюдалось повышение систолического давления (САД) до 180 мм рт.ст., диастолического (ДАД) – до 100 мм рт.ст. Пациент регулярно в плановом порядке принимал антигипертензивные препараты, привычное АД около 130/80 мм рт.ст. Отмечал ухудшение самочувствия в течение 4 сут, когда стали немотивированно нарастать слабость и одышка, позже появилась тяжесть в области сердца. Контакт с больными COVID-19 отрицал, температура тела не повышалась.
При осмотре состояние средней степени тяжести. Сознание ясное, несколько заторможен в ответах, ориентирован. Лицо симметричное. Зрачки D=S. В легких перкуторно над всеми легочными полями ясный легочный звук, дыхание везикулярное, хрипов нет. Частота дыхательных движений (ЧДД) в покое 18/мин. Тоны сердца приглушены, ритмичные. Частота сердечных сокращений (ЧСС) 100/мин, пульс 100/мин, АД 140/80 мм рт.ст. Язык обложен белым налетом, сухой. Живот симметричный, участвует в акте дыхания, при пальпации мягкий, безболезненный. Печень не увеличена. Мочеиспускание свободное, безболезненное.
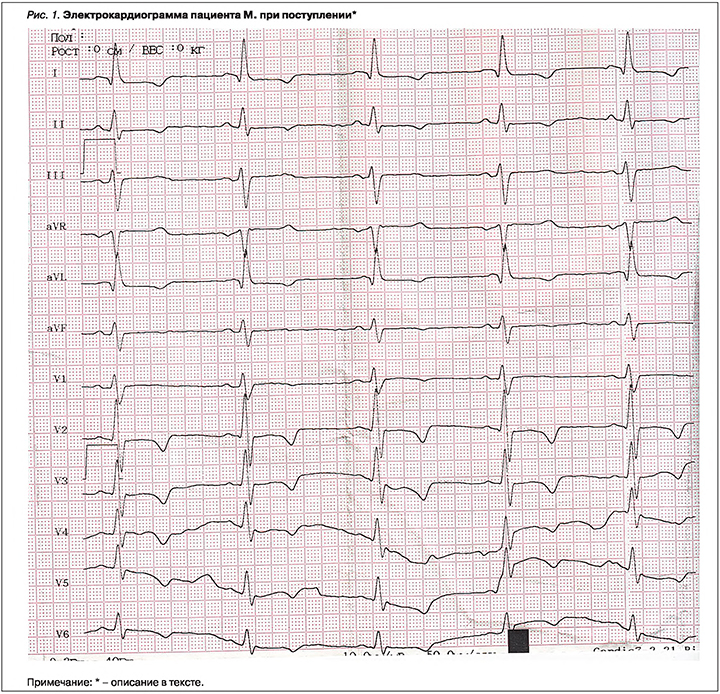
Электрокардиография (ЭКГ) при поступлении (рис. 1): ритм синусовый, ЧСС 79/мин, в V1 зубец Р с преобладанием положительной фазы, в V1 r=s (4 мм), отрицательный зубец Т I, II, AVL, V2–V6, депрессия сегмента ST (горизонтальная, до 1,5–2 мм) в отведениях I, II, AVL, V2-V3, возможно, в V4–V6 (не качественная запись отведений). Больной был госпитализирован в отделение интенсивной терапии с подозрением на острый коронарный синдром без подъема сегмента ST (ОКСбпST). В день поступления регистрировался пароксизм фибрилляции предсердий, купированный внутривенным введением пропафенона, в последующем выявлялась единичная наджелудочковая экстрасистолия по данным мониторирования ЭКГ. Со слов пациента, ранее на ЭКГ выявляли изменения зубца Т, архив ЭКГ не сохранился.
Данные анализов крови: гемоглобин – 121 г/л; эритроциты – 4,2×1012/л; лейкоциты – 11,5×109/л; тромбоциты – 201×109/л; скорость оседания эритроцитов (СОЭ) – 54 мм/ч; глюкоза – 5,6 ммоль/л; креатинин – 59 мкмоль/л; билирубин общий – 13,6 мкмоль/л, аланинаминотрансфераза (АЛТ) – 36,9 ед./л; аспартатаминотрансфераза (АСТ) – 36,4 ед./л; С-реактивный белок (СРБ) – 119 мг/л; протромбиновый индекс – 94%; фибриноген – 6,3 г/л; активированное частичное тромбопластиновое время (АЧТВ) – 36 с; международное нормированное отношение (МНО) – 1,07; D-димер – 1000 нг/мл; тропонины – 0,008 нг/мл.
Данные инструментальных исследований: эхокардиография (ЭхоКГ) – гипертрофия стенок левого желудочка, диастолическая дисфункция левого желудочка по I типу, митральная регургитация 1 степени, трикуспидальная регургитация 2 степени, дилатация ствола легочной артерии, легочная гипертензия (систолическое давление в легочной артерии 44 мм рт.ст.).
Дуплексное сканирование вен нижних конечностей: окклюзирующий тромб задних большеберцовых вен, подколенной вены слева без признаков флотации верхушки тромба. Компьютерная томография (КТ) органов грудной полости (рис. 2): в обоих легких, мультилобарно – зоны «матового стекла» с консолидацией, ретикулярные изменения. Процент поражения легочной ткани справа и слева около 60%. Множественные разнокалиберные буллы в обоих легких. Трахеи, бронхи проходимы. Средостение расположено обычно, не расширено. Свободной жидкости в плевральных полостях не выявлено. Внутригрудные лимфатические узлы (ВГЛУ) не увеличены. Кальцинированные атеросклеротические бляшки в стенках аорты и коронарных артерий.
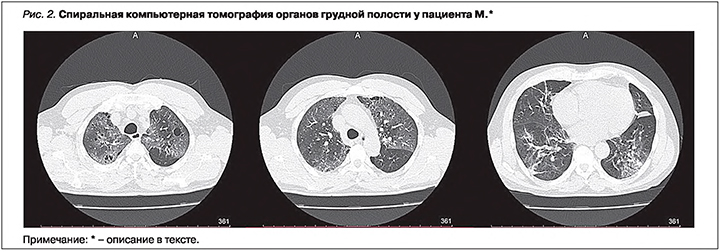
Заключение: МСКТ-картина типичной вирусной (в том числе COVID-19) пневмонии. Степень тяжести КТ – 3.
Больному проводилось лечение нитратами, дезагрегантами, антикоагулянтами, антигипертензивными средствами, статинами, симптоматическая терапия.
При поступлении у больного были взяты мазок из носоглотки для лабораторного теста на коронавирусную инфекцию SARS-CoV-2 и сыворотка крови для определения уровня антител к коронавирусу SARS- CoV-2. Определение РНК коронавируса SARS- CoV-2 в мазках со слизистой оболочки носоглотки методом полимеразной цепной реакции (ПЦР): РНК обнаружена. Достоверное повышение уровня антител класса IgM обнаружено, IgG не обнаружено.
По получении данных результатов больной на следующий день с целью дальнейшего лечения был консультирован пульмонологом и переведен в лечебное учреждение, оказывающее медицинскую помощь пациентам с новой коронавирусной инфекцией (СОVID-19).
ОБСУЖДЕНИЕ
Сложность диагностики в рассматриваемом клиническом случае состояла в отсутствии типичных проявлений коронавирусной инфекции и эпидемиологического анамнеза у больного с длительно протекающей АГ на фоне жалоб на тяжесть в области сердца и изменений на ЭКГ, которые были расценены как ОКС. Вместе с тем известно, что из-за системной инфекции в сочетании с нарастающей гипоксией повышается потребление кислорода миокардом, которое на фоне атеросклеротического поражения коронарных артерий и коагулопатии может спровоцировать ишемическое повреждение тканей сердца. Кроме того, электролитный дисбаланс (в частности, гипокалиемия), развивающийся в результате воздействия вируса на ренин-ангиотензин-альдостероновую систему, способен вызвать развитие аритмий [7]. Эти факторы могли вызвать у наблюдаемого больного клиническую картину декомпенсации сердечно-сосудистого заболевания с проявлениями ишемии миокарда, экстрасистолией и пароксизмом фибрилляции предсердий.
Не менее сложен вопрос, касающийся выявленного венозного тромбоза. С одной стороны, тромбоз задних большеберцовых вен с распространением на подколенную вену мог возникнуть у пациента независимо от заражения SARS-CoV-2 и вызвать симптомы тромбоэмболии легочной артерии, такие как одышка и боли в груди, а также изменения на ЭхоКГ – дилатацию легочной артерии и признаки легочной гипертензии [8]. Отметим, что данные признаки не исключают и возможного при COVID-19 микротромбоза мелких легочных артерий в результате локализованного внутрисосудистого свертывания [9]. Исследования, проводимые с анализом аутопсий пациентов с COVID- 19, показывают высокую степень встречаемости как тромбозов глубоких вен, так и тромбоэмболии легочной артерии [10–11]. Известно, что при коронавирусной инфекции могут реализовываться два разных патологических механизма нарушения свертываемости крови: локальное поражение эндотелия сосудов, приводящее к ангиопатии и формированию тромбов, и системная гиперкоагуляция и гиперфибриногенемия, также повышающая вероятность тромбозов и тромбоэмболических осложнений [12].
Развитие коагулопатии и синдрома диссеминированного внутрисосудистого свертывания служат предикторами тяжелого течения COVID-19. О нарушениях коагуляции могут свидетельствовать такие лабораторные признаки, как повышение концентрации D-димера и продуктов распада фибрина, умеренная тромбоцитопения, удлинение протромбинового времени, увеличение МНО [13–15].
У нашего пациента протромбиновый индекс, АЧТВ, МНО оставались в пределах референсных значений. Это может быть объяснено исследованиями Thachil J. et al. (2020) и Wang D. et al. (2020) [16–17], в которых указывалось, что данные показатели, в частности МНО, не улавливают сравнительно небольшие отклонения протромбинового времени и тромбинового отношения, возникающие при коронавирусной инфекции. При этом у больного обнаруживалось повышение уровня фибриногена, что, согласно ретроспективному исследованию Буланова А.Ю. с соавт. (2020) [18], выступает проявлением системного воспаления и в 14% случаев переходит впоследствии в гипофибриногенемию, предвещающую неблагоприятный исход у больных COVID-19. Высказывается мнение, что при коронавирусной инфекции уровень фибриногена вначале повышается как защитный ответ организма на воспаление, что находит отражение в среднем повышении D-димера без клинических признаков образования тромбов. Однако при продолжающемся воспалении система гемостаза отвечает системным тромбообразованием для ограничения распространения микроорганизмов или белков, ассоциированных с повреждениями. Это сопровождается значительным увеличением уровня D-димера, истощением тромбоцитарных гранул и уменьшением количества фибриногена [15]. Очевидно, что наблюдение за уровнем фибриногена и D-димера в динамике представляется очень важным для оценки состояния пациента при COVID-19.
Таким образом, повышение фибриногена, умеренный уровень D-димера и количество тромбоцитов в пределах референсных значений в рассматриваемом клиническом случае свидетельствуют о защитной реакции организма на воспаление и требуют дальнейшего наблюдения.
ЗАКЛЮЧЕНИЕ
Декомпенсация сердечно-сосудистых заболеваний может быть единственным проявлением заражения SARS-CoV-2, возникающим при отсутствии типичных признаков коронавирусной инфекции. Независимо от наличия классической симптоматики у больных COVID-19 могут развиваться ишемия миокарда, венозные тромбозы и тромбоэмбоэмболия легочной артерии, что значительно повышает риск неблагоприятного прогноза болезни.


