Среди наиболее интенсивно разрабатываемых в последние годы лекарственных средств на одно из первых мест выдвинулись противовирусные препараты. Вирусная инфекция является более трудной проблемой для химиотерапии, чем бактериальная. Сложность заключается в том, что вирусы паразитируют и размножаются внутри клетки организма-хозяина, перестраивая ее обмен веществ. Невозможно воздействовать на вирус, не затрагивая пораженную им клетку. Кроме того, вирусные заболевания могут быть связаны с пробуждением скрытых вирусов, которые какое-то время никак не проявляли себя в организме-хозяине. Очень часто вирусные инфекции развиваются на фоне снижения иммунной защиты организма, т.е. при различных состояниях иммунодефицита.
Иммунная система человека выполняет важную функцию по сохранению постоянства внутренней среды организма путем распознавания и элиминации из организма чужеродных веществ антигенной природы как эндогенно возникающих (клетки, измененные вирусами, ксенобиотиками, злокачественные клетки и т.д.), так и экзогенно проникающих (прежде всего микробы и вирусы). Эта функция осуществляется с помощью факторов врожденного и приобретенного иммунитета: к первым относятся нейтрофилы, моноциты/макрофаги, дендритные клетки, NК- и Т-NК-лимфоциты, ко вторым – Т- и В-клетки, ответственные за клеточный и гуморальный ответ [1–3]. При нарушении количества и функциональной активности клеток иммунной системы развиваются заболевания иммунитета: иммунодефициты, аллергические, аутоиммунные, аутовоспалительные, лимфопролиферативные процессы. Их лечение проводится с помощью комплекса методов иммунотерапии, один из которых – применение иммунотропных лекарственных препаратов.
К современным средствам с иммунотропными свойствами следует отнести прежде всего интерфероны (ИФН) и индукторы ИФН. Фармакологическое действие этих веществ проявляется и противовирусным эффектом. Надо отметить, что ИФН как составная часть общей цитокиновой системы организма отнесены еще и к иммунорегуляторным молекулам, оказывающим действие на все клетки иммунной системы [4–8].
Учение об ИФН сформировалось в конце XX в. в самостоятельный раздел биологии и медицины, названный интерферонологией. Дальнейшее их изучение отмечено пятью важнейшими событиями в интерферонологии:
- сформулировано понятие о системе ИФН и обнаружены ее прямые и обратные связи с иммунной и нейроэндокринной системами;
- доказана множественность генов ИФН (не менее 20 в клетках человека) и системный мультивалентный диапазон их действия;
- разработана методология оценки интерферонового статуса организма, позволяющая определять роль и место системы ИФН на популяционном уровне;
- получен ряд клинически перспективных оригинальных индукторов ИФН;
- в основном определены показания и противопоказания к клиническому использованию ИФН и их индукторов при вирусных и невирусных заболеваниях.
ИФН стали рассматривать как одни из наиболее изученных классов медиаторов иммунитета (цитокинов), обладающих широчайшим спектром биологической активности. Академик РАН Ф.И. Ершов предложил следующее определение ИФН: «Интерфероны относятся к цитокинам (медиаторам иммунитета) и представлены семейством клеточных белков, обладающих антивирусной, иммуномодулирующей, противоопухолевой и другими видами активности, что позволяет отнести их к важнейшим факторам врожденного (естественного) “внутриклеточного” иммунитета, полифункциональным биорегуляторам широкого спектра действия и гомеостатическим агентам». В настоящее время известно, что целостное функционирование иммунной системы поддерживается слаженной работой многих компонентов [5, 6, 9].
Гуморальная составляющая межклеточных взаимодействий в иммунной системе опосредуется продуктами взаимодействующих клеток – цитокинами. Это белковые или полипептидные продукты активированных клеток иммунной системы, которые выступают медиаторами межклеточных коммуникаций при иммунном ответе, гемопоэзе и развитии воспаления, эффекторами некоторых реакций иммунитета, и служат связующим звеном между иммунной и другими системами организма. Значение цитокинов существенно выходит за рамки иммунологии, поскольку они играют важную роль в кроветворении, развитии патологии и т.д. [3, 10, 11].
Наряду с ИФН к цитокинам относятся интерлейкины (ИЛ), хемокины, факторы некроза опухоли (ФНО), колониестимулирующие факторы (КСФ), факторы роста. Они действуют по эстафетному принципу: воздействие цитокина на клетку вызывает образование ею других цитокинов (цитокиновый каскад) [1, 3].
Различают интракринный, аутокринный, паракринный и эндокринный механизмы действия цитокинов.
1. Интракринный механизм – действие цитокинов внутри клетки-продуцента; связывание цитокинов со специфическими внутриклеточными рецепторами.
2. Аутокринный механизм – действие секретируемого цитокина на саму секретирующую клетку. Например, ИЛ-1, ИЛ-6, ИЛ-18, ФНО-α являются аутокринными активирующими факторами для моноцитов/макрофагов.
3. Паракринный механизм – действие цитокинов на близко расположенные клетки и ткани. Например, ИЛ-1, ИЛ-6, ИЛ-12, ИЛ-18, ФНО- α, продуцируемые макрофагом, активируют Т-хелпер (Th0), распознающий антиген, и главный комплекс гистосовместимости (МНС) макрофага (рис.).
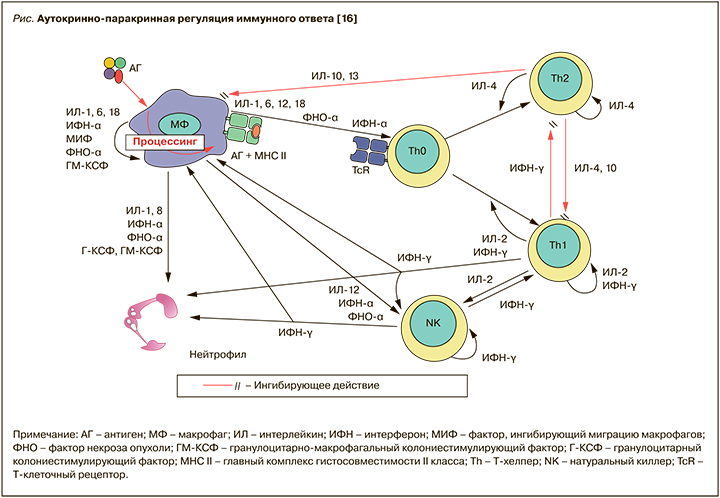
4. Эндокринный механизм – действие цитокинов на расстоянии от клеток-продуцентов. Например, ИЛ-1, ИЛ-6 и ФНО-α, помимо ауто- и паракринных воздействий, могут оказывать дистантное иммунорегуляторное действие, пирогенный эффект, индукцию выработки белков острой фазы гепатоцитами, вызывать симптомы интоксикации и мультиорганные поражения при токсикосептических состояниях.
Интерлейкины (ИЛ) – цитокины, ответственные за межклеточные взаимодействия между лейкоцитами. Описано около 20 видов ИЛ.
Факторы некроза опухоли. Различают собственно фактор некроза опухоли (ФНО), или ФНО-α, и лимфотоксины, или ФНО-β. ФНО-α продуцируется макрофагами, а также тучными клетками и лимфоцитами. Он обусловливает развитие токсического шока и кахексии (старое название «кахектин»), индуцирует острофазные белки и стимулирует ангиогенез. ФНО-α может индуцировать апоптоз, способен вызывать геморрагический некроз ряда опухолей. ФНО-β продуцируется Т- и В-лимфоцитами и обладает аналогичным действием.
ИФН – гликопротеины, вырабатываемые клетками в ответ на вирусную инфекцию и другие стимулы. Они блокируют репликацию вируса и участвуют во взаимодействии между клетками иммунной системы. Различают две серологические группы ИФН: I типа – ИФН-α и -β; II типа – ИФН-γ. ИФН I типа оказывают противовирусное и противоопухолевое действие, в то время как ИФН II типа регулирует специфический иммунный ответ и неспецифическую резистентность.
ИФН-α и ИФН-β, отличаясь по структуре и клеткам-продуцентам, обладают практически одинаковым механизмом действия. В норме ИФН-α вырабатывается мононуклеарными фагоцитами (отсюда одно из названий – «лейкоцитарный ИФН»), а ИФН-β – фибробластами («фибробластный ИФН»). Под воздействием микроба они секретируются многими клетками, усиливают продукцию других ИФН, пирогенное действие ИЛ-1 и вызывают понижение рН в межклеточной жидкости на фоне повышения температуры. Защитное действие ИФН I типа реализуется посредством ингибирования репликации РНК или ДНК под воздействием олигоаденилат-синтетазы, которую продуцируют интерферонсодержащие клетки. Связываясь со здоровыми клетками, ИФН I типа защищает их от вирусов. Антивирусное действие этого типа ИФН может объясняться и тем, что он способен угнетать клеточную пролиферацию, препятствуя синтезу аминокислот, например триптофана. Этот механизм, а также способность индуцировать программированную клеточную гибель некоторых опухолей лежат в основе противоопухолевого действия ИФН I типа.
ИФН-γ («иммунный ИФН») продуцируется Т-лимфоцитами и NK, стимулирует активность Т- и В-лимфоцитов, моноцитов/макрофагов и нейтрофилов, усиливает экспрессию молекул МНС I, МНС II и стимулирует дифференцировку Th0 в Thl. «Иммунный ИФН» вместе со своим антагонистом ИЛ-4 поддерживает баланс Thl/Th2. Помимо этого, ИФН-γ регулирует апоптоз целого ряда нормальных, а также некоторых инфицированных и трансформированных клеток. Так, он индуцирует программированную клеточную гибель активированных макрофагов, кератиноцитов, гепатоцитов, клеток костного мозга, эндотелиоцитов и подавляет апоптоз периферических моноцитов и герпес-инфицированных нейронов.
Хемокины – низкомолекулярные цитокины, ответственные за хемотаксис клеток (привлекают в очаг воспаления лимфоциты и лейкоциты).
В здоровом состоянии в организме синтезируются как провоспалительные, так и противовоспалительные (цитозащитные) цитокины, и в нормальных условиях их содержание сбалансированно; это обеспечивает адекватный иммунный ответ на антигенное раздражение. Группу цитокинов с провоспалительным действием составляют ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-18, ФНО-α, ИНФ- γ. К противовоспалительным и регуляторным цитокинам относятся ИЛ-4, ИЛ-10, ИЛ-11, эндогенные антагонисты рецепторов ИЛ-1, растворимые рецепторы ФНО-α I и II типа. При воспалении возникает дисбаланс цитокинов с преобладанием провоспалительных медиаторов.
В воспалительном каскаде активируются как центральное звено воспаления – презентация антигенов и Т-клеточная стимуляция, так и периферические реакции, включающие синтез провоспалительных цитокинов и других сигнальных молекул, миграцию клеточных элементов в зону воспаления и сосудистые изменения. Селективная активация субпопуляций Т-лимфоцитов CD4+ (Тh1 и Th2) выступает существенным звеном в нарушениях клеточно-опосредованного иммунитета [8, 11]. Первые опосредуют воспалительные и цитотоксические реакции, вторые обеспечивают антителообразование и торможение функций Тh1. Характер иммунного ответа при том или ином заболевании зависит, как полагают, от преимущественной активации Тh1 или Тh2.
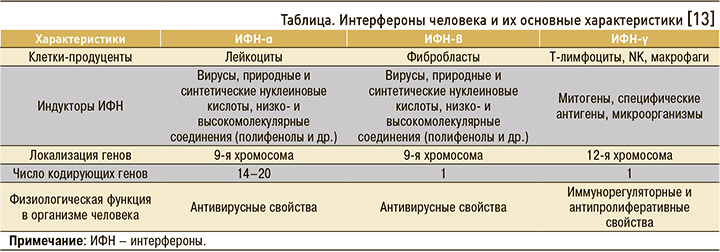
Индукторы ИФН относятся к новому поколению лекарственных средств, вызывающих в организме человека образование собственных (эндогенных) ИФН-α, ИФН-β, ИФН-γ [9] (табл.). В свою очередь, сами ИФН – это цитокины, которые служат важнейшими естественными факторами устойчивости (неспецифической резистентности) организма, обеспечивая антивирусную защиту, а также регуляцию дифференцировки, роста и размножения клеток. Антивирусные свойства в большей степени выражены у ИФН-α и ИФН-β, а иммунорегуляторные и антипролиферативные – у ИФН-γ. Важно, что система ИФН существенно опережает во времени специфический иммунный ответ.
Образование эндогенного ИФН – более физиологичный процесс, чем постоянное введение больших доз ИФН, которые к тому же быстро выводятся из организма и угнетают образование аутологичных ИФН по принципу отрицательной обратной связи. Универсальность системы ИФН заключается в том, что основные механизмы противовирусного действия ИФН осуществляются путем влияния на регуляцию синтеза нуклеиновых кислот. При этом происходит активация ферментов и ингибиторов, блокирующих трансляцию вирусных нуклеиновых кислот (иРНК), т.е. блокирование синтеза вирус-специфических белков и репликации вируса, активация нуклеаз, разрушающих свободные (вирусные) нуклеиновые кислоты, и в итоге предотвращение инфицирования вирусами здоровых клеток.
К сожалению, препараты высокодозированных рекомбинатных ИФН не лишены побочных эффектов, к которым относятся формирование антиинтерфероновых антител (гиперчувствительность); гриппоподобный синдром (лихорадка, озноб, потливость, слабость, утомляемость, астения, миалгии, артралгии, головные боли); транзиторная гипо- и гипертензия, отечность, цианоз, аритмии, стенокардия; лейко- и тромбоцитопения, анемия; диспепсические явления (потеря аппетита, тошнота, рвота, боли в кишечнике, усиление моторики, метеоризм, изжога); кожные высыпания, зуд, экзантема, крапивница, выпадение волос, сухость кожных покровов; судорожный синдром, галлюцинации, головокружение, депрессия, нарушения церебральных функций, парестезии, нейропатии, тремор, потеря чувствительности; протеинурия, альбуминурия, редко повышение уровня мочевины, креатинина, мочевой кислоты в плазме крови [9, 14].
Фармакологические препараты из группы индукторов ИФН отличает лучшая переносимость. Их прием не приводит к образованию в организме антител к ИФН, они слабо аллергенны, вызывают пролонгированную продукцию эндогенного ИФН в физиологических дозах, достаточных для достижения терапевтических и профилактических эффектов [1]. Этот класс соединений стимулирует нейтрофилы периферической крови, увеличивая их противовоспалительный потенциал и возможность генерации активных форм кислорода, чем повышает бактерицидные свойства крови. Это особенно важно при широко распространенных смешанных (вирусно-бактериальных) инфекциях [6, 15].
Еще один аспект оптимизации противовирусных возможностей организма представлен поддержкой реакций адаптации, которые направлены на приспособление организма к меняющимся условиям существования. Влияние окружающей среды на человека складывается из ряда различного рода непрерывных воздействий, и, чтобы поддерживать постоянство внутренней среды, наш организм отвечает на это неспецифическими и специфическими изменениями. Интегральные регуляторные системы функционируют в тесной взаимосвязи и выступают компонентами адаптации организма. К ним относятся способность переносить стресс, увеличивать физические и умственные нагрузки, приспосабливаться к новым климатическим условиям, повышенному загрязнению окружающей среды и другим неблагоприятным факторам. За счет возрастания концентрации гормонов, повышения интенсивности обмена веществ мобилизуются функциональные резервы клеток. Метаболические адаптационные процессы в организме осуществляются на различных уровнях и имеют универсальный характер. Молекулярной основной адаптации признаны процессы липопероксидации мембран [15]. В результате лучше переносится недостаток кислорода, повышается устойчивость организма к действию болезнетворных микробов и т.д.
Пределы адаптации у каждого человека различны и обусловлены его наследственностью, возрастом, состоянием здоровья и степенью тренированности. Природой у человека заложены высокие способности приспособления к постоянно меняющимся условиям существования. Вместе с тем они не безграничны, и при одновременном воздействии многих неблагоприятных факторов этих способностей становится недостаточно. К адаптогенам относят лекарственные средства, которые повышают неспецифическую устойчивость организма к неблагоприятным воздействиям внешней среды. Все большее распространение среди них получают средства природного и синтетического происхождения. В результате их использования снижается утомляемость, повышается физическая и умственная работоспособность, нормализуются нарушения сна и другие признаки астении, ускоряются процессы восстановления. Эти препараты увеличивают интенсивность обмена веществ, защищают высшие центры нервной и эндокринной и иммунной регуляции от истощения при экстремальных воздействиях.
Трекрезан (оксиэтиламмония метилфеноксиацетата) относится к группе адаптогенных препаратов с противовирусной активностью. Он опосредованно стимулирует выработку α- и γ-интерферонов, что определяет спектр его фармакологической активности (иммуностимулирующей, адаптогенной) [10]. Обладая выраженным мембраностабилизирующим действием, являясь ингибитором перекисного окисления липидов, свободного дыхания в митохондриях, трекрезан нормализует функции регуляторных систем – нейроэндокринной, гуморальной, иммунной [15].
Динамика перекисного окисления липидов в экспериментальных работах свидетельствует о влиянии трекрезана на изменение синтеза «традиционных» макроэргических соединений, таких как АТФ и НАД, с увеличением синтеза РНК как одного из макроэргов, что особенно необходимо в условиях нарушения структуры тканей. При этом уменьшается интенсивность дыхания в митохондриях, ведущая к переходу процессов биологического окисления с гексозного пути на пентозный, бескислородный путь, одним из сопряженных звеньев которого является образование макроэргов [15].
Антистрессовое действие трекрезана объясняется минимизацией потребления кислорода в дыхательной цепи митохондрий, а также ингибированием в них процессов ферментативного и перекисного окисления липидов. Активация перекисного окисления липидов служит универсальным механизмом повреждения биологических мембран независимо от характера пускового механизма (воспаление, эндотоксикоз, интоксикация ядами и др.). За счет наличия в структуре трекрезана триоксиэтиламмониновой группы препарат обладает способностью перехватывать свободные радикалы, вследствие чего предупреждается истощение эндогенных антиоксидантов и модифицируетcя функция супероксиддисмутазы, которая вступает в конкурентные взаимоотношения с препаратом. Не исключается ингибирование цитохромоксидаз под действием трекрезана, так как в работах in vitro показано возрастание содержания цитохрома Р450 в гепатоцитах при его применении. Следовательно, можно допустить, что трекрезан является индуктором цитохромов [15].
С учетом вышесказанного можно заключить, что трекрезан активно влияет на процессы биологического окисления, оказывает антиоксидантное и мембраностабилизирующее действие, улучшает работу клеток гуморальной, иммунной, эндокринной и других систем. Универсальность и многогранность воздействия на различные звенья процессов свободно-радикального окисления и состояние системы антиоксидантной защиты организма определяют фармакологические эффекты препарата, которые проявляются в увеличении выносливости при физических и умственных нагрузках, уменьшении действия различных токсинов, повышении устойчивости организма к гипоксии, низким и высоким температурам, вирусным и бактериальным интервенциям [10].
Влияние трекрезана на иммунный статус организма складывается из активации клеточного и гуморального звеньев иммунитета, повышения фагоцитарной активности макрофагов и стимуляции выработки ИФН, как быстрой ранней в течение 6 ч (ИФН-α), так и длительной до 72 ч (ИФН-γ) [10, 16]. Как иммуномодулятор, трекрезан обладает протективным эффектом в отношении Т-клеточного звена иммунитета, прямым стимулирующим влиянием на пролиферацию В-клеток, тем самым стимулируя гуморальный иммунный ответ. Выраженное активирующее действием препарата на образование антител сочетается с влиянием на функции существующих лимфоцитов, а не со стимуляцией появления новых, функционально незрелых лимфоидных клеток. Низкая скорость гидролиза и молекулярная масса трекрезана позволяют считать, что его молекула проникает внутрь клетки и может действовать как в виде отдельных фрагментов, так и в целом [10].
Согласно имеющимся данным [10, 15], оксиэтиламмония метилфеноксиацетат характеризуется высокой биодоступностью, быстро метаболизируется в печени, выделяясь почками преимущественно в виде глюкуронидов, не кумулирует в организме при длительном применении. У лиц пожилого возраста, детей 12–18 лет, пациентов с почечной и печеночной недостаточностью фармакокинетика оксиэтиламмония метилфеноксиацетата существенно не меняется. Трекрезан применяется в составе комплексной профилактики и лечении острых респираторных вирусных инфекций, для повышения устойчивости организма к различным стрессовым воздействиям (гипоксия, переохлаждение) и неблагоприятным воздействиям окружающей среды (резкая смена климатических условий, адаптации к перепадам атмосферного давления).
Трекрезан хорошо сочетается с антибиотиками, химиотерапевтическими и другими средствами. Комбинированное применение трекрезана с указанными группами лекарств приводит к синергичному эффекту [17]. Препарат имеет ряд преимуществ по сравнению с другими медикаментами: хорошую результативность, удобство применения, отсутствие побочных реакций, клинически значимый противовирусный эффект.
В текущих условиях распространения новой коронавирусной инфекции и ограниченности доказательной базы по ее лечению использование препаратов в режиме off-label (т.е. назначение тех или иных препаратов с медицинской целью вне показаний, содержащихся в официальных инструкциях по их применению) для оказания медицинской помощи пациентам с COVID-19 базируется на международных рекомендациях, а также согласованных экспертных мнениях, основанных на оценке степени пользы и риска при использовании терапии off-label [13, 18]. Согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), возможен прием off-label препаратов с предполагаемой этиотропной эффективностью, при этом их назначение должно соответствовать этическим нормам, рекомендованным ВОЗ, и осуществляться на основании Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств», Национального стандарта РФ ГОСТ Р ИСО 14155-2014 «Надлежащая клиническая практика», приказа Минздрава России от 01.04.2016 № 200н «Об утверждении правил надлежащей клинической практики» (зарегистрирован Министерством юстиции России 23 августа 2016 г., регистрационный № 43357), Хельсинкской декларации Всемирной медицинской ассоциации (ВМА) об этических принципах проведения исследований с участием человека в качестве субъекта, декларированных на 64 Генеральной ассамблее ВМА (Форталеза, Бразилия, 2013). Вышеуказанная практика оценки целесообразности применения лекарственных препаратов вне показаний, указанных в инструкции по медицинскому применению, является общепризнанной в мире [5]. Информация о случаях побочных эффектов, не указанных в инструкциях к лекарственным препаратам, серьезных нежелательных реакциях, непредвиденных нежелательных явлениях, особенностях взаимодействия препаратов с другими лекарственными средствами должна с передаваться в установленном порядке в Росздравнадзор [13, 18].
Таким образом, несмотря на бесспорные достижения, проблема лечения вирусных заболеваний далека от своего окончательного разрешения, в связи с чем она требует дальнейших широких исследований с привлечением специалистов многих дисциплин (клинических генетиков, экспертов по лабораторной диагностике, представителей фундаментальных и клинических дисциплин). Трекрезан, обладая интересным набором фармакологических характеристик, широтой терапевтического спектра, способен давать положительный клинический эффект при многих патологических состояниях, включая вирусные заболевания различной этиологии. Препарат может входить в арсенал лекарственных средств, предназначенных для расширения наших возможностей по оптимизации противовирусной защиты организма.


