Диагностика

1.
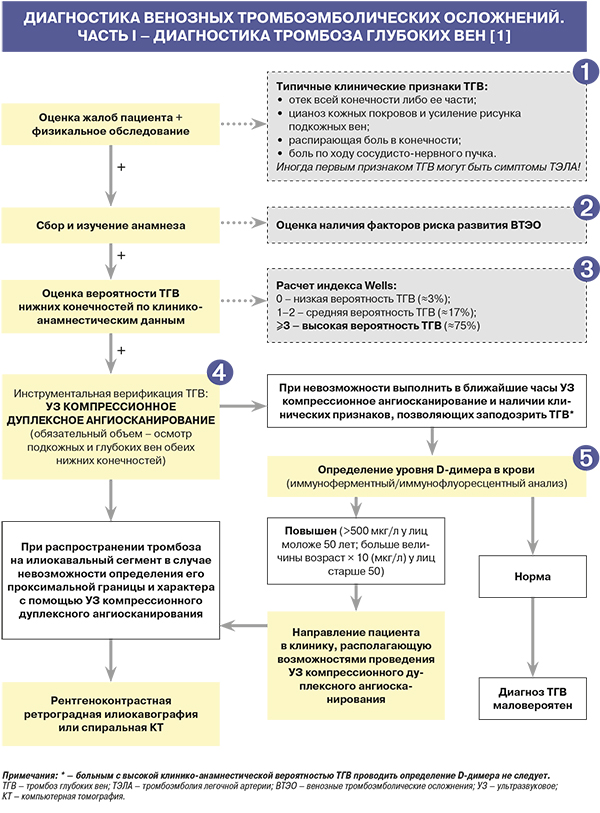
• Клинические проявления тромбоза глубоких вен (ТГВ) зависят от локализации тромбоза, распространенности и характера поражения венозного русла, а также длительности заболевания. В начальный период при неокклюзивных формах ТГВ клиническая симптоматика не выражена либо вовсе отсутствует [1].
• ТГВ в системе верхней полой вены характеризуется [1]:
- отеком верхней конечности;
- отеком лица, шеи;
- цианозом кожных покровов и усилением рисунка подкожных вен;
- распирающей болью в конечности.
2.
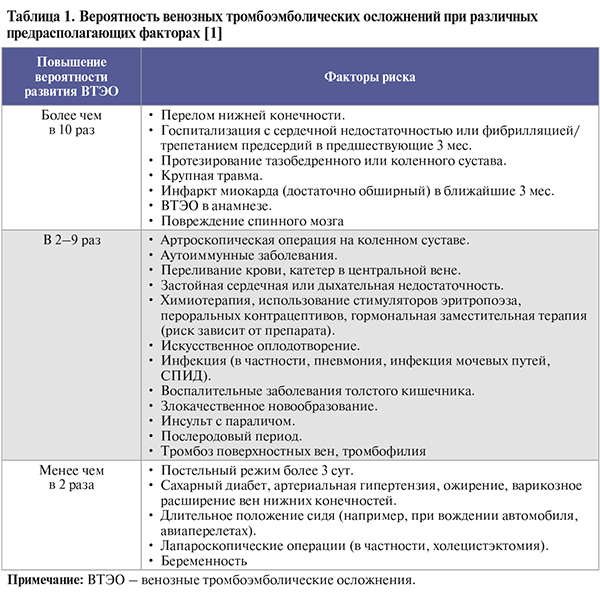
Ведущие факторы риска венозных тромбоэмболических осложнений (ВТЭО) и степень вероятности их развития отражены в таблице 1.
3.
Оценка вероятности ТГВ нижних конечностей по клиническим данным (индекс Wells) представлена в таблице 2. Только клинико-анамнестические данные не позволяют с уверенностью судить о наличии или отсутствии ТГВ, поэтому диагностический поиск должен также включать последующее лабораторное и инструментальное обследование.

4.
Ультразвуковое компрессионное дуплексное ангиосканирование – основной метод обследования при подозрении на венозный тромбоз. В обязательный объем исследования входит осмотр подкожных и глубоких вен обеих нижних конечностей, так как существует вероятность контралатерального тромбоза, который часто протекает бессимптомно. При наличии у пациента симптоматики тромбоэмболии легочной артерии (ТЭЛА) и отсутствии ультразвуковых признаков ТГВ магистральных вен конечностей, таза и нижней полой вены следует осмотреть гонадные, печеночные и почечные вены [1].
5.
• Повышенный уровень D-димера в крови свидетельствует об активно протекающих процессах тромбообразования, но не позволяет судить о локализации тромба. Наибольшую чувствительность (более 95%) обеспечивают количественные методы, основанные на иммуноферментном (ELISA) или иммунофлуоресцентном (ELFA) анализе. После развития тромбоза D-димер постепенно снижается и через 1–2 нед может нормализоваться [1].
• Метод определения уровня D-димера при подозрении на ТГВ имеет высокую чувствительность, но низкую специфичность. Повышенный уровень D-димера выявляют при многих состояниях, в том числе при опухолях, воспалении, инфекционном процессе, некрозе, после перенесенных хирургических вмешательств, во время беременности [1].
• Больным без каких-либо клинических признаков, позволяющих предположить наличие ТГВ, проводить определение уровня D-димера с целью скрининга не следует [1].
• Степень эмболоопасности венозного тромбоза определяется особенностями клинической ситуации. Решение о степени потенциальной угрозы для жизни больного принимает лечащий врач на основании комплексной оценки соматического статуса, особенностей тромботического процесса и данных ультразвукового ангиосканирования. При этом следует принимать во внимание время возникновения и локализацию тромба, его характер (подвижность в просвете вены), объем подвижной части и диаметр основания. Эмболоопасные тромбы располагаются в бедренной, подвздошных и нижней полой венах, длина их подвижной части обычно составляет не менее 7 см. Вместе с тем у больных с низким кардиопульмональным резервом вследствие сопутствующей патологии или предшествующей ТЭЛА реальную угрозу возникновения жизнеопасной эмболии могут представлять флотирующие тромбы меньших размеров [1].
6.
• Источником ТЭЛА в 90% случаев служат тромбы, локализующиеся в глубоких венах нижних конечностей, тазовых, почечных и нижней полой венах [1]. Тромботическое поражение правых отделов сердца и магистральных вен верхних конечностей крайне редко осложняются ТЭЛА [1].
• Эмболизация легочного артериального русла возникает при наличии флотирующего тромба, свободно расположенного в просвете вены и прикрепленного к венозной стенке лишь в зоне его основания. В зависимости от величины тромбоэмболов могут быть полностью или частично окклюзированы артерии различного калибра: от сегментарных ветвей до легочного ствола [1].
• Наличие и выраженность того или иного симптома ТЭЛА во многом определяются размерами, локализацией эмболов и исходным кардиореспираторным статусом пациента [1].
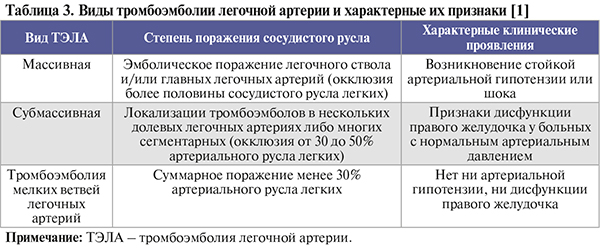
• По степени поражения сосудистого русла и клиническим признакам ТЭЛА может быть условно подразделена на три группы – массивная, субмассивная и тромбоэмболия мелких ветвей легочных артерий (табл. 3). Трудность клинической диагностики ТЭЛА заключается в том, что в половине случаев в момент развития эмболии (даже массивной) венозный тромбоз протекает бессимптомно, т.е. легочная эмболия служит первым проявлением ТГВ нижних конечностей или таза [1].
• Легочный инфаркт, который включает плевральные боли, кашель, кровохарканье, плевральный выпот и типичные треугольные тени на рентгенограмме, при ТЭЛА развивается не всегда. Он относится к поздним проявлениям эмболии периферических легочных артерий, появляясь через несколько дней (при рецидивирующем характере эмболии может регистрироваться и в случае массивной ТЭЛА) [1].
7.
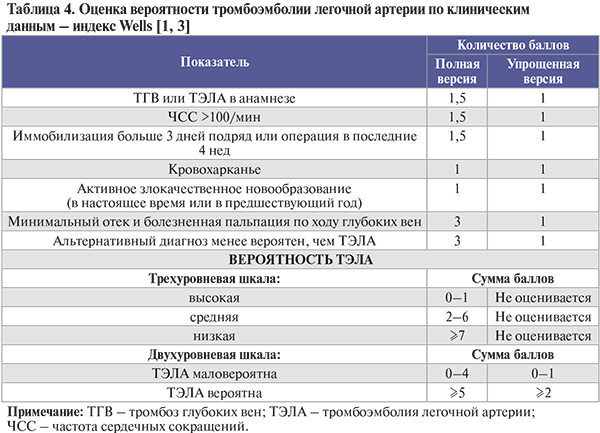
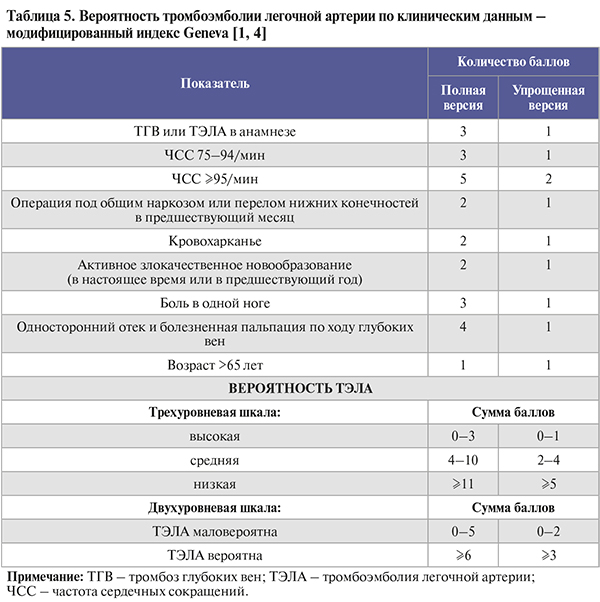
• Оценка вероятности ТЭЛА по клинико-анамнестическим данным (индексы Wells, Geneva) представлена в таблицах 4, 5. По клиническим данным нельзя с достаточной уверенностью ни подтвердить, ни отвергнуть наличие ТЭЛА, однако такая предварительная оценка необходима, чтобы надлежащим образом интерпретировать результаты инструментальной и лабораторной диагностики [1].
8.
• У больных с низкой или средней вероятностью ТЭЛА по клиническим данным нормальный уровень D-димера позволяет с большой надежностью исключить ТЭЛА. При этом следует использовать высокочувствительные количественные методы его определения в крови (ELISA или ELFA). Менее чувствительные тесты могут применяться для исключения ТЭЛА только у больных с низкой вероятностью заболевания по клиническим данным [1].
• У пожилых больных при наличии сопутствующей патологии, у беременных уровень D-димера в крови часто бывает повышенным и без ТЭЛА. Поэтому при выявлении высокого содержания D-димера необходимо использовать визуализирующие методы диагностики ТЭЛА [1].
• Из других лабораторных методов в рамках комплексного обследования на предмет ТЭЛА может использоваться оценка уровня мозгового натрийуретического пептида или N-концевого фрагмента его предшественника в крови (высокий уровень – показатель повышенной нагрузки на правый желудочек), а также сердечного тропонина (увеличение указывает на повреждение миокарда). Оба признака служат косвенными свидетельствами высокого давления в легочной артерии и не используются собственно для диагностики ТЭЛА. При этом они играют важную роль в оценке риска неблагоприятного исхода. Повышенный уровень сердечного тропонина характеризует тяжесть ТЭЛА и не может быть критерием для дифференциальной диагностики с инфарктом миокарда; отрицательный результат тропонинового теста полностью исключает инфаркт миокарда, но не ТЭЛА [1].
9.
• Спиральная компьютерная томография (КТ) с контрастированием легочных артерий является информативным и наиболее распространенным методом диагностики ТЭЛА. Она обладает широкими возможностями визуализации просвета легочных артерий, характера поражения сосудистого русла, выявления инфарктов легкого, а при одновременном выполнении нативного исследования легких – проведения дифференциального диагноза [1].
• Значение субсегментарных дефектов перфузии при спиральной КТ с контрастированием легочных артерий остается невыясненным; в подобных случаях возможно использование дополнительных методов диагностики ВТЭО. Выявление множественных субсегментарных дефектов перфузии легочных артерий и/или субсегментарные дефекты перфузии при высокой вероятности ВТЭО новообразованиями разумно рассматривать как основание для лечения антикоагулянтами [1].
10.
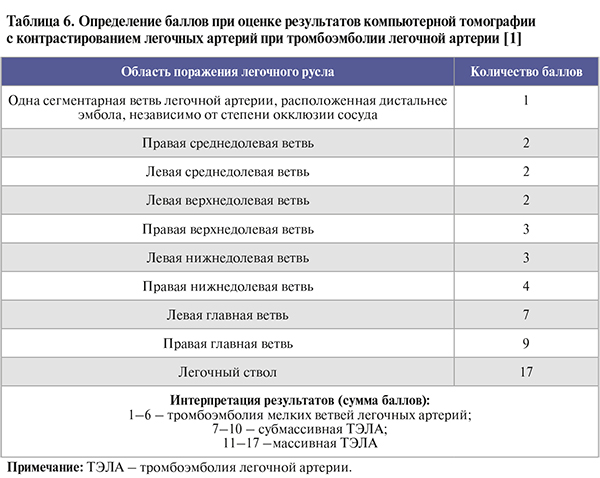
• Объем эмболического поражения и форму ТЭЛА по итогам спиральной КТ с контрастированием легочных артерий можно оценить в баллах (табл. 6).
• Оценка соотношения размеров правого и левого желудочков сердца при спиральной КТ с контрастированием легочных артерий позволяет оценить наличие гипертензии в малом круге кровообращения. Расширение области исследования дает возможность проводить диагностику ТГВ нижних конечностей [1].
11.
• К другим методам инструментальной верификации ТЭДА относятся компрессионная ультрасонография вен нижних конечностей, вентиляционноперфузионная сцинтиграфия легких, ангиопульмонография [1].
• При выполнении компрессионной ультрасонографии вен нижних конечностей выявление проксимального ТГВ у больных с подозрением на ТЭЛА свидетельствует в пользу наличия ТЭЛА. При выявлении дистального ТГВ необходимо дальнейшее обследование, поскольку ТГВ голени сравнительно редко становится источником ТЭЛА [1].
• Высокая вероятность ТЭЛА по результатам вентиляционно-перфузионной сцинтиграфии легких позволяет подтвердить диагноз, отсутствие нарушений легочной перфузии – исключить его. У больных с низкой и, возможно, средней вероятностью ТЭЛА по клиническим данным отвергнуть диагноз можно при отсутствии явных признаков ТЭЛА по результатам вентиляционно-перфузионной сцинтиграфии легких в сочетании с отсутствием проксимального ТГВ по данным компрессионной ультрасонографии вен нижних конечностей [1].
• Ангиопульмонография является наиболее информативным методом диагностики ТЭЛА. Она позволяет определить характер и объем эмболического поражения, оценить тяжесть гемодинамических расстройств. Ангиопульмонографию стоит использовать при несоответствии клинической картины и результатов неинвазивного обследования [1].
12.
Такие широко используемые методы инструментального исследования сердечнососудистой системы, как электрокардиография (ЭКГ), рентгенография органов грудной клетки, эхокардиография (ЭхоКГ), для подтверждения или исключения ТЭЛА не рекомендуются. Вместе с тем они необходимы для дифференциальной диагностики, обнаружения сопутствующей патологии и уточнения тяжести проявлений заболевания. Эхокардиография (ЭхоКГ) также используется для стратификации риска смерти у больных с ТЭЛА, подтвержденной другими методами [1].
Лечение
1.
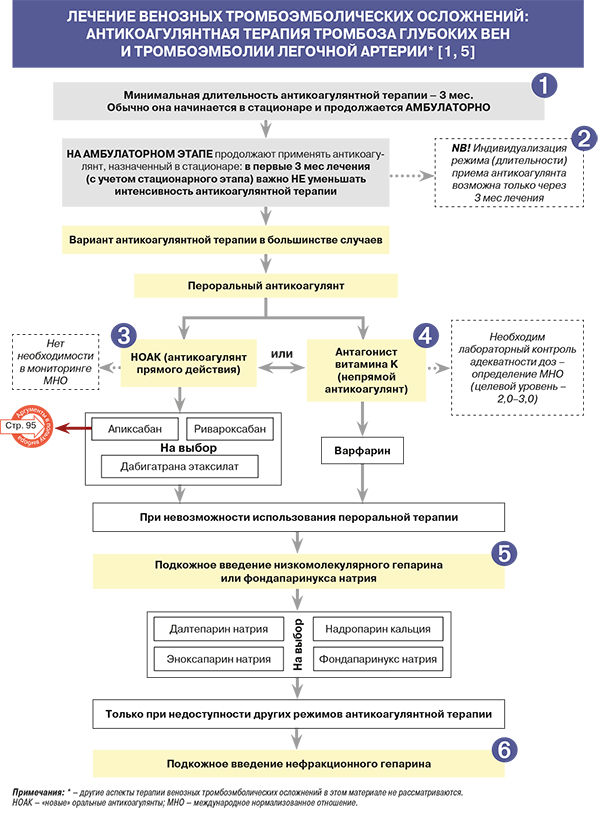
• ТГВ нижних конечностей и ТЭЛА имеют свойство рецидивировать. Риск рецидива, уменьшающийся со временем, максимален в первые 3 мес после острого эпизода ВТЭО, в связи с чем минимальная длительность применения антикоагулянтов у таких больных составляет 3 мес. Соответственно оно обычно начинается в стационаре и продолжается после выписки. В этих условиях на амбулаторном этапе важно не уменьшать интенсивность антикоагулянтной терапии, поскольку это сопряжено с высоким риском возобновления тромбообразования [1, 5–8].
2.
• Прежде чем индивидуализировать длительность приема антикоагулянта (по истечении первых 3 мес антикоагулянтной терапии в режиме, назначенном в стационаре), необходимо оценить у конкретного больного [1, 5–8]:
- риск рецидива;
- переносимость предшествующего использования антикоагулянтов;
- угрозу возникновения существенного кровотечения;
- возможность длительное время поддерживать надлежащий уровень антикоагуляции (достаточное время нахождения международного нормализованного отношения в границах целевого диапазона при приеме варфарина, регулярный прием «новых» оральных антикоагулянтов).
С учетом этих факторов выбирается длительность применения антикоагулянтов (табл. 1).

• Риск рецидива во многом зависит от обстоятельств возникновения ТГВ нижних конечностей и/или ТЭЛА. Он наименьший при наличии явного провоцирующего фактора, действие которого прекратилось (приоперационный тромбоз, полностью излеченное острое нехирургическое заболевание) и наиболее высок при неспровоцированном эпизоде тромбообразования. К другим факторам, связанным с опасностью рецидива, относятся:
- распространенность и локализация тромбоза (дистальный тромбоз в этом плане более благоприятен, чем проксимальный);
- число перенесенных эпизодов тромбоза (при первом в жизни прогноз благоприятнее, чем при рецидивирующем);
- сохранение факторов риска тромбообразования (в частности, неизлеченное злокачественное новообразование) [1, 5–8].
3.
• «Новые» оральные антикоагулянты (НОАК: апиксабан, дабигатрана этексилат и ривароксабан) могут назначаться [1, 5–8]:
- для профилактики ВТЭО у отдельных категорий больных в ортопедической хирургии (изучены при плановом протезировании тазобедренного или коленного суставов);
- для раннего лечения проксимального ТГВ и/ или ТЭЛА у гемодинамически стабильных больных, которым не проводилась тромболитическая терапия, не выполнялась тромбэктомия и не был имплантирован кава-фильтр;
- для длительной вторичной профилактики после проксимального ТГВ/ТЭЛА в случаях, когда не был имплантирован кава-фильтр.
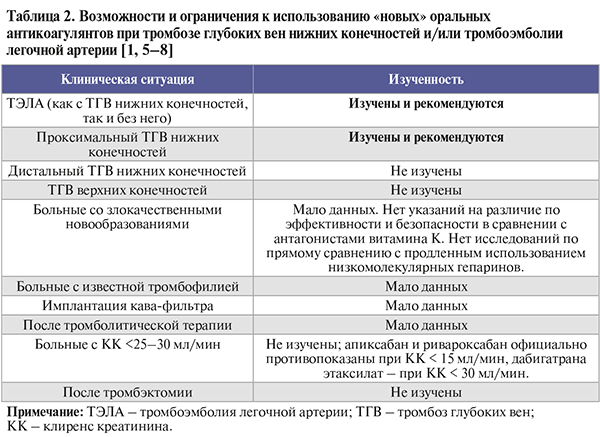
• Контроль показателей свертывающей системы крови при повседневном использовании НОАК не требуется. Возможности и ограничения к использованию этой группы антикоагулянтов при ТГВ и ТЭЛА в различных клинических ситуациях суммированы в таблице 2.
• Достаточное антитромботическое действие НОАК проявляется уже через ≈2 ч после приема, период полувыведения составляет около 12 ч (у больных с выраженной почечной недостаточностью период полувыведения возрастает, особенно при приеме дабигатрана этексилата) [1, 5–8].
• При использовании НОАК ключевое значение имеет регулярность их приема (фактор комплаентности), так как при пропуске доз защитный эффект препаратов этой группы быстро утрачивается. В целом НОАК сопоставимы по эффективности с антагонистами витамина K (варфарином), но имеют преимущество в безопасности: при их приеме реже возникают крупные и/или клинически значимые некрупные кровотечения [1, 5–8]. Согласно последним рекомендациям Американского колледжа специалистов в области торакальной медицины (American College of Chest Physicians, ACCP), пациентам с ВТЭО (без онкопатологии) рекомендуется длительная антикоагулянтная терапия НОАК вместо терапии антагонистами витамина К [5].
• Эффективность и безопасность НОАК в лечении ВТЭО подтверждена множеством крупных рандомизированных контролируемых исследований (РКИ). Так, в исследовании AMPLIFY (n=5395) было показано, что апиксабан (по 10 мг 2 раза/сут 7 дней, далее по 5 мг 2 раза/сут) не уступает по эффективности низкомолекулярному гепарину эноксапарину/варфарину в плане предотвращения рецидивов при острой ВТЭО; при этом его прием сопряжен со значительно меньшим риском большого кровотечения [9].
• Дозы НОАК для длительного лечения (профилактики рецидивов) ТГВ нижних конечностей и/или ТЭЛА представлены в таблице 3.

• Противопоказания к применению НОАК включают аллергию или гиперчувствительность к препаратам, продолжающееся клинически значимое кровотечение, геморрагический диатез, геморрагический инсульт в анамнезе, клиренс креатинина <30 мл/мин (для дабигатрана этексилата) или <15 мл/мин (для бана и ривароксабана), выраженная печеночная недостаточность, беременность, кормление грудью, возраст до 18 лет [1].
4.
• Обязательные обследования перед назначением антагонистов витамина K (обычно это варфарин) включают общий анализ крови (признаки анемии), биохимический анализ крови (печеночные ферменты, общий белок, билирубин, креатинин), международное нормализованное отношение (МНО), анализ кала на скрытую кровь, общий анализ мочи/анализ мочи по Нечипоренко, ультразвуковое исследование почек, осмотр гинеколога. Дополнительные обследования перед назначением варфарина – эзофагогастродуоденоскопия (при наличии анамнеза язвенной болезни желудка или двенадцатиперстной кишки, положительного результата анализа кала на скрытую кровь, а также болевом синдроме в животе), осмотр окулиста (для больных с высокой артериальной гипертензией для исключения кровоизлияний на глазном дне), КТ и/или магнитно-резонансная томография головного мозга (у больных, перенесших инсульт, для исключения геморрагического характера инсульта и оценки постинсультных изменений) [1].
• Эффект антагонистов витамина K проявляется медленно (в течение нескольких суток), поэтому они не подходят для раннего лечения ВТЭО, а также в случаях, когда необходимо быстрое появление антикоагулянтного действия. Кроме того, из-за медленного прекращения антитромботического эффекта их не следует использовать для краткосрочной дооперационной профилактики венозного тромбоза [1].
• При подборе дозы варфарина (табл. 4) важно стремиться как можно дольше поддерживать международное нормализованное отношение (МНО) в границах целевого диапазона – от 2,0 до 3,0 [1, 5–8]. Важнейший показатель, характеризующий эффективность и безопасность длительного использования антагонистов витамина K – время нахождения МНО в границах терапевтического (целевого) диапазона: оно должно превышать 60%. Для более успешного поддержания стабильного уровня антикоагуляции при длительном использовании варфарина рекомендуются определение МНО самим больным (при наличии у него портативного прибора), организация «коагуляционных» кабинетов и клиник, а также внедрение компьютерных систем централизованного мониторинга пациентов, принимающих антагонисты витамина K [1].
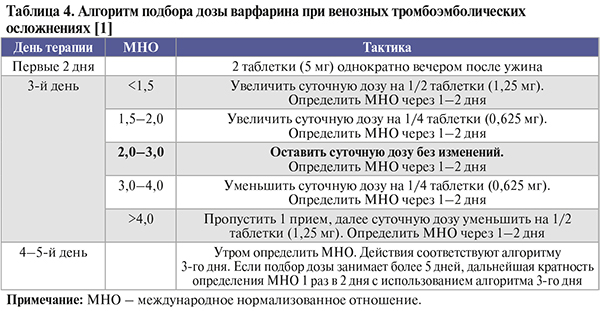
• К абсолютным противопоказаниям для приема антагонистов витамина K относятся аллергия и индивидуальная непереносимость препаратов; беременность; геморрагический инсульт в анамнезе; геморрагический диатез; содержание тромбоцитов в крови <100 тыс/мм3; активное кровотечение. Другие противопоказания включают недавнюю или планируемую в ближайшее время операцию, недавнюю травму; геморрагические осложнения в анамнезе (желудочно-кишечное кровотечение, макрогематурия, метроррагия); внутримозговые аневризмы и сосудистые мальформации; расслаивающую аневризму аорты; перикардит или выпот в перикарде; бактериальный эндокардит; злокачественную артериальную гипертензию; язвенную болезнь желудка, двенадцатиперстной кишки в стадии обострения; портальную гипертензию с варикозным расширением вен пищевода; тяжелую почечную или печеночную недостаточность; деменцию, алкоголизм, психозы, тяжелые нарушения центральной нервной системы в анамнезе, социальную дезадаптацию; высокий риск падения (паркинсонизм, эпилепсия и другие судорожные расстройства); отсутствие возможности лабораторного контроля уровня антикоагуляции (МНО) [1].
• Помимо правильного выбора дозы и обеспечения надлежащей приверженности к лечению, при приеме пероральных антикоагулянтов важно регулярно контролировать функцию почек (с обязательным расчетом клиренса креатинина) и печени (от минимум 1 раза в год до 1 раза в 3–6 мес в зависимости от функции почек, возраста и риска возникновения кровотечений) [1, 5–8]. Режим применения антикоагулянтов для перорального приема при почечной недостаточности приведены в таблице 5.

5.
• При невозможности использовать пероральные антикоагулянты для длительного лечения ТГВ и/или ТЭЛА следует рассмотреть подкожное введение препаратов низкомолекулярного гепарина (НМГ) или селективного ингибитора Xa фактора фондапапинукса натрия. Дозы этой группы препаратов для длительного лечения (профилактики рецидивов) ТГВ нижних конечностей и/или ТЭЛА приведены в таблице 6.

• Если рецидив ТГВ и/или ТЭЛА произошел на фоне длительного регулярного подкожного введения лечебной дозы НМГ, разумно увеличить дозу препарата на четверть или на треть и вводить ее 2 раза/сут [1, 5–8].
• Вплоть до недавнего времени НМГ считались «золотым стандартом» антикоагулянтной терапии онкоассоциированного венозного тромбоза: их длительное использование позволяло уменьшить риск рецидива ВТЭО без влияния на опасность геморрагических осложнений и летального исхода по сравнению с результатами применения антагонистов витамина К [10]. Однако серьезным недостатком длительного применения НМГ является низкий комплаенс больных, приводящий в лучшем случае к переходу на другие препараты, а в худшем – к преждевременному прекращению лечения [11]. С этой точки зрения у пациентов с ВТЭО и злокачественными новообразованиями в качестве более удобной альтернативы НМГ могут быть рассмотрены некоторые НОАК, что подтверждают результаты ряда крупных РКИ. Так, апиксабан в масштабном исследовании CARAVAGGIO (n=1155) продемонстрировал не меньшую эффективность и сопоставимую безопасность с дальтепарином, в том числе на фоне применения апиксабана не наблюдалось увеличения риска желудочно-кишечных кровотечений [12], а ривароксабан в исследовании SELECT-D (n=406) в сравнении с тем же НМГ показал более высокую эффективность при схожем риске больших кровотечений и увеличенной частоте небольших, но клинически значимых кровотечений [13, 14].
• Противопоказаниями к применению НМГ являются аллергия и индивидуальная непереносимость препарата; геморрагический диатез; содержание тромбоцитов в крови <100 000/мм3; тромбоцитопения, вызванная гепарином, в анамнезе; острые язвы желудка и кишечника; продолжающееся тяжелое кровотечение; недавнее внутричерепное кровотечение; тяжелая неконтролируемая артериальная гипертензия; тяжелое заболевание печени (в том числе варикозное расширение вен пищевода); тяжелая травма или недавно перенесенное хирургическое вмешательство (особенно на глазах и нервной системе); острый бактериальный эндокардит [1]. Фондапаринукс натрия противопоказан при аллергии или гиперчувствительности к препарату, геморрагическом диатезе, клиренсе креатинина <20 мл/мин при использовании профилактической дозы и <30 мл/мин при лечении ТГВ/ТЭЛА, активном тяжелом кровотечении, бактериальном эндокардите. Из-за недостаточной изученности фондапаринукс натрия нежелательно использовать при беременности [1].
• В процессе лечения парентеральными формами антикоагулянтов необходим лабораторный контроль гемоглобина, гематокрита, числа тромбоцитов в крови, клиренса креатинина или скорости клубочковой фильтрации [1]. Режимы коррекции дозировок НМГ/фондапаринукса натрия приведены в таблице 7.

6.
• Из-за низкой биодоступности и малой предсказуемости эффекта стандартных доз нефракционировааного гепарина (НФГ) решение о его длительном использовании должно приниматься только при недоступности других режимов антикоагулянтной терапии [1, 5–8].
• Режимы введения НФГ при лечении ТГВ/ТЭЛА (высокие дозы) [1, 5–8]:
- подкожно 17 500 ЕД (или 250 ЕД/кг); через 12 ч – 17 500 ЕД (или 250 ЕД/кг) 2 раза/сут для поддержания значений активированного частичного тромбопластинового времени (АЧТВ) посередине между инъекциями в 1,5–2,5 раза выше верхней границы нормы для конкретной лаборатории;
- подкожно 333 ЕД/кг; через 12 ч – 250 ЕД/кг 2 раза/су без контроля АЧТВ.
• Профилактические (низкие) дозы НФГ вводятся без контроля АЧТВ [1].
• Круг противопоказаний НФГ аналогичен таковому у НМГ. У пациентов с выраженной почечной недостаточностью профилактическая доза НФГ может быть снижена до 5 000 ЕД 2 раза/сут. Коррекции лечебной дозы НФГ у таких пациентов не предусмотрена; подбор дозировки проводится под контролем АЧТВ [1].



