Диагностика
1.
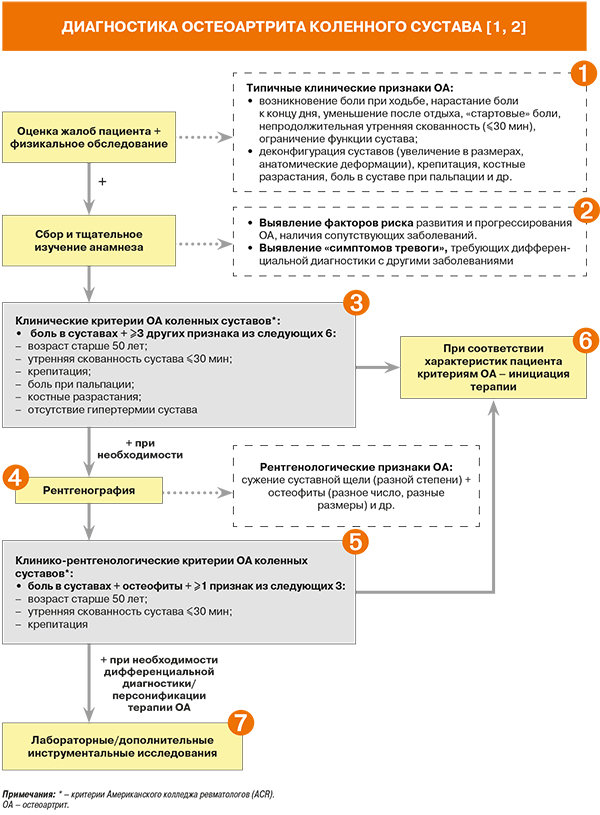
• При оценке жалоб и осмотре пациента рекомендовано учитывать следующие особенности суставного синдрома на фоне остеоартрита (ОА): постепенное начало боли; боль в течение большинства дней предыдущего месяца; усиление боли при ходьбе и стихание после отдыха (механическая боль); «стартовые боли» (кратковременные эпизоды интенсивной боли в суставах, возникающие после периодов покоя и проходящие на фоне двигательной активности); припухлость сустава (за счет небольшого выпота или утолщения синовиальной оболочки); утренняя скованность продолжительностью менее 30 мин; крепитация в суставе; ограничение движений в суставе; изменение походки [1, 2]. Уровень убедительности рекомендаций (УУР) B, уровень достоверности доказательств (УДД) I b–II b [1].
• При выраженных стадиях ОА возможно также появление ночных болей в суставе, свидетельствующих о присоединении воспалительного компонента [1].
• Жалобы пациента с предполагаемым ОА могут также включать значительное снижение физической активности [2]. Течение ОА у различных больных весьма вариабельно: симптомы чаще имеют эпизодический характер, зависят от тяжести заболевания [1, 2].
• При первичном осмотре пациента с подозрением на ОА рекомендовано оценить и отразить в клинической документации [2]:
- болезненные суставы;
- интенсивность боли (по 10-сантиметровой визуально-аналоговой шкале), ее продолжительность, наличие стартовой боли (утром, после периода покоя);
- сведения о купировании предыдущих рецидивов боли.
• В процессе физикального обследования (осмотр и пальпирование суставов) рекомендовано обращать внимание на такие признаки ОА, как крепитация, ограничение движений в суставе, увеличение объема сустава, костные разрастания, деформации (сгибательные контрактуры, укорочение конечности, плоскостопие, варусная или вальгусная деформация), нестабильность, отек периартикулярных тканей или синовит, болезненность при пальпации, атрофии околосуставных мышц [1, 2]: УУР D, УДД 4 [1]. Осмотр больного проводят в положениях больного стоя и лежа [1]. Также следует изучить влияние поражения суставов на выполнение бытовых функций, оценить походку, выявить нарушения сна и депрессию, вызванных болью [2].
2.
• Факторы риска развития и прогрессирования ОА коленных суставов отражены в таблице 1. К наиболее частым коморбидным состояниям при ОА, способствующим его прогрессированию, относятся [2]:
- ожирение;
- артериальную гипертензию;
- атеросклероз и ассоциированные с ним состояния (ишемическая болезнь сердца, периферический атеросклероз, дисциркуляторная энцефалопатия);
- сахарный диабет;
- патологию щитовидной железы;
- хроническую обструктивную болезнь легких;
- токсические висцеропатии;
- патологию желудочно-кишечного тракта (ЖКТ)..
• Симптомы тревоги («красные флаги») при боли в суставах, требующие дифференциальной диагностики [2]:
- симметричный полиартрит (возможен коллагеноз);
- моноартрит (возможна травма сустава в анамнезе, что требует консультации ортопеда);
- длительная утренняя скованность сустава (более 30 мин) с невозможностью совершить движения в суставах, особенно суставах кисти и стоп (возможен коллагеноз);
- возникновение боли после значимого стресса – травмы, переохлаждения, операции и т.п. (возможен коллагеноз);
- появление боли после перенесенного инфекционного заболевания (возможен инфекционный артрит);
- боли у молодых мужчин, злоупотребляющих белковыми коктейлями в фитнес-центрах (возможна подагра);
- боли у пациентов с дисплазией соединительной ткани (необходима консультация ортопеда для подбора ортопедических приспособлений, снижающих нагрузку на сустав);
- боли в суставах у больных с патологией щитовидной железы или у больных с сахарным диабетом (необходима консультация эндокринолога и акцент внимания на нейропатический компонент боли);
- безрезультатность множества обследований, вовлечение в патологический процесс группы мышц, болезненность мышц, острофазовые белки в анализах (возможна ревматическая полимиалгия);
- боли у астеничных женщин с анамнезом частых заболеваний в детском возрасте (необходимо исключение инфекционного артрита).
3.
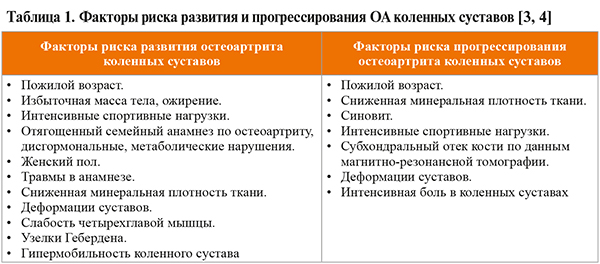
В схеме приведены достаточно широко используемые клинические критерии ОА Американского колледжа ревматологов (ACR; УУР D, УДД 4, чувствительность – 95%, специфичность – 69%) [1, 3, 5]. Наряду с ними в мировой практике применяются клинические критерии ОА Национального института здоровья и клинического совершенствования Великобритания (NICE) и Европейской лиги против ревматизма (EULAR; табл. 2).

4.
• Рентгенологическое исследование – наиболее достоверный инструментальный метод подтверждения ОА, который выявляет сужение суставной щели, краевые остеофиты, субхондральный склероз кости и субхондральные кисты (табл. 3).
При ОА коленных суставов рекомендовано выполнять рентгеновский снимок в переднезадней и боковой проекциях в положении стоя, для исследования пателло-феморального сустава – в боковой проекции при сгибании: УУР В, УДД I b–II b [1].
В случае выявления характерных рентгенологических признаков ОА дальнейшего инструментального обследования для диагностики этого заболевания не требуется [1]. При этом только рентгенологических изменений для установления диагноза ОА недостаточно – необходимо наличие типичных клинических симптомов [2].
• Важно отметить, что согласно рекомендациям Американского общества по изучению ОА (OARSI), у пациентов старше 40 лет с болью в коленном суставе, возникающей при нагрузке, c непродолжительной утренней скованностью, функциональными нарушениями и одним или несколькими типичными физикальными признаками ОА (крепитация, ограничение движений, костные разрастания) диагноз может быть установлен без рентгенологического исследования. Такой подход применим даже при отсутствии видимых изменений на рентгенограммах коленных суставов [3, 7].
5.
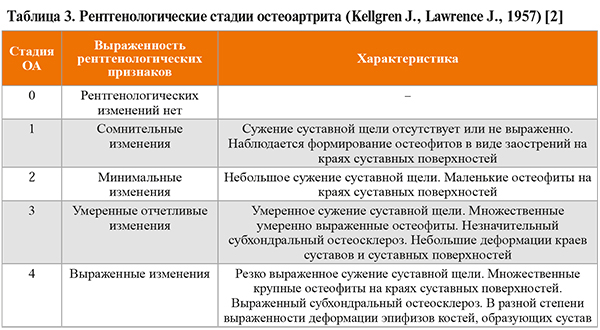
В схеме приведены достаточно широко используемые клинико-рентгенологические критерии ОА коленных суставов ACR (чувствительность – 91%, специфичность – 86%) [3, 5].
6.
Согласно рекомендациям OARSI, для лучшего управления терапией ОА перед ее началом следует оценить не только локализацию заболевания, сопутствующие патологии и соматический статус пациента (боль, функция, скованность, отек, нестабильность, нарушение оси сустава), но и эмоциональное состояние больного и влияние на его состояние окружающих факторов (социальную позицию, отношение к собственному здоровью, настроение, качество сна) [8].
7.
• При необходимости дифференциальной диагностики ОА проводятся следующие лабораторные исследования [2]: общий анализ крови (скорость оседания эритроцитов, анемия при коллагенозах, лейкоцитоз при реактивном артрите), мочевая кислота, креатинин, С-реактивный белок, антитела к цитруллиновому пептиду, антитела к двуспиральной ДНК, ревматоидный фактор, общий анализ мочи. Кроме того, изучение концентрации мочевой кислоты рекомендовано для персонификации стратегии терапии с учетом микрокристаллического стресса [2].
• Результаты лабораторных исследований также могут быть использованы для верификации ОА коленных суставов в соответствии с критериями ACR. Диагноз гонартроза ставят при наличии суставной боли + не менее 5 из 9 следующих признаков: возраст >50 лет; утренняя скованность суставов <30 мин; крепитация; боль при пальпации; костные разрастания; отсутствие гипертермии; скорость оседания эритроцитов <40 мм/ч; ревматоидный фактор <1:40; синовиальная жидкость, характерная для ОА. Чувствительность этого клинико-лабораторного метода диагностики составляет 92%, специфичность – 75% [5].
• К дополнительным инструментальным методам диагностики ОА, проведение которых строго регламентировано специальными строгими показаниями, можно отнести магнитно-резонансную томографию суставов, костную денситометрию. Чаще данные методы используются для дифференциальной диагностики [2].
• При повторном осмотре больных необходимо оценить и отразить в клинической документации [2]:
- наличие болезненных суставов или присоединение новых болезненных суставов (в том числе фасеточных суставов и пояснично-крестцового сочленения);
- динамику интенсивности боли (по 10-сантиметровой визуально-аналоговой шкале) и ее продолжительность;
- динамику синовита, если он был ранее;
- оценку терапии самим пациентом;
- при наличии коморбидности – клиническую динамику сопутствующего заболевания.
• Показания для консультации ревматолога при первичном обращении пациента в поликлинику [2]:
- длительно (более месяца) существующий синовит;
- подозрение на другие воспалительные заболевания суставов или системные заболевания соединительной ткани (длительное припухание сустава, повышенная скорость оседания эритроцитов, высокий уровень С-реактивного белка).
Лечение
1.
• Обучение пациентов с ОА рекомендовано проводить с учетом индивидуальных особенностей больного и включать информацию о заболевании, рекомендации по изменению образа жизни, снижению веса и необходимости выполнения физических упражнений. Рекомендовано проведение групповых или индивидуальных занятий, возможны телефонные контакты. Работа может проводиться и с больными, и с их родственниками. Обучающие программы должны быть организованы на постоянной основе, а не в качестве разового мероприятия. УУР B, УДД 1b [1].
• Больным с ОА следует оптимизировать рацион питания, пациентам с избыточным весом (индекс массы тела более 25 кг/м2) рекомендовано снижение массы тела: УУР B, УДД 1a–1b [1]. При избыточной массе тела показано уменьшение потребления жира, углеводов, соли, увеличение в рационе количества фруктов и овощей. Для достижения клинически значимого симптоматического эффекта необходимо снижение веса на 10% от первоначального [1].
• К пищевым продуктам, полезным при ОА (источники мукополисахаридов и коллагена), относятся постное мясо, жирная и заливная рыба, субпродукты (бараньи, свиные, говяжьи почки), злаковые продукты, крупы, студни, холодцы, желе, кисели, варенье, мед, джем, мармелад (обязательно домашнего приготовления), листовые растения, бобовые культуры, кисломолочные, молочные продукты без наполнителей и с пониженной жирностью, корнеплоды [2].
2.
• Больным ОА рекомендованы регулярные физические упражнения (изометрические), направленные на укрепление мышц, увеличение объема движений, а также аэробные нагрузки. В качестве лечебной физкультуры может использоваться ходьба. УУР B, УДД 1a–1b [1].
• Физические упражнения при ОА способствуют снижению боли и сохранению функциональной активности суставов [1, 10], особенно при сочетании с образовательными программами. Упражнения для укрепления силы четырехглавой мышцы бедра при поражении коленных суставов вызывают достоверное уменьшение боли и сопоставимы по эффективности с применением нестероидных противовоспалительных препаратов (НПВП) [1, 11].
• Необходимо учитывать противопоказания для занятий лечебной физкультурой у больных ОА как абсолютные (неконтролируемая аритмия, блокада 3 степени, недавние изменения на электрокардиограмме, нестабильная стенокардия), так и относительные (кардиомиопатия, пороки сердца, плохо контролируемая артериальная гипертензия) [1].
• Лицам с ОА рекомендовано носить удобную обувь с хорошими амортизирующими свойствами и поддержкой стопы. Преимущественно на ранних стадиях и при отсутствии механической нестабильности коленных суставов показано применение эластичного наколенника. У лиц с преимущественным поражением медиальных отделов коленных суставов и варусным изменением оси сустава рекомендуются вальгизирующие ортезы и/или стельки с клиновидным краем 5-10° с латеральной стороны. УУР C, УДД 1а–III [1].
• При ОА коленных суставов с признаками воспаления можно рекомендовать применение холодовых аппликаций. Для уменьшения боли при ОА показаны тепловые процедуры, которые осуществляются с помощью различных методов, включая диатермию, аппликации, погружение в ванну с теплой водой. УУР C, УДД 1а–II [1].
3.
• Рекомендовано всем больным сразу после установления диагноза первичного ОА назначение симптоматических препаратов замедленного действия (SYSADOA): УУР А–В, УДД 1b–III [1]. Симптоматический эффект от применения SYSADOA развивается через 8–12 нед после начала приема, для структурно-модифицирующего действия препаратов продолжительность лечения должна составлять не менее 2 лет. В отличие от НПВП, SYSADOA после прекращения лечения обладают эффектом последействия в течение 2–4 мес [1].
• Одна из стратегических ошибок при назначении SYSADOA – кратковременное лечение. Данные рандомизированных контролируемых исследований подтверждают целесообразность их продолжительного применения (от 2 лет и больше). Существенными клиническими преимуществами такой стратегии является профилактика рецидивов хронической боли и возможность избегать назначения системных НПВП [2].
• Назначение препаратов, содержащих хондроитина сульфат и/или глюкозамина сульфат, рекомендовано для уменьшения боли, улучшения функции суставов. Эффект таких препаратов сохраняется в течение нескольких месяцев после отмены, они хорошо переносятся больными: УУР А, УДД 1а [1].
• В Кокрановском обзоре (43 рандомизированных клинических исследования) было продемонстрировано небольшое или умеренное уменьшение боли и улучшение функции суставов при использовании хондроитина сульфата по сравнению с плацебо при наблюдениях за пациентами продолжительностью до 6 мес [12]. В то же время в исследованиях, в которых применялся хондроитина сульфат фармацевтического класса, через 3–6 мес наблюдалось уже значительное уменьшение боли и улучшение функции по сравнению с плацебо [13]. Результаты трех 2-годичных клинических исследований показали, что хондроитина сульфат обладает модифицирующим действием на болезнь, замедляя скорость сужения суставной щели на 0,13 мм, что соответствует величине эффекта 0,23 [13, 14].
• Хондроитина сульфат применяют по 500 мг 2 раза/сут, длительно [1, 15]. Препарат имеет хороший профиль безопасности в дозах до 1200 мг/сут [16].
• Анализ работ, в которых применялся запатентованный кристаллический глюкозамина сульфат (pCGS), показал, что он превосходит плацебо в плане влияния на боль и функции суставов по сравнению с другими формами глюкозамина [17]. Глюкозамина сульфат pCGS обладает хорошей биодоступностью (44%), что обеспечивает высокую концентрацию активного вещества в плазме, необходимую для максимального воздействия на медиатор воспаления интерлейкин-1 [18]. Частота нежелательных явлений при применении pCGS аналогична таковой у плацебо [19, 20]. Доказательства структурно-модифицирующего действия препарата получены в двух 3-годичных исследованиях [19, 20].
• Глюкозамина сульфат назначают по 1500 мг/сут в течение 4–12 нед, курсы повторяют 2–3 раза в год [1, 15].
• Наряду с монопрепаратами хондроитина сульфата и глюкозамина сульфата, на фармрынке России также представлены их фиксированные комбинации в различных дозировках [15].
• Назначение ингибитора интерлейкина-1 диацереина рекомендовано для лечения ОА коленных и тазобедренных суставов в качестве симптоматического средства для уменьшения боли и как альтернатива НПВП: УУР В, УДД 1b [1]. Диацереин оказывает небольшое влияние на уменьшение боли в коленных и тазобедренных суставах.
Действие препарата развивается через 2–4 нед, а эффект сохраняется в течение нескольких месяцев после завершения лечения [1, 21]. Из-за высокого риска развития диареи препарат не рекомендуется назначать пациентам старше 65 лет с диареей в анамнезе [15].
• Лечение диацереином начинают с 50 мг/сут на протяжении 2–4 нед, затем дозу увеличивают до 50 мг 2 раза/сут, применяя препарат непрерывно или курсами длительностью не менее 4 мес [15].
• Назначение препарата, содержащего неомыляемые соединения авокадо и сои, рекомендовано для уменьшения боли, улучшения функции суставов и, вероятно, замедления прогрессирования ОА: УУР В, УДД 1b [1]. Этот SYSADOA уменьшает боль, снижает потребность в НПВП [1, 22]. В двух исследованиях было показано, что неомыляемые соединения авокадо и сои обладают потенциальным структурномодифицирующим эффектом при ОА коленных и тазобедренных суставов [1].
• Неомыляемые соединения авокадо и сои применяют по 300 мг 1 раз/сут, длительно [1, 15].
4.
• Использование инъекционных форм SYSADOA может быть целесообразным для достижения более быстрого клинического эффекта при ОА [23]. Одобренный для внутримышечного и внутрисуставного введения биоактивный концентрат из мелкой морской рыбы содержит мукополисахариды (хондроитина-4-сульфат, хондроитина- 6-сульфат, дерматансульфат, кератансульфат), аминокислоты, пептиды, ионы натрия, калия, кальция, магния, железа, меди и цинка, глюкуроновую кислоту – предшественницу гиалуроновой кислоты. Эффективность и безопасность препарата подтверждены клиническими исследованиями. Доказано, что препарат обладает симптоматическим, противовоспалительным и структурно-модифицирующим эффектами [2]. Недавно выполненный методический обзор серии из 37 клинических исследований биоактивного концентрата из мелкой морской рыбы (n=3676) показал хороший анальгетический потенциал этого препарата при различных скелетномышечных заболеваниях, включая ОА. В среднем после курса внутримышечных и/или внутрисуставных инъекций интенсивность скелетно-мышечной боли снижалась на 40–60%. При этом препарат демонстрировал благоприятный профиль безопасности у различных возрастных и коморбидных групп пациентов: на фоне его введения не было отмечено серьезных нежелательных реакций [24].
• При полиостеоартрозе и остеохондрозе биоактивный концентрат из мелкой морской рыбы вводят глубоко внутримышечно:
- по 1 мл в день, курс лечения – 20 инъекций (по 1 инъекции в день в течение 20 дней) или
- по 2 мл через день, курс лечения – 10 инъекций (по 1 инъекции через день в течение 20 дней).
• При преимущественном поражении крупных суставов (например, коленных) биоактивный концентрат из мелкой морской рыбы вводят внутрисуставно по 1–2 мл в каждый сустав с интервалом 3–4 дня. Курс лечения составляет 5–6 инъекций в каждый сустав. Возможно сочетание внутримышечного и внутрисуставного введения препарата. Курс лечения целесообразно повторить через 6 мес [15].
• Наряду с биоактивным концентратом из мелкой морской рыбы, на фармрынке России зарегистрирован ряд других SYSADOA для инъекционного применения [15]:
- для внутримышечно и внутрисуставного введения – отдельные парентеральные формы хондроитина сульфата;
- только для внутрисуставного введения – сывороточный гликопротеин;
- только для внутримышечного введения – глюкозамина сульфат, гликозаминогликанпептидный комплекс, большинство парентеральных форм хондроитина сульфата.
5.
При слабых или умеренных болях в суставах рекомендовано применять парацетамол в минимальной эффективной дозе, но не выше 3,0 г/сут: УУР А, УДД 1a–b [1].
При этом парацетамол оказывает небольшой и непродолжительный эффект при ОА и показан лишь при болях без признаков выраженного воспаления [1, 25]. По силе обезболивающего действия он уступает НПВП [26]; кроме того, появились свидетельства повышения частоты развития неблагоприятных явлений со стороны сердечно-сосудистой системы, ЖКТ, печени и почек при его применении [27].
В связи с этим парацетамол следует назначать коротким курсом в дозе ≤3 г/сут в случае непереносимости НПВП [23].
6.
• Для купирования боли при ОА коленных суставов, а также суставов кистей рекомендуются трансдермальные (топические) формы НПВП: УУА А, УДД 1a [1]. В алгоритме Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO) купирование боли рекомендуется начинать именно с локальных, а не пероральных НПВП, поскольку сравнение установило равную эффективность этих форм и лучший профиль безопасности препаратов для наружного применения вследствие их низкой системной абсорбции [9, 28].
• Локальные НПВП могут быть средствами выбора у пациентов старше 75 лет или больных имеющих серьезную гастроинтестинальную и/или кардиоваскулярную патологию, поскольку практически не вызывают нежелательные явления со стороны ЖКТ, сердечно-сосудистой системы и почек, что дает возможность назначать их пациентам с отягощенным коморбидным фоном [23]. В то же время локальные НПВП чаще по сравнению с системными могут вызывать кожные побочные эффекты [3].
• НПВП для наружного применения следует применять не менее 2 нед до 4 раз/сут. [23].
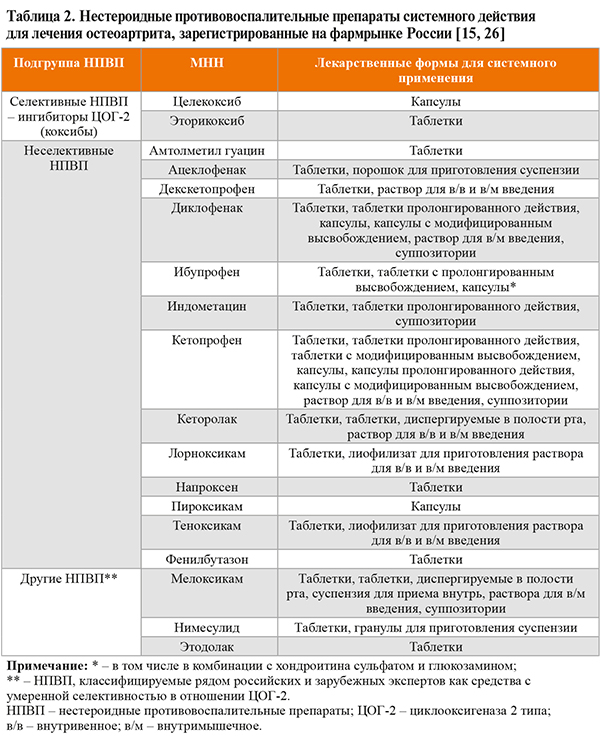
• Локальные формы НПВП, зарегистрированные в России, приведены в таблице 1.

7.
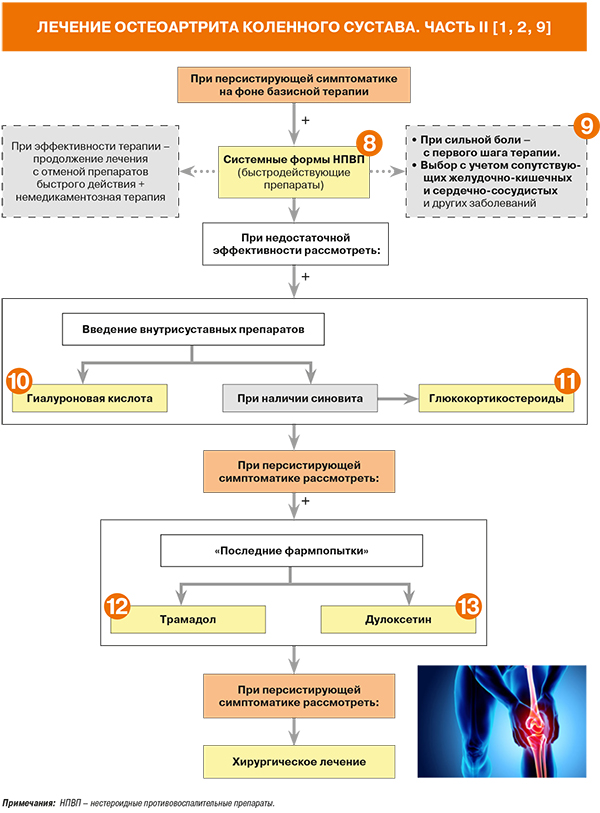
Согласно рекомендациям OARSI, вывод о неэффективности назначенной терапии (наличие персистирующих симптомов ОА) и переход к следующему шагу лечения делаются при условии достаточной приверженности пациента к назначенной терапии на момент оценки. При отсутствии таковой необходимо исследовать причины некомплаентности (и сделать все возможное для их устранения), при необходимости скорректировать дозировку назначенных препаратов и продолжить прежнюю схему лечения [8].
8.
• Назначение системных форм НПВП рекомендовано больным ОА при неэффективности парацетамола, наличии признаков воспаления. При сильной боли в суставах лечение следует начинать сразу с НПВП. УУР А, УДД 1a [1].
• Зарегистрированные в России системные НПВП, показанные для купирования суставной боли, представлены в таблице 2. Все НПВП в адекватных противовоспалительных дозах (средних и максимальных терапевтических) при длительном применении имеют равный обезболивающий потенциал: УДД 1a [26]. При этом НПВП более эффективны для купирования боли, чем парацетамол [1, 2, 26].
• Эффективность НПВП в целом зависит от дозы. Использование более высоких дозировок позволяет обеспечить более выраженное обезболивающее и противовоспалительное действие: УДД 1b [26]. При ОА длительное непрерывное использование НПВП обеспечивает лучший контроль симптомов, чем прием в режиме «по требованию»: УДД 1b [26]. Длительный прием НПВП при ОА в ряде случаев способен уменьшить частоту рецидивов болезни: УДД 1b [26].
• У больных с умеренной или сильной болью в суставах НПВП могут применяться одновременно с SYSADOA, тем более что у последних клинический эффект развивается не сразу, а спустя 8–12 нед от начала приема [23].
9.
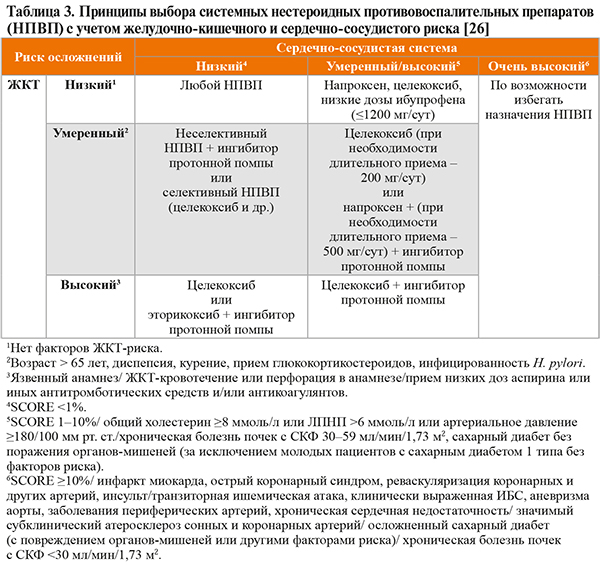
Перед назначением системных НПВП всегда следует учитывать риск развития нежелательных явлений, прежде всего кардиоваскулярных и гастроинтестинальных (табл. 3). Необходимо также принимать во внимание угрозу токсического поражения печени, почек. Относительная вероятность возникновения побочных эффектов варьирует у различных НПВП и является дозозависимой [26]. Рекомендован контроль артериального давления и течения хронической сердечной недостаточности на фоне приема НПВП [1]. Также следует учитывать возможность лекарственных взаимодействий.
10.
• Внутрисуставное введения препаратов гиалуроновой кислоты (или ее производных – гиалуронатов) при ОА рекомендовано для уменьшения боли и улучшении функции сустава: УУР В, УДД 1b–III [1]. Доказательства эффективности гиалуроновой кислоты по сравнению с плацебо и НПВП представлены во многих рандомизированных клинических исследованиях и метаанализах [29].
• Показания к внутрисуставному введению препаратов гиалуроновой кислоты [2]:
- главный критерий – отсутствие выпота в сустав (необходимо выполнить ультразвуковое исследование сустава);
- недостаточная эффективность проводимой терапии (плохой и очень плохой эффект при приеме НПВП и SYSADOA 3 мес и более).
11.
Внутрисуставное введение глюкокортикостероидов (ГКС) рекомендовано при ОА с синовитом: УУР А, УДД 1b [1]. В России в формах для внутрисуставного введения представлены бетаметазон, гидрокортизон и триамцинолон [15]. Применение этой группы препаратов должно проводиться не более 1–2 раз в год в один сустав, однако их действие может быть кратковременным и не принести желаемого результата.
В Кокрановском обзоре 2015 г. (27 исследований, 1767 участников) при сравнении внутрисуставных инъекций ГКС с плацебо было показано, что улучшение после однократного введения гормональных средств сохранялось не более 4 нед [30].
В 2017 г. были опубликованы результаты длительного внутрисуставного применения глюкокортикоидов (4 инъекции в год в течение 2 лет), которые показали отрицательное влияние такой терапии на прогрессирование ОА коленных суставов [31].
12.
При сохранении выраженного болевого синдрома на фоне указанного лечения или невозможности назначения НПВП к терапии возможно добавление опиоидного анальгетика трамадола: УУР В, УДД 1b [1]. Его рекомендовано назначать короткими курсами пациентам, которые не ответили на другие методы лечения, или при наличии очень интенсивной боли в суставах. В недавно опубликованном систематическом обзоре были продемонстрированы высокие риски развития побочных реакций со стороны ЖКТ и центральной нервной системы на фоне приема пероральных опиоидов для лечения ОА [32].
13.
Эффективность антидепрессанта дулоксетина подтверждена в двойном слепом плацебо-контролируемом исследовании при ОА коленных суставов и безрезультатности предшествующей терапии НПВП, особенно у пациентов с хронической болью и признаками центральной сенситизации [33, 34].


