I. ВВЕДЕНИЕ
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
- BiPAP – двухуровневая неинвазивная вентиляция легких
- CPAP – неинвазивная вентиляция с положительным давлением
- EzPАP – дыхательный тренажер с дополнительным расклинивающим давлением
- FiО2 – индекс Фика (содержание кислорода в газовой смеси)
- HbA1c – гликированный гемоглобин
- PaCO2 – парциальное давление углекислого газа в артериальной крови
- PaO2 – парциальное давление кислорода в артериальной крови
- PEEP (ПДКВ) – положительное давление в конце выдоха
- РЕР – дыхательный тренажер с сопротивлением воздушного потока на выдохе
- oPEP – дыхательный тренажер с сопротивлением и осцилляцией воздушного потока на выдохе
- SaO2 – сатурация кислорода
- аГПП-1 – агонисты рецепторов глюкагоноподобного пептида-1
- АЛТ – аланинаминотрансфераза
- АМКР – антагонисты минералокортикоидных рецепторов
- АПФ – ангиотензинпревращающий фермент
- АРА – антагонисты рецепторов ангиотензина II
- АСТ – аспартатаминотрансфераза
- АЦД – активное циклическое дыхание
- ВчОГК – высокочастотная осцилляторная вентиляция грудной клетки
- ГКС – глюкокортикостероиды
- ДДБА – длительно действующие бета2-агонисты
- ДДАХ – длительно действующие антихолинергические препараты
- ДК – дыхательная техника «дыхательный контроль»
- ИБС – ишемическая болезнь сердца
- иДПП-4 – ингибитор дипептидилпептидазы 4 типа
- ИПВЛ – интрапульмональная перкуссионная вентиляция легких
- КРГК – дыхательная техника «контроль расширения грудной клетки»
- МВС – мотивирующий вдох спирометр
- НАЖБП – неалкогольная жировая болезнь печени
- НМГ – низкомолекулярные гепарины
- НПВП – нестероидные противовоспалительные препараты
- НФГ – нефракционированный гепарин
- ОНМК – острое нарушение мозгового кровообращения
- ПОАК – прямые оральные антикоагулянты
- ПСК – пиковая скорость кашля
- ПСМ – препараты сульфонилмочевины
- ПССС – пероральные сахароснижающие средства
- РААС – ренин-ангиотензин-альдостероновая система
- СД – сахарный диабет
- СКФ – скорость клубочковой фильтрации
- ТЗД – тиазолидиндионы
- ТЭЛА – тромбоэмболия легочной артерии
- УДХК – урсодезоксихолевая кислота
- ФП – фибрилляция предсердий
- ФЭМ-Х – дыхательная техника «форсированный экспираторный маневр с хаффингом»
- ХБП – хроническая болезнь почек
- ХОБЛ – хроническая обструктивная болезнь легких
- ХС ЛПВП – холестерин липопротеидов высокой плотности
- ХС ЛПНП – холестерин липопротеидов низкой плотности
- ЧДД – частота дыхательных движений
- ЧСС – частота сердечных сокращений
- ЭЗДП – экспираторное закрытие дыхательных путей
I. ВВЕДЕНИЕ
Реабилитация пациентов, перенесших COVID-19, должна быть комплексной и учитывать не только патологические изменения в органах и системах, выраженность которых определяется тяжестью болезни и объемом тканевого поражения, но и возможные ятрогенные поражения, связанные с побочным действием лекарств (кардиотоксичность, гепатотоксичность и др.) и медицинских вмешательств (интубация и др.), а также сопутствующую патологию.
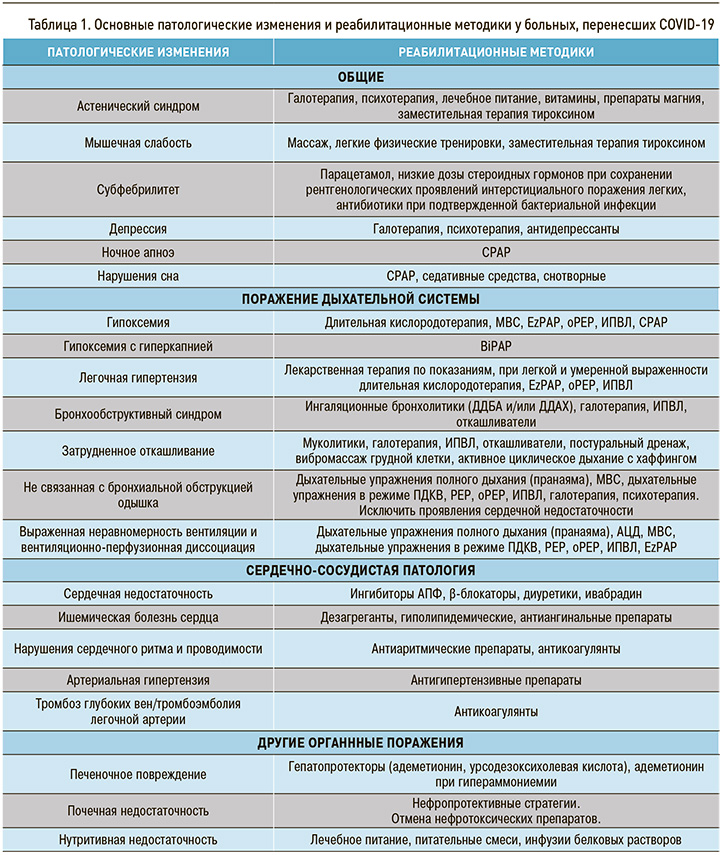
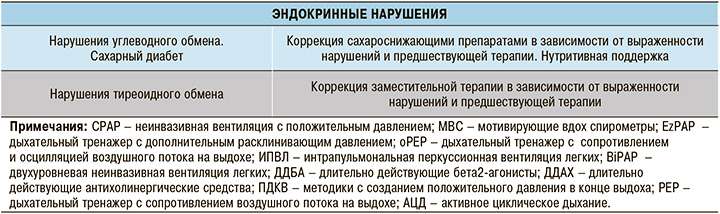
С учетом этого практически невозможно предложить универсальную схему реабилитации. Разумным представляется индивидуальный синдромно-патогенетический подход, реализующий максимальное использование возможностей реабилитационных методик в зависимости от имеющегося у пациента набора патологических изменений. Однозначно при построении программы реабилитации следует учитывать противопоказания отдельных методик, их возможное взаимодействие, а также избегать полипрагмазии. В таблице 1 представлены основные патологические изменения у больных, перенесших COVID-19, и соответствующие реабилитационные методики.
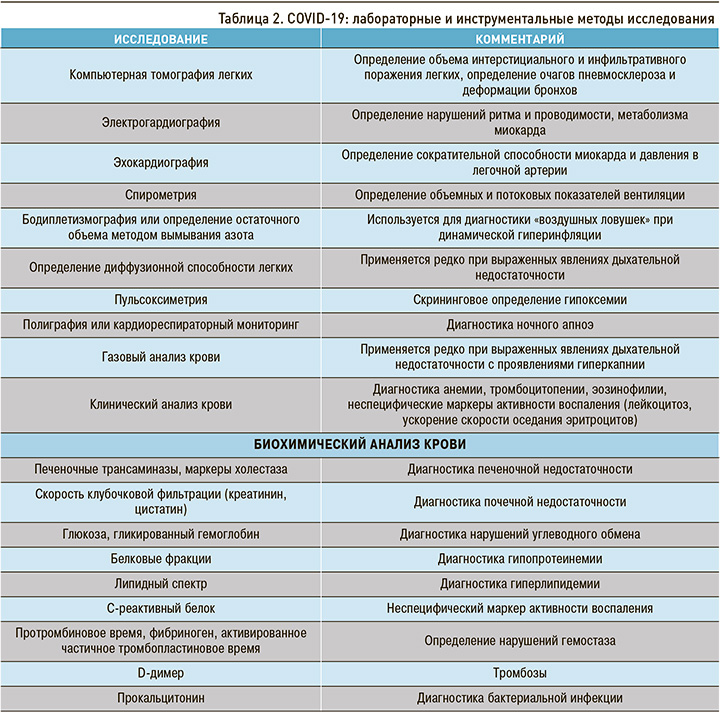
COVID-19 во многих случаях характеризуется полиорганным поражением, поэтому на этапе реабилитации, помимо данных анамнеза и клинического обследования, могут потребоваться лабораторные и инструментальные методы исследования, перечень которых приведен в таблице 2.
II. ОСНОВНЫЕ РЕСПИРАТОРНЫЕ ТЕХНОЛОГИИ
Ниже рассмотрены основные респираторные технологии. Их применение должно базироваться на наличии соответствующих симптомов и синдромов, сопутствующей патологии, а также с учетом противопоказаний и возможного как позитивного, так и негативного взаимодействия. Более полно показания и противопоказания к этим респираторным техникам отражены в клинических рекомендациях «Физиотерапия и кислородотерапия пациентов с дыхательными расстройствами и нарушением мукоцилиарного клиренса» (Малявин А.Г., Мартынов А.И., Адашева Т.В. с соавт. Национальные клинические рекомендации. Физиотерапия и кислородотерапия пациентов с дыхательными расстройствами и нарушением мукоцилиарного клиренса. Терапия. 2019; 5 (приложение): 101–152).
ФИЗИЧЕСКИЕ ТРЕНИРОВКИ
Цель: стимуляция крово- и лимфообращения в утомленных мышцах.
Применяются аэробные длительные тренировки на фоне малых нагрузок при частоте дыхательных движений (ЧДД), не превышающей 100 уд./мин. Предпочтительные виды: скандинавская ходьба, гребной тренажер, плавание стилем брасс.
МАССАЖ
Цель: стимуляция крово- и лимфообращения в утомленных мышцах.
Рекомендуется массаж шейно-воротниковой зоны и грудной клетки. Методики сдавления и вибромассажа применяются в сочетании с постуральным дренажом.
ДЫХАТЕЛЬНЫЕ УПРАЖНЕНИЯ В РЕЖИМЕ СОЗДАНИЯ ПОЛОЖИТЕЛЬНОГО ДАВЛЕНИЯ В КОНЦЕ ВЫДОХА
Цель: увеличение равномерности вентиляции легких.
У пациентов с нестабильностью дыхательных путей, высокое положительное давление и большая скорость воздушного потока в период форсированного выдоха сопровождается динамической компрессией воздухоносных путей (раннее экспираторное закрытие дыхательных путей – ЭЗДП), что приводит к неполному опорожнению альвеол и задержке слизи в бронхах. Для предотвращения ЭЗДП при отсутствии экспираторных тренажеров возможно использовать простейшие дыхательные методики с созданием положительного давления в конце выдоха (ПДКВ). Чаще всего используют надувание эластических предметов с малым сопротивлением (презервативов, медицинских перчаток, гимнастических шаров, ранее использованных воздушных шариков).
Нежелательно использование новых воздушных шариков из-за высокого сопротивления, создающего риск баротравмы легких. Важно объяснить пациенту, что маневр выдоха должен производиться без значительного участия вспомогательной дыхательной мускулатуры. К недостаткам метода следует отнести неконтролируемое сопротивление и его значительные колебания в процессе выдоха.
Относительно стабильное сопротивление может быть достигнуто при выдыхании через коктейльную трубочку под воду. При этом уровень воды должен быть выше нижнего конца трубочки примерно на 5 см.
Продолжительность и кратность таких дыхательных упражнений не определены.
РЕСПИРАТОРНАЯ ГИМНАСТИКА И ПОСТУРАЛЬНЫЙ ДРЕНАЖ
Цель: стимуляция мукоцилиарного и кашлевого клиренса при обильной трудно отделяемой мокроте.
Различают различные типы респираторных упражнений и постуральный дренаж. Характер таких упражнений определяется локализацией нагноительного процесса. При выполнении дренажных упражнений зона поражения должна располагаться выше бифуркации трахеи, что создает оптимальные условия для оттока отделяемого из пораженных бронхов и полостей. Принято выделять:
- статическое дыхание: выполняют в различных исходных положениях без движения ног, рук и туловища, под их влиянием происходит урежение дыхания, нормализуется его ритмичность;
- динамическое дыхание: дыхательные упражнения в сочетании с движениями, на вдохе разведение или поднятие рук вверх, разгибание позвоночника, выпрямление ног, на выдохе приведение и опускание рук, наклоны туловища, сгибание ног, приседания. Упражнения увеличивают объем вентилируемой поверхности легких;
- статическое диафрагмальное дыхание: «дыхание животом», при котором наиболее интенсивно работает диафрагма, и помогают ей мышцы брюшного пресса (для контроля правильности выполнения упражнения одна рука кладется на грудь, другая – на живот);
- произвольно управляемое или локализованное дыхание: на вдохе нужно стараться направить вдыхаемый воздух в определенные доли легких, в одну или обе верхние доли при верхнегрудном дыхании, при этом плечи и верхняя часть грудной клетки поднимаются, а на выдохе опускаются. При выполнении нижнегрудного дыхания руки кладутся на нижние ребра, на вдохе следует направить вдыхаемый воздух в нижние доли легких, кисти рук при этом активно выталкиваются работающими межреберными мышцами;
- специальные дыхательные упражнения: усиливают вентиляцию отдельных долей или всего легкого для нормализации функции внешнего дыхания. Это достигается посредством механического сдавления грудной клетки на стороне тренируемого легкого или в положении лежа на противоположном тренируемому боку с подложенным валиком. При локализации процесса в нижней доле тренируют дыхание в верхних средних отделах путем ограничения экскурсии (сдавления) нижней доли легкого. Вентиляция нижних отделов достигается снижением экскурсии верхних и средних отделов легких, для этого выполняется статическое напряжение мышц плеча и руки;
- дыхательные упражнения с дозированным сопротивлением: основное внимание уделяется стимуляции выдоха, что способствует более равномерной вентиляции при последующем вдохе. Для этого во время выдоха руками производятся вибрирующие сдавления грудной клетки, с каждым вдохом степень воздействия на грудную клетку усиливается, достигая оптимальной величины. Место приложения рук рекомендуется менять каждые 2–3 дыхательных движения, располагая их на различных участках грудной клетки, области реберной дуги и живота, что способствует усилению рецепции дыхательного аппарата;
- дренажные упражнения (статического и динамического характера). Активный дренаж направлен в основном на улучшение выведения мокроты, для этого выполняют упражнения для различных групп мышц, используя частую смену исходных положений и приемы постурального дренажа; частая смена исходных положений, активные движения, связанные с поворотами туловища, являются благоприятными факторами, улучшающими опорожнение бронхов. После каждого упражнения надо откашлять мокроту;
- постуральный (позиционный) дренаж – метод, суть которого заключается в приеме специально заданного исходного положения тела, направленного на отток экссудата по дыхательным путям по принципу желоба; зона поражения легких находится также выше места бифуркации трахеи. Мокрота при этом продвигается под воздействием силы тяжести к месту разветвления трахеи, где наиболее высока чувствительность кашлевого рефлекса. В результате возникновения непроизвольного рефлекторного кашля она выводится из дыхательных путей, повышается продуктивность кашля. В начале лечения дренажное положение принимается на 5–10 мин, время пребывания в этом положении нужно увеличивать постепенно. Если отделяемого много и больной привык к дренажному положению, дренирование можно продолжать до 30–40 мин. Чтобы избежать затекания отделяемого в здоровое легкое, процедуру дренирования нужно заканчивать дренажом здорового легкого. Постуральный дренаж должен быть прерван, если во время процедуры возникает значительная одышка или удушье. Принято выделять постуральный дренаж правого и левого легкого (рис. 1).

Повысить эффективность постурального дренажа могут предварительные аппликации теплоносителей (лечебные грязи, парафин, озокерит) и облучение значимой зоны легкого электромагнитными волнами дециметрового диапазона за счет теплового разжижения мокроты и стимуляции локальной гемодинамики.
ЗВУКОВАЯ ГИМНАСТИКА
Цель: тренировка дыхательных мышц, увеличение равномерности вентиляции легких.
Звуковая респираторная гимнастика – специальные упражнения, заключающиеся в произнесении определенных звуков и их сочетаний строго определенным способом, при этом вибрация голосовых связок передается на гладкую мускулатуру бронхов, легкие, грудную клетку, расслабляя спазмированные бронхи и бронхиолы. Сила вибрации зависит от силы воздушной струи, возникающей при произнесении тех или иных звуков; этот факт используется для тренировки дыхательных мышц, и более всего диафрагмы. По силе воздушной струи и вибрации все согласные звуки подразделяются на три группы:
- максимальная сила возникает при произнесении глухих согласных (П, Т, К, Ф, С), соответственно требуется и наибольшее напряжение мышц грудной клетки и диафрагмы;
- среднее по силе напряжение развивается при произнесении звонких согласных (Б, Д, Г, В, З);
- наименьшая сила воздушной струи при произнесении так называемых сонант (М, Н, Л, Р);
- специальные согласные звуки:
- жужжащие (Ж, З);
- свистящие и шипящие (С, Ф, Ц, Ч, Ш);
- рычащий (Р).
Правильная техника звуковой гимнастики
1. Вдох через нос, продолжительность 1–2 с, пауза 1 с, активный выдох через рот 2–4 с, снова пауза 4–6 с. Выдох должен быть в два раза больше вдоха. При таком соотношении дыхательных движений происходит наиболее полный газообмен в альвеолах и полное смешение вдыхаемого воздуха с альвеолярным.
2. Все звуки следует произносить строго определенным образом, в зависимости от цели гимнастики.
3. При обратимой бронхиальной обструкции жужжащие, рычащие, шипящие звуки произносятся громко, энергично, «возбуждающе».
4. При необратимой бронхиальной обструкции с выраженной дыхательной недостаточностью те же звуки произносятся мягко, тихо, можно шепотом – «успокаивающе».
5. Занятие начинают с «очистительного выдоха» – пфф. Произносят через губы, сложенные в трубочку.
6. «Очистительный выдох» производят до и после каждого звукового упражнения.
7. Второе обязательное упражнение – «закрытый стон» ммм – выполняют сидя, наклонившись вперед, положив кисти на колени ладонями вниз.
8. При выполнении комплексов звуковых упражнений через 2–3 занятия следует вводить постепенно гимнастические упражнения.
9. Продолжительность занятий: начинают с 5–6 мин, в дальнейшем постепенно увеличивая время занятия, но не превышая 25–30 мин 2–3 раза в день.
10. Проводить занятия желательно до приема пищи или через 1,5–2 ч после еды.
РЕСПИРАТОРНАЯ ГИМНАСТИКА (ПРАНАЯМА)
Цель: увеличение равномерности вентиляции легких, формирование правильного стереотипа дыхания.
К традиционным методикам респираторной гимнастики, создающей навыки полного дыхания в сочетании с формированием правильного дыхательного стереотипа, относят йоговское упражнение пранаяма. В его основе лежит последовательная и максимально полная вентиляция различных участков легких с возможной нормализацией вентиляционно-перфузионных отношений.
Методика проведения пранаямы
1. Исходное положение: сидя на стуле с прямой и опертой на спинку спиной, руки на коленях, голова не наклонена («горделивая осанка»).
2. Перед началом упражнений необходимо расслабить грудную клетку, подняв плечи и затем расслабленно опустив их кзади и назад.
3. Вдох через нос при слегка напряженной носоглотке (втягивание воздуха, как при принюхивании).
4. В первую фазу вдоха вентилируются нижние отделы легких. Для этого при сокращении и опущении диафрагмы передняя брюшная стенка выдвигается вперед.
5. Затем плавно, без задержки вентилируются верхние отделы легкого. Для этого во вторую фазу вдоха за счет работы межреберных мышц расширятся грудная клетка. Максимальный вдох по возможности осуществляется без заметных усилий со стороны дополнительной дыхательной мускулатуры.
6. Выдох осуществляется не форсировано, пассивно под тяжестью грудной клетки через неплотно сомкнутые или вытянутые в трубочку губы (эффект «проколотой шины»).
7. Необходимо совершать по 20–30 вдохов 3 раза в день.
На этапе обучения респираторную гимнастику целесообразно проводить перед зеркалом. При этом одну руку следует располагать в области грудины, а другую на поверхности верхней части живота.
ФОРСИРОВАННЫЙ ЭКСПИРАТОРНЫЙ МАНЕВР С ХАФФИНГОМ
Цель: увеличение равномерности вентиляции легких, стимуляция кашлевого клиренса при трудно отделяемой мокроте, расправление дистелектазов.
Описание действия над пациентом
1. После 3–5 медленных глубоких дыхательных движений глубоко вдохнуть носом. Используя диафрагмальное дыхание, выдохнуть через сомкнутые губы (одиночный маневр).
2. Глубоко вдохнуть и задержать дыхание на 1–3 с.
3. Выдохнуть средний/низкий легочный объем (для очистки от секрета периферического отдела бронхиального дерева).
4. Сделать обычный вдох. Затем, во время выдоха, выдавить воздух из легких, используя мышцы живота и груди с открытой голосовой щелью, произнося звук «ха-aф-фа» (звучит как вынужденный вздох). Повторить несколько раз (3–4 раза).
5. При ощущениях наличия секрета в верхних отделах дыхательных путей провести выдох с большим/средним легочным объемом (для очистки от слизи проксимальных отделов бронхов). Повторить маневр 2–3 раза.
6. Провести несколько релаксационных диафрагмальных маневров перед следующим кашлевым усилием.
7. Запротоколировать умение пациента выполнять процедуру в медицинской карте больного.
МЕТОД «АКТИВНОГО ЦИКЛИЧЕСКОГО ДЫХАНИЯ»
Цель: увеличение равномерности вентиляции легких, стимуляция кашлевого клиренса при трудно отделяемой мокроте, расправление дистелектазов.
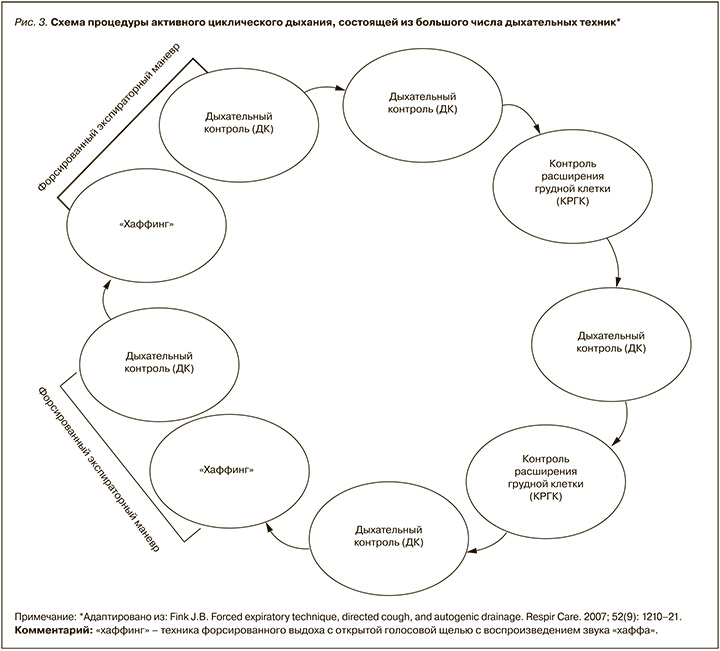
Активное циклическое дыхание (АЦД) представляет собой сочетание трех основных дыхательных техник: «дыхательный контроль» (ДК), «контроль расширения грудной клетки» (КРГК), «форсированный экспираторный маневр с хаффингом» (ФЭМ-Х).
ДК называют диафрагмальное дыхание, или «нежное расслабленное дыхание» в нормальном темпе для расслабления дыхательных путей и мышц. При осуществлении ДК пациент контролирует верхнюю часть грудной клетки, его плечи должны быть расслаблены. Он дышит обычным для него дыхательным объемом с обычной частотой. При этом пациент должен ощущать «разбухание» вокруг талии при вдохе, связанное с опускающейся диафрагмой, вытесняющей содержимое брюшной полости. «Разбухание» исчезнет при выдохе. Дыхательный контроль по существу служит основой релаксационного дыхательного маневра между циклами активных дыхательных техник АЦД.
КРГК называют активные вдохи, значительно большие, чем при обычном дыхании, следующие за релаксационным дыхательным маневром ДК. Техника КРГК – глубокий, медленный, полный вдох с незначительной задержкой дыхания, а затем медленный, спокойный, неглубокий выдох. Это позволяет воздуху пройти в самые дистальные отделы бронхиального дерева. Более того, большие легочные объемы повышают воздухоносный поток через периферические дыхательные пути и коллатеральные вентиляционные каналы, что увеличивает объем воздуха, способного мобилизовать секрет в период выдоха. Проведение КРГК, как правило, ограничено 3–4 циклами глубоких вдохов. Это позволяет избежать усталости и гипервентиляции.
Техника ФЭМ-Х состоит из 1–2 форсированных выдохов, или «хаффингов», комбинированных с периодом ДК. Выполняется обычный вдох с задержкой или без задержки дыхания на 1–3 с. После этого выполняют резкий выдох, используя мышцы живота и груди, с открытым ртом и открытой голосовой щелью.
Описание действия над пациентом
1. Пациент должен находиться в расслабленном состоянии в положении сидя, а при невозможности в положении полусидя по Фаулеру.
2. Проведите несколько минут расслабленного диафрагмального дыхания (техника ДК).
3. Выполните 3–4 активных глубоких вдоха с пассивным расслабленным выдохом (техника КРГК).
4. Выполните расслабленное диафрагмальное дыхание (техника ДК).
5. При ощущениях наличия секрета в верхних отделах дыхательных путей выполните 2–3 «хаффинга» (техника ФЭМ-Х), начиная с малых объемов. Затем выполните 2–3 «хаффинга» (техника ФЭМ-Х) большим объемом (для очистки от слизи проксимальных отделов бронхов). Далее следует расслабленное диафрагмальное дыхание (техника ДК).
6. Повторите цикл 2–4 раза в зависимости от переносимости.
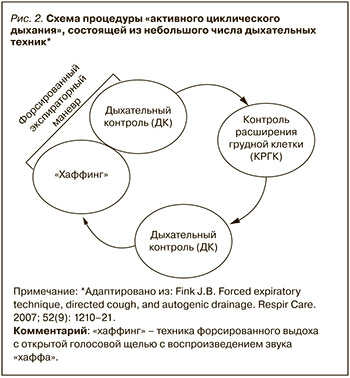 Пациенты с продукцией большого объема слизи, но без выраженной гиперреактивности бронхов, ателектазов, множественных «слизистых пробок» или закупорки мелких дыхательных путей могут использовать АЦД, состоящую из (ДК)+(КРГК)+(ДК)+(ФЭМ-Х) (рис. 2). У пациентов с бронхоспазмом и обструкцией дыхательных путей выгоднее использовать продолжительные эпизоды дыхательного контроля. При закупорке дыхательных путей слизью, ателектазах, некоторых рестриктивных заболеваниях легких особенно полезными признаются длинные циклы с многократно повторяющимися техниками (рис. 3). Несмотря на то что показателем клинической эффективности проводимой терапии является очевидное изменение аускультативной картины легких, на сегодняшний день не хватает рандомизированных клинических исследований с доказательствами преимуществ данных стратегий у различных групп пациентов.
Пациенты с продукцией большого объема слизи, но без выраженной гиперреактивности бронхов, ателектазов, множественных «слизистых пробок» или закупорки мелких дыхательных путей могут использовать АЦД, состоящую из (ДК)+(КРГК)+(ДК)+(ФЭМ-Х) (рис. 2). У пациентов с бронхоспазмом и обструкцией дыхательных путей выгоднее использовать продолжительные эпизоды дыхательного контроля. При закупорке дыхательных путей слизью, ателектазах, некоторых рестриктивных заболеваниях легких особенно полезными признаются длинные циклы с многократно повторяющимися техниками (рис. 3). Несмотря на то что показателем клинической эффективности проводимой терапии является очевидное изменение аускультативной картины легких, на сегодняшний день не хватает рандомизированных клинических исследований с доказательствами преимуществ данных стратегий у различных групп пациентов.
ИНСПИРАТОРНАЯ ТЕРАПИЯ С ПЕРЕМЕЖАЮЩИМСЯ ДАВЛЕНИЕМ
Цель: тренировка дыхательной мускулатуры, увеличение равномерности вентиляции легких, рекрутирование плохо вентилируемых участков легких.
Инспираторная терапия (терапия вдоха) с перемежающимся давлением (ИТПД) представляет собой вариант физиотерапии с избыточным давлением у пациентов с сохраненным дыхательным контролем, проводимой коротким сеансом для тренировки «вдоха» пациента (контроль дыхательного объема и потока) и расправления легочной ткани.
ИТПД-терапия осуществляется с помощью двух типов респираторных устройств, называемых «мотивирующие вдох спирометры» (МВС) и воздействующих высокой частотой потока или объемом воздуха на дистальные дыхательные пути пациента в период вдоха (рис. 4):
1. потоковые спирометры (CliniFlo, Portex, Tri-Flo);
2. объемные спирометры (Coach, Voldyne).

МВС помогают поддерживать дыхательные пути пациента открытыми в период вентиляции легких. У пациентов с суженными или обтурированными дыхательными путями они позволяют: а) устранить воздушную ловушку; б) предотвратить или устранить ателектаз; в) мобилизовать накопившийся секрет.
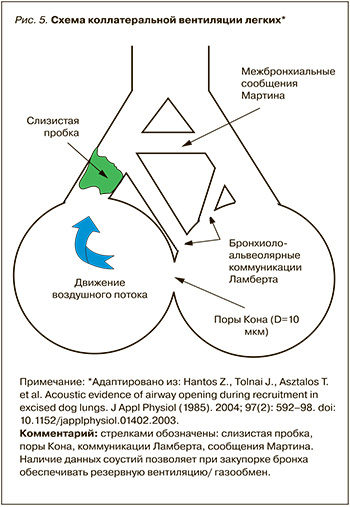 Главные физиологические эффекты МВС связаны с усилением коллатеральной вентиляции (рис. 5), снижением альвеолярных коллапсов, увеличением времени постоянства «альвеолярной открытости».
Главные физиологические эффекты МВС связаны с усилением коллатеральной вентиляции (рис. 5), снижением альвеолярных коллапсов, увеличением времени постоянства «альвеолярной открытости».
Проведение процедур ИТПД-терапии с использованием МВС-устройств связано с физическим усилием, расправляющим и перераспределяющим объем поступающего воздуха в дыхательные пути и альвеолы. Нагрузка стимулирует альвеолярное смешивание путем повышения потока вдыхаемого воздуха и возрастания кровотока. Так, при физической нагрузке повышение транспорта O2 и CO2 приводит к повышению их градиентов концентраций, которые способствуют «альвеолярной стратификации» (затрудняют газообмен и формируют дополнительное препятствие диффузии между газовой фазой и кровью).
Таким образом, применение МВС позволяет существенно усиливать коллатеральную вентиляцию и кровоток, что клинически выражается в расправлении ателектазов легких и нормализации газообменной функции:
- уменьшение альвеолярных коллапсов и увеличение времени постоянства «альвеолярной открытости»;
- усиление коллатеральной вентиляции уменьшает альвеолярные коллапсы, расправляет легкое и нормализует вентиляционно-перфузионное соотношение. Такое воздействие называют «маневр рекрутмента» – преднамеренный динамический процесс повышения транспульмонального давления, целью которого является полное открытие нестабильных безвоздушных (коллапсированных) альвеол;
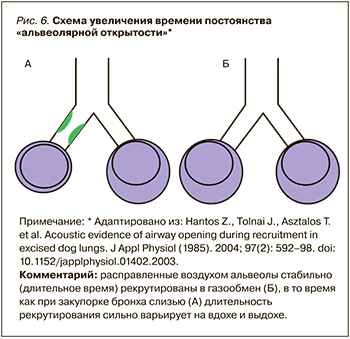
- открытие ателектазированных альвеол приводит к увеличению функционального остаточного объема легких, улучшая газообмен и ослабляя повреждение легких. Важный компонент в оценке «маневр рекрутмента» – увеличение времени постоянства «альвеолярной открытости».
 МВС «потокового типа» (CliniFlo, Portex, Tri-Flo) уместно назначать у пациентов с ослабленным дыхательным драйвом и склонных к редкой ЧДД (рестриктивный тип дыхательной недостаточности с нормокапническим рисунком дыхания). МВС «объемного типа» (Coach, Voldyne) эффективен у пациентов с обструктивными нарушениями вентиляции, когда требуется контроль за дыхательным объемом, дыхательной частотой, минутным объемом дыхания.
МВС «потокового типа» (CliniFlo, Portex, Tri-Flo) уместно назначать у пациентов с ослабленным дыхательным драйвом и склонных к редкой ЧДД (рестриктивный тип дыхательной недостаточности с нормокапническим рисунком дыхания). МВС «объемного типа» (Coach, Voldyne) эффективен у пациентов с обструктивными нарушениями вентиляции, когда требуется контроль за дыхательным объемом, дыхательной частотой, минутным объемом дыхания.
РЕСПИРАТОРНАЯ ТЕРАПИЯ С ПОЛОЖИТЕЛЬНЫМ ДАВЛЕНИЕМ (PЕP-ТЕРАПИЯ)
Цель: мобилизация секрета и создание условий для его эвакуации посредством повышения внутригрудного давления в дистальных отделах, усиление коллатеральной вентиляции, тренировка дыхательной мускулатуры, предотвращение ЭЗДП.
Основными типами устройств для PEP-терапии являются:
- PEP-устройства низкого давления (PEP-маски, Thera PEP-насадки);
- PEP-устройства для мышечной тренировки (Threshold – MEP);
- PEP-устройства высокого давления или изменяющие отношение «давление – объем» (EzPAP).
Основные физиологические эффекты таких устройств:
- снижение альвеолярных коллапсов;
- увеличение времени постоянства «альвеолярной открытости»;
- повышение коллатеральной вентиляции.
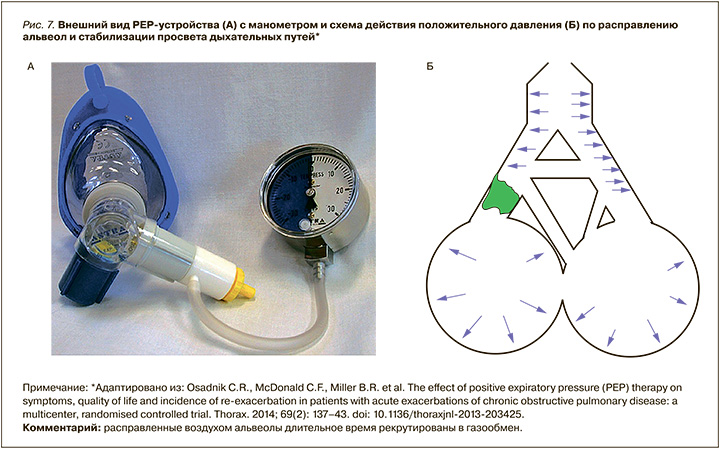
Действие PEP-устройств низкого давления и для мышечной тренировки основано на преодолении порогового сопротивления, создаваемого на выдохе (рис. 7, 8, 9).
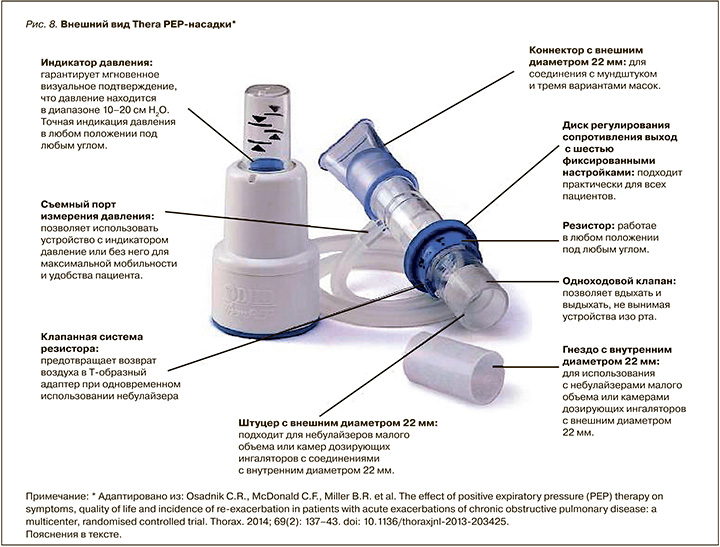
 Показания для проведения метода:
Показания для проведения метода:
- «возвратная» мокрота, не реагирующая на спонтанный кашель;
- история легочных заболеваний с накоплением слизи, ранее успешно леченных методом постурального дренажа (включая манипуляции на грудной клетке);
- доказательства накопления секрета;
- уменьшение «воздушной ловушки»;
- прекращение или уменьшение ателектазов легких;
- оптимизация распределения аэрозоля при бронхорасширяющей терапии.
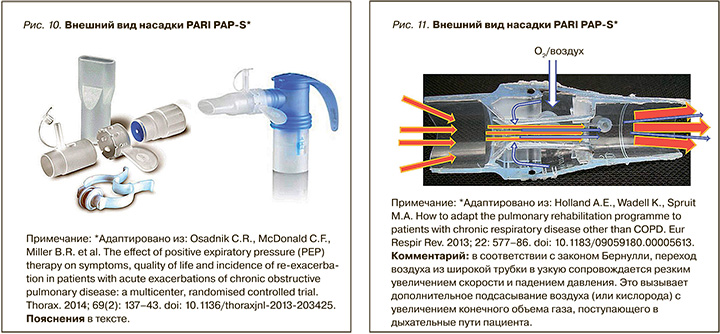
Аналогичными свойствами обладают специальные насадки для небулайзеров, создающие условия для PEP-терапии одновременно с ингаляционной терапией через небулайзер (рис. 10). Насадка для PEP-терапии создает положительное экспираторное давление 20–90 см вод.ст. Она предназначена для использования с приборами PARI LC® Plus и LC® Sprint (небулайзер малого объема), такая комбинация позволяет одновременно проводить PEP-терапию и доставлять необходимые аэрозоли.
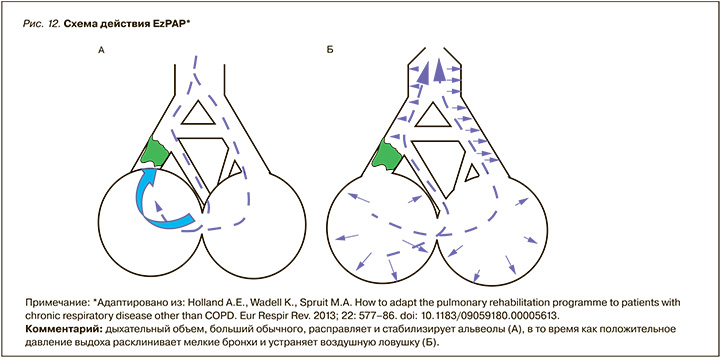
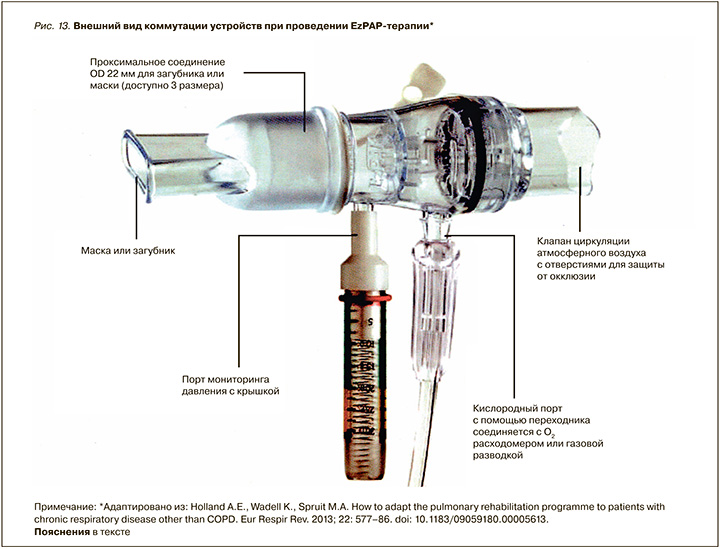
Отдельную нишу занимают устройства, основанные на одновременном изменении давления и объема в процессе проведения терапии, основанные на эффекте Коанда и законе Бернулли. К таковым относится EzPAP-устройство (рис. 11).
В соответствии с законом Бернулли, падение давления в трубке обратно пропорционально скорости движения воздушного потока. Сочетание в одной системе различных по размеру трубок для движения газа вызывает эффект «падения давления» в узкой части.
Этим можно воспользоваться, если организовать поступление воздуха (или кислорода) извне через калиброванное отверстие. Дополнительное поступление воздуха в зону низкого давления вызывает повышение общего потока в зоне выхода в 4–6 раз (ротовая часть системы), без существенного изменения давления (ширина трубки на выходе снова увеличивается для создания положительного давления).
Таким образом достигается двойной эффект: 1) пациент вдыхает большой дыхательный объем (глубокое дыхание); 2) положительное давление расклинивает мелкие дыхательные пути и снимает воздушную ловушку (рис. 12, 13).
Устройства для PEP-терапии с низким давлением (PEP-маски, Thera PEP, Threshold PEP) уместно назначать у пациентов с ослабленным дыхательным драйвом и сохранным мышечным усилием (обструктивный или рестриктивный тип дыхательной недостаточности с нормокапническим рисунком дыхания).
Устройства для EzPAP-терапии с высоким давлением эффективны, когда необходим контроль за дыхательным объемом, дыхательной частотой, минутным объемом дыхания. Такая терапия особенно важна для исключения возможности гиперкапнического типа дыхательных нарушений.
РЕСПИРАТОРНАЯ ТЕРАПИЯ С ОСЦИЛЛЯЦИОННЫМ ПОЛОЖИТЕЛЬНЫМ ДАВЛЕНИЕМ (оPЕP-ТЕРАПИЯ)
Цель: мобилизация секрета и создание условий для его эвакуации посредством повышения внутригрудного давления в дистальных отделах, стимуляция мукоцилиарного и кашлевого клиренса, усиление коллатеральной вентиляции, тренировка дыхательной мускулатуры, предотвращение ЭЗДП.
oPEP-терапия предусматривает сочетание положительного давления на выдохе с определенной частотой колебаний (резонансная частота). Она основана на выдохе с усилием против быстро меняющегося (осциллирующего) сопротивления в устройстве для осуществления:
- открытия периферических дыхательных путей (давление расклинивания);
- устранения воздушной ловушки (давление расклинивания);
- повышения мобилизации трахеобронхиального секрета (тиксотропный эффект);
- оптимизации экспекторации секрета в ходе терапии (резонансная частота).
Создание положительного давления в конце выдоха позволяет расправить, стабилизировать мелкие бронхиолы и альвеолы. Кроме того, эти зоны легких наполняются воздухом путем частых осцилляций небольшими порциями воздуха, что значительно повышает газообмен. Это безопасно, поскольку маленькие порции воздуха не создают резкого повышения давления в системе и не способствуют баротравме легких. Оптимальное давление находится в диапазоне 15–20 мбар.
Осцилляции воздушного потока внутри бронхиального дерева оказывают специфичное воздействие на трахеобронхиальный секрет – эффект «встряски» и эффект «движение–остановка» (англ. stop and go). Встряска трахеобронхиальной слизи вызывает уменьшение вязкости муцинов слизи, а «движение–остановка» провоцирует незначительную компрессию секрета, обеспечивающую поступательное его движение в каудальном направлении в сторону крупных бронхов. Особенно выражен такой эффект при частоте осцилляций от 12 до 30 Гц.
Если частота осцилляций воздушного потока станет равной частоте колебаний ресничек, наступает резонанс: усиление колебаний с ускорением движения трахеобронхиального секрета. Такой эффект наиболее выражен при частоте осцилляций от 12 до 16 Гц.
Экспекторация мокроты особенно эффективна при сочетании методов АЦД (маневр ФЭВ-Х) с oPEP-терапией.
Показания для проведения метода:
- «возвратная» мокрота, не реагирующая на спонтанный кашель;
- история легочных заболеваний с накоплением слизи, ранее успешно леченных методом постурального дренажа (включая манипуляции на грудной клетке);
- доказательства накопления секрета;
- уменьшение «воздушной ловушки»;
- прекращение или уменьшение ателектазов легких;
- оптимизация распределения аэрозоля при бронхорасширяющей терапии.
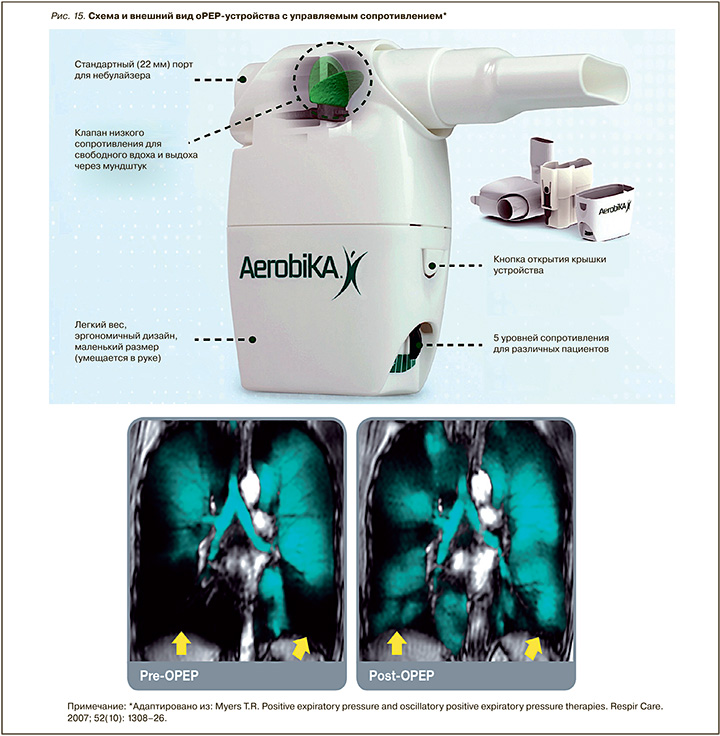
Основные устройства для проведения oPEP-терапии:
- гравитационный флаттер (PARI O-PEP®, Flutter®) (рис. 14);
- oPEP-устройство с управляемым сопротивлением и коммутацией с небулайзером (Aerobika®, Acapella®) (рис. 15, 16).


В зависимости от угла наклона может существенно изменяться как давление выдоха, так и частота осцилляций воздушного потока в бронхиальном дереве. Это правило особенно важно в случае использования гравитационных флаттеров.
Для эффективности oPEP-терапии важна упорядоченная последовательность действий пациента. Клинический алгоритм применения oPEP-устройства с управляемым сопротивлением Acapella® приведен в Приложении 4.
Последовательность действий при процедуре oPEP-терапии:
1. Пациент находится в вертикальном положении, сидя с прямой спиной и слегка вытянутой вверх головой, выполняя технику расслабленного контроля над дыханием.
2. Пациент выполняет глубокие вдохи (глубже в 2–3 раза, чем при обычном дыхании), с задержкой дыхания на высоте вдоха на 2–3 с.
3. Пациент подносит мундштук флаттера ко рту и усиленно выдыхает с большим потоком воздуха (поток в 2 раза больший, чем обычно), более 6 с или до достижения пациентом функциональной остаточной емкости легких.
4. NB! Необходимо избегать непродуктивных приступов кашля во время начальной фазы цикла «выдох–вдох».
5. NB! Необходимо во время выхода располагать флаттер горизонтально, чтобы добиваться максимальной осцилляции потока и ощущений вибрации в легких (правило для гравитационных флаттеров).
6. После серии циклов «глубокого дыхания» выполнить максимально глубокий вдох, на высоте которого задержать дыхание на 2–3 с, а затем форсировано выдохнуть через флаттер до достижения функциональной остаточной емкости.
7. После 1–2 циклов дыхания с максимальным объемом и высоким потоком выдоха (для экспекторации слизи) провести маневр «хаффинга» (ФЭМ-Х) или другого эффективного маневра выдоха (АЦД).
8. NB! Необходимо помнить, что все перечисленные действия должны выполняться после основных лечебных процедур (базовой терапии) или после активной бронхолитической терапии (в случае пациента с воздушной ловушкой или обструкцией дыхательных путей).
Необходимо отметить, что максимальная эффективность оPEP-терапии достигается при соблюдении следующих простых физических требований:
- пиковой скорости выдоха (ПСВ, PEF) в границах 0,5–1,2 л/с;
- осцилляции потока в бронхиальном дереве в границах 5–30 Гц;
- пиковом давлении выдоха (ПДВ, PEP) в границах 10–70 мбар.
Системы для PEP-терапии обычно хорошо переносятся большинством пациентов. Их можно использовать самостоятельно или в комплексной терапии. В отличие от традиционной физиотерапии грудной клетки, PEP-терапия является экономичным и эффективным методом удаления секрета. Независимость от необходимости ежедневного привлечения ассистирующего персонала не только повышает показатели эффективности, но и служит важным фактором сокращения расходов медицинского учреждения на данный вид терапии.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПРОТОКОЛА РЕСПИРАТОРНОЙ ФИЗИОТЕРАПИИ, УЛУЧШАЮЩЕЙ МОБИЛИЗАЦИЮ И ДРЕНАЖ ТРАХЕОБРОНХИАЛЬНОГО СЕКРЕТА
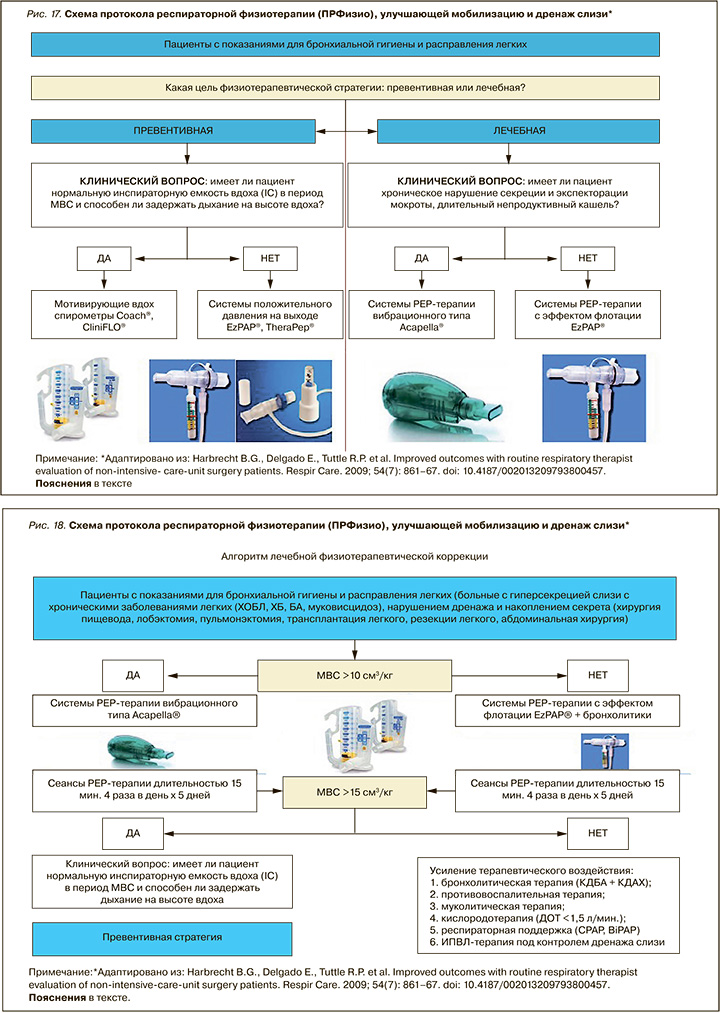
Наиболее интересным представляется опыт применения различных техник дренажа слизи у стационарных пациентов различных групп, опубликованный Harbrecht B.G. et al. в 2009 г. Он получил название «Питсбургский алгоритм». Его эффективность была проанализирована при проведении рандомизированного клинического исследования (РКИ) у 2805 пациентов Питсбургского медицинского центра, получающих респираторную физиотерапию методами PEP-терапии, МВС, ИТПД, аэрозольной бронходилатации (через небулайзерные устройства). Сравнение клинических свойств различных технологий очистки дыхательных путей отражено в таблице 3.

Предложен отдельный адаптированный в клинических условиях алгоритм физиотерапии для пациентов, находящихся на стационарном и амбулаторном этапе оказания лечебного пособия, имеющих и не имеющих хронического легочного заболевания (рис. 17, 18).
ИНТРАПУЛЬМОНАЛЬНАЯ ПЕРКУССИОННАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ
Цель: стимуляция мукоцилиарного и кашлевого клиренса, усиление коллатеральной вентиляции, стимуляция легочной микроциркуляции, нормализация вентиляционно-перфузионного соотношения, предотвращение ЭЗДП.
В настоящее время существует метод осцилляторной терапии с положительным давлением (oPEP-терапия), совмещенный с респираторной поддержкой, создающий условия для мобилизации секрета и способствующий адекватной вентиляции легких (высокочастотная вентиляция легких).
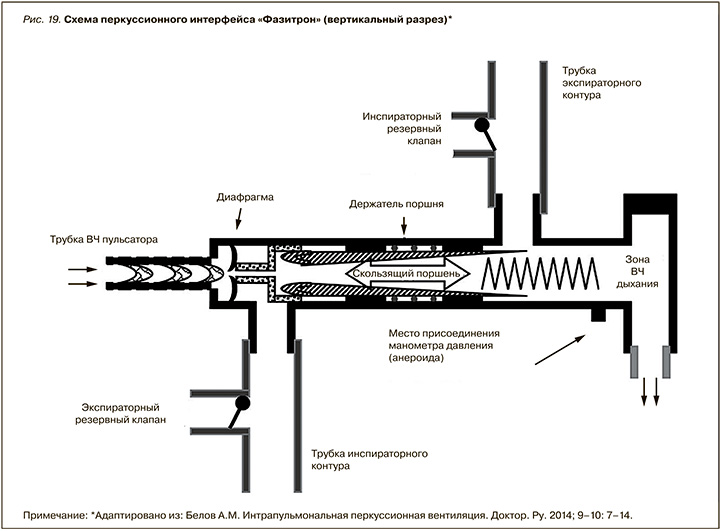
Интрапульмональная перкуссионная вентиляция легких (ИПВЛ) – это такой метод респираторной терапии, когда посредством воздушного потока с высокой скоростью через специальный открытый дыхательный контур пациенту подаются маленькие объемы воздуха (по автору – «перкуссии») с высокой регулируемой частотой и низким уровнем давления, которые накладываются на самостоятельное дыхание пациента.
«Сердцем» прибора служит открытый дыхательный интерфейс, соединяющий пациента с аппаратом, названным по автору «Фазитрон». В конструкции «Фазитрона» использованы закон Бернулли и эффект Вентури. Для своей работы «Фазитрон» использует энергию сжатого воздуха, поступающего на распределительную диафрагму под давлением в 4–6 атмосферы из баллона (транспортный вариант) или стационарного порта высокого давления (реанимационная консоль). Совершая возвратно-поступательное движение (возможно регулировать частоту этих движений), диафрагма «нарезает» воздушный поток на «пневматические диффузионные конвективные толчки» – «перкуссии», которые при работе возвратно-поступательного «скользящего поршня» приобретают определенную высокую частоту (регулируемую по обратной связи) и полностью теряют давление, сохраняя при этом скорость движения, что обеспечивает поступление воздуха в дыхательные пути пациента. Выдох пациента происходит через отверстие выдоха, расположенное до зоны возвратно-поступательного движения поршня, что обеспечивает эффект вентиляции с «открытым контуром» (рис. 19).
Оригинальным техническим решением явилась идея «открыть» контур и перед рабочей частью поршня. Тем самым появилась возможность в соответствии с законом Вентури «присасывать» порцию воздуха извне (вне контура пациента), поддерживая необходимое значение уровня индекwса Фико (содержания кислорода в газовой смеси; FiO2) во вдыхаемой смеси. Такая оригинальная технология создает условие для увлажнения воздуха, резко уменьшает расход «рабочего газа», позволяет совместить эту зону с небулайзером для своевременной доставки лекарственного вещества.
Поступательные пневматические диффузионные конвективные толчки вызывают обратные пневматические толчки, активируя слизь и систему мукоцилиарного бронхоальвеолярного клиренса, что крайне важно для большинства вентилируемых пациентов (рис. 20).

«Фазитрон» автономно регулирует соотношение «поток–давление», исключая потенциальную возможность баротравмы. Можно с уверенностью говорить, что из всех существующих вентиляционных устройств «Фазитрон» на сегодняшний день – самый безопасный.
В настоящих рекомендациях устройство ИПВЛ рассматривается исключительно с позиции респираторной физиотерапии, когда основным действием на бронхиальное дерево пациента становится мобилизация секрета, улучшение его дренажа и создание условий для устранения воздушных ловушек и ателектазов легких. Это важно, так как комплекты устройств для ИПВЛ-терапии существенно отличаются друг от друга в зависимости от предполагаемых задач. Именно поэтому здесь и далее речь пойдет об устройстве Universal Bi-phasic Home Therapy (HC) IMPULSATOR®, которое, по сути, является оригинальным физиотерапевтическим устройством для домашнего и стационарного использования (рис. 21).
Механизмы действия ИПВЛ-терапии:
1. Вовлечение легочных структур или «рекрутирование легких».
2. Мобилизация и удаление трахеобронхиального секрета.
3. Усиление процессов диффузии.
4. Улучшение бронхиального кровотока и микроциркуляции.
5. Устранение ограничений воздушного потока и «воздушных ловушек».
При ряде хронических легочных заболеваний появляется патологическая гетерогенность, которая особенно выражена и разнообразна при наличии воздушной ловушки и/или ателектазах легких. В таких случаях при самостоятельном дыхании пациента воздушные потоки и газообмен будут оптимальны только в доступных, открытых для прохождения воздуха зонах. Закрытые участки существенно повлияют на вентиляционно-перфузионные соотношения и газообмен (рис. 22).

При такой гетерогенности поражения, чтобы включить в газообмен («рекрутировать») все зоны легких, рационально использовать:
- маленькие объемы, способные проникнуть в узкие просветы дыхательных путей;
- высокую частоту потока (для предупреждения резких повышений давления) и волновые колебания (для преодоления сопротивления);
- высокую скорость потока (для достижения периферических зон бронхиального дерева вплоть до альвеол);
- низкое давление потока (для предупреждения баротравмы);
- наличие обратной связи по сопротивлению, т.е. способности вентилирующей системы реагировать на изменения состояния легких.
Отдельно следует остановиться на технике мобилизации секрета с помощью «расклинивающего» давления. Пульсирующий быстрый поток воздуха при ИПВЛ-терапии создает в дыхательных путях колебательные движения, способствующие мобилизации бронхиального секрета. В соответствии с третьим законом Ньютона высокоскоростной воздушный поток, достигая препятствия или узких периферических зон легких, производит силу, действующую в противоположном направлении. Возникает противофазный поток, перемещающий секрет в проксимальном направлении, откуда пациент может его самостоятельно удалить посредством кашля. Интенсивность противофазного потока зависит от эластичности легочной ткани и эффекта «рикошета». Для улучшения дренажа слизи в ряде случаев целесообразно использовать специальные эластичные пояса, накладываемые на грудную клетку для усиления «рикошетных сил».
Особым фактором, способствующим движению мокроты из дистальных отделов при ИПВЛ-терапии, является PEEP-эффект, или сохранение положительного давления после каждого перкуссионного цикла. Оно поддерживает периферические дыхательные пути в открытом состоянии и стабилизирует их (так называемое расклинивающее давление). РЕЕР-эффект значимо уменьшает легочную гиперинфляцию, особенно в случае раннего экспираторного коллапса с формированием феномена «воздушной ловушки». Различные экспериментальные и клинические исследования подтверждают наличие эффективной дренажной функции при ИПВЛ-терапии (рис. 23).
Последовательность действий при процедуре ИПВЛ-терапии:
1. Пациент находится в вертикальном положении, сидя с прямой спиной и слегка вытянутой вверх головой, выполняя технику расслабленного контроля над дыханием.
2. Пациент расслаблено спокойно дышит через загубник в режиме «небулайзер» в течение 2 мин («Фазитрон» скоммутирован с небулизационным стаканчиком, и в него залито 15 мл физиологического раствора комнатной температуры). Этап увлажнения секрета для его мобилизации.
3. Пациент расслабленно спокойно дышит через загубник в режиме «перкуссия Bi-PHASIC» в течение 3 мин, используя частоту «предварительной» перкуссии (ручка регулировки в положении от «9 часов» до «12 часов»). Частота подбирается в зависимости от переносимости пациентом силы перкуссий.
4. Пациент расслабленно спокойно дышит через загубник в режиме «перкуссия Bi-PHASIC» в течение 5 мин, используя частоту «усиленной» перкуссии (ручка регулировки в положении от «12 часов» до «6 часов»). Частота подбирается в зависимости от переносимости пациентом силы перкуссий.
5. Пациент расслаблено спокойно дышит через загубник в режиме «небулайзер» в течение 2 мин («Фазитрон» скоммутирован с небулизационным стаканчиком, и в него залито 15 мл физиологического раствора комнатной температуры). Этап увлажнения секрета для его мобилизации.
6. Пациент расслабленно спокойно дышит через загубник в режиме «перкуссия Bi-PHASIC» в течение 5 мин, используя частоту «усиленной» перкуссии (ручка регулировки в положении от «12 часов» до «6 часов»). Частота подбирается в зависимости от переносимости пациентом силы перкуссий.
7. Завершающие 3 мин пациент дышит глубоко через загубник в режиме «перкуссия Bi-PHASIC», используя частоту «усиленной» перкуссии (ручка регулировки в положении от «12 часов» до «6 часов»). Частота подбирается в зависимости от переносимости пациентом силы перкуссий.
8. После 1–2 циклов дыхания с максимальным объемом и высоким потоком выдоха (для экспекторации слизи) пациент проводит маневр «хаффинга» (ФЭМ-Х) или другого эффективного маневра выдоха (АЦД) для экспекторации мокроты.
9. NB! Необходимо избегать непродуктивных приступов кашля во время начальной фазы цикла «выдох–вдох».
10. NB! Необходимо помнить, что все перечисленные действия должны выполняться после основных лечебных процедур (базовой терапии) или после активной бронхолитической терапии (в случае пациента с воздушной ловушкой или обструкцией дыхательных путей).
ЭКСТРАПУЛЬМОНАЛЬНАЯ ВЫСОКОЧАСТОТНАЯ ОСЦИЛЛЯЦИЯ ГРУДНОЙ КЛЕТКИ (ТЕХНОЛОГИЯ VEST-ЖИЛЕТ)
Цель: стимуляция мукоцилиарного и кашлевого клиренса, тренировка дыхательной мускулатуры.
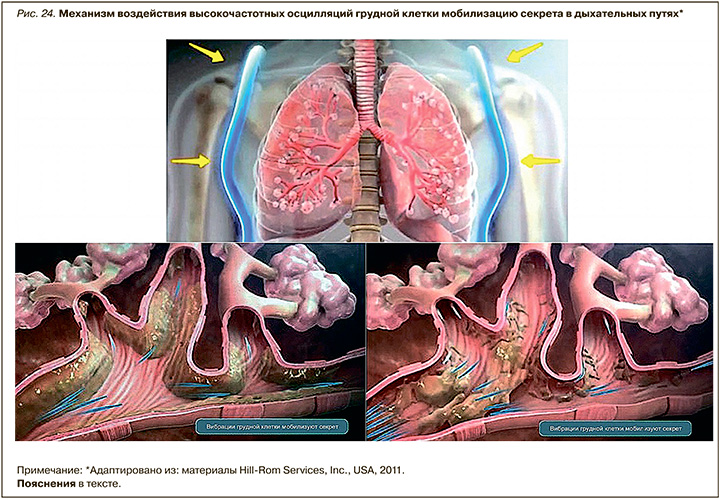
Сущность этой методики заключается в создании неинвазивным путем высокочастотных осцилляций грудной клетки (ВчОГК), которые, передаваясь бронхам и бронхиолам (дыхательным путям) и проходящему по ним воздушному потоку (воздух, газ), способствуют улучшению мобилизации слизи, легочному газообмену и трахеобронхиальному клиренсу (рис. 24).
 В настоящий момент в России зарегистрирован и используется аппарат для проведения ВЧОГК The Vest Airway Clearance System (Hill-Rom Services, Inc., США, 2011), который представляет собой систему очистки дыхательных путей 5 поколения (рис. 25).
В настоящий момент в России зарегистрирован и используется аппарат для проведения ВЧОГК The Vest Airway Clearance System (Hill-Rom Services, Inc., США, 2011), который представляет собой систему очистки дыхательных путей 5 поколения (рис. 25).
Система состоит из: 1) надувного жилета; 2) двух трубок, соединенных с жилетом и дистанционным генератором воздушного давления.
Показания к проведению ВЧОГК:
- заболевания бронхолегочной системы, сопровождающиеся изменениями легочной вентиляции, механики дыхания, гиперпродукцией мокроты;
- сегментарные и долевые ателектазы на фоне респираторных инфекций нижних дыхательных путей;
- пневмонии с нарушением дренажной функции бронхов.
Противопоказания к проведению ВЧОГК:
- высокая лихорадка (температура тела выше 38 °С);
- буллы в легких, особенно дистального расположения;
- кровохарканье и тромбоэмболия легочной артерии (ТЭЛА);
- тяжелые нарушения ритма сердца и имплантированный электрокардиостимулятор;
- нестабильная гемодинамика (острый инфаркт миокарда, острые нарушения мозгового кровообращения (ОНМК), нарушения ритма сердца, кардиостимулятор, хроническое легочное сердце 2–3 ст., застойная сердечная недостаточность);
- острое повреждение головы и шеи, нарушение сознания;
- парциальное давление кислорода в артериальной крови (PaO2) <40 мм рт.ст., парциальное давление углекислого газа в артериальной крови (PaCO2) >75 мм рт.ст., pH <7,25;
- злокачественные опухоли любой локализации;
- наличие кожных повреждений в зоне воздействия;
- беременность и лактация.
Процедура на аппарате ВчОГК Vest проводится до еды или через несколько часов после еды. Под жилет надевается хлопчатобумажная футболка. Не требуется принятия какого-либо специального положения во время процедуры, аппарат воздействует равномерно на все легочные поля. Широкий диапазон регулировок параметров вентиляции позволяет оптимизировать режим строго индивидуально.
Генератор воздушного давления быстро нагнетает и выпускает воздух из жилета, надувая и сдувая его. Создается насильственное движение грудной клетки за счет сжатия и расслабления. Частота вибрации и давления грудной клетки регулируется с помощью настройки прибора.
Высокочастотные колебания передаются на стенки бронхов, мобилизуя секрет, способствуя его эвакуации в бронхи более крупного калибра, что облегчает откашливание мокроты. Необходима следующая последовательность установок:
- частота от 1–20 Гц;
- давление от 1–12 Бар (зависит от фасона комплекта);
- время процедуры от 1–30 мин;
- количество процедур ВчОГК в день:
- 2–3 раза в домашних условиях;
- 3–4 в условиях стационара;
- пациенту рекомендуется прерывать процедуру каждые 5 мин для того, чтобы сделать сильный выдох, глубокий вдох, а затем откашлять образовавшийся секрет (метод ФЭМ-Х);
- возможно проведение ВЧОГС при наличии дренажных трубок, катетеров, если:
- обеспечить правильное положение и безопасность катетеров, дренажных трубок и т.д. до начала процедуры;
- избегать давления или действия осцилляций, а места рядом с точками выведения дренажей проложить полотенцем;
- до начала сеанса и по его окончании проверить правильное расположение и состоятельность всех дренажей, трубок, инвазивных устройств.
ОТКАШЛИВАТЕЛИ
 Цель: стимуляция мукоцилиарного и кашлевого клиренса, тренировка дыхательной мускулатуры.
Цель: стимуляция мукоцилиарного и кашлевого клиренса, тренировка дыхательной мускулатуры.
Методика «помощи кашлю» путем аппаратного ассистента (помощника) осуществляется через специальные «откашливатели», представляющие собой эффективный инсуффлятор/эксуффлятор (вдуватель/выдуватель воздуха), используемый для неинвазивного удаления мокроты посредством наращивания положительного давления в дыхательных путях пациента с последующим быстрым переключением на отрицательное. Благодаря резкому перепаду давления провоцируется глубокий естественный кашель с отделяемым секретом. Одним из наиболее интересных устройств является откашливатель Cough Assist E70 (Philips Respironics., США) (рис. 26).
Как показывает практика, использование откашливателя Cough Assist E70 позволяет добиться более продолжительного терапевтического эффекта, чем при традиционной трахеальной аспирации. При этом удается существенно сократить число возможных осложнений.
Применение Cough Assist Е70 позволяет снизить интенсивность и сократить частоту появления респираторных инфекций рецидивирующего характера. Специальный алгоритм Cough-Track (метод направленного кашля) обеспечивает автоматическую синхронизацию работы Cough Assist Е70 с дыханием пациента, что снижает нагрузку на его дыхательную систему и улучшает переносимость процедуры. Интуитивный интерфейс и три настраиваемых шаблона терапии (рассчитанные на низкую, среднюю и высокую скорость вдоха) позволяют быстро адаптировать интенсивность процедуры под текущее состояние пациента. Компактные размеры, небольшой вес и возможность питания откашливателя Cough Assist E70 от аккумулятора (до 24 ч) обеспечивают его простую транспортировку и мобильность применения.
Особенностью Cough Assist E70 как устройства для инсуффляции/эксуффляции является создание в момент вдоха/выдоха пациента высокочастотных осцилляций, поддерживающих дыхательные пути открытыми, даже у пациентов с существенным нарушением мышечного тонуса.
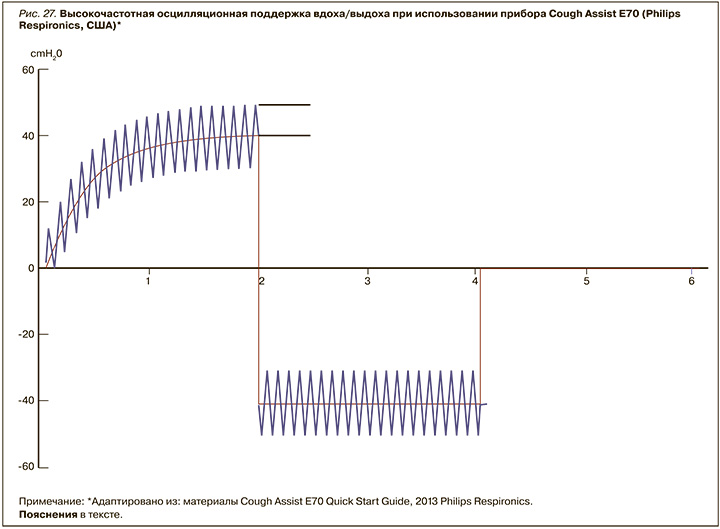
Поскольку снижение показателя пиковой скорости кашля (ПСК=PCF) в диапазоне 160–270 л/мин вызывает умеренный риск нарушений дренажа слизи, а значение <160 л/ мин создает условие невозможности такового дренажа, использование других техник, кроме «аппаратных помощников кашля», становится проблематичной. Знание того, что дыхательные пути при ослабленной мускулатуре способны коллапсировать как в момент вдоха, так и в момент выдоха, простое нагнетание/разрежение в цикле «вдох–выдох» могут вызвать серьезные механические повреждения или баротравму.
Для исключения такой возможности в устройстве Cough Assist E70 используется высокочастотная настраиваемая осцилляция вдоха–выдоха, не создающая никакого дополнительного сопротивления к движению воздушного потока (рис. 27).
Показания для проведения метода – пациенты с неэффективным кашлем.
Абсолютные противопоказания:
- буллезная эмфизема легких;
- пневмоторакс;
- повторяющиеся баротравмы или баротравма в анамнезе;
- неконтролируемый приступ удушья при бронхиальной астме;
- тяжелая гипотензия;
- клинически значимое легочное кровотечение;
- коллапс верхних воздухоносных путей.
Повышенный контроль:
- проведение процедуры после приема пищи;
- гастроэзофагеальный рефлюкс;
- резкое учащение дыхательных движений (повышение частоты дыхания);
- гемодинамическая нестабильность;
- тяжелый бронхоспазм в период процедуры;
- выраженные боли грудной клетки в период процедуры.
Последовательность действий при использовании CoughAssist-E70:
1. Пациент находится в вертикальном положении, сидя с прямой спиной и слегка вытянутой вверх головой, выполняя технику расслабленного контроля над дыханием.
2. Пациент расслаблено спокойно дышит через маску с давлением вдоха (инспираторное) +10 и +15 см H2O и давлением выдоха (экспираторное) -10 и -15 см H2O. Установки скорости потока вдоха минимальные.
3. Нажмите кнопку «терапия» для начала процедуры. Начните с попытки одиночного простого маневра кашля для акклиматизации к устройству. «Цикл кашля» состоит из одного глубокого вдоха, далее паузы и выдоха. Установите переключатель в позицию «вдох» и удерживайте в течение 1–3 с. После этого быстро переместите переключатель в позицию «выдох» на 0,5–2 с, а затем установите нейтральное положение. Убедитесь в комфортности для пациента и переносимости маневра. Регулируйте время вдоха–выдоха для наилучшего согласования вдоха и частоты дыхания. При автоматическом режиме используйте режим Cough-Trak для автоматической синхронизации прибора и пациента.
4. Продолжайте терапию с использованием «циклов кашля». В течение одной сессии у педиатрических пациентов следует использовать от 3 до 6 таких циклов, у взрослых больных – от 4 до 6. Следите за толерантностью к проводимой процедуре. Между сессиями необходимо выдерживать паузу в 30–60 с. Следите за восстановлением сатурации и вентиляции легких в период отдыха пациента. Выполните не менее 3–5 сессий для педиатрических пациентов и не менее 4–6 сессий для взрослых больных за один лечебный сеанс.
5. Периодически повышайте уровень инспираторного и экспираторного давления. Установите уровень воздушного потока, комфортный для пациента. Положительное давление вдоха устанавливается по эффективным экскурсиям грудной клетки и аускультативной картине билатерального распределения воздуха в легких. Отображаемый на дисплее дыхательный объем является подсказкой в титрации инспираторного давления и адекватных инспираторных объемов. Отображаемый на дисплее уровень ПСК является критерием эффективного давления выдоха. Обычно давление вдоха–выдоха уровнем +/- 40 см H2O хорошо переносятся пациентами. В режиме автоматической работы настройка параметров происходит самостоятельно аппаратом с использованием триггера для пациента. При этом аппарат самостоятельно повышает или понижает давление, руководствуясь оптимальными параметрами пиковой скорости кашля.
6. Установка осцилляционной поддержки доступна как в режиме ручной, так и автоматической коррекции при вдохе и выдохе пациента. Задача осцилляторной поддержки – устранить препятствия для мобилизации и экспекторации слизи. Начинайте осцилляторную поддержку с частоты в 20 Гц c низкой амплитудой в 1 см H2O и увеличивайте параметр в зависимости от переносимости пациентом.
7. Критерием эффективности проведенного сеанса Cough Assist E70 служит увеличение ПСК >270 л/мин при бронхолегочных заболеваниях (наличии аспирации или инфекции дыхательных путей) или >160 л/мин при нейромышечных нарушениях. При этом сатурация крови должна поддерживаться на уровне SpO2 >95% при FiO2=21%.
ГАЛОТЕРАПИЯ
Цель: стимуляция мукоцилиарного клиренса, седативный эффект.
Галотерапию проводят в галокамерах – помещениях с покрытием стен (иногда и пола) кристаллами поваренной соли и оснащенных генераторами дозированного мелкодисперсного аэрозоля поваренной соли. Солевые аэроионы стимулируют мукоцилиарный клиренс и при седиментации на слизистой бронхов уменьшают ее отечность. Действие аэроионов сопряжено с достаточно выраженным седативным эффектом. Процедуры проводят ежедневно по 45 мин в течение 10–12 дней.
ДЛИТЕЛЬНАЯ ОКСИГЕНОТЕРАПИЯ
Цель: ликвидация или минимизация хронической дыхательной недостаточности.
Длительная малопоточная оксигенотерапия (ДОТ) может быть определена как кислородотерапия, используемая более 15 ч/сут у хронических пациентов с дыхательной недостаточностью. Хроническая гипоксемия у таких пациентов определяется как PaO2 ≤7,3 kPa (1 kPa=7,5 мм рт.ст. и 1 мм рт.ст.=0,133 kPa), а в конкретной клинической ситуации PaO2 ≤8,0 kPa (60 мм рт.ст.). Фактически практикующий специалист может ориентироваться на показатель насыщения артериальной крови кислородом у своего пациента (SpO2): при условии сохраненной циркуляции крови и уровня гемоглобина показатель SpO2 в покое менее 88% является аргументом в пользу проведения ДОТ.
Для проведения оксигенотерапии используют автономные и портативные источники кислорода: концентраторы кислорода, баллоны со сжатым газом и резервуары с жидким кислородом. На сегодняшний день чаще всего используются концентраторы кислорода.
Кислородный концентратор – аппарат для выделения молекул кислорода из окружающего воздуха, их концентрирование и подача в виде потока чистого кислорода. Принцип работы кислородного концентратора таков: обыкновенный воздух (FiO2=21%) компрессором нагнетается в цилиндр, содержащий шарики цеолита (молекулярное решето), где под действием давления и цеолита происходит его разделение на фракцию азота (N2) и кислорода (O2). Кислород концентрируется с одной стороны (порт пациента), а с другой стороны азот. Далее 95% кислородная смесь направляется по системе воздуховодов к дыхательным путям пациента, а азот сбрасывается в атмосферу комнаты (рис. 28).

Аппарат имеет 2 цилиндра, наполненных цеолитом. Специальный дроссель (заглушка) с периодичностью пропускает воздух то в один цилиндр, то в другой. При работе одного цилиндра (концентрация кислорода и накопление азота) второй автоматически «промывается» (выход азота в атмосферу). Срок годности цеолита зависит от интенсивности использования концентратора. Современные аппараты в среднем рассчитаны на 45 000–50 000 часов работы; работают от электросети; просты в эксплуатации; требуют минимального технического ухода (рис. 29).

Баллоны со сжатым газом в последнее время как постоянный источник О2 практически не используются, так как требуется частая их заправка (стандартные 40-литровые баллоны содержат О2 под давлением 150 Бар, такого количества кислорода хватает на 2 сут при потоке 2 л/ мин). Однако небольшие баллоны (1–2 л) могут быть использованы как источник кислорода во время прогулок, поездок и т.д. (амбулаторный источник кислорода). При потоке 2 л/мин таких баллонов хватает на 1–3 ч. Основным недостатком таких портативных систем являются сложности их заправки.
Существует различные кислородные интерфейсы для доставки O2 в дыхательные пути пациента. В домашних условиях чаще всего используются носовые канюли. Они довольно удобные, недорогие и хорошо воспринимаются большинством больных (рис. 30).
 Канюли позволяют создавать кислородно-воздушную смесь с содержанием кислорода (FiO2) до 24–40% при потоке О2 до 5 л/мин (FiO2, % = 20+4× (поток О2, л/мин)). Однако реальная фракция вдыхаемого кислорода зависит, кроме потока О2, от многих факторов: геометрии носоглотки, ротового дыхания, минутной вентиляции, дыхательного паттерна. Уменьшение дыхательного объема и минутной вентиляции приводит к повышению FiO2. Однако доставка кислорода в альвеолы происходит только во время ранней фазы вдоха (примерно 1/6 часть дыхательного цикла), в то время как остальной О2 расходуется вхолостую. Для осуществления более эффективной доставки О2 предложено несколько типов кислородосберегающих устройств: резервуарные канюли, пульсирующие устройства доставки кислорода и транстрахеальные катетеры; при их использовании достигается экономия О2 в 2–4 раза, т.е. возможно снижение потока О2 на такую величину, и, следовательно, увеличить время использования источников кислорода, что особенно важно для портативных систем.
Канюли позволяют создавать кислородно-воздушную смесь с содержанием кислорода (FiO2) до 24–40% при потоке О2 до 5 л/мин (FiO2, % = 20+4× (поток О2, л/мин)). Однако реальная фракция вдыхаемого кислорода зависит, кроме потока О2, от многих факторов: геометрии носоглотки, ротового дыхания, минутной вентиляции, дыхательного паттерна. Уменьшение дыхательного объема и минутной вентиляции приводит к повышению FiO2. Однако доставка кислорода в альвеолы происходит только во время ранней фазы вдоха (примерно 1/6 часть дыхательного цикла), в то время как остальной О2 расходуется вхолостую. Для осуществления более эффективной доставки О2 предложено несколько типов кислородосберегающих устройств: резервуарные канюли, пульсирующие устройства доставки кислорода и транстрахеальные катетеры; при их использовании достигается экономия О2 в 2–4 раза, т.е. возможно снижение потока О2 на такую величину, и, следовательно, увеличить время использования источников кислорода, что особенно важно для портативных систем.
Показания к ДОТ представлены в таблице 4.
Назначение ДОТ должно основываться на показателях газового состава артериальной крови; данных пульсоксиметрии в данном случае недостаточно, так как при наличии повышенных уровней карбоксигемоглобина и метгемоглобина значения насыщения крови кислородом будут завышены. Кроме того, ошибка метода пульсоксиметрии (аккуратность ±2–3%) в области значений, соответствующих РаО2 около 60 мм рт.ст., может сделать данный метод неадекватным для выявления гипоксемии.
Задачей кислородотерапии является коррекция гипоксемии и достижение значений РаО2 >60 мм рт.ст. и сатурации кислорода (SaO2) >90%. Считается оптимальным поддержание РаО2 в пределах 60–65 мм рт.ст. Благодаря сигмовидной форме кривой диссоциации оксигемоглобина, повышение РаО2 более 60 мм рт.ст. приводит лишь к незначительному увеличению SaO2 и содержанию О2 артериальной крови (СаО2), однако может приводить к ретенции углекислоты.
Длительная оксигенотерапия (ДОТ) у пациентов с хронической обструктивной болезнью легких:
- больные хронической обструктивной болезнью легких (ХОБЛ) с показателями покоя PaO2 ≤7,3 kPa (55 мм рт.ст.) должны рассматриваться как лица, подлежащие обязательному проведению ДОТ с целью сохранения легочной гемодинамики;
- ДОТ показана стабильным пациентам ХОБЛ с показателями покоя PaO2 ≤8,0 kPa (60 мм рт.ст.) и явлениями периферических отеков, полицитемии (гематокрит ≥55%) или легочной гипертензии;
- ДОТ показана всем пациентам с гиперкапнией покоя, если они имеют все остальные обязательные критерии ДОТ.
Длительная оксигенотерапия (ДОТ) у пациентов с другими респираторными заболеваниями или сердечной патологией:
- показана пациентам с интерстициальным заболеванием легких (ИЗЛ) и показателями покоя PaO2 ≤7,3 kPa (55 мм рт.ст.);
- показана пациентам ИЗЛ с показателями покоя PaO2 ≤8,0 kPa (60 мм рт.ст.) и явлениями периферических отеков, полицитемии (гематокрит ≥55%) или легочной гипертензии.
Длительная оксигенотерапия (ДОТ) у пациентов с легочной гипертензией показана пациентам с легочной гипертензией, включая идиопатическую легочную гипертензию, при показателях PaO2 ≤8,0 kPa (60 мм рт.ст.).
Длительная оксигенотерапия (ДОТ) у пациентов с сердечной недостаточностью:
- показана пациентам с сердечной недостаточностью и показателями покоя PaO2 ≤7,3 kPa (55 мм рт.ст.);
- показана пациентам с сердечной недостаточностью и показателями покоя PaO2 ≤8,0 kPa (60 мм рт.ст.) при явлениях периферических отеков, полицитемии (гематокрит ≥55%) или ЭКГ и Эхо-КГ доказательствами легочной гипертензии.
ДОТ необходимо выполнять с минимальной длительностью от 15 ч/сут. Проведение ДОТ в течение 24 ч может иметь дополнительные преимущества.
Сила воздушного потока для проведения ДОТ:
- инициация ДОТ у пациентов, соответствующих критериям, производится воздушным потоком в 1 л/мин и титруется с повышением на 1 л/ мин до тех пор, пока SpO2 не превысит 90%. При проведении газового анализа артериальной крови необходимо убедиться, что в покое PaO2 ≥8,0 kPa (60 мм рт.ст.);
- инициацию ДОТ у негиперкапнических пациентов возможно проводить в период сна повышением на 1 л/мин при условии отсутствия любых противопоказаний к ДОТ;
- пациенты с достаточной амбулаторной активностью, находящиеся на ДОТ, должны получать дополнительный кислород в связи с возрастающей потребностью в нем при выполнении физической нагрузки.
Контроль за проведением ДОТ:
- пациенты на ДОТ должны через 3 мес пройти обязательную процедуру оценки газов крови и скорости кислородного потока для понимания необходимости дальнейшего проведения процедуры и ее терапевтической эффективности;
- в свою очередь, через 6 и 12 мес после этой оценки пациенты на ДОТ должны пройти обязательный контроль на дому или в стационаре;
- визиты для контроля за выполнением ДОТ проводит специалист, имеющий необходимую подготовку и знания в области проведения домашней кислородотерапии.
НЕИНВАЗИВНАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ
Цель: ликвидация или минимизация хронической дыхательной недостаточности и острой дыхательной недостаточности, возникающей в определенное время суток.
СРАР-терапию назначают при наличии у пациента среднетяжелого и тяжелого обструктивного апноэ сна (индекс апноэ–гипопноэ более 15 соб./ч или десатурация ≤90 в течение более 10% времени сна). Диагностика ночного апноэ осуществляется при помощи полисомнографии, полиграфии или ночного кардиореспираторного мониторинга. Современные СРАР-аппараты подают в дыхательные пути воздух под давлением 5–20 см вод.ст. Давление на вдохе и выдохе автоматически изменяется в зависимости от сопротивления дыхательных путей (режим autoCPAP).
Успех СРАР-терапии в значительной мере определяется правильным подбором интерфейса (назальные подушечки, носовые, носоротовые маски), обеспечивающего комфорт пациента и минимализацию утечек воздуха. Аппараты оснащены картой памяти, фиксирующей показатели давления в системе, утечки и наличие эпизодов апноэ. Оптимально использование СРАР не менее 6 ч в течение ночного сна.
В настоящее время пока нет объективных данных, отражающих влияние инфекции COVID-19 и ее последствий на выраженность ночного апноэ, однако есть основания предполагать негативный характер этого влияния, особенно у лиц с избыточным весом. Применение технологии СРАР может значительно уменьшать продолжительность гипоксемических эпизодов. Последнее в значительной мере послужило основанием для использования этой методики у больных COVID-19 не только в ночное, но и в дневное время.
Двухуровневая неинвазивная вентиляция (BiPAP) показана больным с гиперкапнической дыхательной недостаточностью (сопутствующие тяжелая ХОБЛ, нейромышечные заболевания, синдром ожирения–гиповентиляции).
III. ЛЕКАРСТВЕННАЯ ТЕРАПИЯ РЕСПИРАТОРНЫХ НАРУШЕНИЙ
Бронхолитическая терапия показана больным с клинически или инструментально подтвержденной бронхиальной обструкцией. При ее отсутствии бронхолитическая терапия нецелесообразна и может быть сопряжена с нежелательными побочными эффектами. Возможно использование коротко действующих ингаляционных α-адреномиметиков, М-холинолитиков или их фиксированных комбинаций, однако такой подход чреват невольной передозировкой, особенно у лиц, впервые получающих подобную терапию. Рационально использование двойной бронходилатации с фиксированной комбинацией пролонгированных α-адреномиметиков и М-холинолитиков (Аноро Эллипта, Спиолто Респимат, Ультибро Бризхалер). В ряде случаев у лиц, перенесших COVID-19 и страдающих ХОБЛ, может наблюдаться обострение этого хронического заболевания. В этом случае необходимо проанализировать характер обострения (усиление бронхиальной реактивности, нарастание сердечной недостаточности, бактериальная инфекция, тромбоэмболия ветвей легочной артерии и др.) и, помимо специфического лечения, увеличить объем бронхолитической терапии, облегчить доставку лекарств путем использования небулайзера и в ряде случаев добавить ингаляционную или пероральную стероидную терапию.
Инфекция COVID-19 способствует повышению бронхиальной реактивности, что может провоцировать ухудшение течения сопутствующей бронхиальной астмы. В этом случае целесообразно увеличить объем базисной медикаментозной терапии на одну ступень сроком на 1–2 мес.
Муколитическая терапия показана пациентам, имеющим сохраняющийся кашель с трудно отделяемой мокротой. Муколитики (N-ацетилцистеин, карбоцистеин, амброксол и эрдостеин) разжижают мокроту и стимулируют мукоцилиарный клиренс. N-ацетилцистеин обладает выраженным антиоксидантным действием, но не может назначаться одновременно с антибиотиками.
Среди химических форм карбоцистеина можно выделить карбоцистеина лизиновую соль – КЛС (Флуифорт): добавление лизина в данном случае позволило улучшить фармакодинамические и фармакокинетические свойства препарата. КЛС регулирует вязкость бронхиального секрета на этапе его образования и повышает скорость мукоцилиарного транспорта. Карбоцистеин может назначаться с антибиотиками, причем он повышает концентрацию лекарственных средств этой группы в очаге воспаления.
Среди противокашлевых (антитуссивных) средств можно выделить препарат с периферическим действием леводропропизин (Левопронт). Он не оказывает негативного действия на центральную нервную систему и не влияет на мукоцилиарный транспорт. Назначение леводропопизина позволяет снизить интенсивность, частоту кашля и пробуждения в ночное время.
В редких случаях при изнуряющем непродуктивном кашле возможно назначение некодеиновых противокашлевых препаратов (бутамират).
Остается дискуссионным вопрос по поводу назначения пероральной стероидной терапии больным, перенесшим COVID-19. С одной стороны, налицо нередко длительно сохраняющиеся морфологические изменения в легких, проявляющиеся в виде феномена «матового стекла» на компьютерной томограмме (КТ), что в значительной мере отражает позднее и медленное развитие экссудативной фазы воспаления, и общевоспалительные изменения (слабость, субфебрильная лихорадка, снижение аппетита), которые не дают достаточных оснований для подозрений насчет присоединения бактериальной инфекции. С другой стороны, известны побочные эффекты пероральной стероидной терапии: гастропатии, артериальная гипертензия (АГ), гипергликемия и возможное обострение бактериальной инфекции.
Тем не менее мы придерживаемся взгляда о целесообразности применения длительной (1–1,5 мес) низкодозовой (4–8 мг метилпреднизолона) пероральной стероидной терапии у лиц с сохраняющимися феноменом «матового стекла» на КТ и общевоспалительными изменениями. Такой подход получает все больше оснований в связи с патоморфологическими данными, свидетельствующими о чрезвычайной схожести поражения легких при COVID-19 с легочными васкулитами, при которых традиционно применяется стероидная терапия. В любом случае ее назначение должно учитывать пользу и риск и оформляться решением консилиума.
Назначение высоких доз стероидов и моноклональных антиинтерлейкин-6 антител (тоцилизумаб) с целью борьбы с «цитокиновым штормом» на этапе реабилитации не актуально.
При нетяжелой легочной гипертензии (давление в легочной артерии до 50 мм рт.ст.) можно рассчитывать на постепенное снижение давления по мере течения заболевания без дополнительного медикаментозного вмешательства. При достаточно выраженной клинической симптоматике возможно использование диуретиков, амлодипина и силденафила. Назначение бозантана и простаноидов требуется при тяжелой и прогрессирующей легочной гипертензии.
Важно учитывать противовоспалительное действие ингибиторов ангитензинпревращающего фермента, связанное с частичной блокадой ангиотензина II, который является одним из важнейших участников воспалительного каскада. Доказано плейотропное противовоспалительное действие статинов, а также аддиктивное действие малых доз селективных β-блокаторов (сверхрегуляция) в отношении чувствительности α-адренорецепторов бронхов. Эти лекарственные средства в настоящее время не рассматриваются в качестве самостоятельных средств воздействия на респираторную систему, однако не стоит игнорировать их доказанные свойства при выборе препаратов и фиксированных комбинаций для пациентов с сопутствующими гиперлипидемиями, АГ и сердечной недостаточностью.
IV. ЛЕКАРСТВЕННАЯ ТЕРАПИЯ ЗАБОЛЕВАНИЙ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ФАКТОРЫ РИСКА ТЯЖЕЛОГО ТЕЧЕНИЯ COVID-19
В соответствии с европейскими рекомендациями по ведению сердечно-сосудистой патологии, во время пандемии коронавирусной инфекции выделяются следующие сопутствующие состояния, с которыми ассоциировано тяжелое течение заболевания:
- хронические заболевания легких, хроническая сердечная недостаточность, лист ожидания сердечной хирургии, имуннодефицитные состояния или предшествующая трансплантация органа;
- АГ;
- ИБС;
- цереброваскулярные болезни;
- сахарный диабет (СД);
- ожирение.
Именно эти клинические группы пациентов требуют пристального внимания в период течения инфекции и на этапе реабилитации.
Патогенез коронавирусной инфекции включает несколько этапов (рис. 31).

Отсутствует единая терминология для определения сути патогенеза с точки зрения формирования системной сосудистой патологии, полиорганной недостаточности и нарушений гемостаза. Используемые термины демонстрируют несогласованность в понимании патогенеза процесса: тромбовоспалительный синдром (MicroCLOTS), системный эндотелиит, микротромбоваскулит и т.д. Однако единой точкой зрения является признание ведущей роли системной воспалительной реакции с формированием «цитокинового шторма» в тяжелых случаях и выраженными нарушениями гемостаза. Вывод: следует максимально применять предсуществующие, уже известные протективные стратегии (препараты с противовоспалительными эндотелий-регурирующими свойствами, дезагреганты и антикоагулянты).
ТАКТИКА ВЕДЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ В ПЕРИОД ПАНДЕМИИ
В период пандемии большую значимость приобретает грамотное ведение сердечно-сосудистой патологии в соответствии с рекомендациями. Принципиальная позиция: не отменять, а, наоборот, интенсифицировать показанную кардиальную, сахароснижающую и респираторную терапию согласно рекомендациям в период пандемии. На фоне коронавирусной инфекции необходимо продолжать принимаемую терапию в амбулаторных условиях (коррекция симптоматики, артериального давления, частоты сердечных сокращений и т.д.) и при поступлении в стационар.
По результатам проведенных исследований, основные группы препаратов, применяемые для терапии сердечно-сосудистых заболеваний (АГ, ИБС, хронической сердечной недостаточности), не влияют на риск заражения коронавирусом и не оказывают воздействие на тяжесть течения заболевания. Завершена дискуссия по поводу назначения препаратов, блокирующих ренин-ангиотензин-альдостероновую систему (ингибиторов АПФ, антагонистов рецепторов ангиотензина II, антагонистов минералокортикоидных рецепторов).
Некоторые группы препаратов с противовоспалительными, антиоксидантными, дезагрегантными эндотелий-регулирующими свойствами (ингибиторы АПФ, статины, дезагреганты и антикоагулянты), как показывают последние данные, обладают способностью влиять на тяжесть течения коронавирусной инфекции.
ТАКТИКА ВЕДЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ ПОСЛЕ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
С учетом патогенеза COVID-19 можно предположить продолжение влияния на пациента следующих неблагоприятных факторов:
- сохранения системной воспалительной реакции с выраженной эндотелиопатией;
- синдрома гиперкоагуляции;
- последствий перенесенной полиорганной недостаточности (сохраняющиеся дыхательная, почечная недостаточность, печеночное повреждение) различной степени выраженности в зависимости от клинической ситуации.
Также часто наблюдается декомпенсация всех предсуществующих заболеваний (хронической сердечной недостаточности, АГ, ИБС, аритмии, СД, ХОБЛ, бронхиальный астмы и т.д.).
При легких формах COVID-19 на этапе реабилитации подобранная сердечно-сосудистая терапия, как правило, существенно не меняется. Коррекция кардиотропной терапии при обострении (декомпенсации) проводится в соответствии с рекомендациями. При этом следует:
- рассмотреть целесообразность назначения противовоспалительных препаратов с эндотелий-протективными, органопротективными эффектами (блокада ренин-ангиотензин-альдостероновой системы);
- выполнить обязательный перерасчет сердечно-сосудистых рисков при первичной профилактике сердечно-сосудистых заболеваний (SCORE) с решением вопроса о назначении статинов. Назначить статины и корректировать их дозы для достижения целевых значений холестерина липопротеидов низкой плотности (ХС ЛПНП) в рамках вторичной профилактики. Рекомендовать старт/рестарт терапии дезагрегантами (вторичная профилактика и первичная профилактика в отдельных случаях у пациентов очень высокого риска).
При среднетяжелых и тяжелых формах COVID-19 кардиотропная терапия зачастую корректируется в процессе лечения в условиях стационара при нестабильности гемодинамики, снижении артериального давления (отмена, уменьшение дозировок антигипертензивных препаратов). Возможна отмена антиаритмических препаратов из-за межлекарственных взаимодействий с препаратами этиотропной терапии COVID-19, назначение антикоагулянтов, переход с варфарина/прямых оральных антикоагулянтов (ПОАК) на низкомолекулярные гепарины и нефракционированный гепарин, коррекция мочегонной терапии на фоне гипер-/гиповолемии и т.д.
После завершения этиотропной терапии и/или выписки пациента необходимо динамическое наблюдение за больным (контроль артериального давления, частоты сердечных сокращений, ритма, симптомов сердечной и коронарной недостаточности). Постепенный рестарт антигипертензивной терапии и коррекция других видов терапии проводятся в зависимости от клинического статуса пациента в соответствии с клиническими рекомендациями. Особое внимание (пересмотр показаний для назначения) уделяется противовоспалительным и эндотелий-регулирующим стратегиям (ингибиторы АПФ, антагонисты рецепторов ангиотензина II, статины, дезагреганты, антикоагулянты). Выполняется коррекция диуретической терапии в соответствии с волемическим статусом. Принципы проведения антитромботической терапии в этой ситуации приведена ниже (п. 4).
Пациентам с острыми сердечно-сосудистыми событиями в период течения инфекции (острый коронарный синдром, ОНМК, тромбоз глубоких вен/ ТЭЛА) и после отделения реанимации и интенсивной терапии реабилитацию лучше осуществлять в стационарах терапевтического профиля. Тактика ведения соответствует с текущим рекомендациями, подход индивидуальный.
АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ
Особенности патогенеза COVID-19 связаны с активацией процесса тромбообразования, который вместе с системной эндотелиопатией на фоне «цитокинового шторма» лежит в основе формирования полиорганной недостаточности. Этот факт предопределил введение в схемы патогенетической терапии антикоагулянтов. Текущая рекомендация – включение в схемы терапии всех госпитализированных пациентов низкомолекулярных гепаринов (НМГ) или (в случае их недоступности) нефракционированного гепарина (НФГ) в профилактических дозах. Обсуждается применение их промежуточных и лечебных доз в целях тромбопрофилактики, а также целесообразность тромбопрофилактики на амбулаторном этапе.
Вопрос продолжения антикоагулянтной терапии на этапе реабилитации остается открытым. Можно выделить следующие клинические сценарии, определяющие тактику антикоагулянтной терапии на фоне COVID-19 (рис. 32):

А. Пациент принимал оральные антикоагулянты до заболевания по специфическим показаниям (фибрилляция предсердий, тромбоз глубоких вен/ТЭЛА в анамнезе, механический протез клапана и т.д.) или дезагреганты (ИБС, ОНМК в анамнезе и т.д.). В этом случае рекомендуется продолжение приема препарата при легких формах течения инфекции. При тяжелых и среднетяжелых формах в условиях стационара по решению клинической команды осуществляется переход на НМГ/НФГ. После выписки из стационара на этапе реабилитации целесообразен возврат к исходной терапии.
Б. Пациент не принимал антикоагулянты, но в процессе течения коронавирусной инфекции произошло клиническое событие (дебют фибрилляции предсердий, тромбоз глубоких вен/ТЭЛА, острый коронарный синдром), ишемический инсульт (атеротромботический вариант), требующие назначения антикоагулянтной/дезагрегантной терапии. На этапе реабилитации следует поступать в соответствии с текущими рекомендациями назначения антикоагулянтов. На амбулаторном этапе выполняется перевод пациента с терапии НМГ/НФГ (если они были назначены ранее) на рекомендованную терапию.
В. Пациент не принимал антикоагулянты до заболевания. При поступлении в стационар со среднетяжелыми/тяжелыми формами COVID-19 была назначена терапия НМГ/НФГ. В амбулаторных условиях в зависимости от тяжести течения инфекции показано продолжение антикоагулянтной терапии. Длительность терапии четко не определена. Дискутируемая продолжительность лечения 30–45 дней. Длительность тромбопрофилактики после выписки определяется следующими факторами: наличием исходных факторов риска тромбозов, выраженностью дыхательной недостаточности, легочной гипертензии, повышением маркеров (D-димера), риском кровотечений. Препараты выбора для продленной тромбопрофилактики пациентам высокого риска тромботических событий – НМГ. Использование ПОАК (дабигатрана этексилат, апиксабан, ривароксабан) в настоящее время не показано из-за отсутствия доказательной базы применения этих препаратов с целью тромбопрофилактики без анамнеза тромботических событий и наличия специфических показаний (фибрилляция предсердий, механические протезы клапанов и т.д.).
ПАЦИЕНТЫ С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК
Пациенты с сердечно-сосудистыми заболеваниями, СД и хронической болезнью почек часто подвержены риску прогрессирования почечной недостаточности на фоне COVID-19 c развитием острого почечного повреждения при тяжелых случаях. На амбулаторном этапе после выписки пациента показано мониторирование креатинина и калия (в зависимости от тяжести почечного повреждения 1 раз в 7–14 дней). Показано назначение или рестарт (при отмене терапии) нефропротективных препаратов. Общие рекомендации при снижении скорости клубочковой фильтрации (СКФ):
- ограничение употребление соли до 5 г/сут;
- малобелковая диета с расчетом потребляемого белка в зависимости от СКФ, возможно назначение кетоаналогов незаменимых аминокислот;
- назначение блокаторов ренин-ангиотензин-альдостероновой системы (ингибиторы АПФ и антагонисты рецепторов ангиотензина II) под контролем креатинина и калия – старт с минимальных доз при СКФ <30 мл/мин;
- достижение целевого уровня АД 130– 140/80– 90 мм рт.ст. (не допуская гипотонии);
- целевой уровень HbA1с при СД <7%;
- анализ сопутствующей терапии на предмет нефротоксичности (особенно НПВП).
V. ТЕРАПИЯ ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ
КОНТРОЛЬ ГЛИКЕМИИ
- В дебюте заболевания и при недостижении целевых уровней гликемического контроля – не менее 4 раз/сут (перед едой, через 2 ч после еды, перед сном, периодически ночью).
- В дебюте заболевания и при достижении в дальнейшем целевых уровней гликемического контроля в зависимости от вида сахароснижающей терапии.
- В случае интенсифицированной инсулинотерапии не менее 4 раз/сут (перед едой через 2 ч после еды, на ночь, периодически ночью). Дополнительно перед физическими нагрузками и после них, при подозрении на гипогликемию, а также если предстоят какие-то действия, потенциально опасные для пациента и окружающих (например, вождение транспортного средства или управление сложными механизмами).
- В случае пероральной сахароснижающей терапии и/или инъекций агонистов рецепторов глюкагоноподобного пептида-1 и/или инъекций базального инсулина не менее 1 раза/сут в разное время + 1 гликемический профиль (не менее 4 раз/сут) в неделю. Возможно уменьшение частоты самоконтроля гликемии при использовании только препаратов с низким риском гипогликемии.
- В случае инъекций готовых смесей инсулина не менее 2 раз/сут в разное время + 1 гликемический профиль (не менее 4 раз/сут) в неделю.
- В случае диетотерапии не менее 1 раза в неделю в разное время суток. Дополнительно перед физическими нагрузками и после них, при подозрении на гипогликемию, а также если предстоят какие-то действия, потенциально опасные для пациента и окружающих (например, вождение транспортного средства или управление сложными механизмами) [1, 2].
ВЫБОР ЦЕЛЕВОГО УРОВНЯ ГЛИКИРОВАННОГО ГЕМОГЛОБИНА
Принципы выбора целевого уровня гликированного гемоглобина (HbA1c) представлены в таблицах 5, 6.
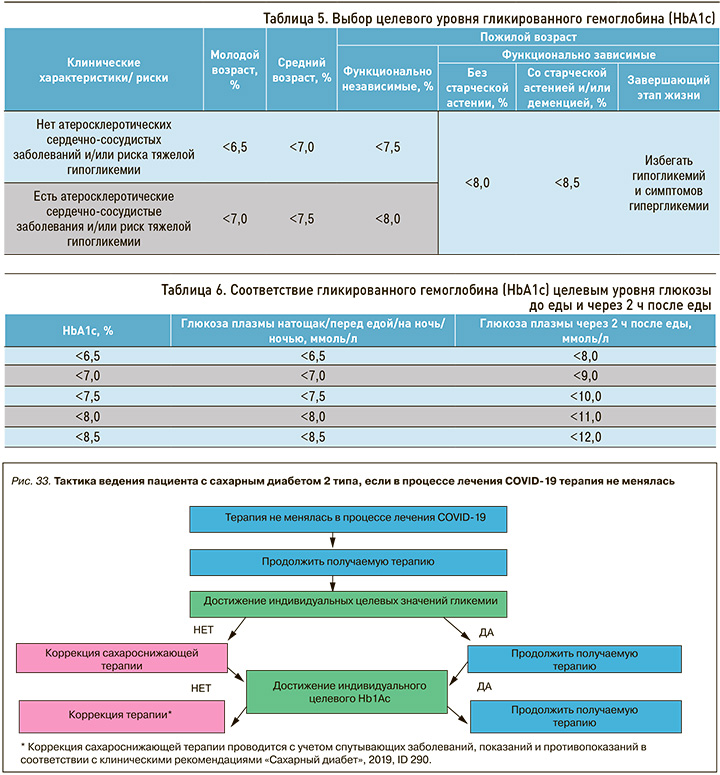
ТАКТИКА МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ
Если в процессе лечения терапия не менялась, следует продолжить получаемую терапию, регулярный контроль гликемии в соответствии со схемой получаемой терапии (рис. 33). При недостижении целевых значений гликемии в течение 2 нед рекомендована коррекция сахароснижающей терапии. Контроль HbA1c проводится через 3 мес.
А. Если в процессе лечения производилась отмена терапии ингибиторами SGLT2 и/или метформина (рис. 34), необходимо:
- оценить наличие противопоказаний к терапии метформином:
- СКФ <30 мл/мин/1,73 м2 (при СКФ 30–44 мл/ мин/1,73 м2 максимальная суточная доза не должна превышать 1000 мг);
- повышение аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) более чем в 3 раза от верхней границы нормы;
- острый коронарный синдром;
- гипоксия (при COVID-19 – восстановление SpO2);
- алкоголизм;
- ацидоз любого генеза;
- беременность и лактация.
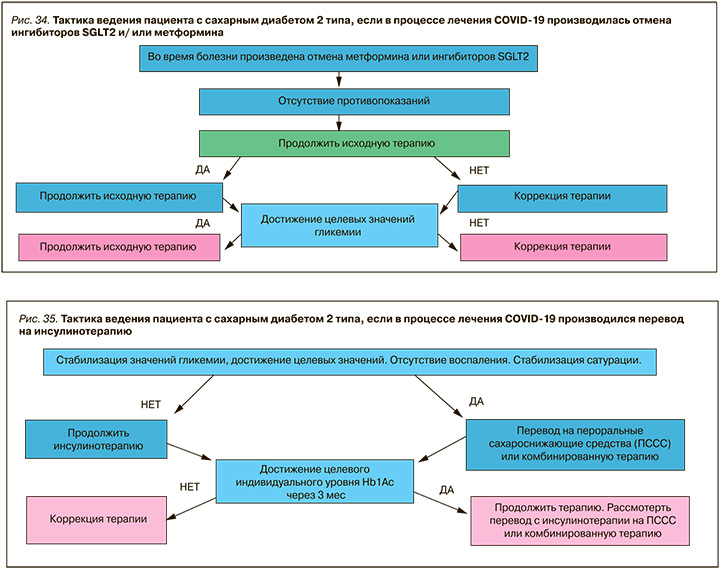
Если противопоказаний нет, следует вернуться к терапии метформином.
- Оценить наличие противопоказаний к терапии ингибиторами SGLT2:
- кетоацидоз;
- беременность, лактация;
- снижение СКФ <45 мл/мин/1,73 м2.
- Осторожность при назначении ингибиторов SGLT2 требуется в следующих ситуациях:
- хронические урогенитальные инфекции;
- прием мочегонных средств.
Если противопоказаний нет, следует вернуться к терапии ингибиторами SGLT2.
Б. Если в процессе терапии был произведен перевод пациента на инсулинотерапию (рис. 35), снижение дозы инсулина следует производить при следующих обстоятельствах:
- уменьшение воспаления (снижение С-реактивного белка);
- уменьшение количества энтерального питания;
- уменьшение или прекращение терапии глюкокортикостероидами (ГКС);
- паллиативный статус пациента.
Возвращение к терапии пероральными сахароснижающими средствами (ПССС) возможно после:
- восстановления сатурации более 95%;
- уменьшения С-реактивного белка или его нормализации;
- стабилизации цифр гликемии;
- отсутствия признаков диабетического кетоацидоза [4].
В. Если гипергликемия впервые выявлена в ходе лечения COVID-19, то в отсутствие противопоказаний к ПССС ведение пациента осуществляется, как в случае с СД 2 типа при регулярном контроле гликемии. В связи с неадекватной оценкой уровня обмена глюкозы рекомендуется выбирать ПССС с минимальным риском гипогликемических состояний (табл. 7). Рекомендован контроль Нв1Ас через 3 мес.
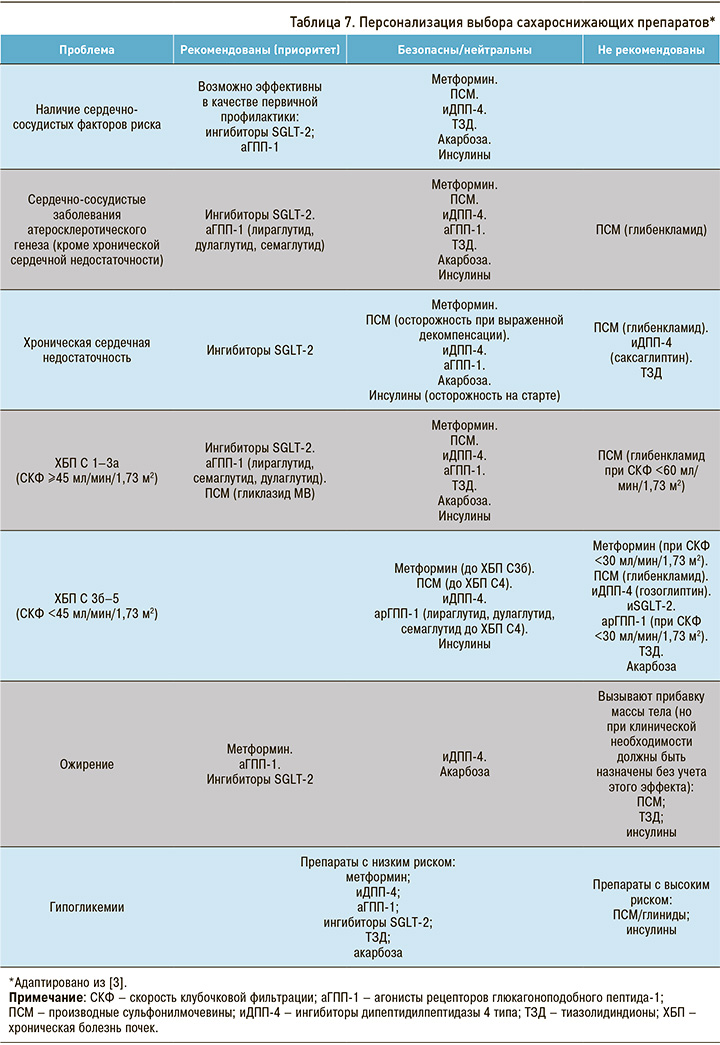
ОБЩИЕ РЕКОМЕНДАЦИИ ПО ВЕДЕНИЮ САХАРНОГО ДИАБЕТА ПОСЛЕ COVID-19
Пребывая в отделении интенсивной терапии, многие пациенты находились в состоянии мальнутриции. Именно поэтому требуется оценка нутритивного статуса пациента и при отсутствии противопоказаний – коррекция калорийности рациона с индивидуальными особенностями:
1. Стол 9, с расчетом индивидуальной калорийности рациона.
2. Возвращение к сахароснижающей схеме до заболевания COVID-19.
3. Контроль гликемии.
4. Соблюдение правил ухода за стопами (осмотр стоп на каждом визите, высокий риск формирования язв и пролежней стопы).
5. Работа с психологом (при необходимости).
6. Биохимический анализ крови: креатинин, расчет СКФ, АЛТ, АСТ, общий холестерин, ХС ЛПНП, холестерин липопротеидов высокой плотности (ХС ЛПВП), триглицериды, калий, магний, кальций общий, витамин Д, фосфор.
7. Осмотр окулиста с расширенным зрачком.
8. Анализ мочи на микроальбуминурию.
9. Контроль HbA1c 1 раз в 3 мес с обязательной коррекцией схемы ПССС.
10. Вакцинация от вируса гриппа и пневмококковой инфекции (при отсутствии противопоказаний).
11. Наблюдение эндокринолога.
VI. COVID-19 И ЗАБОЛЕВАНИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Рекомендации больным COVID-19 с заболеваниями щитовидной железы:
1. Терапия препаратом левотироксина должна быть продолжена в прежней дозе.
2. Если в результате болезни у пациента отмечены эпизоды нарушения приема левотироксина/изменилась масса тела/назначены препараты, нарушающие всасывание левотироксина, рекомендован обязательный контроль тиреотропного гормона (ТТГ) через 3 мес [5].
3. Пациент, принимающий антитиреоидные препараты, может продолжить получаемое лечение. Пациент, инфицированный COVID-19, может продолжать применять тиреостатические препараты, если количество нейтрофилов >1,0×109/л.
4. Если у пациента, принимающего тиреостатические препараты, наблюдаются любые симптомы, указывающие на нейтропению (боль в горле, язва во рту, лихорадка, признаки мочевой или кишечной инфекции), следует приостановить применение тиреостатиков и срочно провести общий анализ крови. Возможно совместное исследование на COVID-19 [6].
VII. ДРУГИЕ СОСТОЯНИЯ, ТРЕБУЮЩИЕ ПРИЕМА ГОРМОНАЛЬНЫХ ПРЕПАРАТОВ
Пациентам, длительно принимающим ГКС (более 3 мес), при тяжелом течении COVID-19 рекомендован переход на парентеральные формы ГКС с возвратом к прежней терапии на амбулаторном этапе.
Пациенткам, получающим менопаузальную гормональную терапию или оральные контрацептивы, в случае COVID-19 следует рассмотреть возможность отмены этих препаратов (в виду усиления гиперкоагуляции). При отсутствии признаков заболевания прием менопаузальной гормональной терапии или оральных контрацептивов возобновляют.
VIII. COVID-19 И ПОВРЕЖДЕНИЯ ПЕЧЕНИ
В процессе лечения инфекции SARS-COV-2 мы получили опыт ведения пациентов с различной коморбидной патологией, в том числе больных с фоновой патологией печени. По статистическим данным Европы и Китая, вероятность поражения печени при COVID-19 составила 13–54%, причем повреждение печени встречалось у пациентов с умеренной и тяжелой формой инфекции.
Генез такого поражения весьма неоднозначный. Во-первых, это иммуноопосредованное воздействие на печень, во-вторых, лекарственно-индуцированные действие. Активное использование гидроксихлорохина, хлорохина, азитромицина для снижения вирусной нагрузки также увеличило токсическое влияние на печеночные клетки.
Многими заболевшими для купирования сохраняющейся лихорадки бесконтрольно применялись НПВП. У таких пациентов часто отмечалось повышение трансаминаз. При этом у 5–27% пациентов повреждения печени протекают бессимптомно и выявляются лишь по повышению активности лабораторных маркеров гепатотоксичности.
Часто для лечения присоединившейся бактериальной инфекции используется амоксициллин + клавулановая кислота. Этот антибактериальный препарат вызывает преимущественно гепатоцеллюлярные поражения печени, хотя при его применении описаны и случаи холестаза с дуктопенией. С использованием амоксициллина/клавуланата связано 13–23% всех выявляемых антибиотикоиндуцированных поражений печени.
Ритонавир, входящий в состав препарата Калетра (лопинавир/ритонавир), метаболизируется системой цитохрома Р450 и может способствовать повышенному образованию токсичных метаболитов, которые кумулируются и вызывают гепатотоксичность.
Комбинация лекарственных препаратов, в свою очередь, в разы повышает риски развития гепатотоксичности.
Гепатотоксичность представляет собой повреждение печени, вызванное чужеродными веществами (ксенобиотиками). Частным случаем гепатотоксичности выступает лекарственное поражение печени (ЛПП) – повреждение, вызванное приемом рецептурных либо безрецептурных лекарственных препаратов. Клинические проявления ЛПП могут быть представлены как острым, так и хроническим поражением печени, а по тяжести варьировать от бессимптомного повышения аминотрансфераз до развития фульминантной печеночной недостаточности (табл. 8, 9).

ТЕРАПИЯ ПЕЧЕНОЧНОГО ПОВРЕЖДЕНИЯ
В условиях пандемии COVID-19 для пациентов с циррозом печени, печеночными проявлениями новой коронавирусной инфекции особое значение имеет рациональный, патогенетически обоснованный выбор гепатопротективного препарата, который целесообразно назначать всем пациентам среднетяжелого или тяжелого течения для предотвращения тяжелых осложнений инфекции SARS-CoV-2 со стороны печени. В связи с этим у коморбидных пациентов с сопутствующими заболеваниями и состояниями, которые могут отягощать течение коронавирусной инфекции (атеросклероз, избыточный вес, прием большого количества гепатотоксичных препаратов, СД, пожилой возраст и др.), предпочтение в терапии следует отдавать плейотропным молекулам, воздействующим сразу на несколько патологических процессов, а также позволяющим значительно снизить лекарственную нагрузку.
Урсодезоксихолиевая кислота
Примером такого лекарственного средства является урсодезоксихолиевая кислота (УДХК), достоверно снижающая как гепатологические, так и сердечно-сосудистые риски у коморбидных пациентов с неалкогольной жировой болезнью печени (НАЖБП). Международное исследование УСПЕХ показало, что использование УДХК (Урсосан®) в дозе 15 мг/кг массы тела/сут в течение 24 нед у больных НАЖБП обеспечивает уменьшение активности воспаления в печени, степени ее стеатоза, улучшает параметры липидного обмена и позволяет получить антиатерогенный эффект. Оптимизация показателей обмена веществ у пациентов с COVID-19 может положительно влиять на прогноз заболевания.
УДХК обладает антифибротическим, иммуномодулирующим и регулирующим апоптоз действием. Дополнительное преимущество использования УДХК в комплексной терапии новой коронавирусной инфекции – универсальная способность активной молекулы тормозить развитие фиброза и оказывать выраженное системное иммуномодулирующее и противовоспалительное воздействие не только в печени, но и в других органах и системах: это может быть актуальным для профилактики такого типичного осложнения инфекции COVID-19, как фиброз легких. Также следует отметить способность УДХК защищать не только гепатоциты, но и холангиоциты (клетки-мишени SARS-Cov-2).
Получены экспериментальные данные, свидетельствующие, что прием УДХК улучшал гистопатологические изменения на фоне ремоделирования дыхательных путей при бронхолегочной патологии. Такой эффект связывают с модуляцией Th-2 производных цитокинов и ингибированием апоптоза эпителиоцитов дыхательных путей под действием препарата. По результатам экспериментальных исследований на крысиной модели установлено, что УДХК значительно уменьшало липополисахарид-индуцированный отек легких и воспалительные изменения в легких за счет стимуляции выведения жидкости из альвеол.
Успешный опыт использования и доказанная эффективность УДХК в лечении печеночной патологии обусловили ее включение во все клинические рекомендации по хроническим диффузным заболеваниям печени, что юридически реализовано в инструкциях к лекарственным препаратам с МНН урсодезоксихолевая кислота. В этих инструкциях регламентированы показания к применению УДХК при всех видах гепатитов, включая вирусные (без уточнения природы вируса), и лекарственных поражениях печени. Это позволяет рассматривать возможность использования препаратов УДХК в программе терапии больных с новой коронавирусной инфекцией и сопутствующим поражением печени.
Рекомендуемый режим применения УДХК: 13–15 мг/кг/сут 2–3 раза в день. Возможен длительный многомесячный прием до разрешения явлений повреждения печени.
Адеметионин
Препарат применяется при 1 и 2 степени ЛПП, возможно его сочетание с УДХК. Адеметионин вводят внутривенно или внутримышечно в дозе 400–800 мг/сут в течение 2 нед с последующим переходом на пероральный прием в дозе 800–1200–1600 мг/сут. Общая длительность терапии зависит от динамики биохимических показателей и может составлять от 4 нед до 6 мес.
При вирусном гепатите HBV-этиологии необходимо определить вирусную нагрузку (HBVDNA количественный анализ), HBeAg, aHDV cуммарный, выявить фиброз по эластографии печени и затем определить дальнейшую тактику лечения.
При хроническом вирусном гепатите HCV-этиологии и применяемой параллельно безинтерфероновой терапии тактика лечения индивидуальна в зависимости от типа и степени гепатотоксичности.
При 3 и 4 степени ЛПП показана госпитализация в терапевтический стационар, симптоматическое лечение. Возможное применение ГКС, решение о котором принимается индивидуально.
IX. CLOSTRIDIUM DIFFICILE-АССОЦИИРОВАННАЯ ИНФЕКЦИЯ
Применение комбинации антибактериальных препаратов при лечении инфекции SARS-COV-2, порой несколькими курсами, может приводить к возникновению очень серьезного осложнения – антибиотико-ассоциированной диареи и псевдомембранозного колита. Пациенты с этим острым состоянием все чаще поступают сегодня в стационары.
В настоящее время доказано, что нерациональное и необоснованное использование противомикробных средств ведет к росту устойчивости бактерий к антибиотикам и увеличению этиологической роли микроорганизмов, ранее не встречавшихся в структуре основных возбудителей. К числу таких патогенов относится Clostridium difficile – облигатно анаэробная, грамположительная, спорообразующая, цитотоксин-продуцирующая, обычно подвижная палочковидная бактерия. В условиях снижения колонизационной резистентности в толстой кишке происходит прорастание спор C. difficile в вегетативную форму, продуцирующую токсины с последующим развитием воспаления слизистой оболочки толстой кишки и диареи. Токсигенный штамм C. difficile выступает этиологическим агентом ПМК.
Clostridium difficile-ассоциированная инфекция (CDI) – заболевание, развивающееся при нарушении кишечного микробиома с избыточной колонизацией C. difficile, токсины которой вызывают воспаление и повреждение слизистой оболочки толстой кишки.
Псевдомембранозный колит (ПМК) – это острое воспаление толстого кишечника, вызываемое условно-патогенными клостридиями и возникающее на фоне приема антибиотиков или (реже) других лекарственных средств. Колит, как правило, вызван токсигенной C. difficile, характерным признаком его служат фибринозные наложения на слизистой оболочке толстой кишки.
3 ОСНОВНЫХ ФАКТОРА ПАТОГЕННОСТИ ШТАММОВ C. DIFFICILE
Токсигенные штаммы С. difficile продуцируют 3 крупномолекулярных белковых экзотоксина: токсин A (энтеротоксин), токсин B (цитотоксин) и бинарный токсин.
В результате действия токсина А повреждаются только ворсинки, крипты остаются интактными. Эпителиальные клетки кишечника опосредованно разрушаются за счет миграции в очаг воспаления большого количества фагоцитов, «привлеченных» гибелью нейтрофилов в результате цитотоксического действия токсинов. Высвобождаемые фагоцитирующими клетками лизосомальные ферменты, как и ферменты, выделяющиеся при разрушении эпителиоцитов, усиливают повреждение клеток. Нейтрофилы, обнаруживаемые в большом количестве в псевдомембранах при ПМК и подлежащей слизистой оболочке кишечника, играют центральную роль в патогенезе С. diffcile-ассоциированных болезней.
Токсин В – это цитотоксин с выраженным цитопатологическим эффектом.
Бинарный токсин усиливает адгезию и колонизацию C. difficile.
Энтеротоксичность C. difficile реализуется двумя путями:
- прямой эффект заключается в непосредственном действии токсинов на энтероциты и нервный аппарат кишечной стенки;
- непрямой эффект реализуется за счет активации макрофагов, тучных клеток и других клеток крови и увеличения продукции нейропептидов и провоспалительных цитокинов.
Проявления CDI представлены в таблице 10.
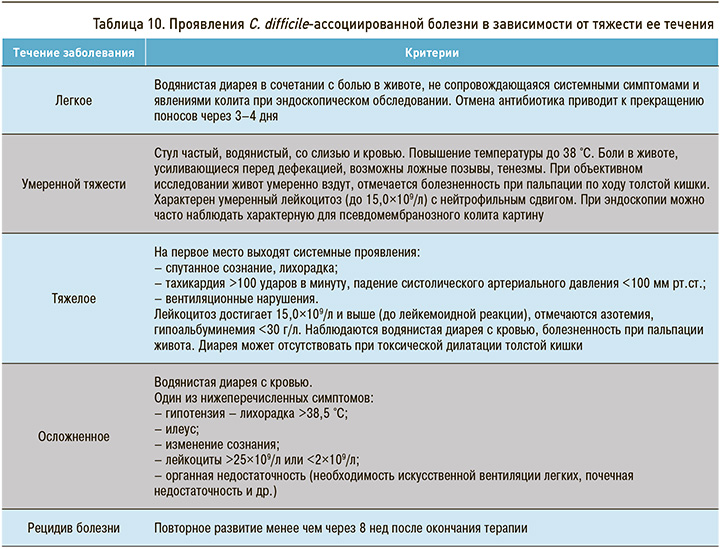
ФАКТОРЫ РИСКА РАЗВИТИЯ C. DIFFICILE-АССОЦИИРОВАННОЙ БОЛЕЗНИ
Риск заболевания повышается в 7–10 раз во время проведения курса лечения антибиотиками и на протяжении месяца после их отмены и остается повышенным в 2–3 раза на протяжении 3 мес после завершения антибиотикотерапии. Любой антибактериальный препарат может спровоцировать C. difficile-ассоциированную болезнь, но наиболее в этом плане скомпрометированы клиндамицин, цефалоспорины третьего поколения, пенициллины и фторхинолоны. Каждая последующая неделя госпитализации увеличивает риск инфицирования на 8%.
К доказанным факторам риска развития C. difficile-ассоциированной болезни относят:
- пожилой возраст (>65 лет);
- наличие конкурирующей патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, СД;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- снижение кислотности желудочного сока, в первую очередь при приеме ингибиторов протонной помпы;
- прием иммуносупрессивных (ГКС, такролимус) и противоопухолевых препаратов.
Прогностические факторы тяжелого течения CDI:
- возраст ≥65 лет;
- лейкоцитоз >15×109/л, гипоальбуминемия (<30 г/л), повышение уровня креатинина крови (≥133 мкмоль/л или ≥1,5 раз от преморбидного уровня);
- сопутствующая тяжелая патология
РЕЦИДИВ C. DIFFICILE-АССОЦИИРОВАННОЙ БОЛЕЗНИ
Рецидив CDI – это повторный эпизод развития симптомов заболевания менее чем через 8 нед после начала предыдущего эпизода при завершении инициального лечения. Рецидив наблюдается в 10–30% случаев. У некоторых пациентов он происходит неоднократно на протяжении ряда лет.
Факторы риска рецидива CDI:
- возраст ≥65 лет;
- продолжение применения антибиотиков не для терапии клостридиальной инфекции после установления диагноза и/или после завершения ее лечения;
- тяжелые сопутствующие заболевания, например почечная недостаточность;
- наличие клостридиальной инфекции в анамнезе (более одного рецидива);
- одновременное применение антисекреторных препаратов (ингибиторов протонной помпы);
- тяжелое течение первого эпизода заболевания.
ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ
- Рекомендуется тестировать только пациентов с клиническими проявлениями CDI.
- Иммуноферментный анализ для определения токсинов А/В C. difficile в кале. Чувствительность метода составляет 75–95%, специфичность 83–98%.
- Исследование глутаматдегидрогеназы (GDH) C. difficile. GDH – фермент, продуцируемый как токсигенными, так и нетоксигенными штаммами C. difficile, в связи с чем этот тест не позволяет дифференцировать наличие именно токсигенного штамма у конкретного пациента (чувствительность – 85–100%, специфичность – 87–98%). Тест обнаруживает присутствие GDH, продуцируемой C. difficile (уровень рекомендаций BII).
- Колоноскопия. Классическая эндоскопическая картина ПМК представлена очаговыми плотно спаянными с подлежащей слизистой оболочкой желто-зелеными или желтоватыми наложениями, между которыми отмечаются участки с гиперемированной слизистой. При попытках удаления пленок, обнажаемая поверхность кровоточит. Часто наложения описываются как бляшки, имеющие диаметр от нескольких миллиметров до 1–2 см. При прогрессировании процесса наложения сливаются и полностью покрывают поверхность слизистой оболочки, которая подвергается некрозу и при отторжении экссудата становится изъязвленной.
- Морфологическая диагностика. Гистологическое исследование биоптатов не служит необходимым условием для установления диагноза при CDI, однако может быть крайне важным для дифференциальной диагностики.
- Компьютерная томография и эхография обнаруживают утолщение или диффузный отек стенки толстой кишки с явлениями периколита и в тяжелых случаях, выпот в брюшной полости. Чувствительность метода эхографии составляет 95%, специфичность – 47%, точность – 84%. Ультразвуковой метод может служить одним из первых и общедоступных методов выявления признаков ПМК у тяжелой категории пациентов, получающих массивную антибактериальную терапию.
- При развитии у пациента клинической картины CDI лечение рекомендуется начать до получения лабораторного подтверждения.
- Нецелесообразно проводить повторные лабораторные исследований после курса антибиотикотерапии, при клиническом улучшении, поскольку серологические реакции остаются положительными на протяжении 30 дней.
- Повторное тестирование после первого отрицательного анализа не рекомендуется проводить в течение 7 дней.
- Отрицательные результаты лабораторных тестов не исключают наличия возбудителя.
- Неспецифические лабораторные исследования при подозрении на CDI:
- общий анализ крови: лейкоцитоз, превышающий в тяжелых случаях CDI 15,0×109/л, сдвиг лейкоцитарной формулы влево, повышение скорости оседания эритроцитов. Неблагоприятным прогностическим признаком является лейкемоидная реакция, при которой количество лейкоцитов может превышать 40,0–50,0×109/л;
- копрограмма: появление слизи, эритроцитов, увеличение количества лейкоцитов, иногда выявляются кристаллы Шарко–Лейдена;
- биохимический анализ крови: при тяжелом течении болезни наблюдается гипопротеинемия, гипоальбуминемия (<3 г/дл), гиперкреатининемия (>50 % от первоначального уровня), электролитные нарушения (гипокалиемия).
ЛЕЧЕНИЕ C. DIFFICILE-АССОЦИИРОВАННОЙ БОЛЕЗНИ
Всем пациентам рекомендуется диета П (частое дробное питание), обильное питье. Следует исключить из рациона жирную, жареную и острую пищу, газированные напитки, сок апельсина и других цитрусовых, алкоголь, кофе.
Лечение CDI легкой/средней тяжести течения:
- метронидазол по 500 мг 3 раза/сут на протяжении 10–14 дней;
- если к 5–7-му дню терапии не удается добиться улучшения в самочувствии пациента, показана смена антибиотика на ванкомицин в дозе 125 мг 4 раза/сут на 10-14 дней;
- при непереносимости метронидазола терапию следует начинать с ванкомицина в вышеуказанной дозе;
- беременным и кормящим женщинам при наличии явной клиники CDI также назначают ванкомицин в дозе 125 мг 4 раза сут;
- параллельно с метронидазолом или ванкомицином может применяться диоктаэдрический смектит (по 1–2 пакетика 3 раза/сут в течение 7 дней, не ранее чем через час после приема антибиотиков), который нейтрализует активность токсинов C. difficile;
- пробиотики используются в течение не менее 3 мес для профилактики рецидива CDI после завершения курса лечения метронидазолом или ванкомицином.
Лечение CDI тяжелого течения:
- ванкомицин по 500 мг внутрь каждые 6 ч или через назогастральный зонд плюс метронидазол по 500 мг внутривенно каждые 8 ч. Дополнительно возможно применения ванкомицина по 250 мг каждые 6 ч ректально в ретенционной (удерживаемой) клизме при кишечной непроходимости;
- хирургическая консультация по поводу возможной субтотальной колэктомии;
- следует избегать применения препаратов, угнетающих моторику желудочно-кишечного тракта, во избежание осложнений CDI (илеус).
Лечение CDI осложненного течения:
- метронидазол по 500 мг каждые 8 ч в сочетании с ванкомицином по 500 мг 4 раза/сут + ванкомицин per rectum по 500 мг 4 раза/сут на протяжении 10 дней;
- инфузионная терапия для устранения белково-электролитных нарушений, дезинтоксикации, при необходимости – коррекция анемии (гемотрансфузии при уровне гемоглобина ниже 80 г/л, далее терапия препаратами железа, предпочтительно парентерально);
- показаниями к колэктомии:
- перфорация кишки;
- развитие синдрома системной воспалительной реакции;
- отсутствие улучшения самочувствия пациента, несмотря на проводимое консервативное лечение на протяжении 5 дней;
- развитие токсического мегаколона, илеуса, симптомов «острого» живота;
- колэктомию следует выполнять до развития тяжелого или осложненного течения заболевания. В качестве маркера тяжести течения может служить уровень лактата сыворотки (>5 ммоль/л).
Лечение первого рецидива заболевания:
- после первого эпизода CDI вероятность рецидива в последующие 8 нед составляет 10–20%, после первого рецидива возможность дальнейших рецидивов достигает 40–65%;
- лечение при первом рецидиве в зависимости от степени его тяжести проводится так же, как при первом эпизоде заболевания;
- при тяжелом течении первого рецидива показан ванкомицин, в том числе в связи с тем, что длительный прием метронидазола повышает риск развития периферической нейропатии;
- пробиотики после окончания курса терапии антибактериальными препаратами должны быть назначены на срок не менее 3 мес.
Лечение последующих рецидивов заболевания:
- после второго рецидива CDI в течение 30–90 дней или если состояние пациента значительно ухудшается после прекращения лечения, рекомендован прием ванкомицина с постепенным снижением дозы: 1-я неделя – 125 мг внутрь через каждые 6 ч, 2-я неделя – 125 мг через каждые 12 ч, 3-я неделя – 125 мг 1 раз/сут, 4-я неделя – 125 мг через день, 5–6-я недели – 125 мг каждые 3 дня. Пульс-дозировка ванкомицина: до 125–500 мг внутрь каждые 2–3-е сутки в течение 3 нед;
- пробиотики (Bifidobacterium bifidum, Bifidobacterium longum, Bifidobacterium infantis, Lactobacillus rhamnosus) назначают после завершения курса лечения антибактериальными препаратами на срок не менее 3 мес.
ПРОФИЛАКТИКА C. DIFFICILE-АССОЦИИРОВАННОЙ БОЛЕЗНИ
1. Первичная профилактика – система мер, направленных на предупреждение возникновения и воздействия факторов риска развития заболевания на организм. К ней причисляют вакцинацию, рациональный режим труда и отдыха, качественное питание, физическую активность, охрану окружающей среды и т. д.
2. Вторичная профилактика – комплекс мероприятий, направленных на устранение факторов риска, которые в условиях стресса, ослабления иммунитета, чрезмерных нагрузок на любые другие функциональные системы организма могут привести к возникновению, обострению и рецидиву заболевания. Наиболее эффективным методом вторичной профилактики считается диспансеризация как комплексный метод раннего выявления заболеваний, динамического наблюдения, направленного лечения, рационального последовательного оздоровления.
Меры профилактики CDI:
- соблюдение правил гигиены, учитывая фекально-оральный механизм передачи C. difficile;
- использование работниками здравоохранения, контактирующими с больным диареей, одноразовых перчаток;
- мытье рук с мылом и применение медицинских перчаток (эффективное мероприятие для уничтожения спор C. difficile);
- применение 6–7,5% перекиси водорода в виде аэрозоля, полученного с помощью специальной автоматизированной системы, для дезинфекции воздуха и поверхностей (бактерицидное и спороцидное действие). После воздействия аэрозоля перекиси водорода в течение 3 ч в помещении регистрируется гибель всех спор микроорганизма;
- показана эффективность импульсной ксеноновой ультрафиолетовой установки для дезинфекции поверхностей от спор C. difficile;
- перспективным методом профилактики CDI может стать создание вакцины.
X. ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ 1: АЛГОРИТМ ИСПОЛЬЗОВАНИЯ МОТИВИРУЮЩЕГО ВДОХ СПИРОМЕТРА
1. Поместите устройство прямо перед собой.
2. Сделайте спокойный глубокий выдох.
3. Плотно сожмите губы вокруг мундштука.
4. Медленно и глубоко вдохните ртом. Этот медленный глубокий вдох будет поднимать поршень по мере того, как будут воздухом наполняться легкие. Сила вдоха должна быть такой, чтобы желтая метка скорости вдоха постоянно занимала срединное положение.
5. Когда вы почувствуете, что больше не можете вдыхать воздух, вытащите мундштук изо рта.
6. Задержите дыхание на высоте вдоха на 3–5 с, после чего сделайте неглубокий выдох.
7. Поддерживайте обычное дыхание, пока поршень в устройстве опуститься в исходное положение.
8. Повторите цикл 15 раз. Если почувствуете головокружение, замедлите дыхание.
Длительность одного лечебного сеанса не должна превышать 15 мин, поскольку при более длительном использовании возможно утомление дыхательной мускулатуры.
При необходимости экспекторации мокроты у пациентов с нарушением дренажа слизи, при 7 и 15 повторении цикла вместо пункта 7 выполняется кашель с хаффингом. Подробное описание «форсированного экспираторного маневра с хаффингом» (ФЭМ-Х) см. в разделе «Метод «"активного циклического дыханияʺ».
ПРИЛОЖЕНИЕ 2: АЛГОРИТМ ПРОВЕДЕНИЯ PEP-ТЕРАПИИ С НИЗКИМ ДАВЛЕНИЕМ
1. Действие первое (начальные установки)
1.1. Установить сопротивление выдоха: в большинстве случаев начинать с такого сопротивления, при котором давление выдоха находится на уровне 10 см вод.ст. (мбар).
1.2. Определить соотношение «вдох‒выдох» (I:E): желаемые значения составляют 1:3 для лиц с рестрикцией и 1:4 для лиц с обструкцией (рестрикция: на вдох 1,5–2,0 с, а на выдох 4,5–6,0 с; обструкция: на вдох 1,5–2,0 с, а на выдох 6,0–8,0 с).
1.3. Проведите регулировку сопротивления:
1.3.1. требуется уменьшать сопротивление, если отношение «вдох–выдох» (I:E) становится 1:1 или 1:2;
1.3.2. требуется повышать сопротивление, если отношение «вдох–выдох» (I:E) становится 1:5 или 1:6.
2. Действие второе (режим терапии)
2.1. Медленно и глубоко вдохните воздух: вдыхаемый объем должен быть приблизительно на 25% больше, чем при спокойном дыхании.
2.2. Выполните активный, не форсированный, продолжительный (более 4 с) выдох с усилием. Во время выдоха поддерживайте давление в устройстве на уровне 15–20 мбар.
2.3. Поддерживайте соотношение «вдох‒выдох» (I:E) равным 1:3 или 1:4 (рестрикция: на вдох 1,5–2,0 с, а на выдох 4,5–6,0 с; обструкция: на вдох 1,5–2,0 с, а на выдох 6,0–8,0 с).
2.4. Проведите 10–20 дыхательных циклов в выбранном режиме.
3. Действие третье (режим откашливания)
3.1. Выполните маневр ФЭМ-Х (хаффинг). Подробное описание «форсированного экспираторного маневра с хаффингом» (ФЭМ- Х) см. в разделе «Метод «активного циклического дыхания».
4. Действие четвертое (циклическое)
Повторите цикл 6–8 раз. Общая длительность алгоритма должна находится в интервале 15–30 мин.
ПРИЛОЖЕНИЕ 3: АЛГОРИТМ ПРОВЕДЕНИЯ PEP-ТЕРАПИИ С ВЫСОКИМ ДАВЛЕНИЕМ
1. Действие первое (коммутация устройства и настройки)
1.1. Провести коммутацию устройств (как показано на рис. 13).
1.2. Установить поток воздуха/кислорода на уровне 5 л/мин.
1.3. Определить соотношение «вдох‒выдох» (I:E): желаемые значения составляют 1:3 для лиц с рестрикцией и 1:4 для лиц с обструкцией (рестрикция: на вдох 1,5–2,0 с, а на выдох 4,5–6,0 с; обструкция: на вдох 1,5–2,0 с, а на выдох 6,0–8,0 с).
1.4. Проведите регулировку сопротивления:
1.4.1. требуется уменьшать поток, если отношение «вдох‒выдох» (I:E) становится 1:1 или 1:2;
1.4.2. требуется повышать поток, если отношение «вдох‒выдох» (I:E) становится 1:5 или 1:6.
2. Действие второе (режим терапии)
2.1. Дышите спокойно, с обычным дыхательным объемом; поддерживайте давление выдоха в устройстве на уровне 15–20 мбар.
2.2. Поддерживайте соотношение «вдох‒выдох» (I:E) равным 1:3 или 1:4 (рестрикция: на вдох 1,5–2,0 с, а на выдох 4,5–6,0 с; обструкция: на вдох 1,5–2,0 с, а на выдох 6,0–8,0 с).
2.3. Проведите 10–20 дыхательных циклов в выбранном режиме.
3. Действие третье (режим откашливания)
3.1. Выполните маневр ФЭМ-Х (хаффинг). Подробное описание «форсированного экспираторного маневра с хаффингом» (ФЭМ-Х) см. в разделе «Метод «активного циклического дыхания».
4. Действие четвертое (циклическое)
Повторите цикл 6–8 раз. Общая длительность алгоритма должна находится в интервале 30–45 мин.
ПРИЛОЖЕНИЕ 4: АЛГОРИТМ ПРОВЕДЕНИЯ oPEP-ТЕРАПИИ С ПОМОЩЬЮ ACAPELLA®
1. Вымойте руки. Соберите устройство Acapella, если вы проводили его санитарную обработку.
2. Установите сопротивление на таком уровне, чтобы выдох продолжался 3–4 с. Без специального врачебного предписания сопротивление устанавливается в максимальное положение.
3. Плотно обхватите губами загубник, при необходимости используйте носовую клипсу или дыхательную маску.
4. Выполните глубокий диафрагмальный вдох. Объем вдыхаемого воздуха должен на 25% превышать объем воздуха при спокойном дыхании. На вдохе задержите дыхание на 2–3 с. Выполните неглубокий выдох. Повторите цикл трижды.
5. Выдохните активно, но не форсировано. Выдох должен продолжаться более 5 с с сохранением постоянства потока. Осцилляции в устройстве при таком выдохе должны быть максимальными по амплитуде. Выполните 10–20 нагрузочных выдохов.
6. Выполните маневр ФЭМ-Х (хаффинг). Подробное описание «форсированного экспираторного маневра с хаффингом» (ФЭМ-Х) см. в разделе «Метод «активного циклического дыхания».
7. Повторите цикл 6–8 раз. Общая длительность алгоритма должна находится в интервале 15–30 мин.


