Хроническая болезнь почек (ХБП) на сегодняшний день рассматривается как стадийный процесс, который формируется при воздействии комплекса взаимообусловленных факторов, участвующих в прогрессировании ренального поражения с формированием нефросклероза [1]. Фибротические изменения ткани почек характеризуются увеличением продукции белка внеклеточного матрикса, уменьшением его деградации, нарушением регуляции межклеточного взаимодействия, инфильтрацией воспалительных клеток и трансформацией резидентных клеток [2].
К числу факторов, участвующих в патогенезе развития необратимой потери почечной функции, относится трансформирующий фактор роста-β (TGF-β). TGF-β – плейотропный цитокин, который принадлежит к семейству димерных полипептидов с молекулярной массой 25 кДа и регулирует широкий спектр биологических процессов, включая клеточную пролиферацию, апоптоз, миграцию, дифференцировку и продукцию экстрацеллюлярного матрикса [3]. У млекопитающих выделяют три изоформы TGF-β – щTGF-β1, TGF-β2, TGF-β3, кодирующиеся 32 различными генами [4]. Основными активаторами латентного TGF-β выступают тромбоспондин 1 и интегрины, ангиотензин II, активные формы кислорода (ROS), которые способствуют диссоциации TGF-β из латентного комплекса [3]. TGF-β1 является наиболее изученной изоформой и биологически значимой, кодируется в 19-й хромосоме [5]. Он выполняет физиологическую репаративную роль в ответ на повреждение тканей, привлекает тучные клетки, нейтрофилы, макрофаги. Однако изоформа TGF-β1 также имеет профиброгенные свойства. Увеличение продукции TGF-β1 приводит к развитию фиброза ткани почек [6].
Цель исследования – изучение роли TGF-β1 в развитии тубулоинтерстициального фиброза (ТИФ) у больных с первичными гломерулонефритами.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 75 пациентов с первичными хроническими гломерулонефритами в стадии обострения и показаниями для проведения биопсии почек в возрасте от 18 до 80 лет. Пациенты с хронической болезнью почек (ХБП) стадий С3 Б, С4, С5 в исследование не включались. Для клинической характеристики группы участников учитывались наличие и степень артериальной гипертензии (АГ), отеки и их выраженность, сывороточные значения креатинина, мочевины, результаты общего анализа крови, мочи и суточной протеинурии. Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле СKD-EPI (Chronic Kidney Disease Epidemiology Collaboration, 2011). Оценка стадий ХБП проводилась по классификации Kidney Disease: Improving Global Outcomes, 2002 г.
Всем участником проводилась нефробиопсия. Изучались параметры ремоделирования почечной ткани, в том числе изменение структуры подоцитов, наличие склеротических изменений в клубочковой и тубулоинтерстициальной ткани. Для изучения экспрессии TGF-β1 в почечной ткани выполнялось иммуногистохимическое исследование с обработкой полученных срезов специфическим антителом. Морфометрия биоптатов осуществлялась с помощью цифрового микроскопа Leica DMD108.
Статистический анализ данных проводился посредством программ Microsoft Office Excel 2016 (MicrosoftCorp., США) и Statistica-10.0 (StatSoft Inc., США). При нормальном распределении данных использовалась параметрическая статистика – средние величины признаков (М), ошибки средних величин (±m), при отклонении от нормального распределения вычислялись медианы и интерквартильный размах. U-критерий Манна–Уитни применялся для определения статистической значимости количественных переменных, бинарные переменные оценивались по критерию χ2. Корреляционные взаимоотношения между исследуемыми показателями устанавливались с помощью критерия Спирмена. В рамках корреляционного регрессионного анализа определялся коэффициент корреляции Пирсона. При значениях р <0,05 различия считались значимыми.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследуемая группа пациентов была представлена в основном лицами трудоспособного возраста, с преобладанием мужчин (табл. 1).
При проведении статистического анализа полученных данных ХБП 1С была зарегистрирована у 41 пациента, ХБП С2 – у 22, ХБП С3 А – у 12. В группе исследуемых у 49 человек имелась АГ, в том числе АГ 1-й степени у 20 пациентов, 2-й степени – у 24, 3-й степени – у 5. У 11 пациентов была выявлена АГ I стадии, у 26 – II стадии, у 12 – III стадия. Хроническая сердечная недостаточность (ХСН) была зарегистрирована у трех пациентов.
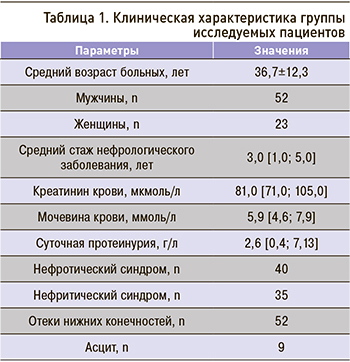
Наиболее частой причиной развития ХБП у участников исследования оказалась IgA-нефропатия, которая была выявлена в более чем половине случаев (42 пациента – рис. 1).
Согласно статистическому анализу морфологических данных, частота выявления перигломерулярного очагового фиброза равнялась 57,3%, склероз клубочков был обнаружен в 53,3% случаев, фокусы атрофии канальцев – 25,3%. Встречаемость тубулоинтерстициального фиброза (ТИФ) составила 73,3%. Распространенность ТИФ по рангам была следующей: 1-й ранг – 58,7%, 2-й – 12,0%, 3-й – 5,3%.
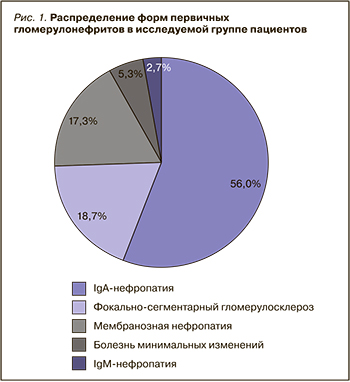
С помощью метода иммуногистохимического анализа была изучена экспрессия TGF-β1 в исследуемых биоптатах. Степень экспрессии оценивалась в 3 баллах: 0 баллов – отсутствие экспрессии, 1 балл – слабо выраженная экспрессия, 2 балла – умеренная, 3 балла – выраженная экспрессия TGF-β1.
Согласно полученным данным, в 15 биоптатах была выявлена слабая степень экспрессии TGF- β1, умеренная – в 44, выраженная – в 15 случаях (рис. 2). Изучение степени экспрессии в отдельных участках нефрона позволило обнаружить слабую экспрессию в эпителии канальцев с признаками эпителиально-мезенхимального перехода (ЭМП) в 68 случаях. Умеренная и выраженная экспрессии TGF-β1 больше всего наблюдались в проксимальных отделах канальцев – в 50 и 12 биоптатах соответственно, поскольку данный отдел канальцев наиболее уязвим к повреждению и играет центральную роль в прогрессировании ТИФ. Изолированное повреждение проксимальных канальцев может привести к развитию ХБП [7].
Корреляционный анализ между экспрессией TGF-β1 и морфологическими параметрами биоптатов позволил зарегистрировать достоверную связь TGF-β1 с развитием перигломерулярного фиброза (r – 0,26; p <0,05). При изучении влияния TGF-β1 на выраженность ТИФ была установлена прямо пропорциональная корреляционная взаимосвязь (r – 0,37; p <0,05). Аналогичные корреляции TGF-β1 были установлены с гиалинозом зон пирамид чашечно-лоханочной системы (r – 0,28; p <0,05), а также с сегментарным склерозом капиллярных петель клубочков (r – 0,34; p <0,05). Полученные корреляции подтверждают вклад TGF-β1 в развитие необратимых изменений в различных участках нефрона. Однако статистически значимой взаимозависимости экспрессии TGF-β1 в почечной ткани с клинико-лабораторными показателями повреждения почек (протеинурия, эритроцитурия, концентрация креатинина и мочевины в плазме крови, величина СКФ) выявить не удалось.
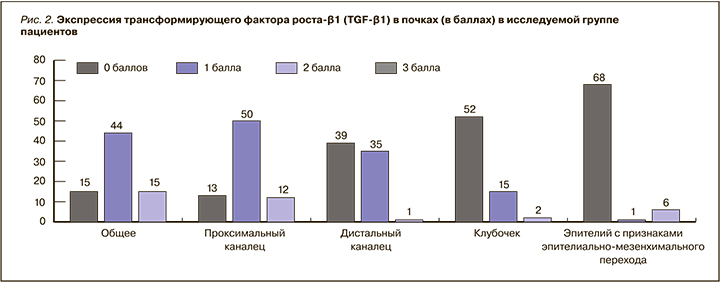
С помощью логистического регрессионного анализа была установлена зависимость увеличения вероятности развития ТИФ от степени экспрессии TGF-β1 в эпителии с признаками ЭМП (рис. 3). TGF-β1 служит ключевым фактором в развитии ЭМП, так как участвует в трансформации канальцевых клеток в миофибробласты, которые продуцируют фибронектин, коллагены I, III, IV, а также способствует накоплению экстрацеллюлярного матрикса. Миофибробласты бывают различного происхождения, включая перициты, резидентные фибробласты почек и канальцевые эпителиальные клетки. Сигнальный путь TGF-β/Smad регулирует процессы дедифференцировки [8].
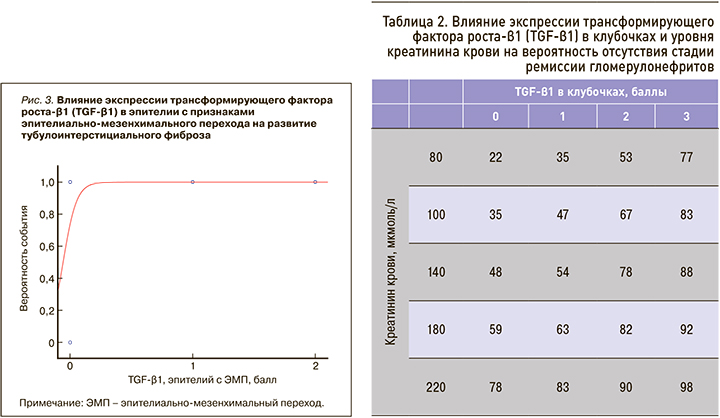
На основании полученных уравнений логистической регрессии была сформирована таблица вероятности отсутствия стадии ремиссии гломерулонефритов от степени экспрессии TGF-β1 в клубочках и сывороточных значений креатинина (табл. 2). Таким образом, TGF-β1 можно считать одним из прогностических критериев исхода ХБП.
ЗАКЛЮЧЕНИЕ
В проведенном исследовании выраженная экспрессия TGF-β1 отмечалась в эпителии проксимального отдела канальцев, поскольку при повреждении (белковая перегрузка с развитием атрофии канальцев, формирование полулуний, нарушающих нормальные процессы мочеобразования) эти клетки могут оказывать паракринное действие на окружающие ткани. Выявленные корреляции TGF-β1 с различными морфологическими параметрами ремоделирования ткани почек характеризуют проксимальные клетки как мощный продуцент профиброгенных факторов, в том числе TGF-β1 [7].
Благодаря своей димерной структуре, TGF-β1 может реализовывать свои профибротические функции посредством активации нескольких перекрестных стеблей. Классическими или иными Smad-независимыми механизмами TGF-β1 через свои рецепторы активирует ген COL1A2 (кодирующий коллаген A2 I типа) и стимулирует синтез проколлагена I типа. При воздействии металлопротеаз А и В, индуцированных TGF-β1, расщепляются амино- и карбоксиконцевые участки проколлагена, образуя тропоколлаген [9]. Одновременно TGF-β1 активирует ингибиторы протеаз, ингибитор активатора плазминогена 1 (PAI-1) и тканевый ингибитор металлопротеиназы 3 (TIMP3), способствуя депонированию тропоколлагена. Для стабилизации коллагена в виде фибрилл необходима лизилоксидаза, которая также активируется благодаря TGF-β1 [10]. Кроме того, TGF-β может вызывать фиброз почек, активируя рецептор эпидермального фактора роста (EGFR) и p53 с помощью протоонкогенной тирозин-протеинкиназы Src (c-Src) и ROS-зависимых механизмов [11].
В свою очередь, TGF-β1 участвует в развитии необратимых изменений в различных участках нефрона, что позволяет считать обсуждаемый маркер в качестве потенциального прогностического критерия исхода хронической болезни почек [12].
Таким образом, ТИФ является показателем выживаемости ткани почек при ХБП, однако необходимо дальнейшее изучение факторов формирования и прогрессирования ТИФ и разработка методов предупреждения развития фиброза с целью замедления темпов прогрессирования ХБП.


