Нарушения углеводного обмена в постковидном периоде
По данным регистра больных сахарным диабетом (СД), в России на 1 января 2019 г. на диспансерном учете состояло более 4,58 млн человек (3,1% населения) с диагнозом СД [1]. Это заболевание увеличивает риск тяжелого течения новой коронавирусной инфекции в 3,68 раза [2, 3].
Гипергликемия пагубно влияет на врожденный иммунитет, вызывая дисфункцию фагоцитоза, клеточного иммунитета и нейтрофилов, хемотаксис [4]. Повышенный уровень глюкозы в крови также влияет на экспрессию АПФ2, т.е. рецептора связывания вируса SARS-CoV-2 для входа в клетку-хозяина [5].
Уже в первых исследованиях, посвященных коронавирусной инфекции, было отмечено, что у пациентов с COVID-19 без СД уровни глюкозы натощак были значительно выше, чем у больных бактериальной пневмонией [6]. В настоящее время остается непонятным, является ли влияние SARS-CoV-2 на функцию бета-клеток прямым или опосредованным, за счет действия противовоспалительных цитокинов [7]. Теоретически возможно, что вирус SARS-CoV-2 может быть тропен к эндокринным клеткам поджелудочной железы, так как уровни мРНК AПФ2, который является рецептором SARS-CoV-2, оказались высокими как в экзокринной, так и эндокринной части этой железы. В последних публикациях имеются указания на наличии антигена SARS-CoV-2 в клетках поджелудочной железы у пациентов, умерших от COVID-19 [8]. С другой стороны, SARS-CoV-2 вызывает «цитокиновый шторм», усиленный иммунным ответом с широким спектром продукции цитокинов, который создает системную провоспалительную реакцию, усиливающую в свою очередь инсулинорезистентность. Повышенный уровень провоспалительных цитокинов (ИЛ-1β, ИЛ-4, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-10, ИЛ-13, фактора, стимулирующего колонии гранулоцитов, макрофагального воспалительного белка-1 бета и ФНО) сохраняется длительно; так же продолжительно сохраняется и гипергликемия.
Ряд препаратов, используемых для лечения коронавирусной инфекции, способен вызывать гипергликемию. К ним относятся ритонавир и глюкокортикостероидные препараты (дексаметазон, преднизолон, метилпреднизолон и др.).
Длительный COVID-19 и сахарный диабет: тактика ведения
После завершения острой коронавирусной инфекции гипергликемия может сохраняться длительно. С одной стороны, уровни цитокинов длительно остаются повышенными после завершения инфекционного процесса, с другой ‒ глюкокортикостероиды (ГКС) повышают уровень сахара в крови с помощью различных механизмов, таких как:
- усиление глюконеогенеза в печени или выработки глюкозы из печени за счет усиления действия контррегуляторных гормонов [9];
- снижение действия инсулина и повышение инсулинорезистентности;
- уменьшение поглощения глюкозы мышцами и жировой тканью [10];
- прямое снижение ответа бета-клеток [11].
Таким образом, нарушение гликемии может играть чрезвычайно важную роль в формировании постковидного синдрома. Гипергликемия может клинически проявляться слабостью, сонливостью, жаждой, полиурией, полидипсией, кожным зудом, генитальным зудом. Все пациенты, предъявляющие жалобы на слабость, утомляемость, снижение работоспособности, должны проходить обследование с обязательным измерением уровня сахара крови. Риск развития СД после перенесенной новой коронавирусной инфекции в 4,9% выше, чем в среднем по популяции [12].
Гипергликемия может сохраняться длительно после перенесенной коронавирусной инфекции. При выявлении жалоб на слабость, апатию, утомляемость, сонливость, жажду, полиурию, кожный зуд, генитальный зуд требуется исследование уровня глюкозы крови и при необходимости гликированного гемоглобина.
Возможно развитие нескольких сценариев развития гипергликемии после завершения острой коронавирусной инфекции.
1. Пациент не имел нарушений углеводного обмена до заболевания COVID-19, но в процессе лечения отмечено повышение гликемии.
2. Пациент продолжает принимать ГКС после завершения острой коронавирусной инфекции.
3. СД впервые выявлен при лечении по поводу COVID-19.
4. СД диагностирован до лечения коронавирусной инфекции, в ходе лечения пациент переведен на инсулинотерапию.
5. Гипергликемия выявлена впервые после завершения коронавирусной инфекции.
Контроль уровня глюкозы в крови имеет чрезвычайно важное значение для любого человека с поставленным диагнозом COVID-19. Контроль гликемии важен даже, если ГКС не назначены, поскольку SARS-CoV-2 может как вызывать дебют СД у людей с высоким риском развития этого заболевания (с ожирением, семейным отягощенным анамнезом по СД, гестационным СД в анамнезе и т.д.), так и повышать уровень сахара у пациентов с ранее существовавшим диабетом.
В долгосрочном наблюдении возможны три варианта развития событий.
1. Пациент не имел нарушений углеводного обмена до заболевания COVID-19, в процессе лечения отмечено повышение гликемии, или пациент был переведен на ГКС. Необходимые меры:
- исследование уровня гликолизированного гемоглобина (HbA1c) и глюкозы с помощью высокоэффективной жидкостной хроматографии;
- самоконтроль гликемии;
- при превышении НbА1с менее 6,5% – модификация образа жизни, динамическое наблюдение. При уровне НbA1c более 6,5% диагностируется СД;
- контроль/самоконтроль гликемии ежедневно;
- назначение сахароснижающих препаратов в следующих случаях:
- при уровне гликемии более 6,5–7 ммоль/л натощак и 9–9,5 ммоль/л через 2 ч после еды у лиц молодого и среднего возраста;
- при уровне гликемии более 7,5–8 ммоль/л натощак и 10–10,5 ммоль/ через 2 ч после еды у лиц пожилого возраста/функционально зависимых или лиц, имеющих сердечно-сосудистое заболевание;
- при превышении целевого HbA1c менее чем на 1% – назначение пероральной сахароснижающей монотерапии, на 1–2,5% – двухкомпонентной схемы, более чем на 2,5% – трехкомпонентной схемы или инсулинотерапии.
2. Пациент получал ГКС и был переведен на инсулинотерапию. Необходимые меры:
- исследование уровня HbA1c с помощью высокоэффективной жидкостной хроматографии;
- контроль гликемии;
- целевой диапазон гликемии у лиц молодого и среднего возраста – 6,5–7 ммоль/л натощак и 9–9,5 ммоль/л через 2 ч после еды;
- целевой диапазон гликемии у лиц пожилого возраста/функционально зависимых или лиц, имеющих сердечно-сосудистое заболевание, – 7,5–8 ммоль/л натощак и 10–10,5 ммоль/л через 2 ч после еды;
- продолжение инсулинотерапии;
- контроль гликемии ежедневно, снижение дозы инсулина под контролем гликемии при снижении дозы ГКС;
- при достижении целевых значений гликемии – рассмотреть переход на пероральные сахароснижающие средства.
3. СД впервые выявлен при лечении по поводу SARS-CoV-2. Необходимые меры:
- исследование уровня HbA1c с помощью высокоэффективной жидкостной хроматографии;
- при повышении гликемии – контроль гликемии ежедневно:
- у лиц молодого и среднего возраста – при уровне гликемии более 6,5–7 ммоль/л натощак и 9–9,5 ммоль/л через 2 ч после еды;
- у лиц пожилого возраста/функционально зависимых или лиц, имеющих сердечно-сосудистое заболевание, – при уровне гликемии более 7,5–8 ммоль/л натощак и 10–10,5 ммоль/л через 2 ч после еды;
- при превышении целевого диапазона гликемии – добавление пероральных сахароснижающих средств или перевод на инсулинотерапию.
4. СД диагностирован до лечения коронавирусной инфекции, в ходе лечения пациент переведен на инсулинотерапию. Необходимые меры:
- исследование уровня HbA1c с помощью высокоэффективной жидкостной хроматографии;
- контроль гликемии ежедневно (целевой диапазон: 6,5–7 ммоль/л натощак и 9–9,5 ммоль/л через 2 ч после еды у лиц молодого и среднего возраста и 7,5–8 ммоль/л натощак и 10–10,5 ммоль/л через 2 ч после еды у лиц пожилого возраста/функционально зависимых или лиц, имеющих сердечно-сосудистое заболевание);
- при превышении целевого диапазона уровня глюкозы – титрация доз инсулина под контролем гликемии. При недостижении целевого диапазона гликемии натощак – увеличение дозы инсулина пролонгированного действия на 2 ЕД каждые 2 дня, при превышении гликемии после еды – увеличение дозы инсулина короткого действия;
- при стойком достижении целевого значения гликемии, нормализации сатурации, печеночных ферментов – пробный перевод пациента на пероральные сахароснижающие средства.
5. Гипергликемия выявлена впервые после завершения коронавирусной инфекции. Необходимые меры:
- исследование уровня HbA1c с помощью высокоэффективной жидкостной хроматографии;
- при превышении HbA1c до 6,5% – модификация образа жизни, динамическое наблюдение;
- при превышении HbA1c более 6,5% диагностируется СД;
- назначение сахароснижающей терапии;
- контроль гликемии ежедневно (целевой диапазон: 6,5–7 ммоль/л натощак и 9–9,5 ммоль/л через 2 ч после еды у лиц молодого и среднего возраста и 7,5–8 ммоль/л натощак и 10–10,5 ммоль/л через 2 ч после еды у лиц пожилого возраста/функционально зависимых или лиц, имеющих сердечно-сосудистое заболевание);
- при превышении целевого HbA1c более чем на 1% – назначение пероральной сахароснижающей монотерапии, на 1–2,5% – двухкомпонентной схемы, более чем на 2,5% – трехкомпонентной схемы или инсулинотерапии (рис. 1).
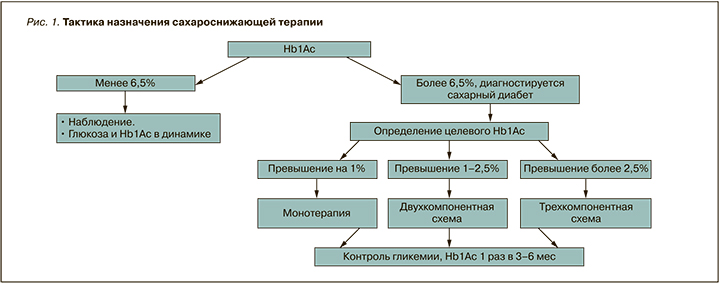
Выбор сахароснижающего средства
Бигуаниды (метформин)
Метформин – наиболее часто применяемый препарат для лечения СД в России. Также он зарегистрирован в нашей стране для лечения преддиабета при неэффективности модификации образа жизни. Большое количество пациентов на данный момент получают препараты метформина как в монотерапии, так и в составе комбинированных препаратов. В соответствии с инструкцией метформин должен быть отменен при СКФ <30 мл/мин/1,73 м2 (при СКФ 30–44 мл/мин/1,73 м2 максимальная суточная доза не должна превышать 1000 мг), печеночной недостаточности; остром коронарном синдроме; заболеваниях, сопровождающихся гипоксией; алкоголизме; ацидозе любого генеза. При возникновении в процессе коронавирусной инфекции снижения сатурации, повышения печеночных ферментов или снижения СКФ, а также при тошноте, рвоте или диарее метформин должен быть отменен из-за риска лактатацидоза [13]. В то же время последние исследования показывают, что метформин может иметь положительное влияние на прогноз пациентов с СД и COVID-19 инфекцией [14].
Метформин может быть возвращен в схему терапии при снижении уровня печеночных ферментов до 3 норм, отсутствии данных в пользу дыхательной недостаточности. Также при решении о возвращении в схему лечения этого лекарственного средства должна проводиться оценка уровня СКФ.
Препараты сульфонилмочевины (гликлазид, гликлазид с модифицированным высвобождением, глимепирид, гликвидон, глибенкламид и аналоги)
На территории России применяются в монотерапии и в комбинации с метформином. Эта группа препаратов характеризуется быстрым развитием сахароснижающего эффекта, однако при их приеме существует риск гипогликемии, быстрого развития резистентности, прибавки массы тела; кроме того, отсутствуют однозначные данные по сердечно-сосудистой безопасности препаратов сульфонилмочевины. В остром периоде коронавирусной инфекции применение препаратов сульфонилмочевины ограничено ввиду сниженного аппетита у пациентов, а также рвоты, что может усиливать риск гипогликемических состояний. В постковидном периоде при назначении препаратов этого класса следует помнить о снижении инсулинорезистентности в динамике и потребности в сахароснижающих средствах. Необходим ежедневный контроль гликемии при возникновении гипогликемических состояний, адаптация дозы препаратов сульфонилмочевины.
Применение препаратов сульфонилмочевины в постковидном периоде возможно при сохраненном аппетите, возможности самостоятельного питания. Следует предупреждать пациента о возможном снижении гликемии ввиду уменьшения инсулинорезистентности, требуется соблюдение навыков профилактики гипогликемических состояний и ежедневый контроль гликемии.
Ингибиторы дипептидилпептидазы-4 (ситаглиптин, вилдаглиптин, саксаглиптин, алоглиптин, линаглиптин, гемиглиптин, гозоглиптин, эвоглиптин)
Дипептидилпептидаза имеет большое значение в регуляции обмена глюкозы в организме. Повышение активности дипептидилпептидазы вызывает нарушение инкритинового ответа. Кроме того, дипептидилпептидаза 4-го типа играет важную роль в иммунной системе, поскольку служит маркером активированных Т-лимфоцитов и регулятором экспрессии многих хемокинов, таких как CCL5, CXCL12, CXCL2 [15].
На основании сообщений об инфекциях верхних дыхательных путей были высказаны опасения по поводу увеличения риска вирусных инфекций на фоне применения ингибиторов дипептидилпептидазы-4 (иДПП-4) [16]. Однако в клинических исследованиях связи между использованием иДПП-4 и риском развития внебольничных пневмоний у пациентов с СД 2-го типа показано не было [17]. В исследованиях in vitro лечение ситаглиптином, вилдаглиптином или саксаглиптином не блокировало вход коронавируса в клетки [18].
На данный момент прием иДПП-4 у пациентов с СД 2-го типа на фоне лечения COVID-19 считается абсолютно безопасным [19, 20]. В ретроспективном исследовании, выполненном в Северной Италии, лечение ситаглиптином во время госпитализации по поводу коронавирусной инфекции было связано со снижением смертности и улучшением клинических исходов у таких пациентов [21]. Использование иДПП-4 представляется весьма эффективным и безопасным как в период острой коронавирусной инфекции, так и в постковидном периоде. Прием этого класса препаратов сопряжен с низким риском гипогликемических состояний, что немаловажно в период уменьшения инсулинорезистентности и снижения дозы ГКС, а также не влияет на массу тела. Для большинства иДПП-4 возможно применение на всех стадиях хронической болезни почек. При СКФ менее 30 мл/мин/1,73 м2 требуется коррекция дозы препаратов группы иДПП-4, кроме линаглиптина.
Применение иДПП-4 безопасно удобно в постковидном периоде и не сопряжено с набором веса и повышенным риском гипогликемических состояний.
Агонисты глюкагоноподобного пептида 1
Агонисты глюкагоноподобного пептида 1 (аГПП-1) представлены 6 препаратами (эксенатид, эксенатид пролонгированного действия, лираглутид, ликсисенатид, дулаглутид, семаглутид) и нашли широкое применение в качестве высокоэффективных сахароснижающих средств с рядом плейотропных эффектов. В ряде крупных исследований доказаны кардиопротективные свойства лираглутида, дулаглутида и семаглутида и их способность влиять на сердечно-сосудистые исходы, в первую очередь за счет снижения числа нефатальных инфарктов и инсультов. В качестве еще одного плейотропного эффекта отмечено влияние аГПП-1на иммунную функцию и воспалительные процессы [22, 23].
У людей рецепторы ГПП-1 широко распространены в различных клетках и органах, в том числе в почках, легких, сердце, эндотелиальных клетках и нервных клетках. Применение аГПП-1 снижает производство противовоспалительных цитокинов и инфильтрацию иммунными клетками печени и почек, легких, головного мозга и органов сердечно-сосудистой системы [24, 25].
Люди с сердечно-сосудистыми заболеваниями или хронической болезнью почек (ХБП) находятся в группе максимально высокого риска по тяжелому течению COVID-19 [26]. Препараты класса аГПП-1 (лираглутид, семаглутид и дулаглутид) обладают нефропротективными свойствами и могут применяться до стадии ХБП 4. Стратегия кардиоренальной протекции у людей с высоким риском заражения SARS-CoV-2 представляется абсолютно необходимой.
Более того, пациенты с COVID-19 и ожирением подвержены более тяжелому течению заболевания и имеют больший риск попадания на ИВЛ и развития ОРДС. АГПП-1 обладают способностью снижать вес и, вероятно, играют важную роль в профилактике тяжелого течения новой коронавирусной инфекции [27]. Однако инициировать терапию этими препаратами в острых или критических ситуациях (например, при тяжелом COVID-19) не рекомендуется, потому что из-за медленной титрации дозы им потребуется время, чтобы развить свои основные эффекты, а также ввиду риска диспепсических расстройств (тошноты и рвоты), которые могут усугубить обезвоживание.
В период восстановления и сохранения постковидной гипергликемии аГПП-1 представляются перспективной группой сахароснижающих препаратов в силу низкого риска гипогликемических состояний, наличия кардио- и нефропротективных свойств.
Ингибиторы натрий глюкозного ко-транспортера 2-го типа (дапаглифлозин, эмпаглифлозин, канаглифлозин, ипраглифлозин, эртуглифлозин)
Ингибиторы натрий глюкозного ко-транспортера 2-го типа (иНГЛТ-2) воздействуют на почки, снижая уровень глюкозы за счет уменьшения реабсорбции глюкозы в почечных канальцах, и используются для лечения СД 2-го типа, а также сердечной недостаточности с низкой фракцией выброса у пациентов без СД. Применение иНГЛТ-2 уменьшает уровни экспрессии мРНК некоторых цитокинов и хемокинов, таких как ФНО, ИЛ-6 и хемоаттрактант моноцитов [28]. Вместе с тем лечение иНГЛТ-2 может вызывать эугликемический кетацидоз [29], особенно у тяжелобольных.
Важно отметить, что иНГЛТ-2 оказывают диуретический эффект за счет усиления экскреции глюкозы и натрия, что приводит к осмотическому диурезу и, возможно, обезвоживанию.
Таким образом, использование иНГЛТ-2 может быть затруднено у пациентов, находящихся в отделении интенсивной терапии, и требует тщательного контроль кислотно-щелочного состояния крови и водно-электролитного баланса. Также ограничением к назначению иНГЛТ-2 может быть снижение СКФ менее 45–30 мл/мин/м2.
Применение иНГЛТ-2 при тяжелом течении коронавирусной инфекции не показано. Если пациент находился на иНГЛТ-2, целесообразен его перевод на инсулинотерапию или препараты с меньшим риском развития дегидратации и кетоацидоза. В то же время при лечении постковидной гипергликемии использование иНГЛТ-2 является перспективным и обоснованным. Отметим, что у эмпаглифлозина, дапаглифлозина, канаглифлозина доказано наличие кардио- и ренопротективных свойств. Препарат класса иНГЛТ-2 может быть возвращен в схему лечения пациента или назначен впервые при достаточном потреблении пациентом жидкости, СКФ более 30 мл/мин и под контролем кетонурии.
иНГЛТ-2 приставляются перспективными и приоритетными препаратами при лечении постковидной гипергликемии ввиду их доказанных кардио- и нефротротективных свойств, низкого риска гипогликемических состояний. Однако для эффективного и безопасного назначения должны быть соблюдены ряд условий: возможность адекватной гидратации, отсутствие кетонурии, СКФ более 30–45 мл/мин в зависимости от выбранного препарата, возможность адекватного соблюдения личной гигиены.
Инсулинотерапия
При лечении коронавирусной инфекции многим пациентам требуется перевод на инсулин как на самое физиологичное и легкоуправляемое сахароснижающее средство. Дозы инсулина, применяемые в течение острого периода коронавирусной инфекции, представляются весьма высокими. В остром периоде рациональная инсулинотерапия базируется на весе пациента и его соматической патологии.
Общая доза инсулина составляет:
- 0,2 ЕД/кг у пациентов с предшествующей панкреатэктомией, 0,3 ЕД/кг у пациентов с острым заболеванием почек, травмой, ХБП, терминальной стадией почечной недостаточности, печеночной недостаточностью, недоедающих или пожилых пациентов;
- 0,4 ЕД/кг у пациентов с СД 1-го типа, у пациентов с СД 2-го типа и индексом массы тела (ИМТ) <30, не получавших инсулин;
- 0,5 ЕД/кг у пациентов с СД 2-го типа и ИМТ> 30, ранее не получавших инсулин;
- 0,6 ЕД /кг у пациентов с СД 2-го типа, применяющих инсулин, у пациентов с СД 2-го типа, получающих ГКС.
Если требуется введение ГКС пациентам, уже получающим инсулин, оправдано увеличение дозы инсулина на 20%. Если преднизолон или гидрокортизон применяются утром, дозу коротко действующего инсулина следует увеличить на 20%, разделив на 3 приема пищи. При использовании ГКС длительного действия, таких как дексаметазон, доза инсулина как пролонгированного, так и быстрого действия должна быть увеличена на 10%.
Контроль гликемии стоит проводить ежедневно. Если глюкоза крови выше индивидуального целевого диапазона, показано повышение дозы инсулина на 10%. Однако если уровень глюкозы в крови составляет менее 5 ммоль/л, то доза должна быть снижена на 10%. В постковидном периоде потребность в инсулине прогрессивно снижается, что может стать причиной тяжелых гипогликемических состояний. Именно в постковидном периоде требуется ежедневное исследование уровня глюкозы крови натощак и через 2 ч после еды с ежедневной адаптацией доз инсулина. Пациент должен быть обучен принципам самоконтроля, технике профилактики гипогликемических состояний. Пациенты на инсулинотерапии в постковидном периоде должны иметь возможность коррекции доз инсулина и регулярных консультаций лечащего врача. В этом аспекте перспективным представляется создание телемедицинских консультаций и применение онлайн-технологий.
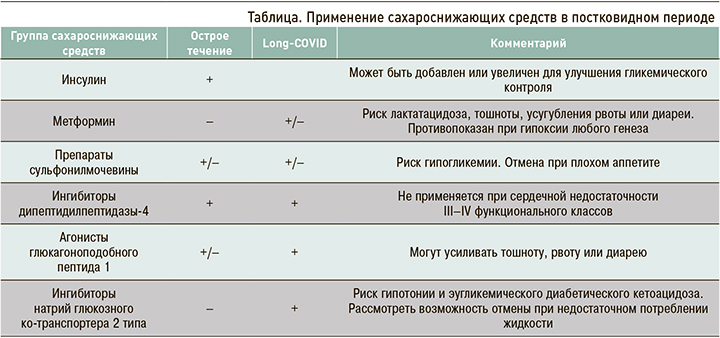
Принципы применения сахароснижающих средств в постковидном периоде обобщены в таблице.
Патология щитовидной железы в постковидном периоде: тактика ведения
В настоящее время нет достаточных данных о влиянии SARS-CoV-2 на щитовидную железу. Рецепторы АПФ2 определяются и в этой железе [30].
В нескольких работах описывается начало подострого тиреоидита у пациентов с диагнозом COVID-19 [31, 32]. Учитывая, что этиологию подострого тиреоидита связывают с вирусными инфекциями, не удивительно, что SARS-CoV-2 может быть его причиной.
Функцию щитовидной железы не следует оценивать во время тяжелого клинического течения заболевания. При тяжелом соматическом состоянии пациента отмечаются снижение уровня свободного трийодтиронина (Т3), свободного тироксина (Т4) и низкий или низконормальный уровень тиреотропного гормона (ТТГ) [33]. Ретроспективный анализ функции щитовидной железы у госпитализированных пациентов с умеренным тяжелыми симптомами COVID-19 обнаружено снижение ТТГ и общего T3 по сравнению с пациентами, у которых нет COVID-пневмонии. Степень снижения ТТГ и общего Т3 коррелировала с тяжестью заболевания, тогда как уровень Т4 существенно не отличался от контрольной группы. После выздоровления показатели функции щитовидной железы нормализовались у всех пациентов [34].
В литературе есть публикации, свидетельствующие о развитии тиреоидита после завершения острой коронавирусной инфекции. Так, в ретроспективном исследовании из 287 пациентов, госпитализированных с SARS-CoV-2, частота тиреотоксикоза составила 20,2%. Присутствия антител к рецептору ТТГ обнаружено не было, и наличие токсикоза было напрямую связано с повышением ИЛ-6 [35].
Развитие тиреоидита возможно даже в отсутствие исходно существующего заболевания щитовидной железы. Деструктивный тиреоидит имеет двухфазное течение. В первой фазе происходит деструкция тироидного эпителия и развивается тиреотоксикоз, во вторую фазу, наступающую через 2–3 мес, возникает транзиторный гипотиреоз, который у 20–30% пациентов может переходить в стойкий гипотиреоз. Учитывая, что в постковидном периоде преобладают жалобы на слабость, утомляемость, сонливость, учащенное сердцебиение, обязательно следует проводить дифференциальный диагноз с патологией щитовидной железы. В этой ситуации требуется исследование уровня ТТГ.
В литературе описаны развития аутоиммунных заболеваний (антифосфолипидный синдром, аутоиммунный тромбоцитемия, гемолитическая анемия, синдром Гийен–Барре) у пациентов, перенесших инфекцию SARS-CoV-2. Аутоиммунные заболевания щитовидной железы были описаны как осложнения COVID-19, даже у пациентов с легкими его проявлениями [36, 37].
При выявлении жалоб на слабость, утомляемость, сонливость, нарушение памяти, отечность, бессонницу, тревожность, угашенное сердцебиение, одышку требуется определение уровня ТТГ.
При повышении ТТГ более 10 мМЕ/л диагностируется манифестный гипотиреоз и назначается терапия левотироксином из расчета 1,6 мкг/кг; для людей, имеющих сердечно-сосудистую патологию, расчетная доза препарата составляет 0,9 мкг на 1 кг веса. При повышении ТТГ менее 10 мМЕ/л необходимо исследование свободного Т4. При нормальном уровне свободного Т4 и ТТГ в диапазоне 4–10 ММЕ/л диагностируется субклинический гипотиреоз и рекомендуется контроль ТТГ через 3 мес. Если уровень ТТГ находится в диапазоне от 4,0–10 ММЕ/л и при этом определяется низкий уровень свободного Т4, необходимо назначение препаратов левотироксина исходя из расчетной дозы 0,9 мкг на 1 кг веса с обязательным контролем ТТГ через 3 мес.
При снижении уровня ТТГ стоит проводить дифференциальный диагноз между медикаментозным тиреотоксикозом, подострым тиреоидитом, деструктивным тиреоидитом, многоузловым токсическим зобом, диффузным токсическим зобом (рис. 2).
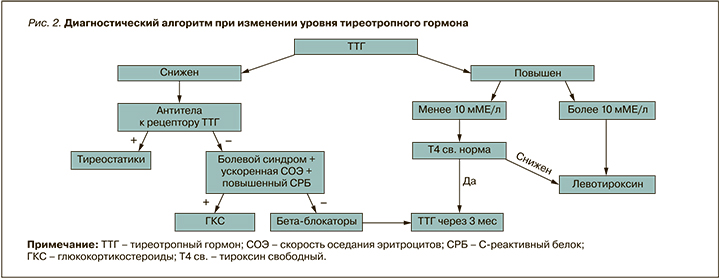
При выявлении сниженного ТТГ в сочетании с сохраняющимся повышением температуры до 38–38,5 °С, болями в горле стоит проводить дифференциальный диагноз с подострым тиреоидитом. К признакам последнего относятся:
- СОЭ более 30–40 мм/ч без сдвига лейкоцитарной формулы;
- повышение СРБ;
- низкий индекс захвата при сцинтиграфии;
- положительная проба Крайя.
Также требуется консультация эндокринолога.
Лечение патологии щитовидной железы в постковидном периоде включает:
- применение НПВП;
- применение бета-блокаторов;
- применение ГКС (преднизолона) в стартовой дозе 20–30 мг со снижением дозы после достижения клинического регресса симптоматики и нормализации скорости оседания эритроцитов (СОЭ) и уровня СРБ;
- контроль ТТГ каждые 3 мес.
При сочетании снижения ТТГ, увеличения свободного Т3, свободного Т4, повышения антител к рецептору ТТГ и/или повышения индекса захвата технетрила при сцинтиграфии щитовидной железы диагностируется диффузный токсический зоб (болезнь Грейвса). Требуется консультация эндокринолога. Лечение проводится тиреостатическими препаратами.
При снижении ТТГ с высоким или высоконормальным уровнем Т3 и Т4 и отсутствием антител к рецептору ТТГ и низким индексом захвата радиофармпрепарата при сцинтиграфии устанавливается диагноз деструктивного тиреоидита. Такая ситуация наиболее типична для постковидного синдрома. В этом случае проводится симптоматическая терапия, назначение тиреостатиков не требуется.
Поражение надпочечников в постковидном периоде: тактика ведения
У пациентов с тяжелым течением заболевания, вызванного инфекцией SARS-CoV-2, в настоящее время используют ГКС. С одной стороны, лечение ГКС может вызвать симптомы ятрогенного синдрома Кушинга (ятрогенный гиперкортицизм), с другой – после отмены препарата из-за подавления оси «гипоталамус–гипофиз–надпочечники» может развиваться вторичная надпочечниковая недостаточность. Последняя потенциально способна увеличить риск заболеваемости и смертности. Кроме того, совместное применение ГКС с ингибиторами ферментов цитохрома P4503A (например, с антиретровирусными препаратами) может продлевать период их полувыведения и приводить к более длительному подавлению оси гипоталамо-гипофизарно-надпочечниковой системы [38].
У пациентов, перенесших COVID-19 и длительно получавших ГКС, при предъявлении жалоб на слабость, снижение АД, нарушение концентрации внимания, диарею, потерю веса, тошноту, рвоту, боли в животе требуется исключить надпочечниковую недостаточность. Необходимо исследование натрия, кортизола в утренней сыворотке крови, исследование кортизола крови после стимуляции синтетическим адренокортикотропным гормоном (АКТГ).
Распознать вторичный гипокортицизм зачастую непросто. Симптомы, возникающие при вторичной надпочечниковой недостаточности, такие как утомляемость, гипотония, потеря веса, тошнота, рвота, боли в животе, абсолютно неспецифичны и могут быть приняты за симптомы, вызванные тяжелым инфекционным заболеванием. Более того, у ослабленных пациентов отмена стероидов может также спровоцировать надпочечниковый криз, который представляет собой опасное для жизни осложнение. В этом случае следует подозревать надпочечниковую недостаточность, особенно при низкой концентрации натрия (<135 мЭкв /л), и диагностировать ее на основании уровней кортизола в утренней сыворотке <80 нмоль /л или пика кортизола <550 нмоль/л после стимуляции синтетическим АКТГ. Измерение кортизола следует отложить по крайней мере на одну неделю после снижения дозы ГКС и полной их отмены [39].
Распространенность надпочечниковой недостаточности после приема ГКС неизвестна. При этом, как правило, краткосрочное (<3 нед) лечение этими препаратами не приводит к подавлению оси «гипоталамус–гипофиз–надпочечники».
Следовательно, у пациентов, получавших высокие дозы ГКС в процессе лечения инфекции, вызванной SARS-CoV-2, требуется постепенное снижение их дозировки. Если в период снижения дозы происходят стрессовые события (инфекционное заболевание, травма или операция), дозу необходимо увеличить. Физиологическая концентрация глюкокортикоидов поддерживается с помощью преднизолона в дозировке 5,0–7,5 мг/сут, гидрокортизона 20 мг/сут (разделенного на 2–3 приема) или ацетата кортизона 25 мг/сут (разделенного на 2 приема). Из-за короткого периода полувыведения гидрокортизон обычно способствует более быстрому восстановлению функции гипоталамогипофизарной системы.
Отмена ГКС должна проводиться медленно, с постепенным снижением дозы. При подтверждении вторичной надпочечниковой недостаточности следует продолжить применение ГКС (гидрокортизона или кортизона ацетата) с постепенной их отменой.


