Определение
Детский мультисистемный воспалительный синдром (ДМВС, синоним – мультисистемный воспалительный синдром у детей; код по МКБ-10 – М35.81 – мультисистемный воспалительный синдром), ассоциированыый с COVID-19 – редкое острое жизнеугрожающее иммунопатологическое отсроченное (развивающееся через 1–6 нед) осложнение новой коронавирусной инфекции COVID-19, которое протекает с лихорадкой, артериальной гипотензией/шоком, системным васкулитом сосудов мелкого и среднего калибра и мультиорганным воспалением, поражающим кожу и слизистые оболочки, сердце, ЖКТ, нервную систему, легкие, почки. ДМВС, выступающий самым тяжелым проявлением COVID-19 у детей, впервые был описан в апреле–мае 2020 г., когда в разных странах появились сообщения о случаях Кавасаки-подобного синдрома с последующим развитием полиорганной недостаточности и шока у детей, перенесших COVID-19 [1–4]. Кроме детей, мультисистемный воспалительный синдром как осложнение COVID-19 описывают и у взрослых.
Эпидемиология
По статистическим данным в США, заболеваемость ДМВС в среднем составила 316 человек на 1 000 000 случаев заражения SARS-CoV-2, со значимыми различиями в зависимости от возраста и расы [5]. Чаще ДМВС встречается у мальчиков (медиана возраста – 9 лет (от 3 мес до 17 лет)), при этом наблюдается этническая предрасположенность к его возникновению. Так, в европейской части России ДМВС чаще (относительно доли соответствующих национальностей в общей популяции) развивается у евреев, представителей кавказских народов, монголоидов, арабов [6]; в США среди лиц африканского, афрокарибского, латиноамериканского, реже восточноазиатского происхождения, ДМВС регистрируется у 1 на 100 000 человек в возрасте до 21 года [7]. Частота госпитализаций детей с ДМВС коррелирует с уровнем заболеваемости COVID-19 в регионе.
Этиология, патогенез и патоморфология
Патофизиология ДМВС исследована недостаточно. Предполагается, что этот синдром возникает вследствие аномалии иммунного ответа на вирус, по некоторым характеристикам, ДМВС схож с болезнью Кавасаки и синдромом активации макрофагов (САМ). Механизмы, при помощи которых SARS-CoV-2 провоцирует аномальный иммунный ответ, до конца неизвестны. У большинства детей с ДМВС результаты теста на SARS-CoV-2, выполненного методом ПЦР, отрицательные (60–80%), в то время как результаты серологического исследования положительные (80–90%), чаще выявляются IgG-антитела [6–9]. Это служит дополнительным аргументом в поддержку гипотезы о том, что ДМВС связан с иммунной дисрегуляцией, возникающей после того, как острая фаза инфекции завершилась.
Показано, что IgG к SARS-CoV-2 могут иметь важное патогенетическое значение для развития «цитокинового шторма» вследствие стимулирующего влияния на продукцию провоспалительных цитокинов макрофагами [10]. Вместе с тем воспалительная реакция при ДМВС может отличаться от «цитокинового шторма» при тяжелом остром COVID-19; она имеет некоторые общие черты с болезнью Кавасаки, но при этом разнится с ней в отношении субпопуляций Т-клеток, ИЛ-17 и биомаркеров, связанных с повреждением артерий. В патогенез ДМВС вовлечены аутоантитела различной специфичности [11]. Обнаружение широкого спектра аутоантител, связывающихся с эндотелиальными, интерстициальными и иммунными клетками, позволяет рассматривать ДМВС как своеобразную форму вирус-индуцированного аутоиммунного заболевания. Клинические и лабораторные проявления ДМВС – результат значительного повышения в крови уровня провоспалительных цитокинов, прежде всего ИЛ-1 и ИЛ-6, служащих мишенями для биологической терапии, а также ФНО-α, ИЛ-8, ИЛ-10, ИЛ-16, ИЛ-17, ИЛ-18, интерферона γ [6, 8, 9, 12–16]. Имеются данные о способности S-белка SARS-CoV-2 напрямую активировать Т-клетки: это связано с присутствием в его структуре мотива, гомологичного с эндотоксином B стафилококка, являющегося суперантигеном, который потенциально может индуцировать гиперпродукцию провоспалительных цитокинов. Предполагается, что при ДМВС анти-SARS-CoV-2-антитела могут индуцировать провоспалительный фенотип иммунного ответа за счет механизмов антителозависимого усиления [15].
По данным анализа состояния здоровья пациентов с ДМВС, примерно у половины из них до манифестации этой патологии имеются сопутствующие заболевания, в числе которых наиболее часто встречаются избыточная масса тела/ожирение (у 1/4 больных), аллергические заболевания (атопический дерматит, бронхиальная астма, пищевая или лекарственная аллергия, поллиноз – у 1/6 детей), реже эндокринологические заболевания (СД 1-го типа, аутоиммунный тиреоидит), врожденные пороки развития и синдромальная патология [6, 12]. Возможна одновременная манифестация ДМВС и СД 1-го типа [13].
Патогенез и патологоанатомическая картина COVID-19 характеризуется развитием тромбовоспаления, генерализованной микроангиопатии в виде деструктивно-продуктивного вирусного васкулита и коагулопатии со вторичным поражением кожи, внутренних органов, ЦНС, гемофагоцитозом [14, 15]. В максимальной степени такие изменения у пациентов детского возраста выражены при ДМВС. При проведении аутопсии на макроскопическом уровне основные изменения сводятся к проявлениям синдрома системного воспалительного ответа небактериальной природы с полиорганной недостаточностью. Основными пострадавшими органами выступают легкие (имеют место признаки острой фазы диффузного альвеолярного повреждения), сердце (признаки миокардита), почки («шоковые» почки), головной мозг (отек, васкулит). Поражения сосудов протекают в виде полиангиита, преимущественно сосудов мелкого и среднего калибра. В среднекалиберных сосудах отмечается воспалительная клеточная инфильтрация их стенок, а в мелких – краевое стояние лейкоцитов и деструкция стенки сосудов, соответствующая микроскопическому паттерну лейкоцитокластического васкулита. Морфологическим выражением ДМВС являются многочисленные воспалительные инфильтраты (преимущественно лимфомоноцитарно-макрофагальные, в меньшей степени гранулоцитарные) в различных органах, что полностью соответствует названию заболевания [9, 16].
Клиническая картина и диагностика
Основные клинические проявления ДМВС включают персистирующую лихорадку и системное воспаление с вовлечением в патологический процесс различных органов и систем – кожи и слизистых оболочек, сердечно-сосудистой и нервной систем, системы крови, ЖКТ, почек. Прогрессирование воспалительного ответа может привести к развитию САМ, полиорганной недостаточности и гибели пациента. Лихорадка характеризуется рефрактерностью к антибактериальной терапии, возобновляется через 1–6 нед после перенесенного COVID-19. Диагностическую сложность представляют пациенты, перенесшие COVID-19 бессимптомно, что типично для детей. В этом случае для установления диагноза определяющее значение имеют данные эпидемиологического анамнеза, результаты лабораторных обследований детей, их родителей и окружения (результаты серологической диагностики, главным образом обнаружение антител IgG). Характерно появление полиморфной сыпи, чаще пятнистой, пятнисто-папулезной, конъюнктивита, склерита, лимфаденопатии, отечности ладоней и стоп, сближающей фенотип ДМВС с болезнью Кавасаки (чаще с неполной формой). Чем младше возраст ребенка, тем чаще у него проявления ДМВС соответствуют болезни Кавасаки.
У пациентов могут отмечаться кашель, одышка, усиливающиеся в горизонтальном положении, десатурация, плевральный выпот, однако все респираторные проявления при ДМВС – результат недостаточности кровообращения, шока, а не поражения легких вследствие пневмонии, вызванной COVID-19. Для стабилизации гемодинамики таким больным необходимы кислородотерапия или ИВЛ. У большинства пациентов с ДМВС результаты рентгенографии органов грудной клетки в норме, могут определяться небольшой плевральный выпот, признаки разрешающейся или перенесенной пневмонии. Аналогичные изменения выявляются на КТ, на них также могут определяться участки «матового стекла», признаки отека междольковых перегородок или в тяжелых случаях недостаточности кровообращения ‒ отека легких.
О вовлечении в патологический процесс сердца будут свидетельствовать также боли за грудиной, цианоз, отеки. При обследовании пациентов с ДМВС обязательно измерение и мониторинг АД. Этот синдром может приводить к артериальной гипотензии, шоку, миокардиту, перикардиту, коронариту, эктазиям и аневризмам коронарных артерий, нарушению ритма сердца, ОКС, тромбозам. Эти кардиальные проявления ДМВС могут развиться как в начале заболевания, так и на фоне нарастания воспалительной активности. Дистрибутивный шок часто рефрактерен к восполнению объема циркулирующей крови, что требует применения вазопрессоров и в редких случаях ИВЛ. Острое повреждение миокарда сопровождается повышением маркеров повреждения миокарда (тропонин, N-терминальная часть прогормона мозгового натрийуретического пептида NT-proBNP или BNP), уровень которых необходимо контролировать в динамике до нормализации. При выполнении эхокардиографии (ЭхоКГ) определяется систолическая дисфункция левого желудочка, о чем будет свидетельствовать снижение его фракции выброса, коронарит и в ряде случаев эктазии, аневризмы коронарных артерий, перикардиальный выпот. У детей с ДМВС результаты ЭКГ могут быть неспецифическими, хотя встречаются описания случаев аритмии и блокады сердца. У пациентов с ДМВС ЭКГ следует проводить не реже чем каждые 48 ч во время госпитализации.
Гастроинтестинальные симптомы также могут быть одним из основных проявлений ДМВС. К ним относятся боль в животе, тошнота, рвота, диарея; клиническая картина при этом сходна с проявлениями острого вирусного гастроэнтерита, в ряде случаев симулирует острый аппендицит, что требует лапароскопии. Возможно развитие серозного перитонита. При УЗИ или КТ брюшной полости могут определяться скопление свободной жидкости, асцит, а также воспаление кишки и брыжейки, включая терминальный илеит, мезентериальную лимфаденопатию и перихолецистический отек, при колоноскопии – колит. В биохимическом анализе крови определяется повышение АЛТ, АСТ.
У ряда пациентов могут отмечаться повышенная возбудимость, судороги, менингеальные симптомы, угнетение сознания. Возможно развитие менингита, цереброваскулита [6–9, 17, 18].
Частота кожных и кожно-слизистых, гастроинтестинальных, неврологических проявлений ДМВС, миокардита и болезни Кавасаки зависит от возраста. У детей в возрасте до 5 лет чаще, по сравнению с другими возрастными группами, регистрируются кожные и кожно-слизистые симптомы болезни Кавасаки, в то время как у подростков ДМВС чаще манифестирует в виде миокардита или неврологических симптомов [7]. В таблице 1 представлена частота основных клинических и лабораторно-инструментальных признаков ДМВС на основании анализа наблюдений 245 госпитализированных пациентов в стационары Москвы и Екатеринбурга.
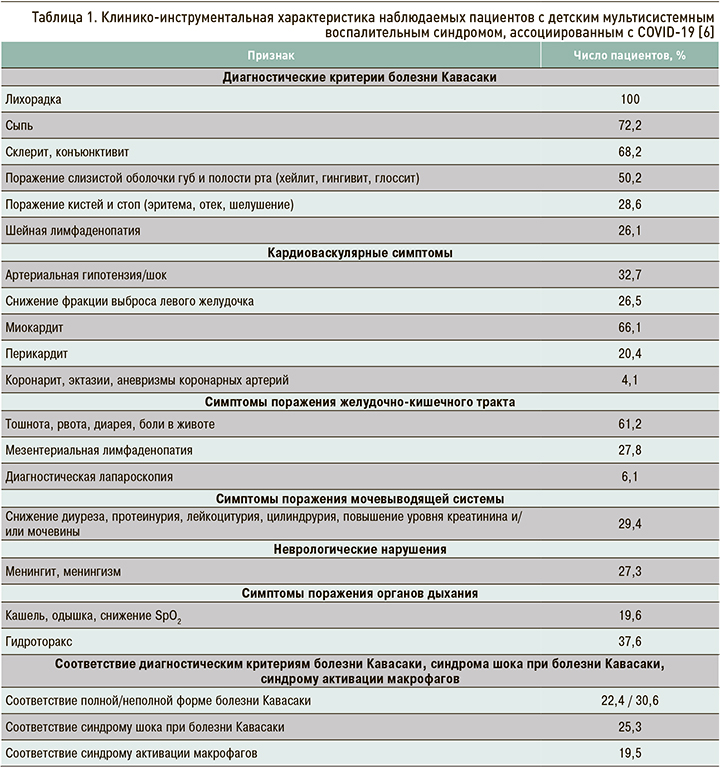
Если в описаниях первых серий случаев сообщалось о частом развитии ДМВС с тяжелыми проявлениями, которые характеризовалась высокой распространенностью шока, вовлечения миокарда и дыхательной недостаточности, то в настоящее время становится понятным широкий диапазон тяжести течения ДМВС, включая легкие формы, протекающие без шока, дисфункции левого желудочка, дыхательной недостаточности и острого повреждения почек [1–3].
Отклонения в результатах лабораторных исследований при ДМВС, ассоциированном с COVID-19, свидетельствуют о его высокой лабораторной активности, проявляющейся нейтрофильным лейкоцитозом (83,8% пациентов), лимфоцитопенией (88,2%), повышением СОЭ (70,5%), СРБ, (98,4%), прокальцитонина (74,3%), ферритина (78,5%), гипоальбуминемией (78,6%), увеличением активности ЛДГ (32,1%). Большинство пациентов имеет коагулопатию, характеризующуюся повышением уровня D-димера (53,8%) и/или фибриногена (92,2%) [6]. Концентрация провоспалительных цитокинов также повышена, но их значение не должно влиять на метод применяемого лечения [7].
Таким образом, необходимо помнить, что как при COVID-19, так и при ассоциированном с ним ДМВС лабораторные маркеры синдрома системной воспалительной реакции повышены без бактериальной инфекции, что затрудняет ее исключение и может быть причиной неоправданно широкого назначения антибиотиков [19].
Диагностические критерии и дифференциальная диагностика
Сообщения о новом заболевании у детей на фоне COVID-19 и накопление опыта ведения таких пациентов позволили экспертам Центров по контролю и профилактике заболеваний США (CDC) 14 мая [20] и ВОЗ 15 мая [21] 2020 г. опубликовать диагностические критерии ДМВС в сравнении с фенотипически сходными заболеваниями, в том числе требующими исключения (табл. 2). У пациентов, которые не соответствуют вышеуказанным критериям ДМВС, следует исключать другие заболевания, продолжая при этом наблюдение в отношении возможности ДМВС, особенно в случае эпидемиологической связи с SARS-CoV-2. При этом у пациентов, которые соответствуют критериям ДМВС, также следует учитывать возможность других причин симптомов, поскольку этот синдром имеет много общих черт с различными заболеваниями, проявляющимися лихорадкой и поражениями кожи (включая инфекции, новообразования и воспалительные заболевания). Шок неясной этиологии в условиях пандемии COVID-19 требует полной диагностики в направлении ДМВС [7].


ДМВС требует проведения дифференциальной диагностики с заболеваниями и осложнениями, развивающимися на фоне других инфекционных, гематологических и ревматических патологий. Среди последних следует в первую очередь обратить внимание на болезнь Кавасаки, гемофагоцитарный лимфогистиоцитоз (САМ), бактериальный сепсис, инфекционный токсический шок, системный ювенильный идиопатический артрит, СКВ и системные васкулиты [15].
ДМВС можно отличить от болезни Кавасаки, не связанной к SARS-CoV-2, по следующим эпидемиологическим, клиническим и лабораторным характеристикам:
- болезнь Кавасаки чаще встречается у выходцев из стран Азии, тогда как для ДМВС характерна другая этническая предрасположенность, и он относительно редок у лиц азиатского происхождения;
- ДМВС развивается у детей более широкого возрастного диапазона, поражая детей с медианой возраста 9 лет, для него характерны более выраженные симптомы со стороны ЖКТ и ЦНС, он чаще связан с шоком и сердечной дисфункцией (аритмией и дисфункцией левого желудочка), чем болезнь Кавасаки, поражающая в основном детей первых 5 лет жизни и сопровождающаяся шоком не чаще, чем в 10% случаев;
- пациенты с ДМВС на момент возникновения симптомов обычно имеют более низкое количество тромбоцитов, более низкое абсолютное количество лимфоцитов и более высокую концентрацию СРБ, чем пациенты с болезнью Кавасаки [7]. Пациенты с положительными результатами теста на SARS-CoV-2 (или после контакта с лицом с COVID-19), которые соответствуют всем или части критериев диагностики болезни Кавасаки, должны рассматриваться как пациенты с ДМВС, и им должна быть проведена стандартная терапия болезни Кавасаки.
Экзантему при ДМВС также необходимо дифференцировать с поражением кожи при острой COVID-19, которая может проявляться участками псевдообморожения на акральных поверхностях конечностей (иногда называемых «ковидные пальцы»), папуловезикулезной, уртикарной, кореподобной сыпью [27].
У всех детей с подозрением на ДМВС необходим забор крови для посева, до получения результатов которого должна проводиться эмпирическая антибиотикотерапия. Применение антибиотиков должно быть прекращено сразу после исключения бактериальной инфекции, если состояние ребенка стабилизировалось. Вовлечение сердца, особенно коронарных артерий, нетипично для бактериального сепсиса и может быть одним из дифференциально-диагностических признаков.
К вирусным патогенам, инфицирование которыми может проявляться мультисистемным поражением и/или миокардитом, осложняться САМ, относятся вирус Эпштейна–Барр, парвовирус В19, цитомегаловирус, аденовирус и энтеровирусы. Эти вирусы редко вызывают острое мультисистемное поражение у иммунокомпетентных детей. Выполнение серологического исследования (важно – до трансфузии иммуноглобулинов) и ПЦР помогают отличить эти вирусные инфекции от ДМВС, ассоциированного с COVID-19 [15].
СКВ может проявляться фульминантным мультисистемным заболеванием с преимущественным вовлечением в патологический процесс почек и ЦНС, что не является типичным признаком ДМВС. Кроме того, большинство пациентов с СКВ сообщает об усталости и плохом самочувствии на протяжении длительного периода времени до проявления симптомов тяжелого заболевания. По контрасту с СКВ большинство детей с ДМВС здоровы до момента резкого развития лихорадочного состояния.
Терапия
Целями лечения ДМВС служат стабилизация клинического состояния пациента в случае возникновения опасных для жизни состояний и предотвращение долгосрочных осложнений со стороны различных органов. Дети с ДМВС или подозрением на него должны быть госпитализированы. В ОРИТ должны госпитализироваться дети с нестабильностью гемодинамики (шок, аритмия), существенными респираторными нарушениями (потребность в кислородотерапии), поражением почек, печени, ЦНС, несущим потенциальную угрозу жизни. Лечение детей с ДМВС требует мультидисциплинарного подхода с привлечением детских инфекционистов, ревматологов, кардиологов, анестезиологов-реаниматологов, гематологов.
В настоящее время нет доказательных данных для непосредственного сравнения различных терапевтических вмешательств при ДМВС, основывающихся главным образом на опыте различных центров и экстраполировании лечения болезни Кавасаки, САМ, тяжелого COVID-19. Актуальные рекомендации [7, 18] включают применение:
- иммуноглобулинов для внутривенного введения и/или ГКС в качестве первой линии терапии;
- ГИБП, в том числе ингибиторов ИЛ-1 (например, анакинры), ИЛ-6 (тоцилизумаба), в качестве второй линии терапии при неэффективности ГКС;
- антиагрегантов (АСК);
- антикоагулянтов прямого (низкомолекулярный гепарин эноксапарин натрия) или непрямого действия (варфарин). Для решения вопроса об их назначении состояние коронарных артерий оценивается при ЭхоКГ с помощью Z-шкалы как при болезни Кавасаки (табл. 3) [28].

Реанимация детей с шоком должна проводиться в соответствии с положениями стандартных протоколов. Адреналин или норадреналин являются вазоактивными агентами, предпочтительными при лечении у детей шока, резистентного к жидкостной нагрузке; применение адреналина предпочтительно при наличии доказательств дисфункции левого желудочка. Для лечения детей с дисфункцией желудочка тяжелой степени может оказаться полезным добавление милринона. При фульминантном течении заболевании может потребоваться механическая гемодинамическая поддержка в форме проведения экстракорпоральной мембранной оксигенации [6, 9, 17].
Прогноз
Прогноз ДМВС остается до конца неопределенным, учитывая новизну этой нозологической единицы. Частота летальных исходов в разных сериях наблюдений составляет 0,4–1,7% [6, 12].
Складывается впечатление, что дилатация коронарных артерий при ДМВС в первую очередь связана с поверхностным воспалением или дисфункцией эндотелия, и стойкие аневризмы коронарных артерий в исходе данного синдрома, в отличие от болезни Кавасаки, не формируются [6, 15, 16]. Вместе с тем ЭхоКГ рекомендуется повторить как минимум через 7–14 дней и 4–6 нед после появления первых симптомов ДМВС. В случае сердечных нарушений в острой фазе заболевания ЭхоКГ может быть рассмотрена через год после постановки диагноза данного синдрома. У большинства пациентов с ДМВС функция левого желудочка очень быстро улучшается, но долгосрочные осложнения миокардита, например фиброз или рубцевание, неизвестны, поэтому через 2–6 мес после установления диагноза ДМВС пациентам со значительной преходящей дисфункцией левого желудочка в острой фазе заболевания (фракция выброса левого желудочка <50 %) или же со стойкой дисфункцией левого желудочка может быть показана МРТ сердца, включая функциональную оценку, T1/T2-взвешенные изображения, T1-картирование и измерение внеклеточного объема, а также изображение с поздним усилением гадолинием [7].



