ВВЕДЕНИЕ
Болезнь Шегрена (БШ) – хроническое системное аутоиммунное заболевание, характеризующееся иммуноопосредованным поражением экзокринных желез, развитием системных проявлений и высоким риском лимфопролиферативных осложнений [1]. По некоторым данным, БШ – второе по частоте встречаемости аутоиммунное заболевание. Распространенность его варьирует в среднем от 61 до 280 случаев на 100 000 человек в зависимости от страны и дизайна исследования [2]. По России точная статистика неизвестна. На поздних стадиях заболевание приводит к существенному снижению качества жизни, а у некоторых пациентов сопровождается развитием тяжелых, жизнеугрожающих осложнений.
Диагностика БШ представляет собой непростую задачу и подразумевает участие врачей разных специальностей: ревматолога, стоматолога и офтальмолога. Критерии диагностики неоднократно пересматривались, последний вариант критериев 2016 г. ACR/EULAR требует исключения ряда заболеваний со схожей клинической симптоматикой, что затрудняет диагностический процесс [3].
Частота развития сухого синдрома увеличивается с возрастом и достигает 30% среди женщин старше 65 лет. Объективное снижение железистой функции встречается лишь в 4% случаев и слабо коррелирует с жалобами на сухость. Распространенность же пациентов с БШ в этой популяции составляет только 0,04% [2].
Первые проявления сухого синдрома могут быть довольно субъективными. Длительное время они не воспринимаются пациентами как патология и выявляются только при активном расспросе. В связи с этим заболевание остается нераспознанным в течение многих лет и диагноз устанавливается на поздней стадии при наличии необратимых деструктивных изменений в железах и лимфопролиферативных осложнений. Период времени от появления первых симптомов до постановки диагноза составляет в среднем около 4 лет [4]. Наличие системных проявлений БШ, таких как васкулит, поражение суставов, легких и другое, в некоторых случаях ускоряет направление пациента к ревматологу и облегчает диагностику. БШ, протекающая преимущественно с поражением желез, длительное время остается нераспознанной. Данная обзорная статья посвящена дифференциальной диагностике основных железистых проявлений БШ – сухого синдрома и сиаломегалии.
СУХОСТЬ ВО РТУ
Термин «сухость во рту», или ксеростомия, используется для описания субъективных ощущений больного. Исследования показали, что это очень распространенный симптом, встречающийся у 20% населения в целом [5]. Здоровый взрослый человек продуцирует в сутки 0,5–1,5 л слюны. До 90% слюны вырабатывается тремя парами больших желез, остальное количество – малыми слюнными железами, расположенными по всей слизистой оболочке полости рта. Ксеростомия может быть связана со снижением выработки слюны либо с уменьшением ее вязкости. Однако жалобы на сухость в полости рта могут иметь и пациенты с нормальной функцией слюнных желез. В ходе эпидемиологических исследований было выявлено увеличение частоты ксеростомии с возрастом, что, вероятно, связано со снижением у ряда пациентов способности желез компенсировать возрастные потери ацинарной ткани [6].
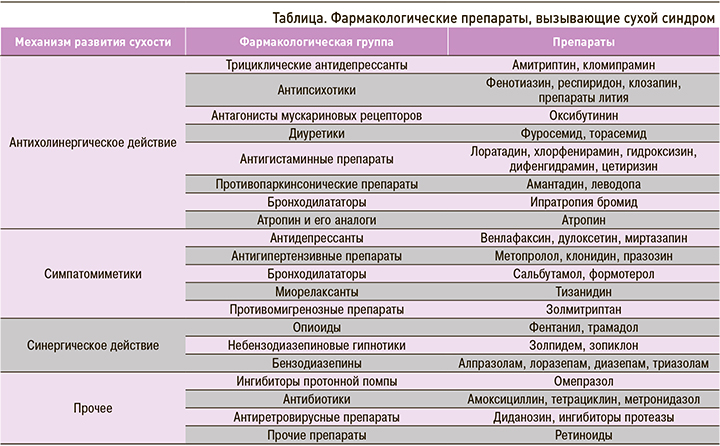
Снижение потока слюны имеет множество неблагоприятных последствий: деминерализация зубной эмали, множественный кариес, периодонтит, инфекции в ротовой полости. Галитоз, ощущение жжения и боли во рту, затруднение жевания, нарушение речи, дисгевзия и дисфагия также могут быть следствием тяжелой ксеростомии. Жалобы на сухость во рту, как правило, свидетельствуют о снижении саливации на 40–50% от нормы [7]. В разных странах в качестве нормальных значений саливации приняты разные величины, например, значения стимулированной саливации в норме составляют более 2,5 мл/5 мин [8]. Исследования показали, что женщины чаще страдают от ксеростомии, чем мужчины. Такие привычки, как курение, употребление алкоголя, кофеинсодержащих напитков, также способствуют появлению ксеростомии. Cильный храп, дыхание через рот, тревожно-депрессивный синдром могут служить причиной сухого синдрома. В этих случаях процесс обратим, если исключить неблагоприятный фактор [9]. Кроме того, сухой синдром может вызывать прием некоторых медицинских препаратов (табл.).
СУХОСТЬ В ГЛАЗАХ
Сухость в глазах – классический симптом БШ. Пациентов беспокоит раздражение, повышенная чувствительность глаз, зуд, чувство песка, инородного тела в глазах при отсутствии внешних признаков воспаления. Также пациенты жалуются на светобоязнь, снижение функциональной остроты зрения (при вождении автомобиля, чтении, работе за компьютером), ощущение пленки на поверхности глаза. Некоторые отмечают невозможность ношения контактных линз. Симптомы усугубляются низким уровнем влажности, воздействием сигаретного дыма, сухого кондиционированного воздуха, приемом ряда медикаментов (антихолинергических, антигистаминных препаратов и др.).
При этом сухость в глазах – распространенная и неспецифическая жалоба, которая может иметь самые разные причины. Однако в таком сложном вопросе, как диагностика БШ, врач не может опираться лишь на субъективные жалобы пациента. Для верификации поражения глаз именно в рамках БШ важное значение приобретают специальные пробы: тест Ширмера, время разрыва слезной пленки (проба Норна), окрашивание конъюнктивы и роговицы витальными красителями (лиссамином зеленым и флюоресциином). Ни один из этих тестов не является высокоспецифическим, поэтому при постановке диагноза БШ важна комплексная оценка состояния глаз, слюнных желез и иммунологического статуса пациента [10].
Диагностика сухого кератоконъюнктивита (СКК) при БШ крайне важна, так как отсутствие своевременной иммуносупрессивной терапии может привести к тяжелым осложнениям. Снижение лакримации повышает риск развития бактериальных и грибковых инфекций. В отсутствие терапии СКК при БШ может осложниться формированием стерильных язв, расплавлением роговицы и ее перфорацией. Еще одно инвалидизирующее осложнение синдрома сухого глаза средней и тяжелой степени – нитчатый кератит. При этом состоянии тяжи слизи и белковые обломки отслоившихся эпителиальных клеток остаются на поверхности роговицы, вызывая сильную боль при моргании, ощущение инородного тела, светобоязнь, снижение зрения. При удалении нитей могут формироваться остаточные эпителиальные дефекты, которые становятся потенциальным очагом инфекции [11]. Изменение слезной пленки у пациентов с БШ необходимо учитывать при проведении любых манипуляций с глазной поверхностью. Описаны случаи перфорации роговицы после обычной операции по поводу катаракты [12].
Характерный для болезни Шегрена СКК встречается примерно у 4% здорового населения старше 65 лет [13]. Важно помнить и о других причинах развития сухого глаза. Первичный или вторичный дефицит слезной пленки может сформироваться, например, при обструкции протоков слезной железы, нейротрофических патологиях роговицы, стать следствием рефлекторного блока после лазерной коррекции зрения. Изолированное снижение времени разрыва слезной пленки встречается при состояниях, связанных с повышенным испарением слезы при нормальной ее секреции. Например, при дисфункции мейбомиевых желез, дефиците витамина А, ношении контактных линз [14].
ПОРАЖЕНИЕ СЛЮННЫХ ЖЕЛЕЗ
Одним их ярких симптомов при БШ является сиаладенит, который наблюдается как минимум у половины пациентов. Чаще поражаются околоушные железы, которые могут вовлекаться в процесс попеременно или же симметрично. Увеличение желез может быть сопровождаться болью, сохраняться несколько дней и спонтанно разрешаться. Длительно сохраняющееся увеличение желез, особенно сопровождающееся их уплотнением, должно насторожить в отношении развития лимфом [15].
Поражение слюнных желез при БШ гистологически характеризуется перидуктальной лимфоцитарной инфильтрацией. Лимфоциты являются поликлональными. Сохраняющаяся длительное время инфильтрация распространяется и замещает нормальную паренхиматозную ткань железы. Образующиеся лимфоэпителиальные островки сужают просвет протоков. Гистологическая картина паренхиматозной инфильтрации слюнных желез и сужение протоков называется лимфоэпителиальным сиаладенитом. У части страдающих им пациентов в последующем развивается лимфома [16].
Лимфомы при БШ в абсолютном большинстве случаев В-клеточные, они происходят из опухолевого клона В-лимфоцитов, который возникает на фоне персистирующей реактивной пролиферации. Со временем моноклональные B-лимфоциты замещают нормальную В-клеточную популяцию, что приводит к развитию MALT-лимфомы (mucosa-associated lymphoid tissue – лимфоидная ткань, ассоциированная со слизистыми оболочками). MALT-ткань в норме отсутствует в слюнных железах и формируется в них лишь в результате хронического воспаления. Большинство лимфом при БШ – экстранодальные В-клеточные лимфомы маргинальной зоны. Кроме MALT-лимфом при БШ встречаются фолликулярные и В-крупноклеточные лимфомы. Наиболее часто поражаются околоушные железы. При лимфопролиферативной трансформации отмечается быстрое и стойкое увеличение желез, которые становятся плотными и безболезненными при пальпации. При приеме пищи не возникает колебаний размера пораженной железы. При подозрении на развитие лимфомы необходимо проведение инцизионной биопсии для верификации ее типа и соответственно определения прогноза [17].
Поражение слюнных желез может встречаться и при других системных ревматических заболеваниях. IgG4-связанное заболевание (IgG4-СЗ) – иммуноопосредованное заболевание, характеризующееся возникновением опухолеподобных очагов в одном или нескольких органах за счет фибровоспалительных изменений с гиперсекрецией иммуноглобулина G 4 подкласса (IgG4) в тканях и/ или сыворотке крови. IgG4-СЗ может локализоваться практически во всех органах и тканях, при этом поражение слюнных желез наблюдается в 30–50% случаев [19, 20]. Схожая клиническая картина поражения желез при IgG4-СЗ и БШ, а также аналогичные морфологические изменения не позволяли до 2005 г. дифференцировать эти заболевания. При IgG4-СЗ поражение слезных и слюнных желез чаще двустороннее, безболезненное, персистирующее более 3 мес. Часто поражаются поднижнечелюстные железы, однако заболевание может протекать с вовлечением околоушных и подъязычных желез. Железистая секреция чаще в норме или незначительно снижена, особенно при поражении подчелюстных желез. Поражение желез при IgG4-СЗ в 50% случаев может сопровождаться изменениями параназальных синусов, в 70% определяется лимфаденопатия. Провести дифференциальный диагноз между IgG4-СЗ и БШ в большинстве случаев позволяет определение анти-Ro/SSA, а также специфическое рентгенологические исследование слюнных желез с введением контрастного вещества в систему протоков и сиалография. Несмотря на схожесть ультразвуковой картины в слюнных железах, при IgG4-СЗ, по данным сиалографии, паренхиматозный паротит не встречается. В 2019 г. были предложены новые классификационные критерии, отражающие современные представления о данной патологии [21].
Крайне редко большие слюнные железы поражаются при гранулематозе с полиангиитом, что сопровождается лихорадкой и болевым синдромом. Это состояние может быть локализованным или сочетаться с поражением параназальных синусов и глаз. Процесс бывает как двусторонним, так и односторонним. Даже при ограниченных формах гранулематоза в 67% случаев у пациентов выявляются антинейтрофильные цитоплазматические антитела, что упрощает диагностику. Подтвердить диагноз возможно также по результатам гистологического исследования биоптата слюнной железы, при котором выявляются классические для гранулематоза Вегенера изменения – гранулематозное воспаление, некроз и васкулит мелких сосудов. Однако классическая триада гистологических признаков встречается лишь в 16% случаев, а 2 типичных признака из 3 – в 22% [18].
Большое количество заболеваний неревматического спектра, также сопровождающихся поражением слюнных желез, делает необходимым широкий диагностический поиск для уточнения генеза сиаломегалии.
Сиалоз – хроническое двустороннее диффузное невоспалительное и неопухолевое симметричное увеличение больших слюнных желез вследствие гиперплазии и гипертрофии секреторных клеток. Исходом сиалоза нередко становится липоматоз слюнных желез. Данное состояние чаще безболезненное или сопровождается некоторым напряжением в железах. Сиалоз является следствием алиментарных или гормональных нарушений: сахарного диабета, гипотиреоза, уремии, хронических заболеваний печени. Помимо этого, он может провоцироваться приемом некоторых медицинских препаратов, особенно гипотензивных. Bulimia nervosa в 10–50% случаев также сопровождается сиалозом [22]. Наиболее часто в общей практике встречается сиалоденоз при сахарном диабете, причем в ряде случаев увеличение околоушных желез может выступать первым проявлением заболевания. Алкоголизм и алкогольный цирроз сопровождаются сиалоденозом в 30–86% случаев. Патогенез сиаладеноза не ясен и объясняется некоторыми учеными нейропатическими процессами в автономной нейрогегуляции, которые ведут к дисбалансу между ацинарным синтезом белка и его секрецией. Терапия этого состояния заключается в лечении вызвавшего его первичного заболевания [23].
Бактериальный острый сиаладенит является следствием инфекционного бактериального процесса в ротовой полости и чаще всего диагностируется у пациентов старше 60 лет. Нормальный отток слюны, как правило, защищает протоки и паренхиму железы от ретроградной колонизации бактериями. Кроме того, сама слюна обладает антибактериальными свойствами благодаря наличию сиаловых кислот, IgA антител и лизоцима. Обструктивные состояния, затрудняющие нормальный отток, способствуют развитию инфекционного процесса. Острый бактериальный паротит характеризуется внезапным диффузным увеличением слюнных желез, сопровождающимся их уплотнением и болезненностью. Болевой синдром в ряде случаев очень сильный в связи с увеличением давления под фиброзной капсулой железы. Процесс может быть как двусторонним, так и односторонним. Предрасположенность околоушных желез к инфекционному поражению обусловлена отсутствием бактериостатического муцина в их серозном секрете. Поднижнечелюстные железы поражаются редко. В 90% случаев инфекционный процесс вызван Staphyloccocus aureus [24].
Нарушение нормального оттока слюны может способствовать развитию обструктивного паротита. Среди возможных его причин – сиалолитиаз, стриктуры основного протока, компрессия протоков извне. Рецидивирующие воспалительные процессы в такой железе приводят к формированию сиалэктазии и прогрессирующей ацинарной деструкции, что у 80% пациентов приводит к выраженной ксеростомии. При обструктивном сиаладените рецидивирующее болезненное припухание околоушных желез провоцируется приемом пищи. Визуализация структуры железы при помощи ультразвука или компьютерной томографии способна помочь в определении сиалолитиаза, неопластического процесса. Сиалоэктизия и стриктуры выявляются при помощи сиалографии [25].
Диффузное увеличение слюнных желез может быть обусловлено вирусом иммунодефицита человека (ВИЧ). У ВИЧ-инфицированных пациентов в 1–10% случаев развивается мультисистемный синдром, имеющий название «диффузный инфильтративный лимфоцитоз»; его проявления (лимфаденопатия, сухой синдром, двусторонний паротит) чрезвычайно схожи с БШ. В основе данного состояния лежит CD8+ инфильтрация пораженных органов и тканей. Впервые диффузный инфильтративный лимфоцитоз был описан до внедрения в терапию ВИЧ-инфекции антиретровирусной терапии и ассоциировался с медленным прогрессированием и меньшей частотой оппортунистических инфекционных осложнений. Сиаладенит может возникнуть на любом этапе течения ВИЧ-инфекции. Активное внедрение высокоэффективной антиретровирусной терапии несколько снизило частоту развития диффузного инфильтративного лимфоцитоза, однако в некоторых случаях этот синдром развивается и на фоне ее применения [26]. В основе этиологии паротидомегалии в данном случае лежат гиперпластическая лимфаденопатия, формирование лимфоэпителиальных кист, инфильтрация CD8+лимфоцитами. Процесс, как правило, медленно прогрессирует, увеличение желез не сопровождается болевым синдромом. У пациентов со стойким сиаладенитом на фоне ВИЧ существует высокий риск развития В-клеточной лимфомы. При малейшем подозрении на лимфопролиферативную трансформацию необходимо проведение биопсии околоушной железы [27].
Одна из редких причин сиаломегалии – туберкулез. Околоушные железы поражаются при первичном процессе, тогда как при диссеминированном поражении легких в процесс чаще вовлекаются подчелюстные железы [28].
Сиаломегалия встречается также при саркоидозе – в 6–30% случаев. Одним из наиболее ярких синдромов поражения желез при саркоидозе является синдром Хейерфорда, который, кроме указанных проявлений, характеризуется увеитом, лихорадочным синдромом, парезом лицевого нерва. Паротидомегалия при саркоидозе сопровождается выраженной ксеростомией, без назначения иммуносупрессивной терапии она может сохраняться в течение нескольких месяцев или лет и разрешается спонтанно. Для подтверждения саркоидоза может быть полезна малоинвазивная биопсия малых слюнных желез [29].
Увеличение слюнных желез с сопутствующей выраженной сухостью может быть последствием лучевой терапии в области головы и шеи. Сиаломегалия характеризуется болевым синдромом и постепенно купируется после завершения курса лучевой терапии. Изменения слюнных желез, индуцированные лучевой терапией, проходят 3 стадии: 1 – умеренное воспаление, интерстициальные изменения, ацинарная атрофия; 2 – воспалительная инфильтрация, фиброз интерстиция, метаплазия эпителия протоков; 3 – выраженная атрофия паренхимы [30]. Таким образом, в дальнейшем происходит развитие фиброза, атрофии железистой ткани и, как следствие, тяжелой ксеростомии, которая может ошибочно трактоваться в рамках БШ. Кроме того, лучевая терапия может индуцировать развитие в железах опухолевых процессов, таких как плеоморфная аденома, онкоцитома [31].
Сиаладенит часто становится осложнением терапии рака щитовидной железы радиоактивным йодом. Слюнные железы, как и щитовидная железа, селективно концентрируют йод и соответственно подвергаются постлучевым изменениям. Абсорбировать 131I могут все слюнные железы, но наиболее активно в этот процесс вовлекаются серозные железы. Как следствие, околоушные железы, продуцирующие серозную слюну, поражаются сильнее, чем подчелюстные и подъязычные, вырабатывающие смешанный серозно-слизистый секрет. Припухание околоушной железы развивается в течение 24 ч после воздействия 131I и существенно уменьшается в течение последующей недели. Крайне важна в этот период стимулиция саливации, уменьшающая экспозицию, а следовательно, и повреждающее действие радиофармпрепарата. В большинстве случаев паротиты после воздействия 131I имеют транзиторный характер, однако может развиться и стойкое поражение. Поздняя стадия поражения железы развивается примерно через 5 мес. Пациентов беспокоят ксеростомия, изменения вкусовых ощущений, рецидивирующие инфекции полости рта, множественный кариес [32].
Папиллярная лимфоматозная цистаденома, также известная как опухоль Уортина, – доброкачественная эпителиальная опухоль ткани слюнной железы. Примерно в 10% случаев опухоль мультифокальная, в пределах одной железы, но процесс может быть и двусторонним. Опухоль в подавляющем большинстве случаев поражает именно околоушные железы, особенно нижний полюс поверхностной доли позади угла нижней челюсти. При этом есть также сообщения о развитии цистаденомы в подчелюстных или же подъязычных железах. В основе патогенеза данного заболевания лежит пролиферация протоковых элементов, сопровождающаяся вторичной лимфоцитарной инфильтрацией. Чаще заболевание развивается у лиц мужского пола старше 40 лет. Соотношение полов, по разным данным, составляет от 1,5:1 до 10:1, средний возраст заболевших – 62 года. У курящих риск развития заболевания в 5 раз выше. Опухоль представляет собой одиночные узловатые, четко очерченные, медленно растущие, образования, плотность которых варьирует от твердых до мягких. Образования безболезненные, подвижные, обычно полностью инкапсулированные. Методы визуализации позволяют выявить хорошо очерченные массы с областями прозрачности и уплотнения, представляющими собой кистозные и солидные опухолевые элементы соответственно. Окончательный диагноз опухоли устанавливают при гистологическом исследовании. Микроскопически опухоль состоит из эпителиальных и лимфоцитарных элементов. Эпителиальный элемент представлен сосочковыми, железистыми и кистозными образованиями, тогда как лимфоцитарный отличается наличием лимфоретикулярных элементов и многочисленных зародышевых центров. Кисты содержат эозинофильный секрет, аморфный материал, эпителиальные и воспалительные клетки [33]. Описаны редкие случаи опухолевой трансформации в сквамозно-клеточную карциному, мукоэпидермоидную карциному или лимфому [34]. Наличие кист при визуализационных методах обследования, лимфоэпителиальной инфильтрации железы с формированием зародышевых центров в ряде случаев способствует неверной постановке диагноза БШ при цистаденоме.
ЗАКЛЮЧЕНИЕ
Таким образом, спектр заболеваний, сопровождающихся поражением слюнных желез и/или развитием сухого синдрома, достаточно широк и характеризуется сложной диагностикой. Повышение информированности об этой проблеме как узких специалистов (офтальмологов и стоматологов), так и врачей общей практики позволит им лучше ориентироваться в рассмотренных патологиях и своевременно направлять пациента с соответствующими клиническими проявлениями к ревматологу.



