ВВЕДЕНИЕ
В настоящее время накоплены данные о связи между коронавирусной инфекцией (COVID- 19) и сердечно-сосудистыми заболеваниями. Известно, что повреждение сердечно-сосудистой системы при COVID-19 многофакторно и происходит как вследствие прямого воздействия вируса на элементы этой системы, так и опосредованно [1].
Инфекция, вызванная SARS-CoV-2, предрасполагает к тромботическим осложнениям в венозном и в артериальном русле из-за чрезмерного воспаления, эндотелиальной дисфункции, активации тромбоцитов и нарушений коагуляции/фибринолиза; следовательно, потенциально это может вызвать разрушение атеросклеротических бляшек и усиленное тромботическое наложение, приводящее к инфаркту миокарда (ИМ) [2]. Развитие острого ИМ у пациентов с коронавирусной инфекцией усложняет лечение и ассоциировано с более высоким риском летальности [3]. В настоящей статье мы приводим описание двух клинических случаев развития ИМ у пациентов с подтвержденной инфекцией COVID-19.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ № 1
У пациента К., 43 лет, на основании клинической картины, положительного ПЦР-теста и данных мультиспиральной компьютерной томографии органов грудной клетки (МСКТ ОГК) был установлен диагноз: коронавирусная инфекция COVID-19, вирус идентифицирован (U07.1). Осложнения: двусторонняя полисегментарная вирусная пневмония (J18.8). Дыхательная недостаточность (ДН) 0–I.
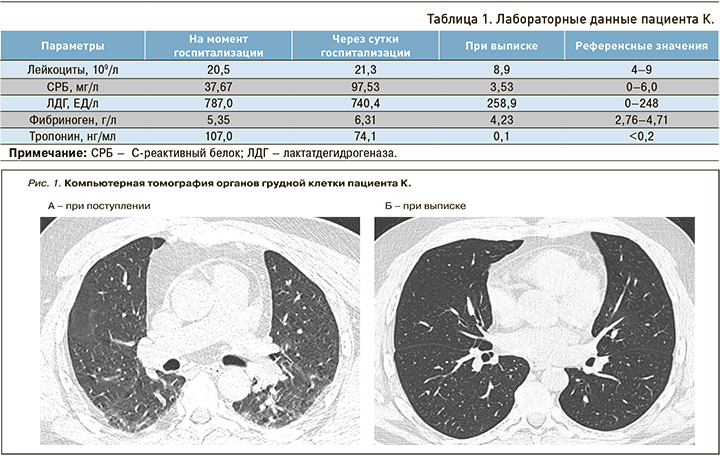
Результаты МСКТ ОГК при поступлении: очаги «матового стекла», расположенные периферически с двух сторон, объем поражения легких 20%, объем здоровой ткани 80%. КТ-паттерн 1-й степени тяжести (рис. 1А).
Лечение проводилось амбулаторно согласно Временным методическим рекомендациям Минздрава России от 17.11.2021, версия 13.1 [4].
На 14-е сутки заболевания у пациента впервые развился интенсивный болевой синдром давящего, сжимающего характера в грудной клетке длительностью более 20 мин, сопровождающийся слабостью. Пациент был госпитализирован.
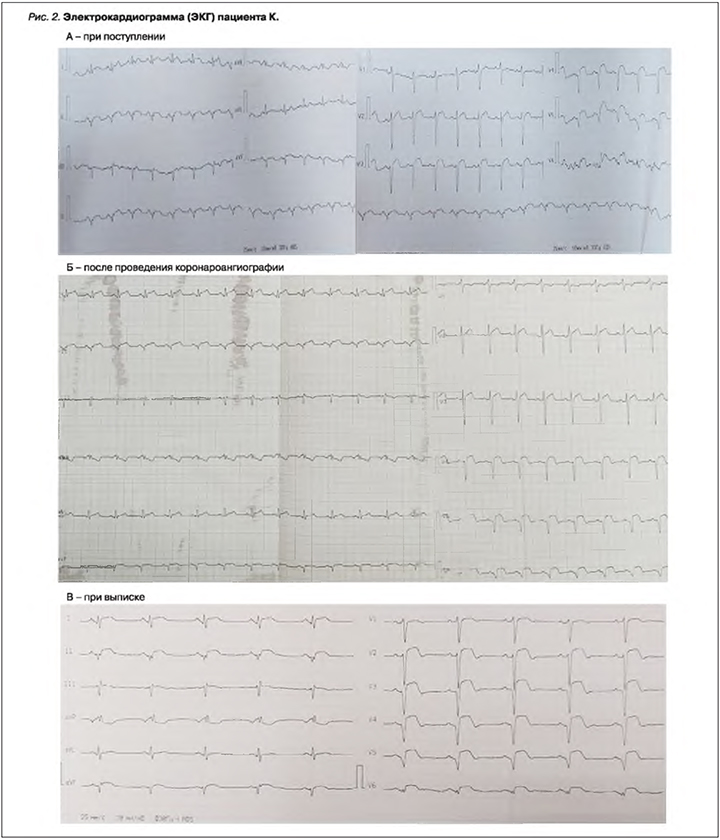
Данные электрокардиограммы (ЭКГ) при поступлении: синусовая тахикардия, частота сердечных сокращений (ЧСС) 100/мин. Элевация сегмента ST I, II, III, aVF, V2-V6, формирование патологического зубца Q V4–V6 (рис. 2А).
По данным лабораторных исследований: выраженный синдром системной воспалительной реакции (ССВР) в виде повышения уровня С-реактивного белка (СРБ) до 97,53 мг/л, лейкоцитов – до 21,3×109/л, лактатдегидрогеназы (ЛДГ) – до 787 ЕД/л, а также значительное повышение уровня тропонина I – до 107 нг/мл (табл. 1).
На основании клинической картины, ЭКГ и лабораторных данных пациенту поставлен диагноз «ишемическая болезнь сердца (ИБС)». Острый инфаркт миокарда с подъемом сегмента ST (ИМпST) переднеперегородочной локализации с распространением на верхушку.
По экстренным показаниям проведена коронароангиография (КАГ; рис. 3).
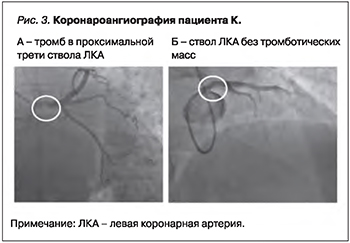
Результаты КАГ: тип коронарного кровоснабжения правый. Левая коронарная артерия (ЛКА): изменения в виде неровности контуров. Ствол ЛКА: в проксимальной трети ствола имеется дефект контрастирования по типу пристеночного тромба с элементами флотации, кровоток TIMI3 (см. рис. 3А). Передняя межжелудочковая артерия (ПМЖА), интермедиарная артерия (ИА) и огибающая артерия (ОА): без ангиографически значимого стенозирования. Правая коронарная артерия (ПКА): изменения в виде неровности контуров, без ангиографически значимого стенозирования.
Согласно клиническим рекомендациям [5], учитывая наличие пристеночного тромбоза ствола ЛКА с замедлением коронарного кровотока на фоне отсутствия атеросклеротического поражения коронарных артерий, консилиумом принято решение об интракоронарном введении ингибиторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов.
Дальнейшее лечение ИМ выполнялось в соответствии с рекомендациями Минздрава России «Острый ИМ с подъемом сегмента ST» [5]. На фоне проведенной терапии отмечена положительная клинико-лабораторная динамика: стойкая нормализация температуры и регресс маркеров ССВР. Кроме этого, наблюдалась положительная динамка по МСКТ ОГК в виде уменьшения плотности очагов «матового стекла», объем поражения легких менее 10%, объем здоровой ткани более 90%, регресс гиповентиляционных изменений в нижних долях (см. рис. 1Б).
Болевой синдром за грудиной не рецидивировал. В лабораторных данных отмечалось снижение уровня тропонина I с 107,0 до 74,1 нг/мл и в дальнейшем до 0,1 нг/мл (см. табл. 1). После КАГ с интракоронарным введением ингибиторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов на ЭКГ наблюдался регресс элевации сегмента ST и формирование патологического зубца Q в I, II, III, aVF, V2–V6 (см. рис. 2Б).
Согласно клиническим рекомендациям, при отсутствии рецидива болевого синдрома, отрицательной динамики ЭКГ и стабильных показателях гемодинамики ангиографический контроль осуществлялся через 48 ч. На контрольной КАГ наблюдалась положительная динамика: ствол ЛКА не изменен, тромботические массы не визуализировались (см. рис. 3Б).
Несмотря на положительную динамику по данным КАГ, на ЭКГ (перед выпиской) сохранялась элевация сегмента ST в I, II, III, aVF, V2–V6, QS в II, aVF, V3–V5 (см. рис. 2В). По данным эхокардиографии (ЭхоКГ) отмечалось снижение фракции выброса левого желудочка (ФВ ЛЖ) до 45–48% с нарушением его локальной сократимости: акинез верхушки циркулярно, вероятно, с формированием аневризмы.
Пациент был выписан в удовлетворительном состоянии на амбулаторный этап лечения с рекомендациями по дальнейшему лечению ИМпST и реабилитации после перенесенной коронавирусной инфекции.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ № 2
Пациенту П., 59 лет, без коронарного анамнеза, коморбидной патологии на основании клинической картины, положительного ПЦР-теста и данных МСКТ ОГК верифицирован диагноз:
- основной: коронавирусная инфекция, вызванная вирусом COVID-19, вирус идентифицирован, средней степени тяжести;
- осложнение: внебольничная двусторонняя пневмония, ДН I ст.
Наблюдалось тяжелое течение заболевания, которое проявлялось клинически рецидивирующей фебрильной лихорадкой до 39,2 °С, интоксикационным синдромом, прогрессирующей ДН.
По данным лабораторных исследований – выраженный ССВР в виде повышения СРБ до 114,32 мг/л, лимфопении – до 0,3×109/л, лейкопении – 1,3×109/л. Кроме этого, наблюдалось увеличение уровня ЛДГ – максимально до 968,9 Ед/л и гиперфибриногенемия – до 7,02 г/л (табл. 2).
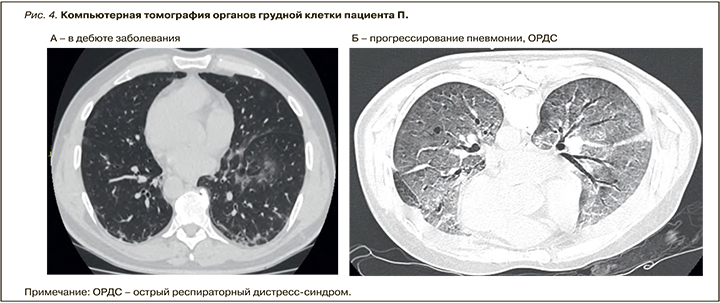
Результаты МСКТ ОГК: очаги «матового стекла», расположенные периферически с двух сторон. В дебюте объем поражения 30%, объем здоровой ткани 70%. КТ-паттерн 2-й степени тяжести (рис. 4А).
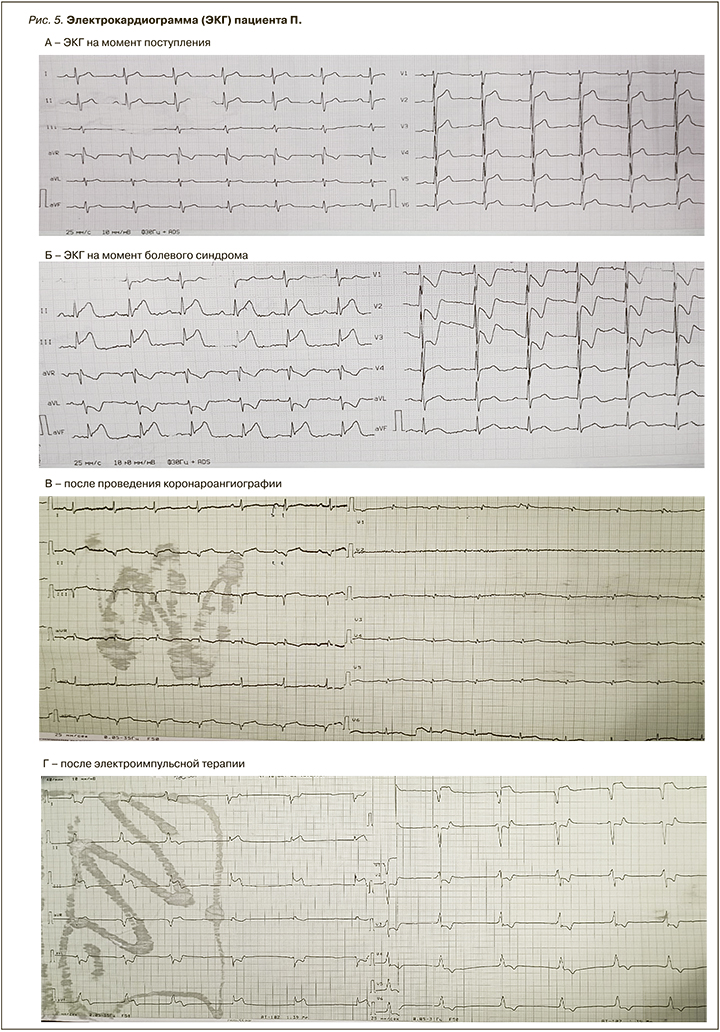
Данные ЭКГ на момент поступления: синусовый ритм, ЧСС 67/мин (электрическая ось сердца ЭОС) не отклонена, QTc 388 мс (рис. 5А).
Данные ЭхоКГ при поступлении: ФВ 55%, зон нарушения локальной сократимости не выявлено. Диастолическая дисфункция ЛЖ по типу псевдонормализации. Незначительная симметричная гипертрофия ЛЖ: толщина задней стенки (ТЗС) 1,2 см, толщина межжелудочковой перегородки (ТМЖП) 1,2 см. Полости сердца не расширены. Сократимость правого желудочка сохранена.
Лечение проводилось в соответствии с Временными методическими рекомендациями Минздрава России от 07.05.2021, версия 11 [6].
В связи с тяжелым течением заболевания пациенту проводилась непрерывная инфузия гепарина через перфузор под контролем активированного частичного тромбопластинового времени (АЧТВ) каждые 6 ч с целевыми значениями (1,5–2 нормы). Несмотря на проводимую терапию, отмечалась отрицательная динамика в виде прогрессирования вирусной пневмонии. По данным МСКТ ОГК, наблюдалось увеличение объема поражения легочной ткани более 80%, объем здоровой ткани составил менее 20%. КТ-паттерн 4-й степени (см. рис. 4Б). Клинически прогрессировала ДН, сатурация на воздухе снизилась до 80%, однако полностью компенсировалась низкопоточной оксигенотерапией (до 20 л/мин).
На 10-е сутки лечения у пациента впервые развился ангинозный приступ за грудиной длительностью 15 мин. На ЭКГ: ритм синусовый, ЧСС 70/ мин. Появилась элевация сегмента ST в II, III, аVF, V5–V6 с реципрокной депрессией ST в I, аVL, V1–V3 (см. рис. 5Б). В лабораторных данных отмечалось повышение тропонина I до 150 нг/мл (референсное значение <0,2 нг/мл).
На основании клинической картины, ЭКГ и лабораторных данных верифицирован ИМпST нижней и боковой стенок. Проведена экстренная КАГ (рис. 6): тип коронарного кровоснабжения сбалансированный. Ствол ЛКА не изменен. ПМЖА: в проксимальном сегменте ПМЖА имеется 40% эксцентрический стеноз. ОА: без ангиографически значимого стенозирования. ПКА: в проксимальном сегменте неровности контуров, в среднем сегменте тандемный эксцентрический стеноз с максимальной степенью сужения просвета артерии 20 и 30%. Дистальнее, в среднем сегменте ПКА имеются ангиографические признаки реканализированного тромба c сужением просвета артерии до 99%, тромботическая окклюзия заднебоковой ветви (ЗБВ) ПКА (см. рис. 6А).
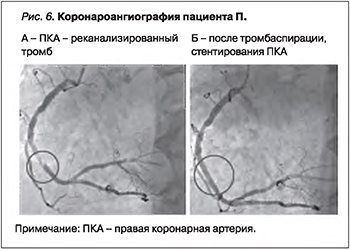
Выполнена тромбаспирация из ПКА и ЗБВ со стентированием ПКА (стент с лекарственным покрытием Abbott XIENCE 3,5×23 мм). Просвет среднего сегмента ПКА восстановлен, без признаков диссекции интимы, кровоток по ПКА – TIMI3 (см. рис. 6Б). В связи с сохраняющейся дистальной эмболической окклюзией ветвей крупной ЗБВ выполнено интракоронарное введение ингибиторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов. Дальнейшее лечение ИМ выполнялось согласно рекомендациям Минздрава России «Острый ИМ с подъемом сегмента ST» [5].
На ЭКГ, выполненной после КАГ: ритм синусовый, ЧСС 66/мин. Наблюдалась резолюция сегмента ST более 50% во II, III, аVF, V5–V6, появление QS во II, III, аVF, регресс реципрокной депрессии ST в I, аVL (см. рис. 5В). По данным ЭхоКГ в динамике появилось нарушение локальной сократимости ЛЖ: гипокинез базального и среднего сегмента задней стенки, акинез базального и гипоакинез среднего и апикального сегментов нижней стенки, гипокинез заднебазального сегмента МЖП. ФВ ЛЖ 55%.
В дальнейшем ангинозные приступы не рецидивировали, однако у пациента прогрессировала ДН с десатурацией до 74% на атмосферном воздухе, в связи с чем ему проводилась высокопоточная оксигенотерапия 60 л/мин.
Через сутки от ИМ у пациента развилась желудочковая тахикардия с падением гемодинамики. Выполнена электроимпульсная терапия, после которой на ЭКГ зарегистрирована АВ-блокада III степени с частотой желудочковых сокращений 43/мин. Кроме этого, наблюдалась элевация сегмента ST в отведениях II, III, aVF (см. рис. 5Г). Верифицирован рецидив ИМпST в бассейне ПКА. С учетом нарушений гемодинамики начата вазопрессорная поддержка и установка временного электрокардиостимулятора (ВЭКС), однако во время его постановки развилась асистолия. Реанимационные мероприятия, проведенные в полном объеме в течение 30 мин, без эффекта.
На секцию был сформулирован диагноз:
- основной: новая коронавирусная инфекция COVID-19 (вирус идентифицирован ПЦР, МСКТ ОГК), крайне тяжелое течение;
- конкурирующий: ИБС, острый ИМпST нижней, боковой локализации. КАГ: тромбаспирация из ПКА, тромбаспирация из ЗБВ ПКА, балонная ангиопластика и стентирование ПКА. Рецидив ИМ;
- фоновое заболевание: гипертоническая болезнь III стадии, артериальная гипертензия 1-й степени, риск сердечно-сосудистых осложнений 4;
- осложнение: внебольничная двусторонняя полисегментарная пневмония (КТ 4-й степени), тяжелая. ДН III степени. Острая сердечная недостаточность по Killip IV. Нарушение ритма и проводимости сердца: пароксизм желудочковой тахикардии. AV блокада III степени.
Данные аутопсии: миокард задней стенки ЛЖ на всю толщу от основания до нижней трети (на участке 8×3 см) желтоватого цвета с диффузными кровоизлияниями темно-красного цвета. Интима коронарных артерий со множественными кальцинированными бляшками, суживающими просвет артерий на 2/3, в просвете правой коронарной артерии – стент с наложениями сгустков крови, на интиме коронарной артерии вблизи стента – белесоватый шероховатый плотно спаянный тромб, закрывающий просвет коронарной артерии на 1/3.
Таким образом, у пациента с тяжелым течением коронавирусной инфекции и ИМ с подъемом сегмента ST развился рецидив ИМ – ИМ 4б тип (вследствие тромбоза стента).
ОБСУЖДЕНИЕ
Характерное гипервоспалительное и прокоагуляционное состояние при COVID-19 предполагает критическую роль эндотелия как эффектора, способствующего воспалению и тромбозу, а также поражение органа-мишени, дисфункция которого может способствовать неблагоприятному исходу.
При дисфункции изменяются тромботические и коагулянтные свойства эндотелия. В частности, сниженная антиагрегационная продукция простациклина из эндотелиальных клеток и повышенный проагрегационный синтез тромбоксана из активированных тромбоцитов могут смещать гомеостатическую ситуацию в сторону протромботического и провоспалительного фенотипа. Внутрисосудистый тромбоз и коагуляция, кроме того, могут дополнительно повредить эндотелий и способствовать эндотелиальному воспалению и дисфункции [7].
De Luca G. et al. (2021) проведено исследование с целью оценить потенциальную связь между инфекцией, вызванной коронавирусной болезнью COVID-19, и тромбоэмболическими событиями, приводящими к ИМ, ишемическому инсульту (ИИ), тромбоэмболии легочной артерии (ТЭЛА) и тромбозу глубоких вен (ТГВ). В исследуемую популяцию вошли лица с положительным тестом на COVID-19 и хотя бы одним тромбоэмболическим событием в период с марта 2019 г. по октябрь 2020 г. Согласно результатам исследования, по всей Шотландии 1449 человек имели положительный результат на COVID-19 и при этом перенесли хотя бы одно тромбоэмболическое событие в указанный период. Риск тромбоэмболии был значительно повышен в течение всего периода наблюдения, но наиболее высок в течение 7 дней после положительного теста (12,01; 95% доверительный интервал (ДИ): 9,91–14,56). У лиц, не госпитализированных по поводу COVID-19, также наблюдался повышенный риск тромботических событий. При этом риск ИМ, инсульта, ТЭЛА и ТГВ был значительно выше через неделю после положительного теста. Вероятность развития ТЭЛА и ТГВ была особенно высока и оставалась значительно повышенной даже через 56 дней после положительного ПЦР. Таким образом, подтвержденная инфекция COVID-19 была связана с ранним увеличением риска ИМ, ИИ и значительно более сильным и длительным повышением риска ТГВ и ТЭЛА среди как госпитализированных, так и не госпитализированных пациентов [2].
Saad M. et al. (2021) [8] провели ретроспективное когортное исследование, включавшее 80 449 пациентов с ИМпST и COVID-19. Первая группа исследования включала пациентов, у которых ИМпST диагностирован при поступлении (внебольничный STEMI), вторая – пациентов, у которых ИМпST развился уже во время госпитализации (внутрибольничный STEMI). Среди больных первой группы 551 пациент был с COVID-19 и 2755 без этой инфекции; возраст исследуемых варьировал от 51 до 74 лет, 70,3% были мужчинами. Во второй группе (тот же возрастной диапазон, 60,7% мужчин) COVID-19 имел место у 252 человек, у 756 отсутствовал.
Среди пациентов с внебольничным ИМпST и COVID-19, по сравнению с больными с внебольничным ИМпST без COVID-19, показатели госпитальной летальности составили 15,2 против 11,2% (р=0,007). Среди пациентов с внутрибольничным ИМпST и COVID-19, по сравнению с больными с внутрибольничным ИМпST без COVID-19, цифры госпитальной летальности были выше: 78,5 против 46,1% (95% ДИ: 29,0–35,9; р <0,001). В этом ретроспективном когортном исследовании было показано, что пациенты с внебольничным или внутрибольничным ИМпST и сопутствующим диагнозом COVID-19 имели более высокий уровень госпитальной смертности по сравнению с сопоставимыми группами пациентов, но без COVID-19.
В рассматриваемых нами клинических случаях представлены 2 варианта развития ИМ у пациентов с СOVID-19-ассоциированной пневмонией: на догоспитальном этапе и во время госпитализации.
Первый случай интересен тем, что, несмотря на среднетяжелое течение коронавирусной инфекции с отсутствием ДН (пациент лечился амбулаторно), тромбоз коронарных артерий развился на пике заболевания и на фоне интактных сосудов (по данным КАГ, атеросклеротических изменений коронарного русла выявлено не было).
Второй клинический случай демонстрирует развитие рецидивирующего ИМ во время тяжелого течения коронавирусной инфекции. Несмотря на то что пациенту первичное чрескожное коронарное вмешательство было выполнено в максимально короткие сроки от развития ИМ (время до реперфузионной терапии составило 40 мин), а до этого проводилась оптимальная антитромботическая терапия, смерть больного наступила вследствие рецидива ИМ. Крайне тяжелое течение СOVID-19 с развитием выраженной гипоксии повлекло за собой критические нарушения коагуляции, которые привели к тромбозу стента.
ЗАКЛЮЧЕНИЕ
Гипервоспалительное прокоагуляционное состояние и дисфункция эндотелия – важные элементы патогенеза коронавирусной инфекции, повышающие риск тромбообразования. Безусловно, тромботические/тромбоэмболические осложнения, связанные с COVID-19, сопряжены с более тяжелым течением заболевания. Следует уделять особое внимание мониторингу, профилактике и лечению тромботических и тромбоэмболических осложнений коронавирусной инфекции вне зависимости от ее тяжести, и не только у госпитализированных пациентов.


