Диагностика
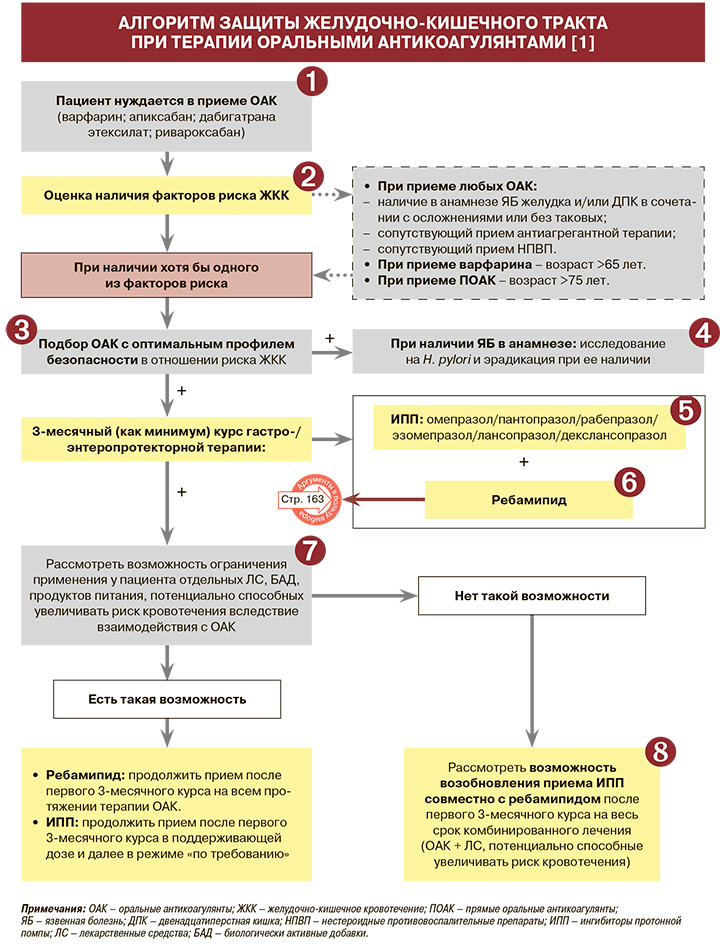
1.
К оральным антикоагулянтам (ОАК), зарегистрированным в России, относятся антагонист витамина K варфарин и прямые ОАК (ПОАК) апиксабан, дабигатрана этексилат и ривароксабан [2]. Первоочередная мера в снижении риска желудочно-кишечных (ЖКК) кровотечений, связанных с приемом ОАК, – избегать назначения этой группы препаратов без соответствующих показаний [1]. Прежде всего это касается ПОАК, которые, в отличие от варфарина, характеризуются простотой применения (прием заранее выбранных фиксированных доз без необходимости коагулологического контроля), из-за чего нередко назначаются больным, нуждающимся в длительном использовании антикоагулянтов, без учета существующих ограничений и изученности в тех или иных клинических ситуациях [3]. Официально показания к ПОАК включают раннее лечение стабильных больных и длительную вторичную профилактику тромбоза глубоких вен нижних конечностей и/или тромбоэмболии легочных артерий; профилактику инсульта при неклапанной фибрилляции предсердий (ФП); вторичную профилактику сосудистых осложнений после перенесенного инфаркта миокарда (только низкие дозы ривароксабана) [3].
2.
Стратификация факторов риска ЖКК в зависимости от подгруппы применяемых ОАК представлена в таблице 1. Еще одна потенциальная предпосылка к развитию ЖКК на фоне приема ПОАК – низкая масса тела. Так, при использовании дабигатрана этексилата ЖКК более чем в половине случаев регистрировались у пациентов с весом менее 60 кг [1, 4]. Подобная картина не наблюдалась при приеме ривароксабана, однако у больных с низкой массой тела фиксировались более высокие концентрации этого лекарственного средства в плазме крови [1, 5]. Сходным образом среди больных с массой тела менее 50 кг, получающих апиксабан, обнаружен повышенный риск кровотечений относительно пациентов с весом 65–85 кг [1, 6].
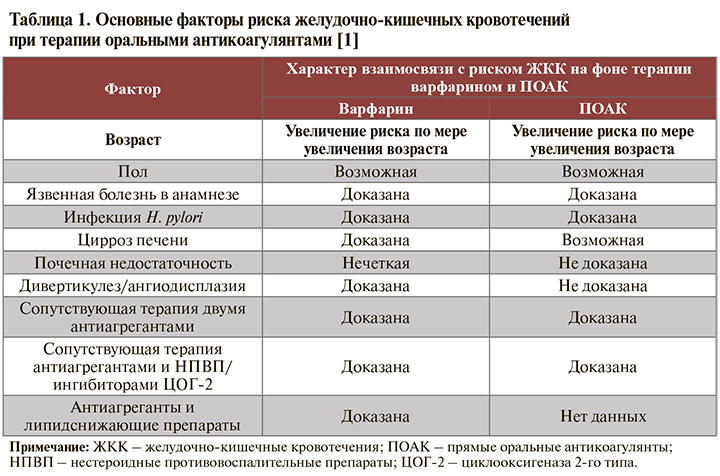
• Если говорить о высоком риске ЖЖК, то на сегодняшний день нет единой общепризнанной трактовки этого понятия. Анализируя рекомендации Минздрава России [1, 7, 8], можно сделать вывод, что под таковым понимается наличие у пациента следующих факторов:
– язвенная болезнь или ЖКК в анамнезе;
– систематическое использование нестероидных противовоспалительных препаратов (НПВП) или кортикостероидов;
– ≥2 из следующих признаков: возраст ≥65 лет; диспепсия; желудочно-пищеводный рефлюкс; инфицирование H. pylori; хроническое употребление алкоголя.
3.
• С точки зрения минимизации риска кровотечений приоритетным ОАК является апиксабан. Так, в ретроспективном анализе пациентов с неклапанной ФП [1, 9] сопоставлялись данные трех групп участников в зависимости от получаемой терапии: ривароксабан по сравнению с дабигатрана этексилатом (n=31 574); апиксабан по сравнению с дабигатрана этексилатом (n=13 084); апиксабан по сравнению с ривароксабаном (n=13 130). ЖКК чаще встречались на фоне использования ривароксабана относительно дабигатрана этексилата (отношение рисков (ОР) 1,20; 95% доверительный интервал (ДИ): 1,00–1,45). Апиксабан обеспечивал статистически значимо более низкий риск ЖКК, чем дабигатрана этексилат (ОР 0,39; 95% ДИ: 0,27–0,58; p <0,001) и ривароксабан (ОР 0,33; 95% ДИ: 0,22–0,49; p <0,001). Во всех исследуемых группах частота кровотечений увеличивалась среди пациентов старше 75 лет. Апиксабан имел преимущества в снижении риска ЖКК и у пожилых пациентов как по сравнению с дабигатрана этексилатом (ОР 0,45; 95% ДИ: 0,29–0,71), так и ривароксабаном (ОР 0,39; 95% ДИ: 0,25–0,61) [1, 9].
• Следует добавить, что апиксабан также является единственным представителем ПОАК, который, по-видимому, не приводит к увеличению риска ЖКК в большей степени, чем варфарин (но при этом, как и другие ПОАК, превосходит его в удобстве применения) [1, 10]. Так, в опорном исследовании ARISTOTLE наблюдалась сопоставимая частота больших ЖКК при приеме апиксабана в дозе 5 мг 2 раза/сут и варфарина ОР 0,89; 95% ДИ: 0,7–1,15 [1, 11].
• Таким образом, при наличии у пациентов показаний к применению ПОАК апиксабан может рассматриваться как препарат первого выбора, поскольку обладает наилучшим профилем безопасности в плане риска ЖКК [1].
4.
У больных с сердечно-сосудистыми заболеваниями и язвенной болезнью в анамнезе особое внимание в контексте минимизации риска развития ЖКК необходимо уделять выявлению и эрадикации H. pylori, причем по возможности это следует делать до инициации антитромботической терапии [1, 12, 13]. Доказано, что у пациентов с ФП, принимающих дабигатрана этексилат, предшествующая H. pylori-инфекция ассоциируется с 4-кратным повышением риска ЖКК (ОР 4,75; 95% ДИ: 1,93–11,68) [1, 14].
5.
• У пациентов с ФП, получающих ПОАК и нуждающихся в длительном приеме ацетилсалициловой кислоты или двойной антитромботической терапии, при наличии в анамнезе верифицированных ЖКК для снижения риска повторного ЖКК из верхних отделов желудочно-кишечного тракта следует добавлять к терапии ингибиторы протонной помпы (омепразол, пантопразол, рабепразол, эзомепразол, лансопразол, декслансопразол) [1, 15–17]. Есть данные, что препараты этого класса способны эффективно предотвращать повторные ЖКК из верхних отделов желудочно-кишечного тракта на фоне терапии ацетилсалициловой кислотой даже при неполной эрадикации H. pylori и одновременном приеме прочих НПВП (не аспирина) [1, 13].
• В исследовании Chan E.W. et al. [18] у пациентов с язвенной болезнью в анамнезе, получающих дабигатрана этексилат, на фоне назначения ингибиторов протонной помпы (ИПП) было обнаружено уменьшение риска кровотечений из верхних отделов желудочно-кишечного тракта приблизительно на 50% (коэффициент заболеваемости 0,53; 95% ДИ: 0,35–0,77).
• В крупном исследовании с участием 1 643 123 пациентов, получающих ОАК (как варфарин, так и ПОАК), было установлено, что частота госпитализаций по поводу кровотечений из верхних отделов желудочно-кишечного тракта была ниже в той подгруппе пациентов, которым, наряду с антикоагулянтами, назначалась сопутствующая терапия ИПП [1, 19].
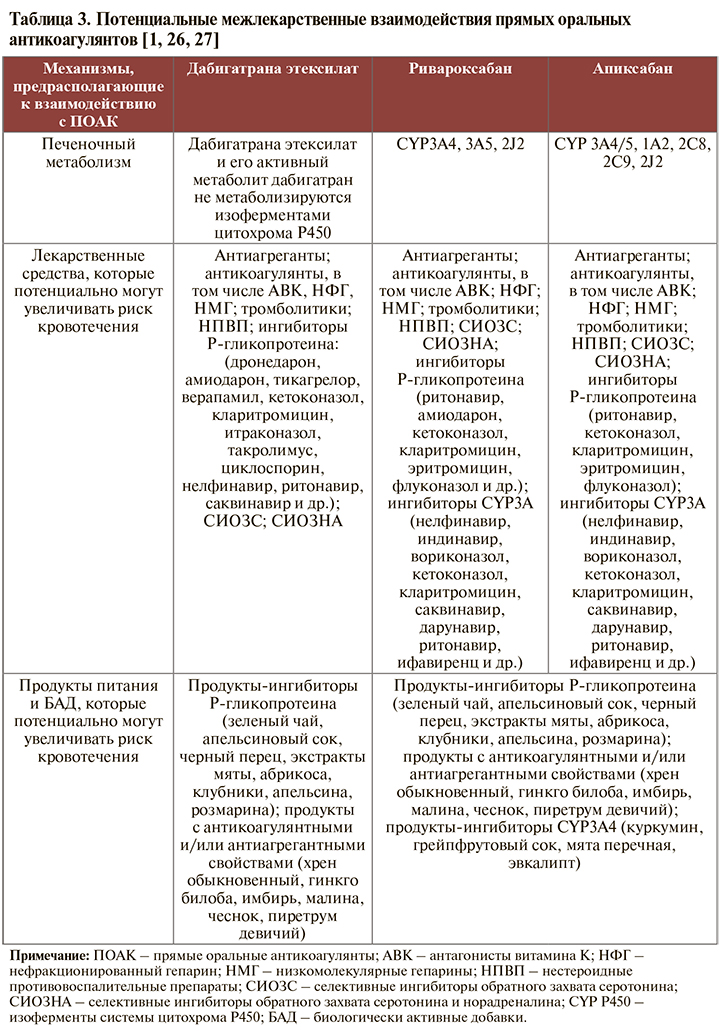
• Несмотря на то что к настоящему времени отсутствуют однозначные данные о нежелательных межлекарственных взаимодействиях ИПП с ПОАК, потенциальные риски таковых на фармакокинетическом уровне все-таки существуют, что следует учитывать при подборе терапии (табл. 2).

6.
• ИПП оказывают свое действие лишь на уровне верхних отделов желудочно-кишечного тракта, в связи с чем представляется актуальным вопрос защиты нижних его отделов на фоне антитромботической терапии [1, 22]. Комплексные протективные эффекты на всем протяжении желудочно-кишечного тракта (ЖКТ) характерны для ребамипида. Спектр его действия включает индукцию синтеза простагландинов и собственно слизи (муцинов) в слизистой оболочке ЖКТ, элиминацию гидроксильных радикалов, подавление активации нейтрофилов, угнетение процессов воспаления в слизистой, регуляцию активности апоптозассоциированных генов, ингибирование нитрования тирозина. Важная отличительная характеристика ребамипида – способность восстанавливать целостность плотных контактов в эпителии слизистой оболочки, благодаря чему он поддерживает нормальную барьерную функцию стенки кишечника [1, 22].
• Возможности ребамипида в цитопротекции ЖКТ на фоне терапии ПОАК изучались в открытом многоцентровом проспективном рандомизированном сравнительном исследовании в параллельных группах с участием 309 пациентов с неклапанной ФП, которым впервые в жизни назначался ПОАК дабигатрана этексилат. Нежелательные явления (НЯ) со стороны ЖКТ анализировались с помощью опросника Global Overall Severity (GOS), включающего шкалу из 7 баллов. Больных с GOS ≥3 баллов рандомизировали на три группы терапии: получавших ИПП, блокаторы Н2-антигистаминных рецепторов или ребамипид на протяжении 4 нед. Симптомы диспепсии были выявлены в 17,2% случаев, причем 77% НЯ были зарегистрированы в первые 10 дней от старта терапии. Вследствие НЯ прием дабигатрана прекратили 5 пациентов. Через 4 нед лечения средний балл по GOS составил 3,5±1,7, при этом доля пациентов с GOS ≥3 баллов снизилась со 100 до 11,3%. Многофакторный регрессионный анализ не обнаружил ни одного фактора, значимо влияющего на частоту или тяжесть симптомов диспепсии. Большинство пациентов (83–100%) отметило уменьшение выраженности симптомов на фоне лечения (GOS ≤2 баллов), при этом ИПП, блокаторы Н2-рецепторов гистамина и ребамипид были одинаково эффективны для купирования симптомов диспепсии, связанной с приемом дабигатрана [1, 23].
• В многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании анализировались эффекты ребамипида с позиций динамики поражения слизистой оболочки тонкого кишечника у больных, получающих АСК в дозе 100 мг/сут с целью профилактики сердечно-сосудистых событий на протяжении ≥3 мес и имеющих как минимум 3 участка поражения слизистой в виде эрозий или язв. Ребамипид в данном исследовании назначался в дозе, в три раза превышающей стандартную терапевтическую: 300 мг 3 раза/сут. Период наблюдения составлял 8 нед. В конце этого периода на фоне терапии ребамипидом наблюдалось статистически значимое снижение количества очагов повреждения слизистой тонкого кишечника – в среднем с 4,0 до 2,0 (р=0,046). При этом в группе плацебо статистически значимых изменений данного показателя обнаружено не было (р=0,08). Ребамипид приводил к уменьшению выраженности поражения слизистой оболочки по индексу Lewis, который базируется на визуализируемых эндоскопических признаках (р=0,02). Кроме того, на фоне приема ребамипида 32% пациентов достигли полной ремиссии поражения слизистой оболочки, тогда как в группе же плацебо аналогичный показатель составил лишь 1%. Добавим, что используемая тройная терапевтическая доза ребамипида отлично переносилась пациентами: нежелательных лекарственных реакций зарегистрировано не было [1, 24].
• Клинически значимой особенностью ребамипида являются механизмы его элиминации из организма: лишь около 10% лекарственного средства выводится почками, остальная часть – с кишечным содержимым. Это может служить его преимуществом при назначении пациентам с поражением почек [1, 25].
7.
• Для ПОАК характерен достаточно широкий спектр взаимодействий с другими фармакологическими средствами, включая реакции, обусловливающие повышение риска кровотечений. В связи с этим стратегия минимизации ЖКК на фоне приема ПОАК предусматривает регулярный анализ листа врачебных назначений пациенту, изучение самостоятельно принимаемых больным безрецептурных препаратов и БАД [1]. Особое внимание следует обращать на применение ПОАК пациентами, которым также требуется антиагрегантная терапия или использование ингибиторов CYP3A4 и/или Р-гликопротеина (в этой ситуации обязательно следует обсудить с пациентов риск ЖКК). У пациентов, нуждающихся в ПОАК, целесообразно НЕ использовать для купирования болевого синдрома НПВП [1].
• Механизмы развития кровотечений вследствие межлекарственных взаимодействий для того или иного представителя класса ПОАК имеют некоторые отличия. Так, для дабигатрана они преимущественно обусловлены ингибированием P-гликопротеина, так как препарат не метаболизируется изоферментами цитохрома P450 [1].
Ривароксабан также представляет собой субстрат P-гликопротеина, но в отличие от дабигатрана активно (примерно на 2/3) метаболизируется цитохромами печени CYP3A4, CYP3A5, CYP2J2, а также CYP-независимыми путями. Следовательно, увеличение риска кровотечений на фоне приема ривароксабана будет происходить при ингибировании изоферментов цитохрома Р450 печени и P-гликопротеина, например, при сочетанном использовании ритонавира, кетоконазола и др. Исходя из этого не рекомендуется назначать ривароксабан одновременно с азоловыми противогрибковыми препаратами или ингибиторами протеазы ВИЧ [1]. Аналогичное ограничение применимо и для апиксабана [1]. Отметим, что риски кровотечения на фоне приема ПОАК прямо пропорциональны величине ингибирования цитохрома и/или P-гликопротеина: чем более мощный ингибитор применяется, тем больше концентрация ПОАК в крови и тем выше риск кровотечения [1].
• Механизмы взаимодействия ПОАК с пищей аналогичны тем, которые наблюдаются при межлекарственном взаимодействии и связаны с ингибированием Р-гликопротеина, цитохрома Р450 печени, а также с возможными фармакодинамическими взаимодействиями. В частности, в отдельных официальных инструкциях по медицинскому применению ПОАК указано, что «взаимодействия с продуктами питания и молочными продуктами отсутствуют», однако потенциально эти лекарственные средства способны взаимодействовать с продуктами, являющимися ингибиторами ферментов цитохрома P-450 (грейпфрутовый сок, куркумин и др.), ингибиторами P-гликопротеина (апельсиновый сок, зеленый чай, розмарин и др.), или продуктами, обладающими антикоагулянтной и/или антиагрегантной активностью (имбирь, хрен обыкновенный, гинкго и др.) [1].
В целом на сегодняшний день еще недостаточно данных для того, чтобы однозначно делать выводы о рисках сочетанного применения ПОАК, БАД и употребления отдельных продуктов питания. Тем не менее следует учитывать возможные фармакодинамические взаимодействия, способные менять уровень ПОАК в крови и их биодоступность [1]. Потенциальные взаимодействия ПОАК с другими лекарственными средствами, а также с БАД и пищевыми продуктами суммированы в таблице 3.
8.
В ситуации, если пациенту требуется назначение антиагреганта, НПВП, системных кортикостероидов, некоторых антидепрессантов и антибиотиков или других жизненно важных лекарственных средства, следует рассмотреть возможность повторного назначения ИПП в дополнение к ребамипиду, при этом продолжительность повторного применения ИПП должна совпадать с продолжительностью терапии вышеперечисленными лекарственными средствами [1].



