ВВЕДЕНИЕ
Сахарный диабет (СД) – хроническое заболевание, терапия которого включает медикаментозное лечение, изменения образа жизни и самоконтроль поддержания уровня глюкозы в крови в целевом диапазоне [1, 2]. Основной целью лечения и самоконтроля диабета служит предотвращение его осложнений путем достижения рекомендуемых уровней глюкозы крови, а также минимизация риска эпизодов тяжелых гипогликемий. Для достижения этой цели используются инструменты управления углеводным обменом – контроль гликемии натощак и после приема пищи, поддержание целевых значений гликированного гемоглобина (HbA1c). Самоконтроль уровня глюкозы в крови (самоконтроль глюкозы) является самостоятельной неотъемлемой частью лечения и может снизить гликированный гемоглобин (HbA1c) в дополнение к терапии сахароснижающими препаратами [3].
Первые крупные клинические исследования были сфокусированы на пациентах с СД, получавших инсулин, и оценивали самоконтроль глюкозы как часть многофакторного вмешательства с целью ранней профилактики развития диабетических сосудистых осложнений. В рамках этих программ выполнение предписанного самоконтроля позволяло пациентам реализовывать и получать серьезные преимущества от интенсивного контроля гликемии, предусматривавшего коррекцию доз инсулина на основании данных глюкозы крови [4]. Именно эти программы закрепили роль самоконтроля глюкозы как неотъемлемого компонента эффективной терапии для людей, получающих базисно-болюсную инсулинотерапию. Однако со временем стало очевидно, что самоконтроль имеет важнейшее значение для любых пациентов независимо от вида сахароснижающей терапии.
Хотя HbA1c считается «золотым стандартом» для мониторинга гликемического контроля и его уровень рассматривается как предиктор риска развития осложнений, связанных с диабетом, этот показатель не предоставляет информации о ежедневных и внутрисуточных изменениях уровня глюкозы. В связи с этим особое значение приобретает самоконтроль уровня глюкозы, поскольку он помогает различать гипергликемию натощак, препрандиальную и постпрандиальную гипергликемию (их вклад в нецелевые значения HbA1c), обнаруживать отклонения уровней глюкозы крови от индивидуальных целевых значений, выявлять гипогликемию и отслеживать нормализацию глюкозы при ее купировании, предоставлять пациентам немедленную обратную связь о влиянии выбора пищи, физической активности и приема лекарств на гликемический контроль.
На сегодняшний день трудно переоценить роль самоконтроля глюкозы (табл. 1) и возможности пациентов в любой момент времени определять показатели гликемии. Измерение глюкозы крови с помощью глюкометра влияет на выбор сахароснижающих препаратов, подсказывает, связано ли ухудшение самочувствия с гипогликемией или стойкой гипергликемией, дает представление о том, как диета, физическая активность и прием препаратов влияют на уровень гликемии, помогая пациентам поменять образ жизни для достижения качественного контроля углеводного обмена.

ИСТОРИЯ ПОЯВЛЕНИЯ И РАЗВИТИЯ САМОСТОЯТЕЛЬНОГО ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ КРОВИ
Для больных СД изобретение глюкометра стало столе же значимым, как и открытие инсулина и появление сахароснижающих препаратов. В 1908 г. американский химик Стэнли Бенедикт (Stanley Benedict) впервые смог измерить уровень глюкозы в моче [5]. Раствор, содержащий сульфат меди и винную кислоту («реактив Бенедикта»), при взаимодействии с мочой менял свой голубой цвет на зеленый или бурый. Цвет при этом зависел от концентрации глюкозы. В 1921 г. начался выпуск таблеток, а чуть позже – тест-полосок с реактивом Бенедикта, однако к тому времени врачи пришли к выводу, что измерение уровня глюкозы в моче дает слишком приблизительные результаты.
Первое количественное измерение уровня глюкозы в крови произвели датские ученые Ханс Хагедорн (Hans Hagedorn) и Йоханнес Йенсен (Johannes Jensen) в 1918 г. [6]. Это тоже была реакция на изменение цвета, но с другими реагентами. Метод Хагедорна–Йенсена прочно вошел в медицинскую практику и применялся в лабораториях вплоть до 1950-х гг.
История глюкометров началась в 1963 г., когда Эрни Адамс (Ernie Adams) изобрел Dextrosti – бумажную полоску, окрашиваемую в синий цвет, интенсивность которого пропорциональна концентрации глюкозы и может быть прочитана путем визуального сравнения цвета полоски с цветовой диаграммой концентрации. Этот метод давал приблизительную оценку уровня глюкозы в крови. В 1970 г. Антон Хьюберт Клеменс (Anton Hubert Clemens) разработал первый глюкометр и систему самоконтроля глюкозы – рефрактометр Эймса для обнаружения отраженного света от Dextrostix. Он весил 3 фунта (1,36 кг), стоил 650 долл. и предназначался для использования в кабинете врача [7].
В 1987 г. Американская диабетическая ассоциация впервые рекомендовала пациентам контролировать уровень глюкозы в крови [8]. С тех пор самоконтроль глюкозы в крови стал неотъемлемой частью лечения диабета.
Самоконтроль глюкозы оказывает благотворное влияние на состояние углеводного обмена, достижение и удержание целевых параметров гликемии и их приближение у пациентов с СД к физиологической норме как в краткосрочной, так и долгосрочной перспективе [10–12]. Сегодня продолжаются многочисленные исследования, направленные на совершенствование технологий как в отношении оценки показателей гликемии, так и в плане возможностей прогнозирования суточного гликемического профиля пациентов на основании данных глюкометрии. Недавнее большое поперечное исследование, в котором оценивались пациенты с СД 2-го типа, получавшие лечение в системе общественного здравоохранения, показало, что больные, которые сообщили о выполнении самоконтроля глюкозы по крайней мере 1 раз/сут, имели лучший гликемический контроль, чем лица, которые не проводили самоконтроль совсем. В этот анализ вошли пациенты с различной сахароснижающей терапией, часть из которых получала различные режимы инсулинотерапии. Следует подчеркнуть, что подавляющее число больных характеризовалось плохим гликемическим контролем, несмотря на активную гипогликемизирующую терапию. Однако группа пациентов, осуществлявших самоконтроль, имела HbA1c 9,3±2,1%, и в этом достоверно отличалось от группы без самоконтроля, где аналогичный показатель составил 9,7±2,3% (p=0,008) [12].
Другое рандомизированное контролируемое исследование (РКИ) с участием пациентов с СД 2-го типа (период наблюдения – не менее 12 мес) также продемонстрировало, что самоконтроль глюкозы способствует значимому снижению HbA1c и достижению целевых показателей гликемии [11]. Особое значение измерение гликемии натощак имело для пациентов с СД 2-го типа, получающих базальный инсулин, поскольку позволяло корректировать его дозу на основании полученных данных самоконтроля и осуществлять эффективную титрацию до достижения целевых показателей, приводя к снижению HbA1c [13, 14].
Метаанализ 24 исследований регулярного самоконтроля глюкозы, который охватил 5454 пациента с СД 2-го типа, получающих сахароснижающую терапию без интенсивной инсулинотерапии, подтвердил, что самоконтроль уровня глюкозы в крови был связан с улучшением гликемического контроля по сравнению с контрольной группой уже через 12 нед (0,31%; 95% доверительный интервал (ДИ): 0,57–0,05), продолжал иметь важное значение и через 24 нед (0,34%; 95% ДИ: 0,52–0,17), однако утрачивал свой вклад в контроль заболевания через 1 год наблюдения [3]. В последующем исследования по оценке роли самоконтроля разделяли в зависимости от исходного уровня HbA1c. Так, работы, включавшие пациентов с более высоким исходным уровнем HbA1c (>8%), убедительно доказали положительное влияние самоконтроля глюкозы на этот параметр: на фоне его выполнения уже через 12 нед динамика HbA1c составила 0,83% (95% ДИ: 1,55–0,11), а через 24 нед – 0,48% (95% ДИ: 0,77–0,19). Исследования, в которых пациенты с СД характеризовались лучшим исходным гликемическим контролем, не продемонстрировали столь существенных различий. Исследователи обращают внимание на необходимость проведения более частых измерений показателей гликемии, а не только гликемии натощак. Количество тестов, проводимых за день, за неделю и т.д., оказывало существенное влияние на ценность самоконтроля гликемии. Рекомендуемое количество измерений уровня глюкозы в крови различается у разных авторов: часть из них предлагает проводить не менее двух измерений перед приемом пищи в день [15], в то время как другие рекомендуют оценку глюкозы до и после еды [16]. И если Schnell O. et al. (17) рекомендовали определение гликемии только в течение двух дней, предшествующих медицинским осмотрам, то Bonomo K. et al. [16] и Chidum E. et al. (18) оценивали глюкозу по трем измерениям, распределенным в течение недели. Напротив, Schwedes U. et al. [19] предложили проводить более интенсивные проверки (6 раз/сут) уровня глюкозы, но только 2 раза/ нед. Все эти авторы изучали пациентов с СД 2-го типа, принимавших только пероральные препараты. По результатам многочисленных последующих наблюдений, оптимальным количеством измерений стало принято считать до 7 в день и не менее 2 профилей в неделю.
Исследования с использованием структурированного самоконтроля глюкозы демонстрируют значительно большее улучшение гликемического контроля, чем при неструктурированном самоконтроле [9, 10, 20–24]. Структурированный самоконтроль гликемии у пациентов, не получающих инсулин, с исходным уровнем HbA1c 8,4% улучшает все наблюдаемые показатели гликемической вариабельности, включая среднее значение глюкозы в крови (-1,25 ммоль/л), глюкозы в крови натощак (-0,97 ммоль/л), стандартное отклонение глюкозы крови (-0,44 ммоль/л), коэффициент вариации гликемии (-1,43%), среднее изменение абсолютного уровня глюкозы (-0,97 ммоль/д) и HbA1c (-0,7%) через 12 мес (p <0,001 для всех показателей).
Применение структурированного самоконтроля глюкозы в течение 12 мес у больных СД 2-го типа, не получающих инсулин, улучшило HbA1c на 0,8% больше, по сравнению с контрольной группой [25]. Khamseh M.E. et al. обнаружили, что структурированный самоконтроль глюкозы у участников с HbA1c выше 8,0% значительно улучшил HbA1c, вариабельность глюкозы и уровень глюкозы в крови натощак – на 1,8%, 0,6 и 1,1 ммоль/л соответственно [21]. Polonsky W.Y. et al. ранее отмечали статистически значимые улучшения как гликемического контроля, так и вариабельности гликемии, определенные с помощью MAGE, у участников с СД 2-го типа со структурированным самоконтролем глюкозы, как получавших инсулин, так и не получавших его [24].
Несколько причин улучшения контроля уровня глюкозы в крови и ее вариабельности могут объяснить преимущества, наблюдаемые при структурированном самоконтроле глюкозы. Во-первых, участники понимают, как те или иные их действия влияют на уровень глюкозы в крови, и, следовательно, могут скорректировать свою диету и/или образ жизни. Например, исследование, изучавшее использование непрерывного мониторинга глюкозы (НМГ) у людей с плохо контролируемым СД 2-го типа без инсулина, показало, что использование НМГ было связано со снижением потребления калорий и повышением физической активности [26]. Во-вторых, определение уровня глюкозы в крови позволяет врачу скорректировать сахароснижающую терапию. Некоторые исследования самоконтроля глюкозы у людей с СД 2-го типа, не применявших инсулин, установили значительные изменения в назначении терапии [20, 22–24], тогда как в других наблюдениях этого не произошло [27, 28]. У людей, проводящих структурированный самоконтроль глюкозы, отмечалось увеличение среднего количества сахароснижающих препаратов, назначенных за период исследования, по сравнению с контрольной группой (47,8 против 27,6%) [25].
Использование самоконтроля глюкозы улучшает показатели гликемической вариабельности, которая в целом отражает количество и степень колебаний уровня глюкозы в крови человека [29]. Метрикой для оценки вариабельности уровня глюкозы может служить время его нахождения в целевом диапазоне.
Вариабельность уровня глюкозы в крови рассматривают как один из важнейших маркеров микро- и макрососудистого риска у больных СД [30]. Кроме того, высокая вариабельность гликемии ассоциирована с риском развития тяжелой гипогликемии. Некоторые исследования продемонстрировали улучшение показателей гликемического контроля и вариабельности с помощью самоконтроля при СД 2-го типа без терапии инсулином, включая средний уровень глюкозы в крови, уровень глюкозы в крови натощак, постпрандиальную глюкозу, среднюю амплитуду гликемического отклонения MAGE [21, 24], которые коррелируют с частотой гипогликемии [31], сердечно-сосудистых осложнений [32, 33] и смертности [34].
Улучшение показателей углеводного обмена наблюдается как среди пациентов с длительным анамнезом СД 2-го типа [35], так и у впервые заболевших [36], независимо от того, использовались ли секретагоги или другие неинсулиновые сахароснижающие препараты. Руководство Международной федерации диабета (IDF) предполагает, что самоконтроль глюкозы следует рассматривать во время постановки диагноза пациентам с СД 2-го типа, не получающим инсулин, в рамках их обучения, чтобы при необходимости обеспечить своевременную коррекцию лечения [37].
Использование мобильного приложения для самоконтроля глюкозы в крови способно помочь стабилизировать колебания гликемии у пациентов с СД 2-го типа. Подход к интерпретации паттернов контроля гликемии включает графическое отображение эпизодов гипер- и гипогликемии и распознавание закономерностей гликемической вариабельности на основе стандартного отклонения и среднего значения глюкозы крови. Исследование по самоконтролю глюкозы у пациентов с СД 2-го типа и использованию приложения для контроля СД позволило сделать следующие выводы: изменение уровня глюкозы в крови у больных в группе пользователей приложения снизилось больше, чем в группе проводивших только самоконтроль (t= -3,873; df=1,81×104; p <0,001); более короткая продолжительность диабета связана с более выраженным снижением глюкозы (t=2,823; df=1,71×104; p=0,005); процент снижения изменения уровня глюкозы в крови у более молодых пациентов больше, чем у пожилых (t =2,652; df=1,71×104; p=0,008); чем чаще пациенты осуществляют самоконтроль глюкозы, тем больше снижается процентное содержание глюкозы в крови [38].
Важно отметить, что самоконтроль сам по себе не снижает уровень глюкозы в крови. Чтобы быть полезной, соответствующая информация должна быть интегрирована в план лечения. Для достижения целей гликемического контроля требуется обучение больных выполнению самоконтроля глюкозы, интерпретации полученных результатов и правильному составлению режима лечения. В свою очередь, врачи на основе интерпретации данных самоконтроля глюкозы могут назначать необходимые препараты и осуществлять наблюдение в целях своевременной коррекции режима терапии, если таковая потребуется.
РЕКОМЕНДАЦИИ ПО ПРОВЕДЕНИЮ САМОКОНТРОЛЯ ГЛЮКОЗЫ
С целью самоконтроля уровня глюкозы крови рекомендованы глюкометры для индивидуального использования, соответствующие ГОСТ Р ИСО 15197-2015 по аналитической и клинической точности. При уровне глюкозы плазмы <5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ±0,8 ммоль/л, при ≥5,6 ммоль/л – не более чем на ±15%. 99% результатов должны быть в пределах зон А и B консенсусной сетки ошибок Паркс [39].
Некоторые характеристики глюкометра, такие как использование менее болезненных прокалывателей [40] и возможность повторного нанесения крови на тест-полоску с недостаточным исходным образцом, также могут оказаться полезными для людей с диабетом [41] и сделать самоконтроль глюкозы менее обременительным для выполнения.
Оптимальное использование глюкометров требует надлежащего анализа и интерпретации данных как самим пациентом с СД, так и лечащим врачом, чтобы гарантировать, что данные используются эффективно и своевременно. В настоящее время существуют глюкометры с настройкой индивидуального целевого диапазона гликемии: они позволяют обозначить, находится ли глюкоза в целевом диапазоне или выходит за его пределы, а также дают советы по возможной коррекции терапии пользователю в режиме реального времени [42]. Глюкометры с функцией беспроводной передачи данных отправляют информацию об уровне глюкозы крови медицинским специалистам, родственникам или в установленное на смартфон пациента специальное приложение для использования при дистанционном наблюдении; они могут применяться как часть интегрированных платформ здравоохранения, позволяющих врачу своевременно получить данные о глюкозе и провести их статистическую обработку в соответствующих программах, что ускорит их интерпретацию и коррекцию лечения при необходимости [43]. Пациентов с СД следует обучать тому, как верно использовать данные самоконтроля глюкозы, чтобы на их основании корректировать дозы инсулина или дополнительный прием пищи, физическую активность или фармакологическую терапию для достижения конкретных целей.
В соответствии с алгоритмами медицинской помощи пациентам с СД частота самоконтроля глюкозы зависит от получаемого пациентом лечения (табл. 2).

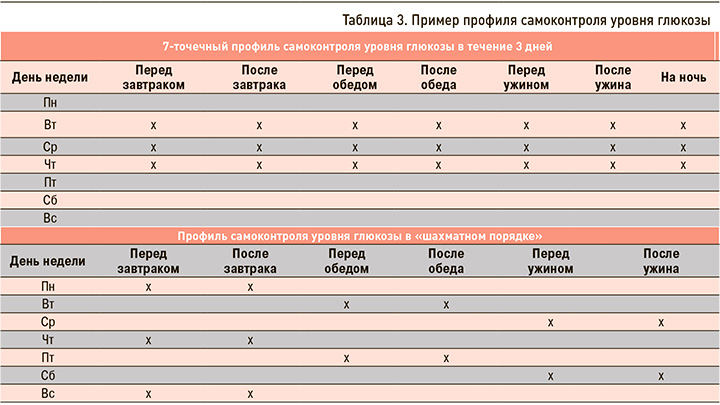
Результаты самоконтроля глюкозы, проводимого регулярно по определенной схеме, представленные в удобном для понимания и интерпретации формате (пример в табл. 3), позволяют понять индивидуальные закономерности изменения гликемии под действием различных факторов. Только путем анализа результатов самоконтроля глюкозы возможно скорректировать сахароснижающую терапию, поведение пациента, его диету и другие аспекты жизни для длительного поддержания оптимальных показателей гликемии.
РАЦИОНАЛЬНЫЙ ВЫБОР ГЛЮКОМЕТРА ДЛЯ САМОКОНТРОЛЯ
Глюкометр Контур Плюс Уан (Contour Plus One, Ascensia Diabetes Care) — инновационный глюкометр последнего поколения с поддержкой беспроводной связи, который подключается через Bluetooth к установленному на смартфоне или планшете приложению Контур Диабитис (Contour Diabetes). Это приложение собирает, сохраняет и анализирует измерения уровня глюкозы в крови пациентов. Результаты измерения глюкозы в крови можно анализировать на наличие закономерностей и тенденций, подсказывающих пациентам, как определенные аспекты их повседневной деятельности влияют на показатели гликемии.
Глюкометр Контур Плюс Уан продемонстрировал высокую точность, превышающую критерии точности ISO 15197:2013 в лабораторных и клинических условиях [44]. Для глюкометра этой модели используются тест-полоски Контур Плюс, содержащие фермент флавинадениндинуклеотид – глюкозодегидрогеназу (FAD-GDH), который практически не имеет взаимодействия с лекарственными средствами.
Функция повторного нанесения образца «Второй шанс» позволяет пациенту в течение 60 секунд нанести образец крови на ту же тест-полоску, когда первого образца недостаточно, что дает возможность выполнить измерение и уменьшить расход тест-полосок.
Функция «Умная подсветка» предоставляет мгновенную обратную связь, сигнализируя пациенту, где находится его уровень глюкозы в крови: в пределах (зеленый цвет), выше (желтый) или ниже целевого диапазона (красный цвет). Это существенно упрощает интерпретацию результатов измерений [25]. В приложении Контур Диабитис пользователь может самостоятельно настроить индивидуальные целевые значения гликемии и получать обратную связь с помощью цветовой индикации. При выявлении экстремально низких или высоких значений глюкозы мобильное приложение выводит на экран уведомление об опасности и предлагает рассмотреть варианты его устранения.
В приложение Контур Диабитис можно добавлять информацию о еде, физических нагрузках и лекарственных препаратах, а также примечания или фотографии и анализировать полную картину самоконтроля глюкозы с врачом на приеме. Через приложение пациент может подготовить и отправить детализированный отчет доктору, что важно при дистанционном консультировании. Учетная запись в облаке позволяет осуществлять удаленный контроль результатов измерений: находясь на расстоянии, можно получать данные о гликемии у своих детей или родителей, а это дает возможность без лишних сложностей корректировать терапию или напоминать о необходимости приема пищи и лекарственных средств. Современные глюкометры подходят как для пациентов, имеющих самые простые потребности (например, периодическое определение уровней глюкозы крови) и нуждающихся в самом простом наборе функций, так и для тех, кто готов использовать дополнительные функции прибора и приложения на смартфоне. Для технически более ориентированных пользователей в приложении есть функция «Мои тенденции», которая позволяет определить тренды в изменениях уровня глюкозы в крови и уведомляет о возможных причинах дисгликемии, благодаря чему пациенты лучше понимают свое состояние. Приложение распознает 14 разных тенденций гликемии, помогая пациентам принимать осознанные решения о питании, физических нагрузках и других аспектах образа жизни [25, 45].
ЗАКЛЮЧЕНИЕ
Самоконтроль глюкозы – неотъемлемая часть не только управления СД, но и высокотехнологичных современных программ, включающих поддержку клинических решений. При совмещении с терапевтическим обучением и наблюдением врача он способен значительно улучшить качество жизни и здоровье людей с диабетом.
Необходимо отметить, что глюкометрия выходит за пределы потребностей пациентов с СД и эндокринологов. На сегодняшний день максимально широкая терапевтическая практика критически нуждается в портативных приборах для домашнего самостоятельного определения показателей гликемии, которым можно доверять. Точность, простота использования и возможности автоматического анализа собранных данных позволяют осуществлять дистанционный контроль и управление хроническим заболеванием, прогнозировать развитие осложнений и планировать посещение врача. Глюкометрия должна быть рекомендована не только людям с СД, но и лицам, имеющим избыточную массу тела или ожирение, возраст старше 45 лет, страдающим артериальной гипертензией или сердечно-сосудистыми заболеваниями, так как все они находятся в группе риска развития нарушений углеводного обмена.



