Несмотря на многочисленные исследования и разработанные в России и за рубежом клинические рекомендации профессиональных сообществ, интерес к гастроэзофагеальной рефлюксной болезни (ГЭРБ) не ослабевает. На сегодняшний день ГЭРБ является одним из самых распространенных гастроэнтерологических заболеваний, негативно влияющим на качество жизни пациентов. Продолжается углубленное изучение механизмов развития ГЭРБ, совершенствуются методы и критерии диагностики, исследуются причины неэффективности медикаментозной терапии. По мере накопления новых сведений о клинико-патогенетических особенностях заболевания, видоизменяется само его определение [1–3].
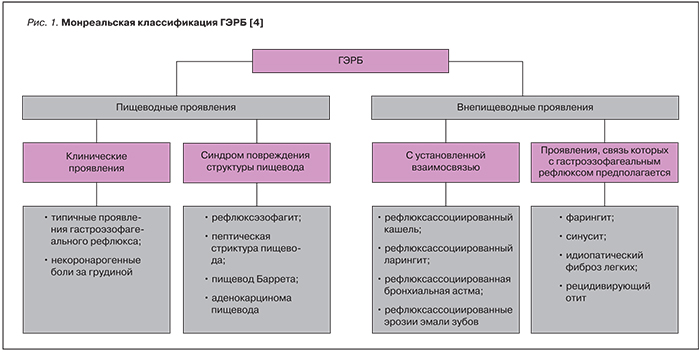
Монреальским консенсусом (2006) ГЭРБ определена как состояние, развивающееся в том случае, когда рефлюкс содержимого желудка вызывает беспокоящие пациента симптомы (изжогу, отрыжку, регургитацию, некоронарогенные ретростернальные боли, внепищеводные симптомы) и/или осложнения [4]. И в определении, и в классификации (рис. 1) акцент сделан на многообразие клинической симптоматики заболевания, включающей, помимо типичных пищеводных симптомов, разнообразные внепищеводные проявления или синдромы. В Клинических рекомендациях Российской гастроэнтерологической ассоциации, посвященных ГЭРБ, к ее внепищеводным проявлениям отнесены бронхолегочный, оториноларингологический, стоматологический, кардиальный и анемический синдромы [5]. Диагностика ГЭРБ в большинстве случаев не представляет значительной сложности для врача любой специальности, поскольку включает в себя, прежде всего, анализ клинической симптоматики. Предположительный диагноз ГЭРБ может быть установлен на основании типичных симптомов (изжоги и регургитации) и является основанием для назначения медикаментозной терапии [6–9]. В качестве скринингового теста может использоваться опросник Gastroesophageal Reflux Disease Questionnaire (GERDQ), чувствительность применения которого для диагностики ГЭРБ составляет 65%, а специфичность – 71% [6]. Проведение эзофагогастродуоденоскопии (ЭГДС) рядом исследователей рекомендуется пациентам с тревожными симптомами и высоким риском развития осложнений [9]. Вместе с тем на практике ЭГДС нередко используется уже на первом этапе диагностики, позволяя верифицировать наличие, характер и степень выраженности морфологических изменений в пищеводе. При эндоскопических признаках пищевода Баррета или подозрении на эозинофильный эзофагит требуется проведение ЭГДС с морфологической верификацией диагноза [9]. Для подтверждения диагноза эндоскопически негативной ГЭРБ, характеризующейся наличием клинических проявлений при отсутствии эндоскопических изменений в пищеводе или катаральном рефлюкс-эзофагите, но при отсутствии эрозий, язв и пищевода Барретта [10], может быть использована суточная пищеводная рН-метрия или рН-импедансометрия [6, 9]. По показаниям проводится тестирование на инфекцию H. pylori.
Основным механизмом развития ГЭРБ считается нарушение моторно-эвакуаторной функции гастроэзофагеальной зоны, характеризующееся спонтанным или регулярно повторяющимся рефлюксом желудочного содержимого в пищевод. Это может приводить к повреждению дистального отдела пищевода с развитием эрозивно-язвенных, катаральных и/или функциональных нарушений [1–3]. Существенное значение в появлении симптоматики заболевания имеют такие факторы, как повышенная чувствительность слизистой оболочки пищевода, снижение функции антирефлюксного барьера и клиренса пищевода, а также так называемый кислотный карман, представляющий собой слой небуферизованной кислоты, образующийся после еды на поверхности желудочного содержимого в области пищеводно-желудочного соединения [11, 12]. В формировании морфологических изменений пищевода (рефлюкс-эзофагита, эрозий, язв) основное значение принадлежит агрессивным компонентам рефлюктата (соляной кислоте, пепсину, желчным кислотам, панкреатическим ферментам) в сочетании с неспособностью слизистой оболочки пищевода противостоять его повреждающему действию.
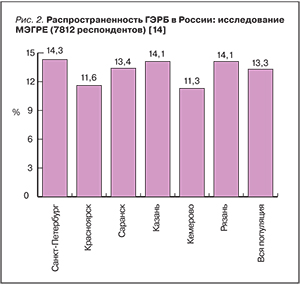 ГЭРБ относится к высоко распространенным заболеваниям во всех возрастных категориях населения. В Европе и США ее распространенность достигает 40% [13]. По данным Многоцентрового исследования Эпидемиологии Гастроэзофагеальной Рефлюксной болезни в России (МЭГРЕ) [14], проведенного в 6 городах РФ (Санкт-Петербург, Красноярск, Казань, Кемерово, Рязань, Саранск), изжога c разной частотой беспокоит 47,5% населения, а у 13,3% наблюдается 1 раз в день и чаще (рис. 2), что, согласно критериям клиники Майо, свидетельствует о наличии ГЭРБ.
ГЭРБ относится к высоко распространенным заболеваниям во всех возрастных категориях населения. В Европе и США ее распространенность достигает 40% [13]. По данным Многоцентрового исследования Эпидемиологии Гастроэзофагеальной Рефлюксной болезни в России (МЭГРЕ) [14], проведенного в 6 городах РФ (Санкт-Петербург, Красноярск, Казань, Кемерово, Рязань, Саранск), изжога c разной частотой беспокоит 47,5% населения, а у 13,3% наблюдается 1 раз в день и чаще (рис. 2), что, согласно критериям клиники Майо, свидетельствует о наличии ГЭРБ.
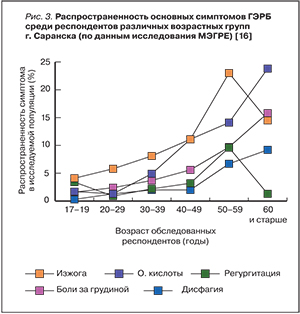
В Саранске в рамках исследования МЭГРЕ были проанкетированы 1400 жителей в возрасте от 17 до 75 лет (средний возраст 35,3±13,2 года). Симптом изжоги отмечался у 51% респондентов, а регулярная изжога и/или регургитация 1 раз в нед и чаще за предшествующие 12 мес – у 13,4% опрошенных, что соответствовало среднестатистическим значениям исследования МЭГРЕ [14–16]. При этом установлено, что распространенность симптомов ГЭРБ увеличивается с возрастом (рис. 3).
Рассматривая ГЭРБ как заболевание с разнообразными клиническими проявлениями, нельзя не учитывать и его существование в рамках чрезвычайно распространенной в современных условиях полиморбидности. Так, например, по данным М. Sandu и соавт. (2013), основанным на результатах анкетирования опросником GERDQ, ГЭРБ была выявлена у 40,9% пациентов, страдавших болезнями органов дыхания, в т.ч. у 45% больных бронхиальной астмой и у 41,6% пациентов с хронической обструктивной болезнью легких [17]. ГЭРБ нередко сочетается с другими заболеваниями органов пищеварительной системы, особенно с синдромом раздраженного кишечника (СРК), функциональной диспепсией, билиарными дисфункциями, протекая одновременно или последовательно в различных вариантах «перекрестов». В исследовании Xuan Jiang и соавт. (2013) отмечена высокая распространенность кишечной симптоматики у пациентов с ГЭРБ: у 25,2% – вздутие живота, у 14% – хронический запор, у 10,3% – СРК [18].
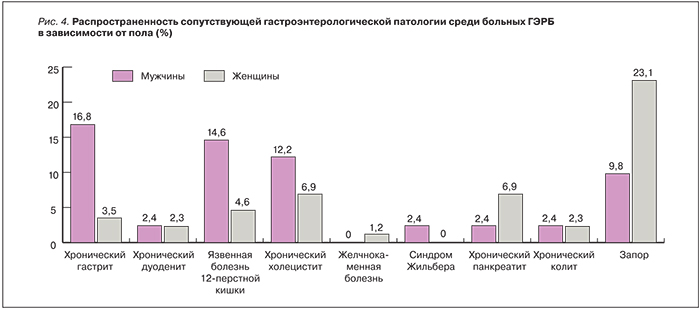
Анкетирование респондентов, проводимое в Саранске в рамках исследования МЭГРЕ, включало учет сопутствующих заболеваний на основании сведений, полученных от пациентов, и анализа медицинской документации. Было обнаружено, что у пациентов с симптоматикой ГЭРБ чаще встречаются различные сопутствующие заболевания. В структуре сопутствующей патологии преобладали заболевания органов пищеварительной системы. При этом распространенность конкретных вариантов патологии имела гендерные отличия (рис. 4).
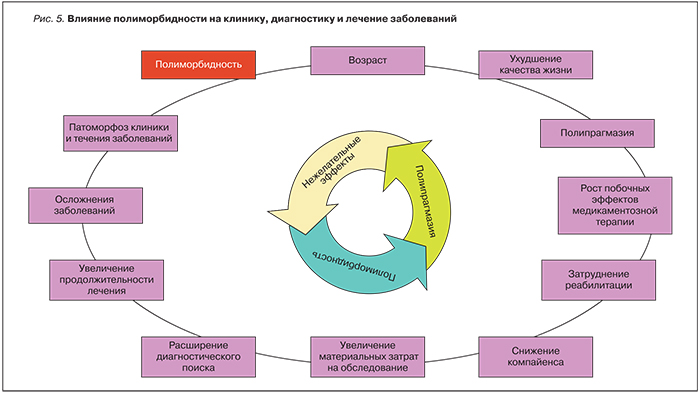
Наше собственное исследование по изучению распространенности сопутствующей патологии у пациентов с ГЭРБ (n=502) показало, что у 87% пациентов отмечались 2 и более заболевания, в т.ч. билиарная патология (билиарные дисфункции, желчнокаменная болезнь, хронический холецистит) – у 42%, хронический гастрит с функциональной диспепсией – у 56%, СРК (чаще – вариант с запорами) – у 38%, хронический панкреатит – у 24%, кардиологическая патология (ишемическая болезнь сердца, артериальная гипертензия, аритмии) – у 25%, бронхолегочная патология – у 19%, патология ЛОР-органов – у 13% пациентов. При этом не вызывает сомнения тот факт, что полиморбидность накладывает существенный отпечаток на тактику ведения пациентов с ГЭРБ, являясь одной из причин недостаточной эффективности лечения (рис. 5).
Современная тактика ведения пациента с ГЭРБ предусматривает, наряду с модификацией образа жизни и питания, длительную медикаментозную (основную и поддерживающую) терапию, включающую применение антисекреторных препаратов (чаще ингибиторов протонной помпы [ИПП]), прокинетиков, антацидов, алгинатов и по показаниям – препаратов урсодезоксихолевой кислоты (УДХК) [5, 7, 9].
Основной курс терапии включает назначение ИПП в стандартной или двойной суточной дозе, распределенной на 1 или 2 приема [19]. В тех случаях, когда на начальном этапе диагностики использовалась ЭГДС, терапия назначается дифференцированно, исходя из наличия и характера выявленных изменений в пищеводе. При эндоскопически негативной ГЭРБ ИПП применяется в течение, как минимум, 4 нед в стандартной дозе 1 или 2 раза в день, а при эрозивной ГЭРБ – минимум 8 нед в стандартной или двойной дозе 1 или 2 раза в день [5]. В тех случаях, когда терапия начата без эндоскопической верификации, на основании клинической симптоматики и/или использования опросника GERDQ, целесообразно воспользоваться вариантом лечения, предусмотренным при эрозивной форме ГЭРБ, т.е. 8-недельный курс лечения ИПП в стандартной дозе.
 Присутствие в рефлюктате компонентов дуоденального содержимого, определяемого по результатам рН-импедансометрии, билиометрии или наличию клинического эквивалента – симптома горечи во рту, является показанием для комбинации ИПП с антацидом, УДХК или/и прокинетиком [20–22]. Присутствие дуоденального содержимого в рефлюктате можно предполагать у пациентов, имеющих сопутствующую билиарную патологию, перенесших холецистэктомию или резекцию желудка. Добавление прокинетика целесообразно и при «перекресте» ГЭРБ с функциональной диспепсией, особенно протекающей в виде постпрандиального дистресс-синдрома.
Присутствие в рефлюктате компонентов дуоденального содержимого, определяемого по результатам рН-импедансометрии, билиометрии или наличию клинического эквивалента – симптома горечи во рту, является показанием для комбинации ИПП с антацидом, УДХК или/и прокинетиком [20–22]. Присутствие дуоденального содержимого в рефлюктате можно предполагать у пациентов, имеющих сопутствующую билиарную патологию, перенесших холецистэктомию или резекцию желудка. Добавление прокинетика целесообразно и при «перекресте» ГЭРБ с функциональной диспепсией, особенно протекающей в виде постпрандиального дистресс-синдрома.
Назначая медикаментозную терапию, следует изначально мотивировать пациента на ее продолжительность – не менее 4 нед основного курса лечения и поддерживающую терапию, вариант и длительность которой определяется индивидуально после завершения основного курса. Согласно современным международным и российским рекомендациям по диагностике и лечению ГЭРБ, поддерживающая терапия в обязательном порядке должна быть назначена пациентам с возобновлением симптомов после прекращения приема ИПП, пациентам с эрозивной рефлюксной болезнью и осложнениями ГЭРБ [5, 8]. Исследования, проведенные во многих странах мира, показали, что более чем у 80% пациентов, не получающих адекватного поддерживающего лечения, рецидив развивался в течение ближайших 26 нед, а в течение года вероятность рецидива составляет 90–98% [8].
Варианты поддерживающей терапии пациентов с ГЭРБ [8]:
- Постоянная поддерживающая терапия: ИПП или блокаторы Н2-рецепторов гистамина в половинных дозах.
- Периодическая (курсовая): ИПП в стандартных дозах, прокинетик, антациды или алгинаты курсами по 2–4 нед.
- Терапия «по требованию»: прием ИПП в стандартной или половинной дозе, блокатора Н2-рецепторов гистамина, антацида или алгината при возникновении изжоги или других симптомов ГЭРБ.
Антациды и алгинаты рассматриваются как средства для симптоматического лечения больных ГЭРБ во время основной и поддерживающей терапии [9]. Критерием эффективности лечения является стойкое устранение симптомов заболевания и полное заживление эрозий при их наличии.
Поскольку ведущим механизмом формирования симптоматики ГЭРБ считается длительное закисление пищевода, а само заболевание отнесено к кислотозависимым, основным направлением терапии является применение антисекреторных препаратов, прежде всего ИПП, эффективность и безопасность длительного применения которых при данном заболевании доказана множеством зарубежных и отечественных исследований [3, 7, 12, 23]. Для лечения ГЭРБ используют омепразол, лансопразол, пантопразол, рабепразол и стереоизомеры ИПП, зарегистрированные в РФ, – эзомепразол и декслансопразол. Все они позволяют обеспечить необходимый для лечения пациентов ГЭРБ уровень внутрижелудочного рН>4 большую часть суток [23]. Стандартные дозы ИПП (омепразол 20 мг/сут, лансопразол 30 мг/ сут, декслансопразол 30 мг/ сут, пантопразол 40 мг/сут, рабепразол 20 мг/сут, эзомепразол 40 мг/сут) обычно назначаются 1 раз в день утром за 30 мин до завтрака [24]. Однако в ряде случаев лучшего эффекта можно добиться при распределении суточной дозы ИПП на 2 приема, что обеспечивает более устойчивое антисекреторное действие в течение суток [25]. Двойная доза ИПП применяется, как правило, для лечения осложненных форм ГЭРБ или рефрактерных пациентов, которые ранее уже были пролечены стандартными дозами не менее 8 нед, а также при наличии у больного грыжи пищеводного отверстия диафрагмы. Двойную дозу чаще распределяют на 2 приема (утром и вечером за 30 мин до еды). Время приема ИПП имеет принципиальное значение для обеспечения максимального эффекта, поскольку данные препараты подавляют лишь активированные пищей протонные помпы, встроенные в мембрану секреторного канальца париетальной клетки [26].
Выбор конкретного препарата из группы ИПП для лечения больных ГЭРБ основывается на результатах исследования мощности и длительности антисекреторного действия, скорости купирования симптомов, скорости заживления эрозий, прогнозируемости эффекта и безопасности при комбинированном лечении, что особенно важно для полиморбидных пациентов. На сегодняшний день ни один из консенсусов по диагностике и лечению ГЭРБ не отдает предпочтения какому-то конкретному препарату из группы ИПП, поэтому выбор препарата из этой группы основан на клинической важности небольших отличий, наблюдаемых между ними [7, 29]. Например, пантопразол имеет преимущество в использовании у полиморбидных пациентов, поскольку обладает минимальным межлекарственным взаимодействием [30, 31]. В ряде работ было показано преимущество пантопразола при лечении кислотозависимых заболеваний у пациентов с сахарным диабетом [32, 33]. Несомненными преимуществами рабепразола являются быстрота действия, выраженный антисекреторный эффект, а также прогнозируемость эффекта вне зависимости от того, является пациент «быстрым» или «медленным» метаболизатором ИПП [5]. Эзомепразол продемонстрировал наиболее высокую среди ИПП эффективность при тяжелых эрозивно-язвенных поражениях пищевода, связанных с ГЭРБ [34–40]. Открытое 5-летнее мультицентровое рандомизированное с параллельными группами исследование LOTUS, проведенное в 11 европейских странах, показало, что на фоне длительного лечения эзомепразолом (20–40 мг/сут) количество пациентов с ГЭРБ, находившихся в ремиссии, было более высоким (92%), чем после хирургического антирефлюксного лечения (85%) [41].
В 2014 г. в РФ для лечения пациентов с ГЭРБ зарегистрирован новый ИПП – декслансопразол, являющийся R-энантиомером лансопразола с модифицированным двойным (через 1–2 и 4–5 ч) высвобождением активного вещества, замедленным выведением и увеличением длительности системного воздействия. Препарат принимается 1 раз в день утром в капсулах по 30 или 60 мг независимо от приема пищи, что представляется полезным для повышения приверженности пациентов к лечению [27, 28].
Следует отметить, что антисекреторная терапия ГЭРБ, успешно нейтрализуя негативное влияние кислоты и уменьшая объем забрасываемого в пищевод содержимого желудка, не устраняет агрессивное действие компонентов дуоденального содержимого, прежде всего желчных кислот. Конъюгированные желчные кислоты оказывают выраженное воздействие на слизистую при рН 2–4, проявляя синергизм агрессивных свойств с кислотой в отношении развития эзофагита. Неконъюгированные желчные кислоты и трипсин вызывают максимальное повреждение при рН выше 7 [42]. Под влиянием антисекреторной терапии пул неконъюгированных желчных кислот возрастает, и они легче проникают в слизистую оболочку пищевода, повреждая ее [42]. Присутствие желчных кислот в составе рефлюктата, независимо от уровня внутрипищеводного рН, способствует более частому развитию эрозивного варианта ГЭРБ, пищевода Баррета и ухудшает результаты антисекреторной терапии [43, 44]. Свой вклад в снижение эффективности антисекреторной терапии вносит и нарушение клиренса пищевода от повреждающих компонентов рефлюктата, приводящее к удлинению времени негативного влияния рефлюкса на пищевод. Этому способствует нарушение опорожнения желудка и увеличение числа преходящих расслаблений нижнего пищеводного сфинктера [45]. Антисекреторная терапия не ликвидирует патологические рефлюксы, не способствует повышению тонуса нижнего пищеводного сфинктера, не влияет на моторику и перистальтику пищевода и желудка, а следовательно, клиренс пищевода [46]. Все это обусловливает необходимость включения в лечение ряда больных, наряду с ИПП, прокинетиков и препаратов УДХК [5, 47].
Прокинетики способствуют улучшению эвакуации пищи из желудка, повышению тонуса нижнего пищеводного сфинктера, нормализации пищеводного клиренса. Для купирования симптоматики ГЭРБ, особенно при «перекресте» с функциональной диспепсией, на этапе основной и поддерживающей терапии, наряду с ИПП, оправдано применение итоприда по 50 мг 3 раза в день перед едой. Препарат обладает широким профилем прокинетического действия на верхние отделы желудочно-кишечного тракта и высоким профилем безопасности, в т.ч. при полиморбидности и полипрагмазии [5, 48–51].
Коррекция агрессивного действия дуоденального содержимого на слизистую оболочку пищевода осуществляется с помощью УДХК, которая модифицирует состав желчных кислот, вытесняя токсичные вещества из общего пула, способствуя их выведению в кишечник и ингибируя всасывание липофильных желчных кислот. Основанием для включения УДХК в основной курс лечения пациентов ГЭРБ является наличие симптома горечи во рту, указание на сопутствующую билиарную патологию (вне стадии обострения) или перенесенную холецистэктомию, а также обнаружение дуоденогастрального рефлюкса при проведении эндоскопического исследования и/или признаков слабокислого или щелочного рефлюкса при проведении суточной пищеводной рН-метрии. Для коррекции билиарного рефлюкса УДХК применяется в небольших дозах – по 250–300 мг/сут однократно вечером на срок от 1 до 3 мес. Эффективность УДХК синергично усиливается при комбинации с прокинетиком и ИПП [52].
Таким образом, основным направлением современной терапии пациентов с ГЭРБ является применение высокоэффективных антисекреторных препаратов, к каким относятся ИПП. Лечение пациентов должно проводиться длительно и включать, наряду с основным курсом, один из вариантов поддерживающей терапии. Неэффективность антисекреторной терапии служит основанием для углубленного обследования пациента и тщательного анализа терапевтической стратегии. Индивидуализация терапевтических мероприятий должна предусматривать имеющиеся у пациента сопутствующие заболевания и проводимое по их поводу лечение.



