Так называемая 4П-медицина – это медицина будущего, которая начинается сегодня. Распространение абсолютно новой модели здравоохранения предполагает использование четырех основополагающих принципов: PREDICT (прогнозирование), PREVENT (предотвращение), PERSONALIZE (персонализация), PARTICIPATE (участие) [1, 2].
4П-медицина – это не отдельный раздел медицины, это идеология, основанная на индивидуальном подходе к пациенту, «пациент-ориентированное здравоохранение». Основной целью ее служит доклиническое выявление заболеваний, разработка комплекса профилактических мер и рациональное использование лекарственных средств терапии. Cовременная медицина в традиционном ее понимании имеет дело с проявлениями болезни (впервые возникшими или хроническими), в то время как 4П-медицина направлена на выявление факторов риска и предрасположенности к возникновению заболеваний, разработке способов их предотвращения.
Реализация основополагающих принципов 4П-медицины возможна благодаря научным открытиям в сфере биоинформатики, транскриптомики, генетики и ряде других дисциплин. Внедрение высокоактивных лекарственных средств в широкую медицинскую практику для лечения онкологических, ревматических, гастроэнтерологических, дерматологических и других заболеваний предполагает изучение и оценку не только локальных (органных) проявлений болезни. Внимание врача должно быть направлено на функциональные молекулярные и клеточные сдвиги, которые позволяют оценить физиологические и клеточные процессы в ответ на лечение, определить степень риска прогрессирования, развития ремиссии, возникновения побочных эффектов, разработать комплекс профилактических мер, направленных на предупреждение осложнений заболеваний [3–7].
Создание многочисленных баз данных по молекулярной биологии, биохимии, структурам белков, хранилищ первичных структур ДНК (EMBL – European Molecular Biology Laboratory, GenBank, DDBJ – DNA Data Base of Japan, SWISS-PROT и др.) позволяют анализировать транскриптомные данные конкретного пациента. Такой анализ является основой для создания индивидуальных стратегий профилактики и лечения (персонализация), позволяет подбирать лекарственные средства и профилактические мероприятия с невероятной точностью, своевременно вносить коррективы в план лечения, минимизировать возникновение неблагоприятных реакций. Персонализация – основа новой концепции здравоохранения. В рамках ее реализации огромное внимание уделяется созданию и распространению генетического паспорта пациента [8–10].
Обладая знаниями об индивидуальных особенностях генома человека, можно создать прогноз здоровья, выделить факторы риска, определить степень вероятности развития того или иного заболевания не только у взрослого пациента, но и у эмбриона (предикция). Так, диагностика хромосомных аномалий позволяет обнаружить более 98% плодов с синдромом Дауна и более 40% сердечных аномалий.
Превентивность – следующий этап после определения факторов риска. Его суть состоит либо в полном предотвращении, либо в снижении риска развития заболевания. Возможно, это самый главный принцип всей концепции, так как 4П-медицину часто называют превентивной медициной. Составленные на основе генетического анализа прогнозы позволяют разработать комплекс профилактических мер, а персонализированный подход позволяет сделать его наиболее эффективным. Одним из наиболее распространенных примеров реализации данного принципа является профилактическая мастэктомия, популярная на Западе, но еще не получившая распространения в нашей стране. Риск развития рака молочной железы в данном случае определяется на основе опасных мутаций в генах BRCA1 и BRCA2. При выявлении подобных мутаций перед пациентом встает выбор – профилактическое удаление яичников и молочной железы либо регулярные осмотры.
Совместное принятие решения, вовлеченность пациента в процесс лечения – партисипативность, партнерство, участие пациента и врача необходимо для реализации всей концепции. Мотивированный пациент делает осознанный выбор (как в случае с мастэктомией) и принимает на себя ответственность за свое здоровье, осознанно участвует в программах профилактики и лечения. Популяризация здорового образа жизни, информированность о рисках, исходах и возможностях – именно это является основой для реализации всей концепции 4П-медицины на практике. Развитие этой модели, несомненно, приоритет для мировой системы здравоохранения.
Рациональное и безопасное использование лекарственных средств терапии было, есть и будет в центре внимания производителей, регуляторов и потребителей лекарственных препаратов. Внедрение новейших технологий при создании молекул лекарственного средства и его форм (лекарственных препаратов), проведение доклинических и клинических исследований (испытаний) направлены на создание «идеального лекарства». Государственное регулирование, законодательные и исполнительные органы (федеральные, региональные, муниципальные) несут ответственность за экспертизу, регистрацию лекарственных средств (лекарственных препаратов), обеспечивают контроль качества и производства, изготовление, хранение, транспортировку, реализацию и уничтожение лекарственных средств (препаратов). «Потребители» лекарственных средств (препаратов) – это аптеки, лечебные учреждения, медицинские работники, которые закупают, реализуют, рекомендуют и назначают лекарственные средства (препараты), а также пациенты, которые самостоятельно или по назначению врача приобретают и используют их с целью профилактики, лечения, диагностики различных заболеваний.
Безопасность лекарственных средств (препаратов) – характеристика, основанная на анализе эффективности в сопоставлении с риском причинения вреда здоровью пациента. Именно оценка «польза–риск», управление рисками лежит в основе глобальной системы мониторинга безопасности лекарственных препаратов. Выбор стратегии эффективной оценки «польза–риск», оценка профиля безопасности лекарственного препарата является актуальной проблемой Фармаконадзора [11].
Использование огромного числа лекарственных средств, внедрение в медицинскую практику большого числа препаратов, обладающих высокой биологической активностью, сенсибилизация населения к биологическим и химическим веществам, нерациональное использование лекарств, медицинские ошибки при назначении терапии, применение некачественных препаратов – это неполный перечень вопросов и проблем, которые находятся в сфере интересов Фармаконадзора. Совершенствование и гармонизация системы безопасности лекарственных препаратов, надлежащая фармакоэпидемиологическая практика представляют особый интерес. Это не только серьезные медицинские, но и социально-экономические проблемы, решение которых согласуется с реализаций принципов 4П-медицины [12].
Прогнозирование нежелательных явлений на примере НПВП
Нестероидные противовоспалительные препараты (НПВП) – наглядный пример того, какие успехи достигнуты в свете прогнозирования и предотвращения побочных эффектов, выбора препаратов с учетом многих параметров, обеспечивающих эффективность, пример того, как решается проблема «польза–риск» и прежде всего гастротоксичности этих средств в клинической практике, как обеспечивается персонализированный подход.
НПВП – универсальные лекарственные средства, созданные для устранения воспаления и боли. Они используются врачами всех специальностей более 100 лет и остаются актуальными до настоящего времени. НПВП представлены различными классами химических соединений, отличающихся друг от друга механизмом действия, фармакокинетическими и фармакодинамическими характеристиками. Способность НПВП оказывать одновременно анальгетическое, противовоспалительное и жаропонижающее действия, общедоступность самостоятельного (безрецептурного) приобретения позволила этим препаратам занять лидирующие позиции при выборе средств для купирования боли. НПВП рассматриваются не только как препараты «первой линии» для симптоматического лечения, но и как средства патогенетической терапии при многих ревматических заболеваниях (анкилозирующий спондилит), воспалительных заболеваниях мягких тканей, остром приступе подагры и др. Эффективность НПВП не вызывает сомнений и доказана в многочисленных масштабных контролируемых клинических исследованиях, отвечающих самым высоким требованиям доказательной медицины. Накоплен длительный опыт применения этих препаратов в клинической практике. Установлено, что все НПВП в адекватных терапевтических дозах сопоставимы по эффективности, но могут отличаться по показателям безопасности. Они имеют ряд преимуществ по сравнению с другими анальгетиками, в частности с наркотическими анальгетиками при лечении хронической боли. НПВП не угнетают дыхательный центр, не вызывают эйфории и лекарственной зависимости, не обладают спазмогенным действием.
Многолетнее тщательное изучение НПВП позволило выделить главный и общий для всех этих препаратов механизм действия – угнетение синтеза простагландинов (ПГ) из арахидоновой кислоты путем ингибирования фермента циклооксигеназы (ПГ-синтетазы). ПГ служат медиаторами воспалительной реакции: вызывают локальное расширение сосудов, отек, экссудацию, миграцию лейкоцитов и другие эффекты (в основном ПГ-Е2 и ПГ-I2), сенсибилизируют рецепторы к медиаторам боли (гистамину, брадикинину) и механическим воздействиям, понижая порог болевой чувствительности, повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (интерлейкин-1 и др.), образующихся в организме под влиянием микробов, вирусов, токсинов (главным образом ПГ-Е2).
К настоящему времени общеизвестно, что существуют как минимум два изофермента циклооксигеназы (ЦОГ), которые ингибируются НПВП. Один из них – ЦОГ-1 – контролирует выработку ПГ, отвечающих за целостность слизистой оболочки желудочно-кишечного тракта (ЖКТ), функцию тромбоцитов и почечный кровоток. Другой изофермент – ЦОГ-2 – участвует в синтезе ПГ при воспалении. Причем ЦОГ-2 в нормальных условиях отсутствует, а образуется под действием некоторых тканевых факторов, инициирующих воспалительную реакцию (цитокины и др.). В связи с этим предполагается, что противовоспалительное действие НПВП обусловлено ингибированием ЦОГ-2, а их побочные эффекты – ингибированием ЦОГ-1.
Помимо ингибирования ЦОГ, противовоспалительное действие НПВП может быть связано с торможением перекисного окисления липидов, стабилизацией мембран лизосом (оба этих механизма предупреждают повреждение клеточных структур), уменьшением образования АТФ (снижается энергообеспечение воспалительной реакции), торможением агрегации нейтрофилов (нарушается высвобождение из них медиаторов воспаления), торможением продукции ревматоидного фактора у больных ревматоидным артритом. Анальгезирующее действие в определенной степени связано с нарушением проведения болевых импульсов в спинном мозге. Кроме того, в последние годы широко обсуждается способность НПВП, наряду со снижением экспрессии ЦОГ-2, снижать синтез интерлейкина-6, концентрацию фактора некроза опухоли α, подавлять активность металлопротеиназ, фосфодиэстеразы IV, стимулировать синтез протеогликанов. С экспрессией ЦОГ-2 и гиперпродукцией ПГ связано образование ядерного фактора транскрипции NF-κB, ответственного, в свою очередь, за стимуляцию синтеза оксида азота и активацию остеокластов [13, 14].
Клиническими проявлениями «ожидаемых» побочных эффектов, индуцированных приемом НПВП, являются поражение ЖКТ, нарушение агрегации тромбоцитов, функции почек, негативное влияние на сердечно-сосудистую систему и систему кровообращения.
О поражении ЖКТ стало известно более 60 лет назад. В нашей стране о «Влиянии некоторых противоревматических средств на слизистую оболочку желудка» было сообщено В.Х. Василенко и соавт. в 1971 г. в журнале «Клиническая медицина» [15]. Позже, в 1987 г., S. Roth предложил термин «НПВП-гастропатии» для описания патологии слизистой оболочки верхних отделов ЖКТ, возникающей на фоне приема НПВП (эрозии, язвы, кровотечения). В настоящее время под НПВП-гастропатиями следует понимать явления дистрофии и нарушения регенерации, возможно, с деструкцией клеток, некрозом, образованием эрозий и язв, в том числе осложненных кровотечением (геморрагические гастропатии), выявляемые при гастроскопии [16].
Установлено, что самостоятельный и часто бесконтрольный прием НПВП сопровождается высокой частотой возникновения гастродуоденальных язв и эрозий. Жалобы на гастралгии, дискомфорт в области эпигастрия, изжогу и другое типичны для пациентов, получающих НПВП. Опасность НПВП-гастропатий определяется не столько клиническими проявлениями (болевой и диспепсический синдромы), тем более что до половины случаев протекают бессимптомно, сколько тяжелыми, нередко фатальными осложнениями, такими как желудочно-кишечное кровотечение, обструкция и перфорация слизистой желудка. Частота осложнений у пациентов, использующих НПВП, оценивается как 0,5–1,0 случай на 100 больных в течение года; это примерно в 4 раза чаще, чем в общей популяции. При этом больные, регулярно получавшие эти препараты, погибают вследствие осложнений со стороны ЖКТ в 2–3 раза чаще, чем лица, не получавшие каких-либо препаратов этой группы [16–19]. Анализ публикаций, посвященных НПВП-гастропатиям, свидетельствует, что за 10 лет (с 1997 по 2008 г.) смертность от кровотечений и перфорации при язвенной болезни снизилась с 11,6 до 7,4%, но среди больных, получавших ацетилсалициловую кислоту и НПВП, смертность от кровотечений и перфорации возросла с 14,7 до 20,9% [20]. В Москве 34,6% случаев госпитализаций с диагнозом «острое желудочно-кишечное кровотечение» связаны с приемом НПВП [20].
Патогенез специфического синдрома НПВП-гастродуоденопатии связан как с локальным повреждением слизистой оболочки желудка органическими кислотами, которые входят в состав большинства НПВП, так и ингибированием изофермента ЦОГ-1 в результате системного действия препаратов. Условно поражение слизистой оболочки желудка протекает в 3 стадии: 1) торможение синтеза ПГ в слизистой оболочке; 2) уменьшение выработки защитной слизи и бикарбонатов на фоне снижения синтеза ПГ; 3) появление эрозий и язв, которые могут осложняться кровотечением или перфорацией [16, 21]. Гастротоксичность не зависит от способа введения препаратов (парентерально, перорально, per rectum). Повреждение чаще локализуется в желудке, преимущественно в антральном или препилорическом отделах. Клинические симптомы почти у 60% больных, особенно пожилых, могут отсутствовать, поэтому диагноз во многих случаях устанавливают при эзофагогастродуоденоскопии (ЭГДС). В то же время у многих пациентов с характерными жалобами повреждения слизистой оболочки не выявляются. Отсутствие клинической симптоматики при НПВП-гастродуоденопатии связывают с анальгезирующим действием препаратов. Поэтому больные, особенно пожилого возраста, у которых при длительном приеме НПВП отмечаются побочные эффекты со стороны ЖКТ, рассматриваются как группа повышенного риска развития серьезных осложнений (кровотечение, тяжелая анемия) и требуют особо тщательного контроля, который включает эндоскопическое исследование. При сборе анамнеза и выборе НПВП пациентам, нуждающимся в длительном приеме препарата, необходимо выяснить, есть ли жалобы на функцию органов ЖКТ, была ли у них язва желудка или двенадцатиперстной кишки, когда проводилась ЭГДС, какие лекарственные препараты для снижения боли они принимают [16].
В качестве факторов риска гастротоксичности рассматривают Helicobacter pylori (HP), женский пол, пожилой возраст (старше 65 лет), курение, злоупотребление алкоголем, семейный язвенный анамнез, наличие в анамнезе указаний на перенесенную язву, осложненную перфорацией или кровотечением, сопутствующие тяжелые сердечно-сосудистые заболевания, сопутствующий прием глюкокортикоидов, иммуносупрессантов, антикоагулянтов, длительную терапию НПВП, большие дозы или одновременный прием двух или более НПВП [16].
На основании анализа литературы и многолетнего опыта использования НПВП были разработаны общие принципы лечения скелетно-мышечной боли [22]. Учитывая современные данные, полученные в ходе хорошо организованных эпидемиологических, клинических исследований, их метаанализов, а также данные масштабных популяционных исследований, имеющих высокий уровень доказательности на основе консенсуса, были предложены клинические рекомендации по рациональному использованию НПВП, поддержанные Ассоциацией ревматологов России, Российской гастроэнтерологической ассоциацией, Российским обществом по изучению боли и др. [16, 23].
Принципы предотвращения побочных эффектов НПВП
Можно говорить о том, что выделение факторов риска НПВП-гастропатий (табл. 1), в зависимости от степени тяжести (низкий, умеренный, высокий), создание алгоритма по рациональному использованию и назначению определенных НПВП с учетом степени риска, является большим шагом по пути 4П-медицины. Предложения конкретных мероприятий по мониторингу безопасности при длительном применении НПВП, а именно проведение ЭГДС по показаниям или 1 раз в 12 мес, оценка жалоб и выявление признаков желудочно-кишечных кровотечений (кал черного цвета, рвота «кофейной гущей», тахикардия, гипотония и др.) на каждом визите пациента не реже 1 раза в 3 мес, также соответствуют этой идеологии. Принцип оценки «польза–риск» и указания на необходимость профилактического приема гастропротекторов (ингибиторов протонной помпы, ребамипида), эрадикация НР – важный этап в профилактике и снижении НПВП-гастропатий.

При низком риске НПВП-гастропатий возможно назначение любых НПВП, а при наличии умеренного риска целесообразно использовать селективные препараты (при отсутствии противопоказаний со стороны сердечно-сосудистой системы) или неселективные средства в сочетании с ингибиторами протонной помпы (ИПП). При высоком риске НПВП-гастропатий рекомендуется использование селективных НПВП в сочетании с ИПП, при очень высоком риске следует избегать применения любых НПВП [16, 23].
Снизить вероятность развития НПВП-гастропатии можно двумя способами: используя более безопасные препараты этого класса или применяя их комбинации с «гастропротекторами» – средствами, снижающими негативное влияние НПВП на слизистую оболочку ЖКТ. Эффективное снижение частоты НПВП-гастропатий доказано для синтетического аналога ПГЕ1 мизопростола, высоких доз Н2-блокаторов, ИПП и относительно нового гастроэнтеропротектора ребамипида.
Мизопростол – первый из гастропротекторов, специально созданный для профилактики и лечения НПВП-гастропатий. В настоящее время практически не используется из-за высокой частоты встречаемости НР, что снижало его терапевтический потенциал и неудобную схему применения. Единственный представитель группы Н2-блокаторов – фамотидин. В настоящее время он рассматривается как «гастропротектор» и имеет убедительную доказательную базу эффективности [23–25].
Получены убедительные доказательства, что ИПП существенно превосходят по эффективности Н2-блокаторы, значительно лучше переносятся пациентами и имеют более удобный режим дозирования [24, 25]. Для достижения антисекреторного эффекта, как правило, требуется небольшая доза препарата. Применяют любой ИПП в стандартной дозировке (омепразол 20 мг, пантопразол 40 мг и др.), прием осуществляется однократно утром за 30–60 минут до еды. Сочетание НПВП и Н2-блокатора при профилактике НПВП-гастропатий значительно уступает комбинации НПВП+ИПП и практически не применяется в клинической практике в настоящее время.
Установлено, что ИПП могут предотвратить НПВП-гастропатии, в патогенезе которых большое значение имеет кислотно-пептический фактор. Однако негативное влияние НПВП распространяется на все отделы ЖКТ, включая тонкую и толстую кишку, сопровождается повышением проницаемости слизистой оболочки кишки с транслокацией микробов и развитием хронического воспаления. Основным проявлением НПВП-энтеропатии выступает постепенно развивающаяся железодефицитная анемия [25]. ИПП не эффективны в отношении этой патологии. Более того, вызывая определенные нарушения микробного равновесия кишечной флоры, ИПП могут способствовать развитию НПВП-энтеропатии [26]. При оценке длительного применения ИПП по критерию «польза–риск» следует иметь в виду возникновение НР, ограничивающих использование этих препаратов, особенно у пациентов пожилого возраста с коморбидными заболеваниями [16, 27]. Так, их прием ассоциируется с определенным повышением частоты развития кишечных инфекций, внебольничной пневмонии, негативным влиянием на функцию почек, нарушение всасывания магния, что сопровождается повышением риска развития аритмий, изменением метаболизма некоторых лекарств, в частности клопидогрела и метотрексата. Кроме того, в последние годы обсуждается вопрос о возможном негативном влиянии длительного (многолетнего) приема ИПП на прогрессирование постменопаузального остеопороза и повышение риска возникновения переломов [28, 29]. С другой стороны, их высокая эффективность для предупреждения угрожающих жизни ЖКТ-осложнений вполне компенсирует относительно невысокий риск возможных побочных эффектов, вызываемых самими ИПП.
В арсенале гастропротекторов появилось новое лекарственное средство ребамипид, способное предупреждать возникновение НПВП-гастропатий, не уступающее мизопростолу по эффективности, но превосходящее его по безопасности [28, 30, 31]. Препарат обладает оригинальным механизмом действия, связанным с комплексным цитопротективным эффектом, в том числе повышением синтеза эндогенных ПГ в слизистой оболочке ЖКТ. Ребамипид обладает противовоспалительным действием, стимулирует образование α-дифензинов (естественных антибиотиков) клетками Панета, подавляя развитие кишечного воспаления [32]. В клинических испытаниях подтверждено протективное действие препарата в отношении НПВП-энтеропатий [33, 34].
Важным направлением повышения профиля безопасности, удовлетворяющим оценке «польза–риск», является разработка и внедрение новых НПВП, известных в англоязычной литературе как ингибирующие ЦОГ доноры NO – CINODs (cyclooxygenase inhibiting NO-donating drugs) или (NO-НПВП) [16, 28, 29]. Они являются производными обычных НПВП, которые были изменены путем добавления к ним молекулы NO. Окись азота (NO) является одним из важнейших «передатчиков» биологических сигналов, участвует в регуляции агрегации тромбоцитов и миграции нейтрофильных гранулоцитов через сосудистую стенку, расслаблении гладкомышечных клеток интимы сосудов, неоангиогенезе, неонейрогенезе и др. В слизистой оболочке ЖКТ NO выполняет защитную функцию, усиливая кровоток, репарацию эпителиоцитов, препятствуя развитию воспаления (во многом благодаря подавлению хемотаксиса нейтрофилов) и блокируя свободно-радикальные процессы. Основное количество этой субстанции образуется при участии i-NOS, экспрессируемой в ответ на повреждение эпителиальных клеток, вызванное различными факторами агрессии, такими как НР, НПВП и соляная кислота [35, 36].
Гипотеза о гастропротекторной роли NO стала основой для создания новой группы препаратов. Наиболее известным из них является напроксиноид — молекула напроксена, к которой присоединена группа NO (NO-naproxen). Разработчики препарата надеялись на существенное повышение как желудочно-кишечной, так и кардиоваскулярной безопасности. К большому сожалению, эти надежды в полной мере не оправдались: результаты клинических испытаний не продемонстрировали явного преимущества напроксиноида, и он так и не вошел в реальную клиническую практику [28, 29].
Эффекты NO и механизм действия с участием капсаициновых рецепторов легли в основу создания другого NO-ассоциированного НПВП — амтолметин гуацила. Препарат получен с помощью комбинированной методики химического синтеза в результате восстановления толметина аминокислотой (глицином) и гваяколом с присоединением ванилиновой группы (в отличие от напроксиноида, когда к напроксену была добавлена молекула NO). Наличие ванилиновой группы в молекуле АМГ привело к существенному изменению фармакологических свойств и появлению гастропротекторной активности, которые подтверждены в ходе рандомизированных клинических испытаний со снижением частоты желудочно-кишечных осложнений. Однако имеется недостаточно крупных рандомизированных клинических испытаний, свидетельствующих о безопасности препарата [37].
 Высоким профилем безопасности обладают гастропротекторы, в состав которых входит S-метилметионинсульфония хлорид (Гастрарекс) – витаминоподобное вещество (витамин U), активированная форма незаменимой аминокислоты – метионина, необходимого для синтеза всех белковых соединений, активации секреторной функции желудка, защиты и восстановления клеток слизистой оболочки желудка и кишечника. Метилметионинсульфония хлорид, благодаря способности отдавать свои метильные группы, необходимые для процессов синтеза, и влиянию на холиновый обмен, стимулирует выработку муцина клетками слизистой оболочки ЖКТ, что способствует повышению ее защитной функции от агрессивных факторов внутренней и внешней среды, защищает ЖКТ от воздействия этанола и его производных, активизирует процессы восстановления клеток слизистой оболочки желудка и кишечника, непосредственно стимулируя процесс регенерации клеток желудка и двенадцатиперстной кишки [38–43]. Гастрарекс обладает антиоксидантной активностью, задерживая процессы перекисного окисления липидов [38, 44–47], способностью нормализовать кислотность и уменьшать дискомфорт в верхних отделах ЖКТ. Гастрарекс метилирует гистамин, превращая его в неактивную форму. Переход гистамина в неактивную форму – метилгистамин, ведет к уменьшению секреции соляной кислоты и снижает вероятность повреждения клеток желудка и кишечника. Вследствие этого уменьшаются типичные желудочно-кишечные нарушения: тяжесть в животе, изжога, вздутие живота и нарушения моторики кишечника [38, 40–42]. При недостаточной секреции соляной кислоты Гастрарекс стимулирует ее выработку. Препарат обладает липотропным действием, оказывает защитное действие на клетки печени. Исследования показали, что он снижает уровни общего холестерина и липидов низкой плотности (вредного холестерина) в крови [48–51], стабилизирует проницаемость клеточных мембран, препятствует замещению тканей печени жировой тканью, улучшает углеводный, белковый и липидный обмены в печени (табл.3).
Высоким профилем безопасности обладают гастропротекторы, в состав которых входит S-метилметионинсульфония хлорид (Гастрарекс) – витаминоподобное вещество (витамин U), активированная форма незаменимой аминокислоты – метионина, необходимого для синтеза всех белковых соединений, активации секреторной функции желудка, защиты и восстановления клеток слизистой оболочки желудка и кишечника. Метилметионинсульфония хлорид, благодаря способности отдавать свои метильные группы, необходимые для процессов синтеза, и влиянию на холиновый обмен, стимулирует выработку муцина клетками слизистой оболочки ЖКТ, что способствует повышению ее защитной функции от агрессивных факторов внутренней и внешней среды, защищает ЖКТ от воздействия этанола и его производных, активизирует процессы восстановления клеток слизистой оболочки желудка и кишечника, непосредственно стимулируя процесс регенерации клеток желудка и двенадцатиперстной кишки [38–43]. Гастрарекс обладает антиоксидантной активностью, задерживая процессы перекисного окисления липидов [38, 44–47], способностью нормализовать кислотность и уменьшать дискомфорт в верхних отделах ЖКТ. Гастрарекс метилирует гистамин, превращая его в неактивную форму. Переход гистамина в неактивную форму – метилгистамин, ведет к уменьшению секреции соляной кислоты и снижает вероятность повреждения клеток желудка и кишечника. Вследствие этого уменьшаются типичные желудочно-кишечные нарушения: тяжесть в животе, изжога, вздутие живота и нарушения моторики кишечника [38, 40–42]. При недостаточной секреции соляной кислоты Гастрарекс стимулирует ее выработку. Препарат обладает липотропным действием, оказывает защитное действие на клетки печени. Исследования показали, что он снижает уровни общего холестерина и липидов низкой плотности (вредного холестерина) в крови [48–51], стабилизирует проницаемость клеточных мембран, препятствует замещению тканей печени жировой тканью, улучшает углеводный, белковый и липидный обмены в печени (табл.3).
Возможно применение препарата Гастрарекс при НПВП-гастропатиях. Рекомендуется взрослым принимать по 1 капсуле в сутки во время еды. Продолжительность приема – 1 мес. При необходимости прием можно повторить через месяц. Гастрарекс противопоказан пациентам с индивидуальной непереносимостью компонентов продукта, беременным и кормящим матерям.
На основе вышеизложенного и с учетом рекомендаций по рациональному использованию НПВП в табл. 2 систематизированы основные гастропротективные препараты, которые применяются для лечения и профилактики НПВП-гастропатий с учетом их преимуществ и недостатков.
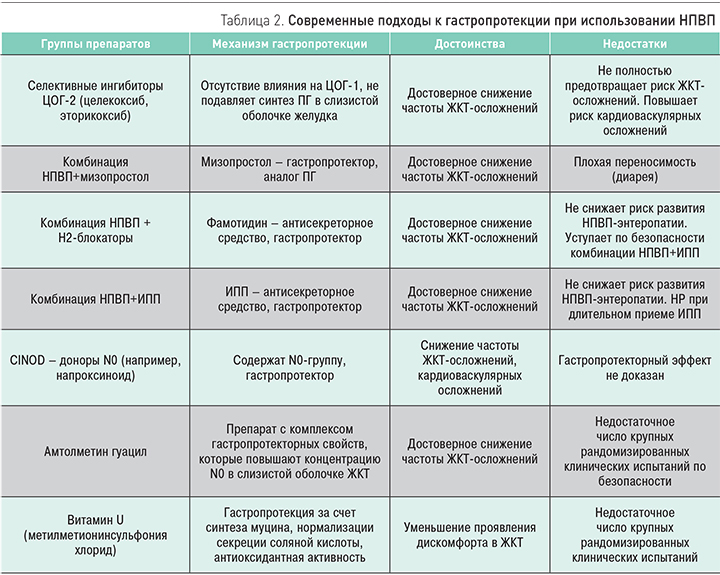
Специалисты утверждают, что популяционная частота ЖКТ-осложнений (катастроф) снизилась. Однако проблема НПВП-гастропатии не решена, и одна из основных причин этого – самостоятельный бесконтрольный прием препаратов, недостаточная приверженность больных при использовании гастропротективной терапии. Обращает на себя внимание то, что больные, имеющие факторы риска ЖКТ-осложнений, регулярно используют НПВП, но не принимают назначенные гастропротекторы. Анализируя причины этого, было установлено, что прием гастропротекторов связывают с определенным неудобством прием двух таблеток вместо одной, увеличением стоимости лечения, отсутствием мотивации в том случае, когда длительный прием НПВП не сопровождается какими-либо неприятными симптомами. Нерегулярный прием гастропротекторов объясняется забывчивостью (преимущественно пациентов пожилого возраста). J. Goldstein и соавт. оценили приверженность гастропротективной терапии в когорте из 144 203 больных ревматическими заболеваниями, принимавших НПВП. ИПП или Н2-блокаторы были рекомендованы 1,8% больных в связи с серьезным риском ЖКТ-осложнений. Однако треть пациентов (32%) использовали гастропротекторы нерегулярно или не использовали вообще. В результате риск ЖКТ-кровотечений у лиц, не придерживавшихся гастропротективной терапии, был в 2,5 раза выше по сравнению с теми больными, которые выполняли назначение врача [52].
Следует особо отметить, что значение и роль пациентов, их «партисипативность» (партнерство, участие) в реализации модели 4П-медицина чрезвычайно велика. Консолидация усилий пациентского сообщества, «производителей» лекарственных средств (совершенствование НПВП, гастропротекторов), регуляторов, обеспечивающих контроль выдачи НПВП (при наличии рецепта) и медицинского сообщества, должно быть направлено на дальнейшее совершенствование и реализацию PREDICT (прогнозирование), PREVENT (предотвращение), PERSONALIZE (персонализация), PARTICIPATE (участие). Выделение фенотипов и субтипов лиц с высоким риском НПВП-гастропатий и ЖКТ-осложнений, неэффективностью или непереносимостью НПВП или гастропротекторов, создание генетического паспорта, достижения в биологии, биохимии, фармакоэпидемиологии, фармакогенетике, биоинформатике, транскриптомике позволят осуществить персонализированный подход к выбору лекарственного средства и профилактических мероприятий с невероятной точностью, своевременно внести коррективы в план лечения, минимизировать возникновение побочных эффектов. Важной составляющей этих мероприятий является использование безопасных препаратов многопланового действия, восполняющих дефицит витаминов, улучшающих метаболизм НПВП.



