ВВЕДЕНИЕ
Цирроз печени (ЦП) является значимой проблемой медицины во всем мире. Moon A.M. et al. (2020) проанализировали обновленные данные центров по контролю заболеваний и исследования глобального бремени болезней относительно заболеваемости и смертности от хронических заболеваний печени, в том числе ЦП. По оценкам, этими заболеваниями во всем мире страдают 1,5 млрд человек, что на 13% больше, чем в 2000 г. Ежегодно примерно 1 млн смертей происходит из-за осложнений ЦП, что делает его 11-й по частоте причиной смерти в мире, даже несмотря на активную трансплантацию печени в развитых странах [1].
Своевременную диагностику ЦП усложняет скудная клиническая картина на ранней стадии заболевания, ее многообразие на стадии декомпенсации заболевания, а также возможное сочетанное воздействие нескольких этиологических факторов [2]. Прогрессирование ЦП может быть обусловлено как продолжающимся воздействием этиологических факторов, так и генетическими особенностями пациента с хроническим диффузным заболеванием печени [3].
Особое значение в прогрессировании поражения печени при циррозе играют эндотелиальная дисфункция, оксидативный стресс, воспаление. Они стимулируют фиброз и неоангиогенез с прогрессирующим нарушением сосудистой архитектоники печени и развитие синдрома портальной гипертензии, от осложнений которого часто погибают больные [4]. При ЦП по сравнению с хроническим гепатитом усиливается выработка регуляторных молекул, в том числе провоспалительных цитокинов; это связано с воздействием эндогенных токсинов на печень и селезенку и проникновением белковых бактериальных антигенов из кишечника через портосистемные шунты на фоне портальной гипертензии [5]. За счет эндогенной интоксикации на фоне уменьшения количества активно функционирующих гепатоцитов у больных с ЦП возрастает эндотелиальная дисфункция, проявляющаяся, помимо прочего, активной выработкой васкулоэндотелиального фактора роста, который активирует неоангиогенез и выработку грубой соединительной ткани в печени [6]. Известно, что хронические заболевания печени имеют разную скорость прогрессирования при прочих равных условиях, что связано с предрасположенностью к заболеванию. Это важный момент для определения прогноза развития ЦП у конкретных больных [7].
В рамках современной предиктивной персонализированной медицины перспективной областью является оценка роли генетических факторов при мультифакториальных заболеваниях, включая хронические гепатиты и ЦП. Одним из путей идентификации генов предрасположенности к ЦП, независимо от этиологии заболевания, является метод геномного сканирования (полногеномный скрининг аллельных ассоциаций). Примером такого анализа может служить исследование, проведенное в США в 2007 г., результатом которого было определение 7 полиморфизмов кандидатных генов – предикторов риска развития ЦП на фоне хронического гепатита [8]. Данный метод ориентирован на выявление общих маркеров с частотой аллелей (MAF) выше 5%, хотя вполне вероятно, что анализ низкочастотных (от 0,5 до 5%) и редких (<0,5%) вариантов сможет объяснить дополнительные риски заболеваний или изменчивость признаков.
Один из способов улучшить обнаружение истинных генетических ассоциаций – уменьшить количество гипотез, подлежащих проверке, путем группирования SNP [9]. Еще один подход – исследование однонуклеотидных полиомрфимов (ОНП) генов патогенетически значимых молекул при заболеваниях печени. Учитывая роль цитокинов в формировании иммуновоспалительного ответа и механизмах преобразования коллагена в печени, а также возможное влияние на уровень продукции цитокинов при локализации полиморфизма в регуляторной части гена, изучение генетических маркеров патогенетически значимых молекул при ЦП является важной прогностической задачей [10]. При этом данные литературы по исследованию полиморфизма генов цитокинов при ЦП часто противоречивы, что может быть обусловлено этническими, популяционными и региональными особенностями пациентов, а также методами оценки генетических маркеров [9].
Целью данной работы стало определение у больных ЦП в Пермском крае сывороточных концентраций провоспалительных цитокинов – фактора некроза опухоли-альфа (TNF-α), интерлейкина 6 (IL-6) и васкулоэндотелиального фактора роста (VEGF), а также полиморфизма их генов: TNF-α в регионе -308G/A (rs1800629), IL-6 в регионе -174G/С (rs1800795) и VEGFA в регионе -634G/C (rs2010963).
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 46 пациентов (24 мужчины и 22 женщины) с ЦП вирусной (HCV) и алкогольной этиологии. Объединение разных по этиологии циррозов обусловлено тем, что прогрессирование хронических диффузных заболеваний печени, независимо от этиологического фактора, имеет общий патогенез, а скорость развития ЦП связана с генетическими факторами. Обследование проводили на базе ГБУЗ ПК «Городская клиническая больница № 2 им. Федора Христофоровича Граля» г. Перми. Возраст больных составил 52,1±8,2 года. Диагноз ЦП устанавливался в соответствии с Европейскими рекомендациями (2011); больным был определен класс тяжести заболевания В по классификации Child–Pugh.
Группа контроля состояла из 80 практически здоровых доноров, сопоставимых по полу и возрасту с основной группой.
Исследование выполнялось в соответствии с Хельсинской декларацией, у всех пациентов было получено информированное согласие.
Пациентам проводилось лабораторное обследование, включавшее стандартные общеклинические тесты, биохимические показатели функционального состояния печени, определение маркеров вирусных гепатитов методом иммуноферментного анализа (ИФА). При опросе использовались шкалы GAGE и AUDIT [11]. Учитывая количество участников в основной (пациенты с ЦП) и в контрольной группах, дизайн исследования был разработан по типу «случай–контроль».
Определение сывороточных концентраций ФНО-α, ИЛ-6 и VEGF осуществлялось методом ИФА с использованием наборов производства ЗАО «Вектор-Бест» (г. Новосибирск) на фотометре Stat-Fax 2100 (США).
Варианты ОНП генов TNF-α -308G/A, IL-6 -174С/G и VEGFA -634G/C изучались с помощью аллель-специфической полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) на детектирующем амплификаторе CFХ-96 (Bio-RadLaboratories, Inc., США) с применением праймеров «SNP-Скрин» (ЗАО «Синтол», г. Москва).
Статистическая обработка данных выполнялась в программе STATISTICA 7.0. Количественные параметры представлены в виде медианы и интерквартильного интервала (25–75%). Статистическая значимость различий независимых выборок оценивалась критерием Манна–Уитни. Соотношения частот генотипов и аллелей исследуемых полиморфизмов генов описывалось с применением метода χ2 и определением отношения шансов (ОШ, OR). Взаимосвязь количественных признаков определялась по коэффициенту корреляции Спирмена (r), между качественными признаками с использованием коэффициента сопряженности Пирсона (Ki). Различия между выборками считались достоверными при значении р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В обследованной группе пациентов с ЦП концентрации TNF-α, IL-6 и VEGF в сыворотке крови были значимо выше, чем в группе контроля (p=0,0001, p=0,0001 и р=0,01 соответственно; табл. 1).
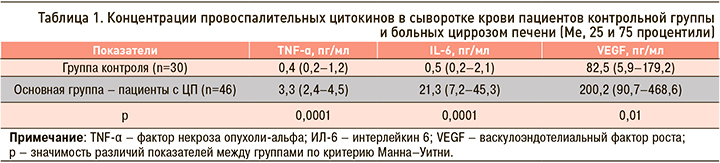
Полученные данные о повышении выработки провоспалительных цитокинов у пациентов с ЦП согласуются с результатами других исследователей [12–14]. В ранее проведенных исследованиях достоверных различий в концентрации цитокинов при вирусном и алкогольном поражении печени у больных выявлено не было, однако их продукция возрастала при увеличении класса тяжести ЦП [5].
Кратность повышения по медиане для TNF-α составила 8 раз, для IL-6 – 42 раза, VEGF увеличился в 2,4 раза. Повышение уровня цитокинов, особенно IL-6, в крови больных ЦП свидетельствует о выраженном воспалительном синдроме. При этом концентрация TNF-α достоверно коррелировала с IL-6 (r=0,51; p=0,001). Интересен также факт взаимосвязи уровней провоспалительных цитокинов с клиническими синдромами при ЦП: TNF-α был достоверно связан с гепатомегалией, которая служит косвенным свидетельством увеличения печени вследствие воспалительной инфильтрации. Выработка IL-6 демонстрировала взаимосвязь с признаками тяжести поражения печени: синдромами портальной энцефалопатии, гепатоцеллюлярной недостаточности и гепатомегалией. Иными словами, в целом IL-6 демонстрировал более высокую значимость в патогенезе ЦП.
Повышенные значения VEGF в сыворотке крови пациентов с ЦП подтверждают наличие дисфункции эндотелия при этой патологии. Положительная корреляция IL-6 с VEGF (r=0,35; p=0,03) говорит о взаимосвязи воспаления и повреждения эндотелия при ЦП.
Таким образом, высокие концентрации цитокинов TNF-α, IL-6 и VEGF отражают степень активации воспалительного ответа и повреждения эндотелия с перестройкой сосудистой архитектоники печени, что вносит свой вклад в развитие портальной гипертензии при ЦП. В ряде исследований также была установлена роль иммунновоспалительных механизмов в прогрессировании ЦП разной этиологии [12–15].
Оценивая полиморфизм гена TNF-А в регионе -308G/A (rs1800629), мы выявили, что доминантный генотип GG в группе больных ЦП встречался в 34,8% случаев, тогда как в когорте доноров значимо чаще – в 53,8% (χ2=4,22; р=0,04). При этом генотипы GA и AA в популяции пациентов с ЦП регистрировались в 58,7 и 6,5% случаев соответственно, что было значимо выше, чем в контроле, где аналогичные показатели составили 43,8% (χ2=4,76,37; р=0,04) и 2,5% (χ2=3,78; р=0,06; табл. 2).
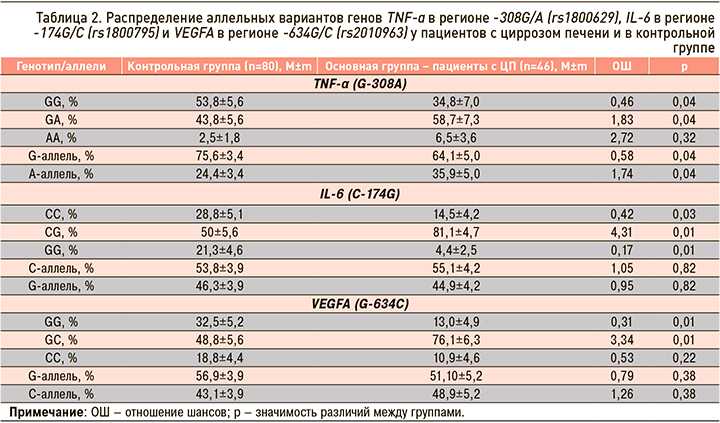
В некоторых работах была показана взаимосвязь аллеля A гена TNF-α с риском развития фиброза печени [16]. А.Г. Скуратов с соавт. (2017) в своем исследовании выявили увеличение частоты встречаемости варианта GA полиморфизма TNF-α (G-308A) у пациентов с тяжелой стадией ЦП [17]. Возможно носительство аллеля A гена TNF-α (G-308A) значимо в плане генетической предрасположенности к развитию ЦП.
При исследовании полиморфизма гена IL-6 в регионе -174С/G (rs1800795) значимых различий в частоте встречаемости аллелей С и G в исследуемых группах найдено не было (р=0,82). Протективная гомозигота СС чаще регистрировалась в группе доноров, чем у больных ЦП – 28,8 против 14,5% (χ2=16,87; р=0,03), тогда как генотип СG достоверно чаще встречался у пациентов с ЦП 81,2 против 50% в контроле (χ2=16,87; р=0,01; см. табл. 2). Данные литературы по полиморфизму этого гена достаточно противоречивы. Некоторыми авторами найдена корреляция между наличием полиморфизма -174 G/C IL-6 и тяжестью повреждения печени с развитием ЦП и даже гепатоцеллюлярной карциномой [15, 18]. В других исследованиях не было получено такой ассоциации [16].
По нашим данным, риск развития ЦП может быть связан с носительством генотипа СG гена IL-6 -174С/G. Генотип GG маркера VEGFA (G-634C) преобладал в когорте доноров – 32,5 против 13,0% в группе пациентов с ЦП (χ2=9,21; р=0,01). Гетерозигота GС достоверно чаще встречалась у больных с ЦП, чем в группе здоровых – 76,1 против 48,8% (χ2=9,21; р=0,01; см. табл. 2). Можно предположить, что предиктором развития ЦП является генотип GС в локусе гена VEGFA (G-634C). В наших предыдущих исследованиях была показана его значимость при хронизации вирусных заболеваний печени [2]. Следовательно, риск развития ЦП ассоциирован с носительством аллеля A гена TNF-α -308G/A, генотипа СG гена IL-6 -174С/G и генотипа СС гена VEGFA -634G/C.
Оценка зависимости качественных признаков выявила ассоциацию маркера VEGFA в локусе G-634C с увеличением выработки TNF-α (Ki=0,619; р=0,04). Это может вызывать запуск более выраженного неоангиогенеза на фоне воспаления и стимулировать выработку грубой соединительной ткани, что, в свою очередь, ведет к прогрессированию поражения печени в группе носителей данной мутации.
ЗАКЛЮЧЕНИЕ
Повышение сывороточных концентраций цитокинов TNF-α, IL-6 и VEGF у пациентов с ЦП отражает степень активации механизмов воспаления и повреждения эндотелия, вызывающих активацию неоангиогенеза и фиброза в патогенезе поражения печени на стадии ЦП.
Исследование ОНП патогенетически значимых генов цитокинов показало значимо большую, чем в контрольной группе, частоту встречаемости среди больных с ЦП минорного аллеля A гена TNF-α -308G/A, генотипа СG гена IL-6 -174С/G и генотипа СС гена VEGFA -634G/C. Это позволяет отнести их к возможным генетическим предикторам развития и прогрессирования ЦП при воздействии этиологичесого фактора в виде вирусного или алкогольного поражения печени.
Ассоциация полиморфизма гена VEGFA в локусе G-634C с гиперпродукцией провоспалительного цитокина TNF-α (Ki=0,619; р=0,04) может приводить к активации механизмов воспаления в печени и прогрессирования заболевания у носителей неблагоприятного генотипа.



