В последние десятилетия в мире отмечается быстрый рост заболеваемости подагрой. Среди основных предрасполагающих факторов к развитию этого заболевания рассматривают изменение характера питания и связанное с этим возрастание количества пациентов, имеющих избыточную массу тела и ожирение, увеличение потребления алкогольных напитков, гиподинамию, артериальную гипертензию (АГ), нарушение углеводного обмена и др.
Сывороточный уровень мочевой кислоты, превышающий 360 мкмоль/л (6 мг/дл), приводит к 4-кратному увеличению риска развития подагры у мужчин и 17-кратному – у женщин (Барскова, 2007, Zhang, 2005). Было показано, что стойкая гиперурикемия способствует развитию эндотелиальной дисфункции и проявлению нестабильности имеющихся атеросклеротических бляшек, оказывает прогипертензивное и провоспалительное действие [1–3]. По результатам исследования Worksite Treatment Program, включавшего 8690 пациентов, было выявлено, что повышение уровня мочевой кислоты на 1 мг/дл (59,5 мкмоль/л) сопровождается увеличением риска развития АГ на 13%, сердечно-сосудистых осложнений – на 32%. С повышением уровня мочевой кислоты риск смерти от ишемической болезни сердца (ИБС) возрастал на 77% у мужчин и на 300% у женщин. В исследовании New York Study (7978 пациентов) гиперурикемия у больных АГ повышала риск сосудистых осложнений в 1,53 раза, что превышало таковой показатель для курения и ожирения.
Ведущая причина смерти у больных подагрой – кардиоваскулярная патология, обусловленная атеросклеротическим повреждением сосудистой стенки. Связь между повышенным уровнем мочевой кислоты и риском сердечно-сосудистых заболеваний установлена в крупных эпидемиологических исследованиях [4].
Несмотря на хорошо изученные механизмы развития и особенности клинической картины заболевания, проблема ранней диагностики подагры по-прежнему остается актуальной. По данным В.Г. Барсковой с соавт. (2004), подагра в течение первого года болезни диагностируется только у 25% больных, в остальных же 75% случаев диагноз был поставлен в среднем лишь на 7-й год болезни. В настоящее время эта тенденция сохраняется: результаты анализа за 2009–2013 гг. 148 случаев первичного обращения в НИИ ревматологии им. В.А. Насоновой показал, что подагра диагностировалась в среднем через 4,6 года от начала заболевания [5].
Наиболее вероятными причинами поздней диагностики многие авторы считают большое число врачебных ошибок, частота которых составляет от 30 до 68%. К этому приводит незнание общепринятых рекомендаций и классификационных критериев подагры. Нередко пациенты длительное время не направляются на консультацию к ревматологу или наблюдаются под маской других ревматических заболеваний, что неизбежно приводит к повышению частоты хронических форм заболевания. Современный уровень знаний о подагре и возможности современной медицины позволяют утверждать, что нет объективных причин для поздней диагностики этой болезни [5–9].
Подагра, как и многие другие ревматические заболевания, часто служит причиной инвалидности у лиц трудоспособного возраста. Повсеместно возрастающая заболеваемость подагрой, ранняя инвалидизация, снижение качества жизни, высокая летальность от сопутствующих кардиоваскулярных осложнений диктуют необходимость повышения осведомленности врачей первичного звена здравоохранения по вопросам ранней диагностики подагры.
В соответствии с Порядком оказания медицинской помощи взрослому населению по профилю «ревматология» (утвержденной приказом Минздрава России от 12.11.2012 № 900н) первичная врачебная медико-санитарная помощь больным подагрой оказывается врачом-терапевтом участковым, врачом общей практики (семейным врачом) по рекомендации врача-ревматолога [10]. В реальности же участковый терапевт, врач общей практики (семейный врач) становится первым, с кем контактирует больной.
25 декабря 2018 г. был подписан Федеральный закон (ФЗ) «О внесении изменений в статью 40 Федерального закона “Об обязательном медицинском страховании в Российской Федерации” и Федеральный закон “Об основах охраны здоровья граждан в Российской Федерации” по вопросам клинических рекомендаций». В соответствии с этим документом клинические рекомендации, опубликованные в рубрикаторе на сайте Минздрава России, обязательны к исполнению.
В связи с этим целью нашего исследования стала оценка готовности врачей первичного звена к обязательному соблюдению клинических рекомендаций по диагностике и лечению подагры.
МАТЕРИАЛ И МЕТОДЫ
Проведено анонимное анкетирование 100 врачей общей практики и участковых терапевтов Чувашской Республики (94 женщины и 6 мужчин), из которых 65 работают в городах республики и 35 – в сельской местности. Стаж работы врачей в среднем составил 18,9±11,9 года (от 1 года до 38 лет). 38% опрошенных не имели квалификационной категории.
Специально разработанная анонимная анкета включала вопросы о принципах ранней диагностики и курации пациентов с подагрой на амбулаторно-поликлиническом этапе.
Результаты анкетирования представлены в виде абсолютных и относительных величин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Большинство (72%) респондентов констатировало, что количество пациентов с подагрой на их приеме невелико (не более 1 пациента в неделю), в среднем в месяц врачи курируют до 4 больных, причем чаще всего это больные с хроническим подагрическим артритом. Возможно, что острый подагрический артрит не диагностируется или проходит под маской других заболеваний.
Как оказалось, в диагностике острого подагрического артрита врачи более всего ориентированы на типичную клиническую картину: это острая суставная атака с быстрым развитием выраженной боли и воспаления, достигающая максимума в течение 24 ч, особенно сопровождающаяся эритемой. По мнению опрошенных, для постановки диагноза наибольшее значение имеет локализация артрита – одностороннее поражение плюснефалангового сустава 1-го пальца стопы. На этот признак указали 75% врачей. А между тем специфичность данного признака составляет 77% [11]. Только четверть опрошенных врачей указали на другую возможную локализацию артрита в дебюте заболевания, подчеркнув, что это может быть артрит коленного, голеностопного суставов или плюснефаланговых суставов 2–4-го пальцев стопы.
13% врачей отметили, что вероятность диагноза подагры повышает указание в анамнезе на «более чем одну атаку острого артрита».
В клинической практике врачи стремятся выявлять факторы риска подагры и сопутствующих заболеваний. 82% опрошенных специалистов среди факторов, способствующих развитию подагры, указывают на злоупотребление алкоголем (особенно пива), ожирение, избыточное потребление богатых пуринами продуктов животного происхождения, сахаро(фруктозо)содержащих безалкогольных напитков, АГ, гиперлипидемию, малоподвижный образ жизни, длительный прием диуретиков. Это соответствует данным клинических рекомендаций [11].
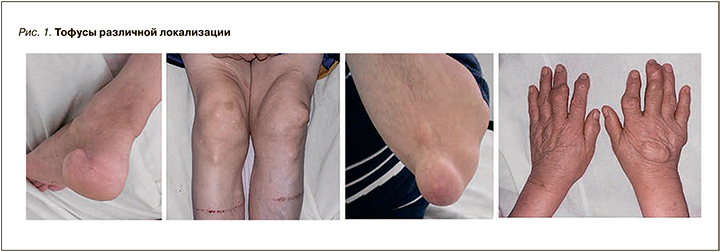
При проведении физикального обследования все врачи указывают на необходимость визуальной оценки наличия артрита, пальпации пораженного сустава, но только четверть респондентов (24%) отдельно осматривают места возможной локализации подкожных тофусов (наиболее часто это ушные раковины, разгибательная поверхность локтевых суставов, тыльная поверхность кистей и/или стоп). Необходимость и целесообразность такого осмотра подчеркивается в клинических рекомендациях [11].
Следует помнить, что в некоторых случаях подкожные тофусы могут быть первым клиническим проявлением заболевания, но чаще всего они относятся к поздним симптомам подагры и формируются в среднем через 7–10 лет от дебюта заболевания [16]. Ряд врачей затруднился указать потенциальную продолжительность периода формирования тофусов от момента дебюта подагры в отсутствие уратоснижающей терапии. На рисунке 1 представлены тофусы различной локализации.
Опрошенные врачи оказались единодушны во мнении, что у всех пациентов с подозрением на подагру необходимо определять сывороточный уровень мочевой кислоты. Однако 72% респондентов считают, что гиперурикемия может рассматриваться как самостоятельный и единственный признак, позволяющий диагностировать подагру. Это утверждение противоречит клиническим рекомендациям. Следует помнить, что, хотя стойкая гиперурикемия и рассматривается как облигатный фактор риска развития подагры, однако повышенный сывороточный уровень мочевой кислоты не является фактором исключения или подтверждения подагры. То есть бессимптомная гиперурикемия не может приравниваться к подагре [11]. У многих людей с гиперурикемией не развивается подагры, а во время острого приступа подагрического артрита содержание мочевой кислоты нередко находится в пределах референсных значений [11]. Оценку сывороточного уровня мочевой кислоты рекомендуется проводить в межприступный период (по истечении не менее 4 нед после начала острой атаки артрита) и, если это возможно, в отсутствие уратоснижающей терапии.
В настоящее время под гиперурикемией принято считать повышение сывороточного уровня мочевой кислоты более 360 мкмоль/л или 6 мг/дл (Барскова, 2007, Zhang, 2005). Каждый четвертый (26%) из опрошенных врачей затруднился правильно указать нормальные значения мочевой кислоты в сыворотке крови.
На вопрос о «золотом стандарте» в диагностике подагры только каждый пятый врач ответил, что это выявление кристаллов моноуратов натрия в синовиальной жидкости методом поляризационной микроскопии. В научной литературе и клинических рекомендациях подчеркивается, что специфичность метода поляризационной микроскопии для демонстрации кристаллов крайне высока (близка к 100%) и именно это позволяет считать его «золотым стандартом». Остальные же врачи присвоили этот статус повышению уровня мочевой кислоты в крови (48%), типичным рентгенологическим изменениям, выявляемым при хроническом подагрическом артрите (17%), артриту 1-го плюснефалангового сустава (9%), обнаружению тофусов (6%).
В клинических рекомендациях отмечено, что при невозможности исследования синовиальной жидкости методом поляризационной микроскопии необходимо ультразвуковое исследование суставов, при котором выявляются типичные признаки подагры. Этот доступный неинвазивный метод может быть использован и для ранней диагностики подагры, в том числе на преклинической стадии (у части пациентов типичные признаки могут выявляться раньше манифестации острого приступа артрита) [11]. Этот вид исследования не используется практикующими врачами (не был указан ни в одной анкете).
Классификационные критерии острого подагрического артрита разработаны Американской ассоциацией ревматологов и одобрены Всемирной организацией здравоохранения для использования в клинической практике. Как показало проведенное анкетирование, с ними знакомо менее 10% опрошенных врачей, хотя основная часть респондентов перечислило в разной совокупности почти все из этих критериев.
Большинство терапевтов регулярно контролирует уровень мочевой кислоты у больных подагрой, но при этом называет различную кратность: от «1 раза в неделю» (2%), «при каждом посещении» (2%), «1 раз в квартал» (48%) до «2 раз в год» (48%). Согласно клиническим рекомендациям, сывороточный уровень мочевой кислоты следует определять не менее 2 раз в год [11].
Для купирования острого подагрического или обострения хронического артрита 95% опрошенных назначают нестероидные противовоспалительные препараты (НПВП). 5% врачей осведомлены о возможности применения для этой цели колхицина, однако в своей практике «ни разу его не назначали». В тройку наиболее популярных НПВП для купирования острой подагрической атаки вошли нимесулид (31%), диклофенак (22%) и мелоксикам (22%). Значительно реже врачи назначают лорноксикам (12%), декскетопрофен (4%), индометацин (4%) и ацеклофенак (3%). 5% опрошенных указали в своей анкете кеторолак и 3% – парацетамол. Следует помнить, что назначение анальгетиков в острый период болезни принято считать терапевтической ошибкой, поскольку они не эффективны для купирования иммунного воспаления [7].
Половина (49%) опрошенных врачей считает необходимым применять локальные формы НПВП в острый период заболевания. Эта рекомендация также расценивается как терапевтическая ошибка, поскольку продемонстрирована неэффективность накожных форм НПВП при системном воспалении [7].
Хорошо известно, что проведение физиотерапии (любой, кроме криотерапии) при остром подагрическом артрите часто приводит к ухудшению состояния, однако 11% респондентов сочли возможным использовать различные физиотерапевтические процедуры (магнитотерапию, электрофорез, диадинамические токи) для купирования приступа.
Практически каждый третий врач (31%) в своей анкете указал на возможность назначения аллопуринола в острый период болезни. В настоящее время этот постулат также принято считать ошибкой, поскольку подобная терапевтическая тактика ведет к утяжелению артрита и формированию негативного отношения пациента к данному препарату. На подобную ошибку указывают и другие исследователи [6–9]. В частности, по данным М.В. Карнаковай с соавт., ретроспективная оценка 132 амбулаторных карт больных подагрой показала, что аллопуринол в острый период болезни назначался в 21% случаев [8, 9]. При анкетировании 50 участковых терапевтов Иркутска М.В. Скляновой и А.Н. Калягиным было выявлено, что 56% врачей считают возможным назначение этого лекарственного средства до купирования острого подагрического артрита [6].
Большинство опрошенных (97%) в качестве препарата первой линии в лечении межприступной подагры назвало именно аллопуринол, 3% – фебуксостат. Согласно клиническим рекомендациям, аллопуринол рассматривается как препарат первой линии для длительного лечения больных с хронической подагрой при нормальной функции почек. Назначение селективного ингибитора ксантиноксидазы фебуксостата показано в случае развития нежелательных неблагоприятных реакций, связанных с применением аллопуринола, недостаточного снижения сывороточного уровня мочевой кислоты, а также при снижении функции почек (препарат метаболизируется в печени, и почечный путь экскреции не является для него основным) [11, 12]. При этом в плане влияния на уровень мочевой кислоты эффективность фебуксостата влиянию превышает таковую у аллопуринола. Так, в трех крупных рандомизированных клинических исследованиях с участием более 4 000 больных подагрой фебуксостат в суточных дозах 80 и 120 мг существенно превосходил по уратснижающему эффекту аллопуринол в дозе 300 мг/сут. [13–15]. Этот момент может быть немаловажен в связи с тем, что, согласно ряду зарубежных исследований, многие пациенты не достигают целевого уровня мочевой кислоты при приеме аллопуринола в дозировке ≤300 мг в день. У больных подагрой со сниженной функцией почек фебуксостат чаще, чем аллопуринол, позволяет достигать целевого уровня мочевой кислоты [11].
Длительность уратоснижающей терапии врачи определили в диапазоне от 2 мес (1%) до пожизненного применения (22%). 17% опрошенных ограничивают срок терапии аллопуринолом временем достижения нормоурикемии. На недопустимость подобного терапевтического решения указала В.Г. Барскова, отнеся подагру к метаболическим заболеваниям, которая стоит в одном ряду с АГ и сахарным диабетом. Через 3–4 дня после отмены аллопуринола уровень мочевой кислоты вновь поднимается, и при этом возрастает риск развития артрита [7].
Максимальные суточные дозы препарата, применяемые терапевтами, тоже находятся в весьма широком диапазоне: от 100 (1%) до 900 мг (3%). Большинство врачей остановились на дозе 365,9±170,8 мг/сут.
Также возникли затруднения при ответе на вопрос о «целевом» уровне мочевой кислоты на фоне уратоснижающей терапии, хотя этот показатель относится к критериям оценки качества оказания медицинской помощи на амбулаторном этапе. Уровень менее 360 мкмоль/л назвали 49% опрошенных, при этом отсчет начинался с 200 мкмоль/л. В клинических рекомендациях отмечено, что необходимо достичь и затем поддерживать уровень мочевой кислоты ниже точки супернасыщения сыворотки уратами (<360 мкмоль/л) [11].
Все врачи единодушны во мнении о подагре как о противопоказании к применению диуретиков. По современным представлениям, больным подагрой мочегонные препараты должны назначаться только по жизненным показаниям [11]. В качестве альтернативы врачи указывают на применение таких групп антигипертензивных препаратов, как антагонисты рецепторов к ангиотензину II, ингибиторы АПФ, блокаторы медленных кальциевых каналов, в редких случаях – бета-адреноблокаторы. 10% врачей в своей анкете указали на лозартан и амлодипин как на препараты с умеренным урикозурическим действием.
В ряде исследований была показана уникальная особенность лозартана – способность вызывать урикозурию и гипоурикемию за счет уменьшения постсекреторной реабсорбции мочевой кислоты в почках. Это свойство в дальнейшем отражено в многочисленных публикациях (Кобалава Ж.Д., 1997, 2003, 2011; Ильина А.Е. и соавт., 2008; Недогода С.В и соавт., 2012, 2014 и др.) [17].
При этом обращает на себя внимание, что каждый десятый (11%) из опрошенных к препаратам, не рекомендованным к назначению больным хронической подагрой, отнесли блокаторы медленных кальциевых каналов и ингибиторы АПФ.
ЗАКЛЮЧЕНИЕ
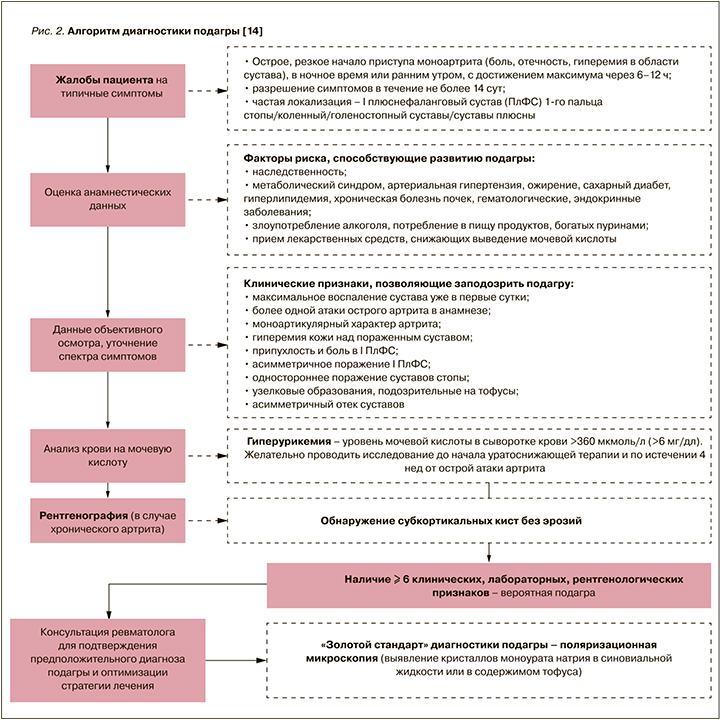
Таким образом, результаты проведенного анкетирования подтверждают данные литературы о низкой осведомленности врачей первичного звена о диагностике и, что весьма печально, лечении подагры. Позволим еще раз процитировать алгоритм диагностики подагры для врачей амбулаторной практики (рис. 2), опубликованный в приложении к журналу «Терапия», который послужит подспорьем для врача первичного контакта в повседневной деятельности [18].



