ВВЕДЕНИЕ
Повышенный уровень холестерина липопротеидов низкой плотности (ХС-ЛПНП) в плазме крови, наряду с артериальной гипертензией и курением, является основным модифицируемым фактором риска развития сердечно-сосудистых заболеваний (ССЗ) [1]. Кроме того, как показано в популяциях с низким уровнем ХС-ЛПНП, курение и гипертония не являются значимыми для развития атеросклероза, они лишь способствуют модификации ЛПНП и усиленному проникновению ЛПНП в сосудистую стенку. Исчерпывающие доказательства причинной роли гиперхолестеринемии в развитие атеросклеротических заболеваний получены в ходе многочисленных исследований: проспективных наблюдательных, исследований полногеномного анализа ассоциаций, а также исследований с применением менделевской рандомизации. Они также свидетельствуют, что снижение уровня ХС-ЛПНП, достигнутое с использованием гиполипидемической терапии (ГЛТ), приводит к снижению частоты значимых атеросклеротических сердечно-сосудистых событий и уменьшению смертности [2]. Поэтому коррекция ХС-ЛПНП лежит в основе клинических рекомендаций по профилактике и лечению ССЗ [1]. Однако в реальной клинической практике, несмотря на наличие в арсенале врачей эффективных и безопасных гиполипидемических препаратов, проблема эффективного лечения гиперхолестеринемии часто остается неразрешенной. Этот факт подтверждают исследования по оценке эффективности ГЛТ в разных странах, в т. ч. и в России. Целевых уровней ХС-ЛПНП, по данным этих исследований, достигают в среднем от 7 до 15% пациентов очень высокого риска и от 15 до 30% пациентов высокого риска [3-7]. Основными причинами недостижения целевых значений ХС-ЛПНП у этих больных являются: исходно высокий уровень ХС-ЛПНП и невозможность назначения адекватных доз гиполипидемических препаратов, в первую очередь статинов, при их индивидуальной непереносимости [3, 6]. Показано, что исходно-высокие значения ХС-ЛПНП у пациентов часто обусловлены наследственными формами дислипидемий, прежде всего семейной гиперхолестеринемией (СГХС) [8].
СГХС – наследственное аутосомно-доминантное нарушение метаболизма липопротеинов, характеризующееся высоким содержанием в плазме крови ЛПНП, наличием кожных и сухожильных ксантом и высоким риском раннего развития ишемической болезни сердца (ИБС). Гетерозиготная форма СГХС считается одним из самых частых наследственных заболеваний с частотой 1 на 200 в открытой популяции [8, 9]. При этом, по данным исследования EUROASPIRE IV, у больных ИБС СГХС встречается в разных странах Европы с частотой от 3,5 до 20,8% (в РФ - 13,8%) [10]. А по данным регистра больных с гетерозиготной формой СГХС 4-х липидных клиник Российской Федерации, ИБС определяется у 58,4% этих пациентов. У больных с СГХС и наличием ИБС до начала лечения средний уровень ХС-ЛПНП составлял 8,33±2,74 ммоль/л [11]. Для достижения целевого уровня ХС-ЛПНП <1,8 ммоль/л таким пациентам требуется снижение уровня ХС-ЛПНП на 80% и более от исходного, что невозможно даже при использовании комбинированной терапии (статин + эзетимиб) [8, 12, 13]. Поэтому уровень ХС-ЛПНП <1,8 достигается только у 6,6% пациентов с СГХС и ИБС [11].
Второй группой являются пациенты с непереносимостью статинов. Наиболее серьезным нежелательным явлением, связанным с их приемом, является миопатия, которая может прогрессировать до развития рабдомиолиза, почечной недостаточности и смерти в особо тяжелых случаях. Основным маркером разрушения и гибели клеток скелетной мускулатуры является повышение в крови уровня креатинфосфокиназы (КФК). Так же возможно возникновение мышечных болей или мышечной слабости без подъема уровня КФК – развитие миалгии. Непереносимость статинов может встречаться у 5-10% пациентов с ИБС, и достижение у этих больных целевых значений ХС-ЛПНП затруднено, т. к. монотерапия эзетимибом позволяет снижать уровень ХС-ЛПНП только на 15-20% от исходного [8].
В настоящее время стало возможным использование для коррекции гиперхолестеринемии нового гиполипидемического средства - эволокумаба. Ранее при проведении клинических исследований было показано, что у пациентов с первичной гиперлипидемией и смешанной дислипидемией присоединение эволокумаба к ГЛТ статином и/или эзетимибом позволяет дополнительно снижать уровень ХС-ЛПНП на 50-70% и достигать целевой уровень ХС-ЛПНП <1,8 ммоль/л у более чем 90% пациентов высокого риска, у 67% больных с СГХС и у 46% пациентов с непереносимостью статинов [14-16]. И что еще более важно, при снижении ХС-ЛПНП также достоверно уменьшается риск серьезных сердечно-сосудистых событий, таких как инфаркт миокарда и инсульт [17]. Цель настоящего обзора - представить информацию для практикующих врачей по вопросам эффективности и безопасности применения ингибитора PCSK9 – эволокумаба среди различных групп пациентов.
ПРОПРОТЕИНОВАЯ КОНВЕРТАЗА СУБТИЛИЗИН-КЕКСИНОВОГО ТИПА 9 (PCSK9)
Белок PCSK9 относится к семейству сериновых протеаз, циркулирует в кровотоке и участвует в регуляции обмена липопротеинов плазмы крови. PCSK9 непосредственно участвует в деградации рецепторов ЛПНП (рЛПНП), рецепторов липопротеинов очень низкой плотности рецепторов аполипопротеина Е 2 типа [18]. Механизм регуляции количества рЛПНП выглядит следующим образом. После взаимодействия рЛПНП с частицей ЛПНП, образовавшийся комплекс интернализуется в гепатоцит в составе эндосомы. После закисления эндосомы происходит диссоциация данного комплекса и свободные рЛПНП возвращаются на поверхность гепатоцита, где повторно могут связываться с ЛПНП, и цикл будет повторяться, а эндосомы сливаются с лизосомами, где и происходит распад ЛПНП. В то же время, показано, что свободная PCSK9, циркулируя в кровотоке, может связываться с комплексом рЛПНП-ЛПНП и в дальнейшем нарушать процесс диссоциации рЛПНП, что приводит к разрушению рЛПНП в лизосоме. В конечном итоге, повышенное содержание в крови PCSK9 приводит к возрастанию уровня ХС-ЛПНП за счет снижения числа рЛПНП на поверхности гепатоцита [19]. Уровень PCSK9 в крови зависит в основном от генетических особенностей пациента, однако показано увеличение плазменных уровней PCSK9 на 14-47% на фоне терапии статинами. Этот механизм объясняет снижение эффективности статинов при длительном приеме [20, 21]. В то же время, ингибирование PCSK9 ведет к повышению количества рЛПНП и снижению уровня ХС-ЛПНП, что может использоваться в лечении гиперхолестеринемии. Также в эпидемиологических исследованиях было показано снижение риска развития ИБС и других атеросклеротических заболеваний у лиц с низкими уровнями PCSK9 [22].
МЕХАНИЗМ ДЕЙСТВИЯ ЭВОЛОКУМАБА И ЕГО ЭФФЕКТЫ
Эволокумаб является полностью человеческим моноклональным иммуноглобулином G2, ингибирующим PCSK9. Эволокумаб селективно и с высокой степенью аффинности связывается с PCSK9 и ингибирует связывание циркулирующей PCSK9 с рЛПНП на поверхности гепатоцитов, предотвращая PCSK9-опосредованое разрушение рЛПНП в лизосомах, что приводит к увеличению числа рЛПНП на поверхности гепатоцитов и к снижению сывороточной концентрации ХС-ЛПНП [23].
В силу своих фармакокинетических особенностей эволокумаб вводиться в виде подкожных инъекций 1 или 2 раза в месяц в зависимости от дозы. Однократное подкожное введение 140 или 420 мг эволокумаба приводит к максимальному падению уровня цикрулирующей несвязанной PCSK9 через 4 часа, что сопровождается снижением содержания ХC-ЛПНП, достигающим среднего минимума к 14 и 21 дню соответственно. Изменения концентрации несвязанной PCSK9 и сывороточных липопротеинов обратимы после отмены эволокумаба. Не отмечено компенсаторного увеличения продукции PCSK9 и ХС-ЛПНП во время лечения, равно как и после выведения эволокумаба не отмечено повышение концентраций несвязанной PCSK9 или ХС-ЛПНП (т. е. отсутствует синдром рикошета). При режиме дозирования 140 мг эволокумаба каждые 2 недели или 420 мг 1 раз в месяц максимальное снижение ХС-ЛПНП составляло от -57 до -72% от исходных значений по сравнению с плацебо. Режимы дозирования были эквивалентны в отношении среднего снижения содержания ХС-ЛПНП (на неделях 10 и 12) [23]. Аналогичное снижение уровня ХC-ЛПНП наблюдалось при применении эволокумаба в монотерапии и в составе комбинированной ГЛТ. Внешние и внутренние факторы, такие как демографические характеристики, одновременно применяемая терапия, вариабельность лабораторных показателей и статус заболевания, не влияют на ответ на терапию эволокумабом [14-17, 23].
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ЭВОЛОКУМАБА
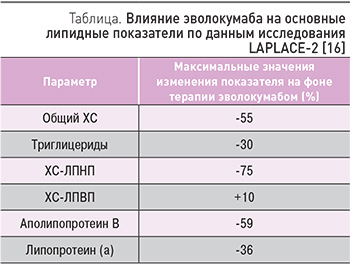 Эволокумаб был изучен в обширной программе клинических исследований - PROFICIO, которая включала более 35 тыс. пациентов. Было показано, что у пациентов с первичной гиперлипидемией и смешанной дислипидемией эволокумаб снижает концентрации несвязанной PCSK9, ХС-ЛПНП, общего ХС, аполипопротеина B, ХС липопротеинов очень низкой плотности, триглицеридов и липопротеина (a) и повышает концентрации ХС липопротеинов высокой плотности (ХС-ЛАВП) и аполипопротеина A1 (табл.). Кроме того, у больных ИБС при длительном лечении эволокумабом отмечается регресс атеросклеротических бляшек коронарных артерий и снижается риск развития сердечно-сосудистых осложнений (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализация по поводу нестабильной стенокардии или коронарной реваскуляризации) [14-17, 24]. Несколько исследований из программы PROFICIO более подробно описаны ниже. Это исследования FOURIER, RUTHERFORD-2 и GAUSS-3.
Эволокумаб был изучен в обширной программе клинических исследований - PROFICIO, которая включала более 35 тыс. пациентов. Было показано, что у пациентов с первичной гиперлипидемией и смешанной дислипидемией эволокумаб снижает концентрации несвязанной PCSK9, ХС-ЛПНП, общего ХС, аполипопротеина B, ХС липопротеинов очень низкой плотности, триглицеридов и липопротеина (a) и повышает концентрации ХС липопротеинов высокой плотности (ХС-ЛАВП) и аполипопротеина A1 (табл.). Кроме того, у больных ИБС при длительном лечении эволокумабом отмечается регресс атеросклеротических бляшек коронарных артерий и снижается риск развития сердечно-сосудистых осложнений (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализация по поводу нестабильной стенокардии или коронарной реваскуляризации) [14-17, 24]. Несколько исследований из программы PROFICIO более подробно описаны ниже. Это исследования FOURIER, RUTHERFORD-2 и GAUSS-3.
Исследование FOURIER
В исследовании III фазы FOURIER (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование по оценке исходов) было включено 27 564 пациента с ССЗ и исходным уровнем ХС-ЛПНП >1,8 ммоль/л на фоне приема ГЛТ. Пациенты были рандомизированы в группы эволокумаба (140 мг 2 раза в месяц или 420 мг 1 раз в месяц; n=13 784) или плацебо (n=13 780). Средний срок наблюдения составил 2,2 года. Среднее снижение уровня ХС-ЛПНП в группе эволокумаба по сравнению с группой плацебо составило 59% (р <0,001). У 87% пациентов из группы эволокумаба удалось снизить уровень ХС-ЛПНП до значений <1,8 ммоль/л, а у 42% – <0,65 ммоль/л. Это снижение привело к снижению на 15% частоты достижения первичной конечной точки (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, госпитализация по поводу нестабильной стенокардии или коронарной реваскуляризации) в группе эволокумаба (относительный риск = 0,85; 95% доверительный интервал 0,79–0,92) по сравнению с плацебо. При этом степень снижения риска в группе лечения со временем увеличивалась: если в первый год она составляла 12%, то в последующем достигала 19%. Частота достижения вторичных конечных точек (сердечно-сосудистая смерть, инфаркт, инсульт) в группе эволокумаба снизилась на 20% по сравнению с плацебо (ОР=0,8; 95% ДИ 0,73–0,88), причем с течением времени наблюдалось увеличение степени снижения риска с 16% в первый год до 25% в последующее время [17].
Исследование RUTHERFORD-2
В исследовании III фазы RUTHERFORD-2 (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование длительностью 12 недель) у 331 пациента с гетерозиготной формой СГХС, имевших концентрацию ХС-ЛПНП ≥2,6 ммоль/л, изучалась эффективность и безопасность эволокумаба, вводимого 1 раз в 2 недели (в дозе 140 мг) или 1 раз в месяц (в дозе 420 мг) на фоне интенсивной ГЛТ, которая включала в себя не только прием статинов, но и их комбинацию с другими гиполипидемическими средствами (эзетемиб, ионообменные смолы, станолы или ниацин). Было показано, что ингибирование PCSK9 эволокумабом в обеих дозировках приводило к сопоставимому и быстрому снижению уровня ХС-ЛПНП на 60% по сравнению с плацебо. Целевые уровни ХС-ЛПНП (<1,8 ммоль/л) на фоне терапии эволокумабом были достигнуты у 67% пациентов против 2% в группе плацебо [23].
Исследование GAUSS-3
В исследовании GAUSS-3 (рандомизированное, двойное слепое, многоцентровое исследование с плацебо- и активным контролем (эзетимибом) длительностью 24 недели) у 511 пациентов с гиперхолестеринемией и доказанной непереносимостью ≥2 статинов изучалась эффективность и безопасность эволокумаба, вводимого 1 раз в месяц в дозе 420 мг. Исследование состояло из двух фаз. Исходно все участники были рандомизированы в группы, которые получали или аторвастатин в дозе 20 мг, или плацебов течение 10 недель, а затем, после 2-недельного отмывочного периода, лечение было изменено на противоположное, чтобы определить, была ли у пациентов истинная непереносимость статинов. По данным анамнеза, 82% участников не переносили, как минимум, 3 различных статина. В результате оказалось, что у 43% пациентов на фоне приема аторвастатина имелись боли в мышцах, расцениваемые ими как непереносимые, которых не было на фоне плацебо. В то же время, 27% участников описывали такие симптомы на фоне плацебо, но не при приеме статина, и еще 10% отмечали симптомы на фоне обоих вариантов лечения. Далее, 218 участников с мышечными симптомами на фоне приема аторвастатина во время 1 фазы, перешли ко второй фазе исследования, которая продолжалась 24 недели. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие инъекции эволокумаба в дозе 420 мг в месяц + перорально плацебо, либо перорально эзетимиб в дозе 10 мг/сут + плацебо в виде инъекций). Средний уровень ХС-ЛПНП перед началом лечения во 2-й фазе составил 5,71 ммоль/л. Средний уровень ХС-ЛПНП для на 22-24-й неделе лечения составил 2,69 ммоль/л в группе эволокумаба и 4,75 ммоль/л в группе эзетимиба (среднее изменение по сравнению с исходным составило -54,5 и -16,7% соответственно; р <0,001), также была показана отличная переносимость эволокумаба у пациентов с непереносимость статинов. Во время второй фазы исследования мышечные симптомы отмечали 21 и 29% пациентов в группах эволокумаба и эзетимиба соответственно, но при этом лишь у 0,7 и 7% пациентов эти симптомы потребовали отмены лечения [15]. Данное исследование показало возможность существенного (>50%) снижения уровня ХС-ЛПНП при использовании эволокумаба на фоне полной непереносимости статинов.
БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ЭВОЛОКУМАБА
Очень важным результатом программы PROFICIO стали благоприятные данные по безопасности эволокумаба. Доли пациентов с нежелательными явлениями были в целом сходными в группах эволокумаба и контроля в течение всех периодов сбора комплексного массива данных по безопасности, а также при сравнении подгрупп и схем лечения. Не отмечалось каких-либо связанных с безопасностью проблем в отношении нежелательных явлений, сообщавшихся для других видов ГЛТ (т. е. риска новых случаев сахарного диабета, а также осложнений со стороны печени и мышечной ткани), а также явлений, которые теоретически могут быть сопряжены с ингибированием РСSК9 / повышением экспрессии рЛПНП (эпизоды развития гепатита С). Каких-либо признаков, свидетельствующих о риске развития нейрокогнитивных осложнений при применении эволокумаба, также не наблюдалось. Единственным нежелательным явлением, для которого было показано значимое различие между группами, была более высокая частота реакций со стороны места инъекции на фоне эволокумаба по сравнению с плацебо (2,1 и 1,6% соответственно) в самом крупном исследовании FOURIER. Кроме того, при введении моноклональных антител, как и в случае введения любых других терапевтических протеинов, существует потенциальный риск развития иммуногенности. Лабораторные результаты показали, что частота образования антител к препарату составляла всего 0,3%, причем ни у одного из пациентов из-за антител не происходило нейтрализации его действия [14-17, 23, 24]. Все это свидетельствует о том, что длительное применение эволокумаба безопасно. Выраженный гиполипидемический эффект не ассоциируется с нарушениями в нейрокогнитивной сфере, поражением мышечной ткани, изменениями углеводного обмена.
ПРИМЕНЕНИЯ ЭВОЛОКУМАБА В РЕАЛЬНОЙ ПРАКТИКЕ
Кроме данных клинических исследований в научной литературе начинают появляться сведения о применении эволокумаба в реальной практике, в т. ч. в РФ. Так, в работе Коновалова Г.А. и соавт. Были представлены результаты лечения эволокумабом в дозе 140 мг 1 раз в 2 недели на протяжении от 4 до 6 месяцев у 17 пациентов с рефрактерной гиперхолестеринемией. У 13 больных имели место наследственные формы гиперхолестеринемии, а у 4 - была непереносимость статинов. После присоединения к терапии эволокумаба отмечалось снижение в среднем по группе уровня общего ХС на 36,8%, ХС-ЛПНП на 60,2%, липопротеида (а) на 31,9% и повышение содержания ХС-ЛПВП на 13,1%, при этом не наблюдалось ни одного случая прекращения приема препарата из-за побочных эффектов [25].
В работе Сусекова А.В. и соавт. была показана возможность регрессии кожного ксантоматоза у 12-летнего пациента с гомозиготной формой СГХС после присоединения к терапии эволокумаба в дозе 420 мг 1 раз в месяц. Комбинированная ГЛТ розувастатином 40 мг/сут, эзетимибом 10 мг/сут и эволокумабом 420 мг/мес. переносилась пациентом хорошо [26].
ЗАКЛЮЧЕНИЕ
В настоящее время в арсенале врачей появился новый инновационный препарат для коррекции нарушений липидного обмена и снижения сердечно-сосудистого риска – эволокумаб. При лечении пациентов с первичной гиперлипидемией и смешанной дислипидемией присоединение эволокумаба к ГЛТ статином и/или эзетимибом позволяет дополнительно снижать уровень ХС-ЛПНП на 50-70% и уменьшать риск серьезных сердечно-сосудистых событий, таких как инфаркт миокарда и инсульт. При этом эволокумаб обладает в целом отличным профилем безопасности и для него не характерны нежелательные явления, характерные для других видов ГЛТ (осложнения со стороны печени и мышечной ткани, повышение риска возникновения новых случаев сахарного диабета 2 типа).



