Клиническая картина заболеваний, в основе которых лежит воспалительное поражение тканей сердца, весьма разнообразна и может проявляться дилатационной кардиомиопатией (ДКМП) с сопутствующей сердечной недостаточностью (СН), имитировать клиническую картину острого инфаркта миокарда, а также манифестировать внезапной смертью [1—3]. Частым проявлением миокардита служат различные нарушения ритма и проводимости сердца, развивающиеся вследствие изменения структуры тканей сердца и их электрофизиологических свойств [4, 5]. В связи с многообразием клинических форм диагностика воспалительных поражений миокарда затруднена. Появление гистологических, так называемых Далласских критериев, сделавших эндомиокардиальную биопсию (ЭМБ) «золотым стандартом» диагностики, дало возможность прижизненно интерпретировать морфологические изменения миокарда [6]. Для повышения диагностической ценности ЭМБ в 1999 г. Далласские критерии дополнены количественными иммуногистохимическими критериями: активное воспаление в миокарде диагностируется при наличии в 1 мм2 ≥14 воспалительных клеток, включая Т- и В-лимфоциты, их активированные формы и до 4 макрофагов [7]. Введение в стандарт исследования эндомиокардиальных биоптатов молекулярно-генетических методов, таких как полимеразная цепная реакция (ПЦР), позволило верифицировать потенциальных возбудителей миокардитов, которыми в большинстве случаев являются вирусы. В настоящее время наиболее часто в эндомиокардиальных биоптатах обнаруживают парвовирус В19 (pVB19) и вирус герпеса 6-го типа [8]. Однако с учетом широкой распространенности этих вирусов в популяции остается неясной их роль в этиологии и патогенезе воспалительных заболеваний миокарда.
Среди вирусов — возбудителей миокардитов наиболее изучены аденовирусы и вирусы Коксаки [9], путь проникновения которых в клетки опосредован специальным белком, Коксаки-аденовирусным рецептором (КАР). В миокарде КАР — белок плотных контактов, локализован преимущественно на мембранах клеток проводящей системы, а также на вставочных дисках [10, 11]. Именно на вставочных дисках расположено множество межклеточных контактов, осуществляющих электромеханическое сопряжение в сокращающемся сердце. Доказано также, что КАР принимает участие в развитии индуцированного Коксаки В3 миокардита, приводящего к кардиомиопатии [12]. Участие этого белка, расположенного в структурах проводящей системы, в воспалительном поражении сердца может предполагать его участие и в развитии нарушений проводимости.
При обследовании больных воспалительными заболеваниями миокарда с наличием и в отсутствие блокады левой ножки пучка Гиса (БЛНПГ) мы поставили целью провести сравнительный анализ клинико-инструментальных показателей, а также изучить морфологическую картину активности воспаления в эндомиокардиальных биоптатах, наличие в них вирусов и КАР.
Материал и методы
В исследование включены 22 пациента (11 мужчин, средний возраст 42,8±10,7 года) с тяжелыми клиническими проявлениями СН (средний функциональный класс по классификации Нью-Йоркской Ассоциации сердца — NYHA 2,4±1,35) или желудочковыми аритмиями, рефрактерными к стандартной медикаментозной терапии (пробежки желудочковой тахикардии — ЖТ), что давало основание предположить воспалительный генез заболевания сердца. Все пациенты получали ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы, диуретики, в некоторых случаях антиаритмические препараты III класса. Всем больным выполняли электрокардиографию в 12 отведениях, холтеровское мониторирование электрокардиограммы — ЭКГ (ХМ-ЭКГ), эхокардиографию (ЭхоКГ), коронарографию. После нее во всех случаях вторым этапом инвазивного вмешательства была ЭМБ. Основанием для ее проведения служило наличие СН продолжительностью более 3 мес при дилатации левого желудочка (ЛЖ) и впервые возникших желудочковых аритмиях, а также отсутствие реакции на стандартное лечение в течение 1—2 нед или наличие ЖТ неустановленной этиологии [13]. В ходе ЭМБ брали 3—4 биоптата из правого желудочка (ПЖ) или ЛЖ размером 1 мм3. Осложнений в ходе проведения ЭМБ не наблюдали. Одну часть каждого образца биоптата заливали в парафин с последующим приготовлением срезов толщиной 5—7 мкм и подвергали обычному гистологическому исследованию, включавшему окраску гематоксилином и эозином по Массону, толуидиновым синим, жировым красным. Другую часть каждого образца охлаждали для приготовления криосрезов с последующей иммуногистохимической оценкой наличия в воспалительных инфильтратах Т-клеток CD3+, Т-хелперов CD4+, Т-киллеров CD8+, активированных Т-лимфоцитов CD45RO, макрофагов CD68+ (антитела к CD3+ клон UCHT-1; CD4+ клон CLB-159; к CD8+; к CD68+ клон KP-1 и к CD45RO клон UCHL-1), а также наличия Коксаки-вируса В3 (антитела Anti-Coxsackie B Virus LS-C79837) и Коксаки-аденовирусного рецептора, КАР (антитела H-300). Иммуногистохимическую реакцию проводили в автоматическом иммуногистостейнере BenchMark XT. При гистологическом анализе препаратов ЭМБ исследовали степень гипертрофии кардиомиоцитов (КМЦ) по трехбалльной шкале, а также их ядер, проводили качественную оценку дегенеративных изменений миокарда. Степень остроты воспалительного процесса в биоптатах оценивали по количественному и качественному составу клеток в инфильтратах, а также по распространенности и тяжести деструктивных изменений КМЦ, наличию некротизированных КМЦ.
Количественный анализ интерстициального и очагового фиброза миокарда выполняли на препаратах ЭМБ, окрашенных трихромом по Массону, с помощью Aperio ScanScope CS в режиме Positive Pixel Count с вычислением процентного отношения негативных пикселей к общему числу пикселей в препарате (участкам, соответствующим фиброзным и прокрашиваемым синим при окраске по Массону, программой автоматически присваивались негативные пиксели; рис. 1, А, см. цв. вклейку). Интенсивность окраски клеточных мембран на КАР в окрашенных иммуногистохимически препаратах оценивалась автоматически по трехбалльной шкале с помощью Aperio ScanScope CS в режиме Membrane (рис. 1, Б, см. цв. вклейку).

Во всех эндомиокардиальных биоптатах изучали наличие вируса герпеса 1-го и 2-го типов, цитомегаловируса, вируса Эпштейна—Барр, вируса герпеса 6-го типа, парвовируса B19 методом ПЦР с помощью тест-систем: «АмплиСенс EBV/CMV/HHV-6-скрин-FL», «АмплиСенс HSV1-2», «АмплиСенс Parvovirus B19-FL». Использовали прибор для ПЦР в реальном времени «RotorGene 3000» и программное обеспечение к нему «Rotor-Gene 6.0». Для выделения ДНК из биоптатов использовали реагенты «ДНК-Сорб Б».
Статистическую обработку полученных данных проводили методами описательной статистики: вычисление средних, стандартных отклонений, стандартных ошибок, а также медианы и 25-го и 75-го процентилей, определение критериев значимости — тест Манна—Уитни и F-критерий Фишера. Сравнение групп выполняли с применением критерия Стьюдента для нормальных распределений, а также критерия Крускала—Уоллиса для ненормальных распределений. Ввод данных, их редактирование и статистический анализ осуществляли с помощью статистического пакета Statistica 8.
Результаты
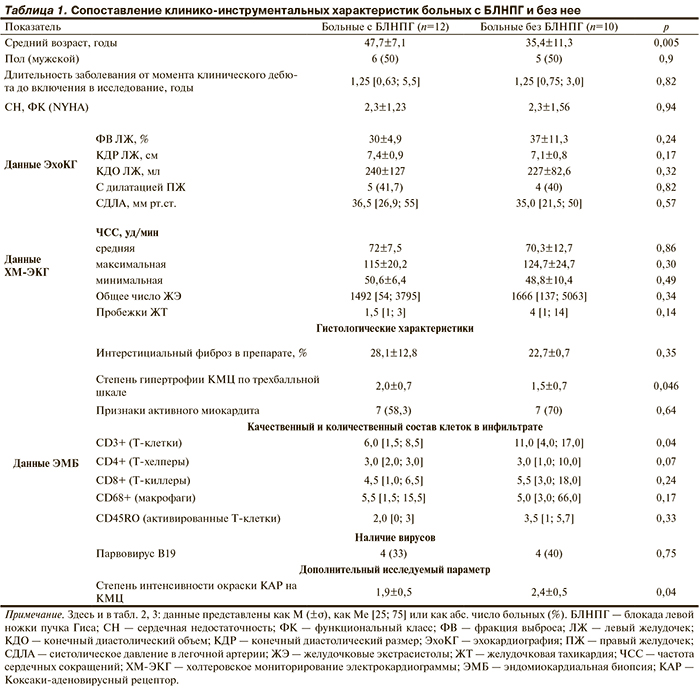
У 12 из 22 больных, включенных в исследование, имелись электрокардиографические признаки БЛНПГ (ширина комплекса QRS 174,8±24,1 мс). Эти пациенты выделены нами в отдельную группу, их результаты сопоставлены с данными больных без БЛНПГ (n=10, ширина комплекса QRS 82±11,1 мс). Клинико-инструментальные характеристики сформированных групп больных представлены в табл. 1.
Согласно представленным данным больные без БЛНПГ отличались более молодым возрастом (35,4±11,3 года против 47,7±7,1 года; р=0,005). Кроме того, между наличием БЛНПГ и возрастом выявлена прямая корреляция (r=0,57; p<0,05). Существенных отличий по тяжести СН, а также эхокардиографическим параметрам — фракции выброса (ФВ) ЛЖ, конечному диастолическому объему (КДО) ЛЖ, конечному диастолическому размеру (КДР) ЛЖ, систолическому давлению в легочной артерии (СДЛА) — у больных с БЛНПГ не обнаружено.
Гистологическая оценка препаратов ЭМБ продемонстрировала более выраженную гипертрофию КМЦ у больных с БЛНПГ (2,0±0,7 против 1,5±0,7; р=0,046), что подтверждено наличием прямой зависимости между степенью гипертрофии КМЦ и шириной комплекса QRS (r=0,43; p<0,05). При сопоставлении степени интерстициального фиброза в исследуемых биоптатах между больными с БЛНПГ и без нее значимых различий не выявлено (28,1±12,8% против 22,7±0,7%; p=0,35). Однако анализ степени интерстициального фиброза у всех 22 пациентов выявил следующую тенденцию: для больных с меньшей ФВ ЛЖ характерна большая степень фиброза. Кроме того, у лиц с высоким процентом интерстициального фиброза чаще диагностировали дилатацию ПЖ (r=0,43; p<0,05), и была выше степень гипертрофии КМЦ (r=0,53; p<0,05).
Для оценки активности воспалительного процесса проведен количественный и качественный анализ иммунных клеток в составе инфильтратов образцов ЭМБ. У больных без БЛНПГ зарегистрировано достоверно более высокое содержание клеток CD3+ (p=0,04); кроме того, у 2 больных этой подгруппы наблюдалось классическое очаговое поражение миокарда с массивными инфильтратами, представленными скоплением воспалительных клеток, в которых доминировали активированные Т-лимфоциты CD8+, клетки CD45RO. Данные инфильтраты располагались по ходу интрамуральных сосудов и сопровождались отложением фибрина. Инфильтрация в биоптатах больных с БЛНПГ во всех случаях имела диффузный характер без формирования очаговых скоплений клеток и была представлена в основном макрофагами.
Таким образом, в ходе выполнения данного этапа работы обнаружено, что больные с БЛНПГ по сравнению с пациентами без нарушения проводимости относятся к более старшей возрастной группе, у них гистологически отмечается большая степень гипертрофии КМЦ, и меньше клеток CD3+ в инфильтратах. Эти данные, возможно, указывают на большую длительность течения заболевания у больных с БЛНПГ, а также на хронический характер воспалительного процесса в миокарде, ведущего к значительному структурному ремоделированию КМЦ.
У 14 из 22 больных, включенных в исследование, число клеток в образцах ЭМБ превышало 14 на 1 мм2, что соответствует общепринятым критериям активного миокардита (7 из этих больных вошли в подгруппу с БЛНПГ). Наличие признаков активного миокардита по результатам ЭМБ в сочетании с дилатированными полостями сердца у пациентов данной категории позволило определить их диагноз как воспалительная КМП [8]. Это явилось основанием для проведения следующего этапа работы, который посвящен сравнительному анализу клинико-инструментальных показателей пациентов с гистологически доказанным активным миокардитом и без него (табл. 2).
Для больных с активным миокардитом была характерна меньшая продолжительность заболевания (r=–0,56; p=0,006). У них несколько реже встречалась дилатация правых отделов и имелась тенденция к меньшей степени гипертрофии КМЦ.
У 4 из 22 больных воспалительная инфильтрация в миокарде не обнаружена, а морфологические изменения миокарда соответствовали идиопатической ДКМП. Еще в 4 случаях степень воспалительной инфильтрации миокарда не соответствовала активному миокардиту, однако в биоптатах отмечался значительный очагово-интерстициальный фиброз, и диагноз этих больных был сформулирован как хронический миокардит с исходом в ДКМП.
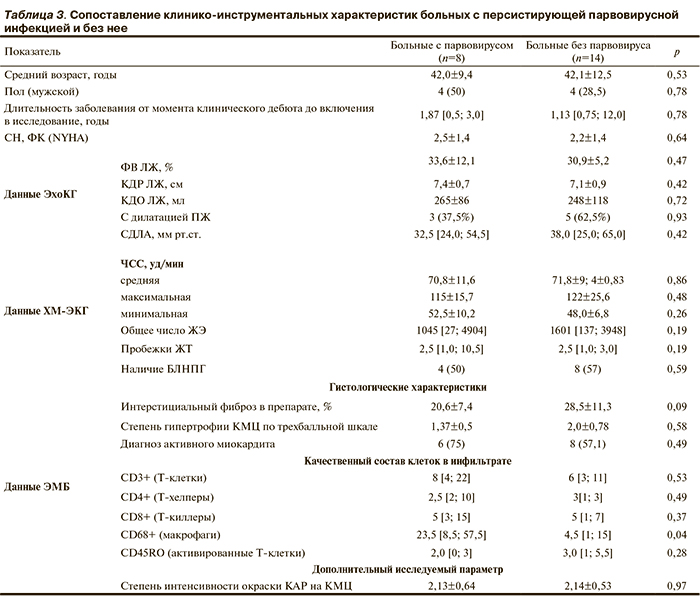
Исходя из возможности инфекционной этиологии воспалительного поражения миокарда биоптаты больных были проанализированы на наличие основных кардиотропных вирусов. Выявить Коксаки-вирус В3, вирусы герпеса 1-го и 2-го типов, вирус Эпштейна—Барр, цитомегаловирус, вирус герпеса 6-го типа в биоптатах не удалось. В образцах ЭМБ 8 (36,4%) больных обнаружен парвовирус В19 в количестве от 87 до 250 000 копий на 1 мл лизата. Сопоставление клинико-инструментальных данных больных с персистирующей парвовирусной инфекцией и без нее представлено в табл. 3.
Достоверных различий по исследуемым показателям больных с диагностированной вирусной инфекцией не обнаружено. Более того, при отдельном рассмотрении больных с наличием парвовируса продемонстрировано, что персистенция вируса в биоптате не всегда сопровождалась гистологическим диагнозом активного миокардита (p=0,49). Количество воспалительных клеток в инфильтратах биоптатов в группе больных с парвовирусом достоверно не различалось, за исключением макрофагов, присутствующих в биоптатах в значимо большем количестве (p=0,04).
Корреляционный анализ не выявил взаимосвязей между количеством вируса и клинико-инструментальными параметрами, а также выраженностью воспалительных изменений миокарда (общим количеством воспалительных клеток и активированных Т-лимфоцитов, r=0,19 и 0,14 соответственно). Так, в некоторых случаях у больных с большим количеством парвовируса в миокарде инфильтрация иммунными клетками вовсе не обнаруживалась. Наиболее яркие примеры подобных сопоставлений представлены на рис. 2 (см. цв. вклейку).
Отсутствие в исследуемых образцах персистенции вируса Коксаки В3 сделало особенно интересным исследование экспрессии специфического рецептора этого вируса — КАР, что явилось еще одним этапом нашего исследования. Данные количественной оценки наличия КАР на мембранах КМЦ представлены в табл. 1—3.
Повышенная экспрессия КАР на мембранах КМЦ наблюдалась в эндомиокардиальных биоптатах 20 больных. По степени интенсивности окраски на КАР больные были разделены на 3 подгруппы. Для больных с максимальной (3-й) степенью экспрессии КАР было характерно плотное окрашивание в области вставочных дисков, а также вдоль всей мембраны КМЦ, что наблюдалось на поперечных и продольных срезах (рис. 3, А, Б, см. цв. вклейку). Кроме того, в некоторых биоптатах отмечалось окрашивание межклеточного интерстициального пространства и медии интрамуральных сосудов (см. рис. 3, Б, см. цв. вклейку). Для больных со 2-й степенью экспрессии КАР были характерны более слабое окрашивание клеточных мембран, гомогенное окрашивание цитоплазмы клеток, четкое окрашивание вставочных дисков (рис. 3, В, Г, см. цв. вклейку). Чем интенсивней была экспрессия КАР на мембранах КМЦ, тем меньше была вероятность БЛНПГ (r=–0,44; p<0,05). Согласно статистическому анализу, проведенному в соответствии со степенями интенсивности окраски на КАР с использованием критерия Крускала—Уоллиса, больные с максимальной интенсивностью окраски (3-я степень) отличались наличием дилатации ПЖ (p=0,012) и более тяжелой СН (p=0,048). При попытке напрямую сопоставить интенсивность окрашивания на КАР мембран КМЦ и наличие парвовируса в миокарде, а также количество воспалительных клеток CD3+, CD4+,CD8+, CD68+, CD45RO), положительной корреляции выявить не удалось.
Таким образом, проведенное исследование не позволяет в полной мере судить о факторах, влияющих на усиление экспрессии КАР на мембране КМЦ, однако полученные результаты свидетельствуют об увеличении значимости этого рецептора при более тяжелом поражении миокарда.
Обсуждение
Воспалительное изменение миокарда способно возникать как непосредственно, вследствие инфекционного поражения, так и в результате активации аутоиммунных механизмов. При этом прогрессированию ремоделирования миокарда способствуют дезорганизация межклеточных контактов, промоция процессов апоптоза и фиброза [14—16]. Поражаться в ходе воспаления способны как сократительный миокард, так и проводящая ткань с развитием нарушений ритма и проводимости [17—19]. Одним из примеров нарушений внутрижелудочковой проводимости сердца является БЛНПГ, диагностируемая у 40% больных ДКМП [20—22]. Результаты ряда морфологических исследований [22—24] свидетельствуют о наличии выраженных дегенеративных изменений в миокарде подобных больных, однако значимость воспалительного компонента в ходе этих работ в полной мере не оценивалась в первую очередь из-за несовершенства диагностических критериев.
Отдельное рассмотрение в нашем исследовании больных кардиомиопатией, сопряженной с БЛНПГ, позволило выявить в 58,3% случаев воспалительные изменения, соответствующие активному миокардиту. Отличительной особенностью воспалительных инфильтратов в этой подгруппе было низкое количество в них Т-клеток CD3+. Этот признак наряду с более старшим возрастом больных, возможно, указывает на большую длительность патологического процесса в миокарде. Сходное наблюдение сделано ранее в работе A. Angelini и соавт., сравнивших клиническое течение и прогноз у больных с активным и пограничным миокардитом. По данным этих авторов, блокады ножек пучка Гиса чаще встречались в группе пациентов с пограничным миокардитом (31%), чем с активным (8%). Помимо этого группа больных с пограничным миокардитом характеризовалась более высокими КДО ЛЖ при меньшем соотношении массы миокарда и объема ЛЖ, меньшей степенью выраженности воспалительной инфильтрации, а также большей длительностью периода между началом заболевания и моментом выполнения ЭМБ. Все эти данные позволили авторам прийти к выводу о том, что пограничный или «хронический» миокардит, сопровождаясь менее выраженной воспалительной инфильтрацией миокарда, тем не менее приводит к дилатации ЛЖ [25]. Таким образом, сопоставление полученных нами результатов и данных литературы наводит на мысль о том, что само воспаление является важным, однако не основным фактором прогрессирования ремоделирования миокарда у больных кардиомиопатией. Выявленные нами характеристики подгруппы больных с БЛНПГ согласуются с гипотезой, выдвинутой P. Eriksson и соавт., о наличии в миокарде подобных больных медленно прогрессирующего дегенеративного процесса, поражающего как сократительный миокард, так и проводящую систему сердца [26].
Большое значение в поддержании воспаления в миокарде, по данным литературы, отводится персистирующей вирусной инфекции. Однако полученные нами данные свидетельствуют о том, что наличие парвовируса в эндомиокардиальных биоптатах и его количество не коррелируют ни с содержанием воспалительных клеток, ни с тяжестью клинического течения заболевания. Наличие парвовирусной инфекции, вероятно, обусловлено широкой распространенностью этого патогена в популяции, а полученные в ходе нашего исследования результаты свидетельствуют об отсутствии прямой этиологической связи между выявляемым парвовирусом В19 и воспалением в миокарде, что согласуется с работами ряда авторов [27—29]. Преобладание в биоптатах у больных с обнаруживаемым парвовирусом В19 макрофагов, скорее всего, указывает на стихающую клеточную реакцию в миокарде.
Некротические изменения КМЦ вследствие вирусной инфекции или в ее отсутствие приводят в дальнейшем к пространственной дезорганизации миофибрилл, фиброзному замещению погибших клеток. Эти последовательные стадии воспалительного процесса можно наблюдать на тканевом уровне, они хорошо диагностируются с помощью ЭМБ. Однако помимо изменений на тканевом уровне изменения на уровне самих КМЦ также вносят значительный вклад в снижение сократительной функции сердца. При этом основным событием патологического ремоделирования миокарда является перераспределение межклеточных контактов. Результаты проведенного нами исследования выявили значительное увеличение количества КАР, белка плотных контактов КМЦ, в отсутствие активной Коксаки-вирусной инфекции. По мнению ряда авторов, само повышение экспрессии КАР может способствовать активации провоспалительных каскадов, миграции в миокард натуральных киллеров и макрофагов и, таким образом, вызывать прогрессирование кардиомиопатии [30]. С этой точки зрения была проведена попытка сопоставления интенсивности экспрессии КАР на КМЦ с активностью воспаления у исследуемых больных. Однако подобные корреляции в нашей работе выявить не удалось. Отсутствие прямой взаимосвязи между высокой экспрессией КАР и признаками активного миокардита также продемонстрировала недавняя работа T. Kaur и соавт., исследовавших экспрессию КАР на аутопсийном материале сердец больных ДКМП [31].
Анализ полученных нами данных указывает на то, что увеличение содержания КАР на клеточных мембранах характерно для больных с дилатацией ПЖ и тяжелой степенью СН. Данный факт, вероятно, свидетельствует об усилении функциональной роли КАР, как белка межклеточных плотных контактов, в ремоделировании КМЦ. При ДКМП мембрана вставочного диска искривляется с сопутствующим увеличением экспрессии адгезивных контактов, что, вероятно, приводит к потере гибкости и повышению ригидности в местах межклеточных контактов [32]. Не подлежит сомнению значительное уменьшение экспрессии в патологических условиях другого типа межклеточных контактов, щелевых контактов, в норме осуществляющих электромеханическое сопряжение между соседними КМЦ [33]. Можно предположить, что подобной заменой необходимых для синхронного сокращения КМЦ белков щелевых контактов, коннексинов, на белки плотных контактов, определяется диффузное снижение контрактильной функции миокарда ЛЖ у больных кардиомиопатией. Вероятно, что обнаруживаемое усиление экспрессии КАР может отражать попытку организма восстановить межклеточные контакты в пораженном миокарде с прогрессирующей дилатацией, а использование в этих целях плотных контактов обусловлено необходимостью отграничения неповрежденных клеток от продуктов некротического лизиса. Однако полученные нами результаты не позволяют в полной мере оценить истинную физиологическую роль этого рецептора в норме и патологии, что, возможно, будет являться поводом для дальнейших исследований.
Заключение
В биоптатах 58,3% больных с воспалительной кардиомиопатией, сопровождающейся блокадой левой ножки пучка Гиса, выявляются признаки активного миокардита. Этих больных отличают принадлежность к старшей возрастной группе, а также меньшее количество клеток CD3+ в клеточных инфильтратах. Эти факты, возможно, указывают на меньший вклад воспалительной деструкции в патогенез кардиомиопатии в этой подгруппе и подтверждают гипотезу о медленно прогрессирующем дегенеративном процессе, поражающем как сократительный миокард, так и проводящую систему сердца. Основным вирусом, выявляемым в биоптатах 36,4% всех исследуемых больных, является парвовирус В19, однако данных о том, что именно он определяет активность воспаления в миокарде, не получено. Его наличие и титр не имеют прямой связи с тяжестью клинического течения заболевания у пациентов, что, вероятно, свидетельствует об отсутствии прямой роли этого вируса в этиологии воспалительных заболеваний миокарда, а лишь указывает на широкую распространенность в популяции. С наличием вирусов, в том числе Коксаки B3, не связана экспрессия белка плотных контактов Коксаки-аденовирусного рецептора. Повышенная экспрессия Коксаки-аденовирусных рецепторов на мембране кардиомиоцитов у исследуемых больных не была связана и с инфильтрацией миокарда воспалительными клетками. Для больных с повышенным содержанием Коксаки-аденовирусных рецепторов на мембранах характерны отсутствие блокады левой ножки пучка Гиса, наличие дилатации правых отделов сердца и более тяжелая сердечная недостаточность. Возможно, что обнаруживаемое усиление экспрессии Коксаки-аденовирусных рецепторов может отражать попытку организма восстановить межклеточные контакты в пораженном миокарде с прогрессирующей дилатацией, а использование в этих целях плотных контактов обусловлено необходимостью отграничения неповрежденных клеток от продуктов некротического лизиса.
Работа выполнена при поддержке гранта РФФИ №14-04-01754 А.



