Проблема дилатационных кардиомиопатий (ДКМП) является одной из самых дискутируемых в современной кардиологии [1, 2]. Распространенность этого полиэтиологичного синдрома среди пациентов кардиологического профиля значительна и неуклонно увеличивается, а течение отличается, как правило, неуклонным прогрессированием с неблагоприятным прогнозом. В США ежегодно регистрируют от 2—5 до 10—13 человек, страдающих ДКМП на 100 тыс. населения [3—10].
Одним из реальных современных путей лечения ДКМП является кардиохирургический подход [11]. В настоящей публикации дан анализ отдаленных результатов (5-летнее наблюдение) обследования пациентов после органосохраняющей операции обратного ремоделирования сердца.
Материал и методы
 Обследованы 24 пациента (5 женщин и 19 мужчин) с ДКМП в возрасте от 20 до 75 лет (средний возраст 50,7±2,5 года), находившихся в Отделении хирургического лечения дисфункции миокарда и сердечной недостаточности РНЦХ РАМН в период с января 2008 по январь 2013 г. Длительность заболевания составила от 4 мес до 12 лет, в среднем 49,4±7,5 мес. При поступлении в стационар всем больным проводили ТШХ, комплекс лабораторных исследований: общий анализ крови и мочи, биохимические анализы, коагулограмма, диагностика методом полимеразной цепной реакции (ПЦР) в целях выявления кардиотропных вирусов, иммунологическое исследование специфических антител к кардиомиоцитам (КМЦ) и проводящей системе сердца, мозгового натрийуретического пептида (МНУП). Применяли инструментальные методы диагностики: электрокардиографию (ЭКГ), Холтеровское мониторирование электрокардиограммы (ХМ-ЭКГ), трансторакальную и чреспищеводную эхокардиографию (Эхо-КГ) с допплерографией, рентгенографию органов грудной клетки, оценку функции внешнего дыхания, ультразвуковое исследование (УЗИ) органов брюшной полости и почек, коронарографию, эндомиокардиальную биопсию правого желудочка (ПЖ) или интраоперационную биопсию левого желудочка (ЛЖ) с ПЦР-диагностикой, магнитно-резонансную томографию (МРТ) или мультиспиральную компьютерную томографию (МСКТ) сердца с контрастированием.
Обследованы 24 пациента (5 женщин и 19 мужчин) с ДКМП в возрасте от 20 до 75 лет (средний возраст 50,7±2,5 года), находившихся в Отделении хирургического лечения дисфункции миокарда и сердечной недостаточности РНЦХ РАМН в период с января 2008 по январь 2013 г. Длительность заболевания составила от 4 мес до 12 лет, в среднем 49,4±7,5 мес. При поступлении в стационар всем больным проводили ТШХ, комплекс лабораторных исследований: общий анализ крови и мочи, биохимические анализы, коагулограмма, диагностика методом полимеразной цепной реакции (ПЦР) в целях выявления кардиотропных вирусов, иммунологическое исследование специфических антител к кардиомиоцитам (КМЦ) и проводящей системе сердца, мозгового натрийуретического пептида (МНУП). Применяли инструментальные методы диагностики: электрокардиографию (ЭКГ), Холтеровское мониторирование электрокардиограммы (ХМ-ЭКГ), трансторакальную и чреспищеводную эхокардиографию (Эхо-КГ) с допплерографией, рентгенографию органов грудной клетки, оценку функции внешнего дыхания, ультразвуковое исследование (УЗИ) органов брюшной полости и почек, коронарографию, эндомиокардиальную биопсию правого желудочка (ПЖ) или интраоперационную биопсию левого желудочка (ЛЖ) с ПЦР-диагностикой, магнитно-резонансную томографию (МРТ) или мультиспиральную компьютерную томографию (МСКТ) сердца с контрастированием.
С целью улучшения сократимости миокарда за 2 сут до операции и в раннем послеоперационном периоде пациентам выполняли внутривенную инфузию левосимендана [12—14]. Медикаментозную терапию проводили согласно рекомендациям ACCF/AHA, предложенным в 2005 г., и национальным рекомендациям ВНОК 2010 г. (табл. 1).
Всем 24 пациентам выполнена операция по методике обратного ремоделирования сердца, которая включает одномоментное выполнение универсального хордосохраняющего протезирования митрального клапана механическим протезом, пластику трикуспидального клапана по Де-Вега или Амосову, объемредуцирующую пластику ЛЖ (при необходимости и ПЖ), «мерседес»-пластику левого предсердия, линейную пластику правого предсердия и имплантацию кардиовертера-дефибриллятора (КД, 3 пациента) и/или ресинхронизатора (CRT-P/CRT-D, 6 пациентов).
Повторное обследование больных проводили через 10—12 сут после операции (обследованы 22 пациента, перенесших хирургическое лечение), через 12 (20 пациентов) и 60 мес (15 пациентов). В указанные сроки проводили общеклиническое обследование, ЭКГ, Эхо-КГ, рентгенографию органов грудной клетки.
Статистическую обработку полученных данных проводили с помощью программы Statistica 6.0 for Windows. Для сравнения количественных показателей до и после оперативного вмешательства и определения различий между ними использовали t-критерий Стьюдента и непараметрический U-критерий Манна—Уитни для связанных выборок. Различия считали достоверными при р<0,05. Для выявления различий по частоте выявления различных признаков использовали критерий χ2 и точный критерий Фишера. Оценка выживаемости проведена по методу Каплана—Мейера [15].
Результаты и обсуждение
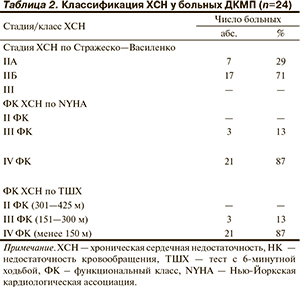
До операции у всех пациентов имелась ХСН 2А—2Б стадии по классификации Н.Д. Стражеско и В.Х. Василенко, III—IV ФК по NYHA и по данным теста с 6-минутной ходьбой – ТШХ (табл. 2).
По данным ЭКГ, нормальный ритм сердца отмечался у 13 (54%) пациентов, синусовый ритм+синдром Вольфа—Паркинсона—Уайта (WPW) — у 1 (4%), миграция водителя ритма (синусный узел — предсердия) — у 1 (4%), постоянная форма фибрилляции предсердий у 9 (38%). Блокада левой ножки пучка Гиса отмечена у 14 (58%) пациентов, правой ножки пучка Гиса — у 4 (17%), замедление внутрижелудочковой проводимости — у 5 (21%), атриовентрикулярная блокада I степени — у 3 (13%). По данным ХМ-ЭКГ у всех пациентов зарегистрированы нарушения ритма сердца по типу желудочковой экстрасистолии высоких градаций и пробежек желудочковой тахикардии по классификации Вольфа—Лауна: у 1 (4%) — 1-й класс, у 4 (17%) — 3-й класс, у 8 (33%) — 4А класс, у 11 (46%) — 4Б класс.
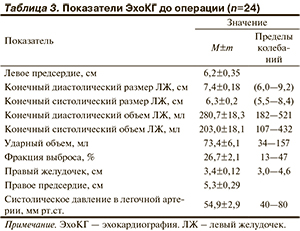
 При анализе показателей трансторакальной Эхо-КГ (табл. 3) выявлено достоверное увеличение размеров ЛЖ (от 6,0 до 9,2 см) и ПЖ (от 3,0 до 4,6 см), снижение фракции выброса левого желудочка – ФВ ЛЖ (с 13 до 47% по Симпсону), повышение систолического давления в легочной артерии (с 35 до 80 мм рт.ст.). При проведении допплер-Эхо-КГ митральная недостаточность III степени выявлена у 9 (38%) больных, IV степени — у 15 (63%). Относительная трикуспидальная недостаточность I степени констатирована у 9 (38%) пациентов, II степени — у 4 (17%), III степени — у 7 (29%), IV степени — у 4 (17%). Легочная гипертензия I степени имелась у 8 (34%) больных, II степени — у 12 (50%), III степени — у 4 (17%). У 20 (83%) пациентов диагностирована диастолическая дисфункция миокарда рестриктивного типа. При оценке результатов тканевой миокардиальной допплерографии у 6 (25%) пациентов диагностирована асинхрония миокарда, из них межжелудочковая асинхрония (50—100 мс, при норме <40 мс) — у 5 (21%) и внутрижелудочковая асинхрония (365 мс, при норме <140 мс) — у 1 (4%). У 1 (4%) больного имелись признаки некомпактного миокарда верхушечного сегмента ЛЖ, локальная форма, у 1 (4%) — отрыв хорд II порядка передней створки митрального клапана. Внутриполостной тромбоз сердца выявлен у 2 (8%) больных.
При анализе показателей трансторакальной Эхо-КГ (табл. 3) выявлено достоверное увеличение размеров ЛЖ (от 6,0 до 9,2 см) и ПЖ (от 3,0 до 4,6 см), снижение фракции выброса левого желудочка – ФВ ЛЖ (с 13 до 47% по Симпсону), повышение систолического давления в легочной артерии (с 35 до 80 мм рт.ст.). При проведении допплер-Эхо-КГ митральная недостаточность III степени выявлена у 9 (38%) больных, IV степени — у 15 (63%). Относительная трикуспидальная недостаточность I степени констатирована у 9 (38%) пациентов, II степени — у 4 (17%), III степени — у 7 (29%), IV степени — у 4 (17%). Легочная гипертензия I степени имелась у 8 (34%) больных, II степени — у 12 (50%), III степени — у 4 (17%). У 20 (83%) пациентов диагностирована диастолическая дисфункция миокарда рестриктивного типа. При оценке результатов тканевой миокардиальной допплерографии у 6 (25%) пациентов диагностирована асинхрония миокарда, из них межжелудочковая асинхрония (50—100 мс, при норме <40 мс) — у 5 (21%) и внутрижелудочковая асинхрония (365 мс, при норме <140 мс) — у 1 (4%). У 1 (4%) больного имелись признаки некомпактного миокарда верхушечного сегмента ЛЖ, локальная форма, у 1 (4%) — отрыв хорд II порядка передней створки митрального клапана. Внутриполостной тромбоз сердца выявлен у 2 (8%) больных.
При анализе рентгенограмм у всех пациентов выявлены признаки кардиомегалии и венозного застоя в малом круге кровообращения, а также признаки одностороннего гидроторакса у 4 (17%) пациентов, двусторонний гидроторакс — у 1 (4%).
При исследовании функции внешнего дыхания значимых вентиляционных нарушений у больных данной подгруппы не выявлено.
По данным УЗИ органов брюшной полости и почек, у 17 (71%) больных констатированы признаки гепатомегалии с повышением активности печеночных ферментов не более чем в 2 раза выше нормы. По данным УЗИ, структурных изменений почек не выявлено. При анализе азотовыделительной функции почек у всех больных отмечалось умеренное или незначительное снижение скорости клубочковой фильтрации от 60 до 50 мл/мин/1,73 м2, по классификации MDRD имелась хроническая болезнь почек II—III стадии.
Оценивая результаты предоперационного обследования группы оперированных пациентов, следует подчеркнуть, что все они имели исходно низкие показатели производительности миокарда, клинически выраженные признаки бивентрикулярной недостаточности и гемодинамически значимые пороки атриовентрикулярных клапанов. По стандартам принятых оценок практически все пациенты этой группы должны рассматриваться как потенциальные кандидаты в лист ожидания на операцию ортотопической трансплантации сердца [11].
При проведении анализа лабораторных показателей крови выявлено достоверное увеличение уровня МНУП по сравнению с нормой (р<0,05).
При визуальном анализе результатов МРТ или МСКТ сердца с внутривенным контрастированием гадолинием, выполненным у 22 (92%) больных, признаки активного миокардита (выраженные диффузные интрамуральные очаги накопления гадолиния) выявлены у 3 (13%) из них. Постмиокардитические изменения неишемического характера (интрамуральное или субэпикардиальное накопление контрастного вещества в виде полоски локального или диффузного характера) обнаружены у 18 (78%) больных, признаки накопления контрастного вещества смешанного характера (субэндокардиальные и трансмуральные очаги отсроченного накопления гадолиния в зонах, соответствующих перфузии коронарных артерий) — у 5 (21%), признаки некомпактного миокарда с локализацией в боковом, нижнем и передневерхушечном сегментах ЛЖ — у 1 (4%).
Наличие ДНК-кардиотропных вирусов в крови методом ПЦР диагностировано у 4 (17%) пациентов: вирус герпеса 6-го типа — у 1 (4%) пациента, вирус Эпштейна—Барр — у 4 (17%), парвовирус В-19 — у 1 (4%).
Выявлено повышение титра специфических антител: у 8 (33%) пациентов к антинуклеарному фактору (более 1:40 при норме 0), у 13 (54%) — к эндотелию (более 1:80 при норме 1:40), у 14 (58%) — к КМЦ (более 1:80 при норме 1:40), у 13 (54%) — к гладкой мускулатуре (более 1:80 при норме 1:40), у 13 (54%) — к клеткам проводящей системы сердца (более 1:80 при норме 1:40).
 Анализ коронарограмм признаки атеросклеротического поражения и гемодинамически значимые (>50%) стенозы венечных артерий позволил диагностировать у 5 (21%) пациентов, из них у 3 — трехсосудистое поражение, у 1 — двухсосудистое поражение, у 1 — однососудистое поражение.
Анализ коронарограмм признаки атеросклеротического поражения и гемодинамически значимые (>50%) стенозы венечных артерий позволил диагностировать у 5 (21%) пациентов, из них у 3 — трехсосудистое поражение, у 1 — двухсосудистое поражение, у 1 — однососудистое поражение.
При дооперационном морфологическом исследовании материала миокарда ПЖ, полученного при эндомиокардиальной биопсии (выполнено у 12 больных), у 3 (25%) диагностирована активная воспалительная реакция. По данным интраоперационной биопсии миокарда ЛЖ, у больных обследуемой подгруппы выявлены выраженные дистрофические изменения КМЦ: некроз, интерстициальный и заместительный склероз различной степени, отсутствие активной воспалительной реакции и наличие «пустых» КМЦ с исходом в их гибель и кардиосклероз без клеточной реакции, приводящей к усиленной деградации компонентов цитоплазмы и ядер КМЦ.
По данным иммунногистохимическом исследования интраоперационного материала миокарда ЛЖ (выполнено у 5 больных), диагностированы дистрофические изменения структурных белков миокарда — отсутствие белка десмина у 1 больного.
При вирусологическом исследовании интраоперационного биопсионого материала наличие вирусного генома в миокарде диагностировано у 12 (50%) больных, из них у 2 (8%) — цитомегаловирус, у 4 (17%) — вирус герпеса 6-го типа, у 3 (13%) — вирус Эпштейна—Барр, у 9 (38%) — парвовирус В-19.
Все перечисленное имеет прямое отношение к факторам, влияющим на функциональное состояние КМЦ и интерстициального вещества миокарда. Высокая частота выявления кардиотропных вирусов, повышенные титры аутоиммунных антител, лимфатические знаки активной воспалительной реакции свидетельствуют о значительной доле вирусной инфекции в развитии ДКМП и несут как угрозу прогрессирования заболевания, так и реальный шанс проведения активной и эффективной терапии, включающей комбинацию органосохраняющей хирургии и современной этиотропной терапии [8]. В настоящее время мы завершаем генетическое тестирование всех этих пациентов. В случаях выявления преимущественно генетического характера патологии, прогрессирующего и доминирующего апоптоза КМЦ или распространенного кардиосклероза таким пациентам можно уверенно рекомендовать трансплантацию сердца или имплантацию постоянного искусственного желудочка сердца. Таким образом, есть два фактора, без знания которых мы неправомочны объективно решать судьбу пациентов с ДКМП: этиологический диагноз патологии и диагноз состояния КМЦ.
После операции всем пациентам проводили антикоагулянтную терапию: гепарин в течение 5 дней (по 20 тыс. ед/сут), со вторых суток назначали непрямые антикоагулянты (варфарин в дозе от 2,5 до 7,5 мг/сут) с поддержанием международного нормализованного отношения на уровне 2,5—3,5 (пожизненно).
В госпитальном периоде умерли 2 (8%) пациента от гемодинамически значимых желудочковых аритмий. В отдаленном послеоперационном периоде умерли 7 (29%) больных. Два пациента (одна женщина через 29 мес и один мужчина через 32 мес после операции) умерли от прогрессирования сердечно-дыхательной недостаточности на фоне активной вирусной инфекции. Два пациента (через 10 и 16 мес после операции) умерли от острого нарушения мозгового кровообращения и мезентериального тромбоза на фоне нарушения антикоагулянтной терапии. Три пациента (одна женщина через 24 мес, один мужчина через 14 мес и мужчина через 12 мес после операции) умерли внезапно от нарушений ритма сердца. Оценка выживаемости проведена по методу Каплана—Мейера. Выживаемость пациентов после операции в течение первого года составила 91,3% (при 95% доверительном интервале — ДИ — от 79,8 до 100%), до 2 лет — 72% (при 95% ДИ от 52,9 до 91,2%) и 5-летняя выживаемость – 50,7% (при 95% ДИ от 25,8 до 75,5%).
Высокая частота развития инсультов и внезапной сердечной смерти у пациентов, перенесших успешно операцию обратного ремоделирования сердца и находящихся в удовлетворительном функциональном состоянии, свидетельствуют о том, что необходимы дополнительные диагностические и лечебные усилия. Прежде всего, речь идет об уточненной диагностике наследственных тромбофилий, качественном фармакогенетическом подборе дозы антикоагулянтов и тщательном контроле показателей свертывающей системы. Имплантацию CRT-D этим пациентам следует рассматривать не только как дополнительный метод нормализации гемодинамики при асинхронии, но и как обязательный фактор профилактики внезапной сердечной смерти [16]. Мы рассматриваем имплантацию ИКД или CRT-D (по показаниям) как компонент операции обратного ремоделирования сердца.
Анализ клинического состояния и показателей инструментального обследования в послеоперационном периоде проведен у 22 (92%) пациентов через год и у 15 (63%) через 3—5 лет после реконструктивной органосохраняющей операции обратного ремоделирования сердца. За период наблюдения у больных не выявлено клинически значимых симптомов рецидива нарушений кровообращения и аускультативных признаков клапанных регургитаций.
При сравнительной оценке тяжести ФК нарушений кровообращения по классификации NYHA отмечено существенное улучшение через 3—5 лет после операции: II ФК — у 6 (40%) пациентов, III ФК — у 9 (60%).

При сравнительном анализе ЭКГ выявлено, что в раннем послеоперационном периоде и в последующем после операции у 11 (73%) пациентов сохранялся синусовый ритм, у 5 (33%) — фибрилляция предсердий (нормосистолический вариант). У 3 (20%) больных первым этапом до операции, у 6 (40%) вторым этапом после операции была имплантирована система ИКД/CRT-D. Срабатывание ИКД по поводу двух эпизодов желудочковой тахикардии и одного эпизода фибрилляции желудочков отмечено у 1 (4%) пациента в послеоперационном периоде.
 При сравнительном анализе рентгенограмм органов грудной клетки отмечено значимое уменьшение признаков венозного застоя в малом круге кровообращения, легочной гипертензии, уменьшения размеров сердца по сравнению с исходными данными. Декомпенсации с гидротораксом через 1—5 лет не отмечено.
При сравнительном анализе рентгенограмм органов грудной клетки отмечено значимое уменьшение признаков венозного застоя в малом круге кровообращения, легочной гипертензии, уменьшения размеров сердца по сравнению с исходными данными. Декомпенсации с гидротораксом через 1—5 лет не отмечено.
По данным трансторакальной Эхо-КГ, выявлено достоверное уменьшение (р<0,05) размеров полостей сердца и объемов ЛЖ, уменьшение систолического давления в легочной артерии, увеличение фракции выброса ЛЖ (рис. 1 а—г).
При изучении уровня МНУП в сыворотке крови как важного маркера течения и эффективности лечения хронической недостаточности кровообращения выявлено достоверное уменьшение показателей (р<0,05) по сравнению с исходными данными в дооперационном периоде (рис. 2).
Заключение
Операцию обратного ремоделирования сердца можно предложить больным любой возрастной группы с синдромом дилатационной кардиомиопатии при клапанных регургитациях и дилатации полостей сердца с сохраненными резервами функции печени, почек, легких и в отсутствие активного миокардита. Несмотря на тяжесть исходного состояния можно получить удовлетворительный клинический результат и избежать трансплантации сердца.



