Диагноз «дилатационная кардиомиопатия» (ДКМП) является одним из наиболее распространенных у больных различными формами кардиомиопатий. Существует несколько подходов к трактовке данного нозологического понятия, по поводу которых не стихают споры в рамках научных публикаций и докладов: от строгого понимания ДКМП как поражения мышцы сердца неясной или генетической природы до кардиомегалии любой установленной этиологии (вплоть до ишемической). Однако на практике диагноз «ДКМП» чаще всего устанавливают по структурно-функциональному принципу, предложенному в классификации ВОЗ 1995 г.: критерием является дилатация камер сердца (как минимум левого желудочка — ЛЖ) со снижением их сократимости. Фактически, диагноз ДКМП оказывается синдромным и во всех случаях требует исключения весьма широкого спектра причин, которые приводят к единому исходу.
Приводится описание одной из наиболее редких и потенциально курабельных причин выраженной дилатации сердца с развернутой бивентрикулярной хронической сердечной недостаточностью (ХСН), но без существенного снижения сократимости миокарда.
Клиническое наблюдение
Больной К., 51 год, поступил в Факультетскую терапевтическую клинику (ФТК) им. В.Н. Виноградова 04.05.12 с жалобами на одышку при умеренных физических нагрузках (подъем на 1—2 этажа), периодически возникающее ощущение учащенного неритмичного сердцебиения, перебои в работе сердца, выраженную слабость.
Семейный анамнез по кардиомиопатиям не отягощен; мать страдала опухолью головного мозга, умерла в 78 лет; отцу 82 года, брату 46 лет, относительно здоровы.
Из анамнеза жизни: служил в армии, по профессии инженер, в настоящее время не работает. Не курит, алкоголем не злоупотребляет. Травм и операций не было. В анамнезе редкие респираторные вирусные инфекции. Аллергические реакции отрицает.
Анамнез заболевания: с 2002 г. отмечает частые кратковременные приступы неритмичного сердцебиения и периодическое повышение артериального давления (АД) до 180/100 мм рт.ст. Постоянно принимал периндоприл 4 мг+индапамид 1,5 мг (нолипрел-форте) и верапамил 240 мг/сут с удовлетворительным гипотензивным эффектом. С сентября 2011 г. без видимой причины отметил появление одышки при обычных физических нагрузках, обратился в поликлинику по месту жительства, на электрокардиограмме (ЭКГ) зафиксирована тахисистолическая мерцательная аритмия (МА). По данным эхокардиографии (ЭхоКГ) выявлена дилатация всех камер сердца, состояние расценено как ДКМП. Начата терапия β-адреноблокаторами, дигоксином, ингибиторами ангиотензинпревращающего фермента, диуретиками, варфарином, состояние стабилизировалось. Консультирован аритмологом, рекомендовано проведение радиочастотной абляции (РЧА).
С этой целью в ноябре 2011 г. госпитализирован в ГНИЦ профилактической медицины. На ЭКГ: МА с частотой сердечных сокращений (ЧСС) 60 уд/мин, отрицательные зубцы Т в отведении V1—V5, признаки гипертрофии обоих желудочков. По данным ЭхоКГ, левое предсердие (ЛП) 5,7 см, конечный диастолический размер (КДР) ЛЖ 6,9 см, конечный диастолический объем (КДО) ЛЖ 250 мл, конечный систолический объем (КСО) ЛЖ 113 мл, фракция выброса (ФВ) ЛЖ 55%, толщина межжелудочковой перегородки (МЖП) 1,0 см, толщина задней стенки ЛЖ 1,1 см, митральная регургитация (МР) II степени, трикуспидальная регургитация (ТР) II—III степени, систолическое давление в легочной артерии (СДЛА) 36 мм рт.ст.
Объем ЛП с ушком, по данным компьютерной томографии (КТ), 322 мл. Принято решение о нецелесообразности проведения РЧА, рекомендована консервативная терапия: варфарин, бисопролол, периндоприл, торасемид. На этом фоне одышка сохранялась, появились и стали нарастать отеки нижних конечностей, увеличился в объеме живот, на 15 кг увеличилась масса тела.
В декабре 2011 г. обратился в клиническую больницу №83 ФМБА, где также рассматривалась возможность выполнения РЧА, была начата терапия амиодароном. К моменту госпитализации отмечено нарастание отеков, появление асцита, отека мошонки. Уровень мозгового натрийуретического пептида (BNP) составил 1075,90 пг/мл. По данным ЭхоКГ, увеличение всех камер сердца — правый желудочек (ПЖ) 4,2 см, правое предсердие (ПП) 356 мл, ЛП 168 мл, ЛЖ 226 мл, значительное расширение ствола легочной артерии (3,8 см), ФВ ЛЖ 48—53%, СДЛА 60 мм рт.ст., МР и ТР III степени. При чреспищеводной ЭхоКГ выявлено незаращение овального окна с непостоянным сбросом крови слева направо, при КТ легких — косвенные признаки тромбоэмболии легочной артерии (ТЭЛА), ее возможных источников не найдено. В результате усиления диуретической терапии (спиронолактон, ацетазоламид, торасемид) отмечено уменьшение одышки, отеков; от РЧА решено воздержаться.
Для определения дальнейшей тактики лечения в феврале 2012 г. пациент был госпитализирован в РКНПК. По данным ЭхоКГ, размеры камер сердца прежние, ФВ ЛЖ 48%, СДЛА 60 мм рт.ст., толщина МЖП 12 мм. По данным мультиспиральной компьютерной томографии (МСКТ) грудной клетки и сцинтиграфии, признаков ТЭЛА не отмечено, выявлена мягкотканая структура в клетчатке переднего средостения (в проекции тимуса) правильной формы размером 10×14 см, достоверно не накапливающая контрастный препарат (фиброз? лимфоузел? тимома?). При МСКТ сердца стенозов коронарных артерий, дефектов перегородок не выявлено.
При магнитно-резонансной томографии (МРТ) сердца признаков внутрисердечного сброса крови не отмечено (соотношение системного и легочного кровотока 1:1), КДР ПЖ 5,9 см, КДР ЛЖ 7,6 см, МР и ТР III степени. Обращало на себя внимание изменение створок митрального клапана (МК) по типу мезенхимальной дисплазии. Состояние было расценено как декомпенсированное гипертоническое сердце, консультирован в РНЦХ им. Б.В. Петровского, где рекомендовано проведение протезирования МК, пластики трикуспидального клапана и предсердий.
На фоне терапии состояние оставалось стабильным, одышка при обычных нагрузках не беспокоила, от хирургического лечения пациент отказался. В марте 2012 г. пациент обратился в клинику в Германии, где при коронарографии стенозов коронарных артерий не выявлено. Состояние было расценено как тахииндуцированная кардиомиопатия. После назначения амиодарона выполнена электрическая кардиоверсия с восстановлением синусового ритма, однако через 4 дня развился устойчивый рецидив МА. Назначен прием ривароксабана, небиволола, спиронолактона, телмисартана, рекомендована замена амиодарона дронедароном. От приема дронедарона пациент воздержался, обратился в поликлинику ФТК, госпитализирован для дальнейшего обследования и лечения.
При поступлении состояние пациента средней тяжести. Рост 192 см, масса тела 85 кг. Кожные покровы умеренно бледные, нормальной влажности. Подкожные вены варикозно не расширены, гемангиом на коже нет. Отеков нет. Периферические лимфатические узлы не увеличены. В легких дыхание с удлиненным выдохом, хрипов нет. Частота дыхательных движений 17 в минуту. Тоны сердца неритмичные, приглушены, выслушивается систолический шум у основания грудины. ЧСС 80 уд/мин, АД 140/80 мм рт.ст. Живот мягкий, безболезненный при пальпации. Печень увеличена на 1,5 см, селезенка не увеличена.
В общем анализе крови отмечено умеренное снижение уровня тромбоцитов до 107,7 тыс. (гемоглобин 135,6 г/л, эритроциты 4,2 млн, лейкоциты 4,3 тыс., формула не изменена, СОЭ 4 мм/ч).
В биохимическом анализе крови: общий белок 65,7 г/л, альбумин 42,6 г/л, глюкоза 4,8 ммоль/л, креатинин 1,13 мг/дл, мочевая кислота 470,9 (норма до 415) мкмоль/л, общий билирубин 26,3 мкмоль/л, прямой билирубин 11,0 мкмоль/л; γ-глутамилтрансфераза 70 ед/л (норма до 61), аспартат аминотрансфераза 33 ед/л, аланинаминотрансфераза 61ед/л, триглицериды 0,52 ммоль/л, общий холестерин 3,16 ммоль/л, холестерин липопротеидов низкой плотности 1,7 ммоль/л. Гормоны щитовидной железы в пределах нормы. В общем анализе мочи: рН 5,0, относительная плотность 1,010, прозрачность неполная, белка, сахара, ацетона, желчных пигментов нет, лейкоциты 1—3 в поле зрения, эритроциты 001 в поле зрения, слизи много, бактерии в умеренном количестве.
При электрофорезе белков, общем иммунологическом обследовании отклонений не выявлено (ревматоидный фактор, С-реактивный белок, антистрептолизин-О, антинуклеарный фактор – АНФ отрицательные, антитела к кардиолипину и ДНК в пределах нормы). В то же время существенно повышены титры антикардиальных антител (лаборатория иммуногистохимии ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова): при отсутствии специфического АНФ (с антигеном сердца быка) и антител к антигенам эндотелия, антитела к антигенам кардиомиоцитов, гладкой мускулатуры и волокон проводящей системы сердца выявлены в титре 1:320 (норма до 1:40). Методом полимеразной цепной реакции геномы вирусов герпетической группы и парвовируса В19 в крови не выявлены.
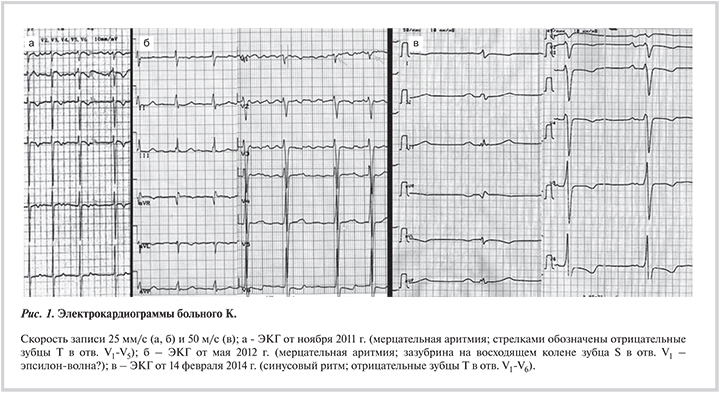
На ЭКГ (рис. 1, б) — МА, период волн ff 019 с., ЧСС 80/мин.
Электрическая ось сердца резко отклонена вправо. Признаки гипертрофии обоих желудочков. Комплекс QRS расширен (120 мс), отмечается зазубрина на восходящем колене зубца S в отведении V1. QT 400 мс (корригированный 440 мс). На ЭКГ от ноября 2011 г. (рис. 1, а) — отрицательные зубцы Т в отведении V1—V5. По трем критериям выявлены низкоамплитудные поздние потенциалы желудочков (QRS 118 мс при норме <114 las40="" 42="" 38="" rms40="" 9="" 5="">20 мкВ). При суточном мониторировании ЭКГ по Холтеру: МА, ЧСС днем 59—142 уд/мин (средняя 82 уд/мин), ЧСС ночью 53—90 уд/мин (средняя 70 уд/мин). Желудочковых полиморфных экстрасистол 614, куплетов 16, в течение всей записи. ST—T без динамики.
По данным ЭхоКГ (рис. 2, а): КДР ЛЖ 6,2 см (индекс 2,8 см/м2), КДО ЛЖ 209 мл (97,2), КСО ЛЖ 99 мл (46) ЛП 5,9 см (2,7), объем 280 мл (130,2), ПЖ 4,6 см, ПП 260 мл (120,9), толщина МЖП 1,3 см, толщина задней стенки ЛЖ 1,3 см, ФВ ЛЖ 53%, ФВ ПЖ 60%. Признаки некомпактного миокарда ЛЖ (соотношение некомпактного и компактного слоев 12 и 7 мм). Аортальный клапан: амплитуда раскрытия 2,5 см, регургитации нет, VTI 21,5 cм. МК: диаметр фиброзного кольца 4,0 см, регургитация II степени, dp/dt 1141 мм рт. ст., пик Е 142, Е' 15, Е/е 9,4. Трикуспидальный клапан: диаметр фиброзного кольца 4,3–5,0 см, регургитация II степени. СДЛА 48 мм рт.ст. Перикард не уплотнен, выпота нет. Незаращение овального окна с минимальным шунтированием слева направо.
По данным рентгенологического исследования органов грудной клетки, корни легких и калибр сосудов в прикорневых отделах верхних долей расширены (картина гиперволемии и легочной гипертензии), сердце значительно увеличено в размерах.
При ультразвуковом исследовании органов брюшной полости отмечены умеренное расширение вен печени, нижней полой вены (32,7 мм), а также мелкие кисты печени. Других структурных изменений не выявлено.
Таким образом, подтверждено наличие у пациента дилатации всех камер сердца с минимальным снижением сократимости ЛЖ, признаков умеренной легочной гипертензии с гиперволемией сосудов малого круга. Не получено данных, подтверждающих гипертоническое сердце (гипертрофия ЛЖ минимальна), тахииндуцированную кардиомиопатию (в течение длительного времени ЧСС близка к норме), гемодинамически значимого внутрисердечного сброса крови, пороков правых отделов сердца, констриктивного перикардита.
С учетом наличия в переднем средостении образования (возможно, тимомы) и существенного повышения титра всех антикардиальных антител, можно было предполагать роль аутоиммунных механизмов (миокардит, паранеопластический синдром) в развитии дисфункции миокарда.
 Кроме того, преобладание дилатации правых отделов сердца (по данным МРТ, увеличение ПЖ до 5,9 см с элементами его дискинезии), более 500 правожелудочковых экстрасистол в сутки, поздних потенциалов желудочков, отрицательных зубцов Т в отведении V1—V4 в анамнезе, возможно, эпсилон-волны на ЭКГ давали основания для постановки как минимум вероятного диагноза бивентрикулярной формы аритмогенной дисплазии правого желудочка (АДПЖ), согласно критериям 2010 г. [1]. Обнаружение некомпактного слоя миокарда ЛЖ подтверждало возможную генетическую природу поражения миокарда. При повторном анализе данных МРТ и МСКТ сердца жировых включений в миокарде не выявлено, толщина некомпактного слоя не достигала диагностического уровня (менее 2:1 по отношению к компактному), что позволяло констатировать лишь повышенную трабекулярность ЛЖ.
Кроме того, преобладание дилатации правых отделов сердца (по данным МРТ, увеличение ПЖ до 5,9 см с элементами его дискинезии), более 500 правожелудочковых экстрасистол в сутки, поздних потенциалов желудочков, отрицательных зубцов Т в отведении V1—V4 в анамнезе, возможно, эпсилон-волны на ЭКГ давали основания для постановки как минимум вероятного диагноза бивентрикулярной формы аритмогенной дисплазии правого желудочка (АДПЖ), согласно критериям 2010 г. [1]. Обнаружение некомпактного слоя миокарда ЛЖ подтверждало возможную генетическую природу поражения миокарда. При повторном анализе данных МРТ и МСКТ сердца жировых включений в миокарде не выявлено, толщина некомпактного слоя не достигала диагностического уровня (менее 2:1 по отношению к компактному), что позволяло констатировать лишь повышенную трабекулярность ЛЖ.
Тем не менее не вполне типичными для АДПЖ были малая агрессивность желудочковой аритмии, выраженная атриомегалия. Не получали объяснения тяжелая степень декомпенсации при очень умеренном снижении ФВ ЛЖ, выраженная дилатация легочной артерии и нижней полой вены. Имелись основания предполагать наличие ХСН с нормальной ФВ ЛЖ (критериями которой являются ФВ ЛЖ>50%, индексированный КДО ЛЖ<97 2="">8, уровень BNP>200 пг/мл при наличии признаков застоя [2]), однако причины ее оставались неясными.
Для повторного исключения хронической ТЭЛА, а также оценки размеров узлового образования в переднем средостении в динамике выполнена МСКТ органов грудной клетки с внутривенным контрастированием: легочный ствол и его ветви расширены (ствол 43 мм, правая ЛА 30 мм, левая 30 мм), дефекты контрастирования в ЛА и их ветвях до субсегментарного уровня не выявлены. В проекции тимуса определяется узловое образование размерами 20×14 мм, слабо накапливающее контрастный препарат (60—75 ед. Н) — лимфоузел? тимома? В связи с выраженным расширением нижней полой вены (36—46 мм, в области конфлюэнса до 53 мм) дополнительно оценены ее притоки: общие и внутренние подвздошные вены расширены, больше справа (до 45 мм). В полости малого таза (вокруг прямой кишки, простаты, семенных пузырьков, справа от мочевого пузыря) определяется артериовенозная мальформация (АВМ) с наличием множественных мелких и крупных извитых артериальных и венозных сосудов диаметром до 35 мм (рис. 3, см. цв. вклейку). Приносящие сосуды являлись ветвями правой внутренней подвздошной артерии (расширена до 28 мм). Нижняя брыжеечная артерия (расширена до 12 мм) также участвует в формировании АВМ. При МРТ эти данные подтверждены (клубок сосудов выполняет весь объем таза).
Впервые за время обследования пациента выявлена массивная тазовая сосудистая мальформация без отчетливых симптомов поражения тазовых органов. Согласно данным литературы, подобная мальформация может приводить к выраженному артериовенозному сбросу слева направо, резкой перегрузке объемом и развитию ХСН с высоким сердечным выбросом [3]. Дополнительным фактором декомпенсации и непосредственной причиной появления симптомов у данного пациента стало развитие устойчивой к лечению МА.
Клинический диагноз был сформулирован следующим образом. ДКМП: гиперволемическая (вследствие АВМ), аутоиммунная (паранеопластический синдром в рамках тимомы? инфекционно-иммунный миокардит?). Повышенная трабекулярность ЛЖ. Открытое овальное окно без гемодинамически значимого сброса. Легочная гипертензия. Относительная недостаточность митрального и трикуспидального клапанов (II—III степени). Нарушения ритма сердца: постоянная форма МА, желудочковая экстрасистолия. Артериальная гипертония (АГ) 3-й степени, гипертоническая болезнь II стадии, риск 4. ХСН с высоким сердечным выбросом IIБ стадии, II—III функционального класса (ФК) по NYHA. Массивная АВМ таза (с нижней брыжеечной и правой внутренней подвздошной артериями в качестве приносящих сосудов). Узловое образование переднего средостения (тимома? лимфоузел?).
Проводилась медикаментозная терапия: небиволол 10 мг/сут, варфарин 17,5 мг/нед, спиронолактон 50 мг/сут, торасемид 10 мг ежедневно, периндоприл 2,5 мг/сут, амиодарон 400—200 мг/сут, гидроксихлорохин 200 мг/сут. На фоне терапии сохранялась умеренная одышка. Пациент был консультирован кардиохирургами: прямое хирургическое вмешательство признано нецелесообразным в связи с большим количеством вовлеченных в мальформацию крупных сосудов и высоким риском геморрагических осложнений. Консультирован торакальным хирургом: образование в переднем средостении малых размеров, не требует верификации и хирургического лечения.
Пациент также консультирован в ряде ведущих московских центров и за рубежом, где получил отказ в хирургическом лечении в связи с высоким риском. В итоге больной был направлен в ФГБУ «Лечебно-реабилитационный центр» Минздрава РФ для рассмотрения вопроса о возможности эндоваскулярного лечения АВМ. В отделении рентгенохирургических методов диагностики и лечения ему выполнена ангиография инфраренального отдела аорты и артерий малого таза, на которой выявили основные афферентные артерии из ветвей правой и левой внутренних подвздошных артерий, а также из нижней брыжеечной артерии. Учитывая выраженные размеры АВМ и, как следствие, высокий риск развития синдрома малого выброса при одномоментной эмболизации всех афферентных ветвей, хирургическое вмешательство было решено выполнить в несколько этапов.
Все этапы выполнялись трансфеморальным контралатеральным доступом с применением стандартного инструментария. В марте 2013 г. наиболее крупные из приносящих ветвей левой внутренней подвздошной артерии с высокоскоростным артериовенозным сбросом были эмболизированы отделяемыми баллонами. Эмболизация более мелких афферентов выполнялась свободноотделяемыми и электролитически отделяемыми спиралями. Через 3 мес пациент был приглашен для выполнения второго этапа. На интраоперационной ангиографии сохранялись признаки заполнения АВМ через мелкие ветви левой внутренней подвздошной артерии. Была выполнена эмболизация оставшихся афферентов из левой внутренней подвздошной артерии, а также большей части афферентов из нижней брыжеечной артерии электролитически отделяемыми спиралями. Ветви правой внутренней подвздошной артерии был эмболизированы третьим этапом, в апреле 2014 г. Операция также выполнялась с помощью отделяемых спиралей.
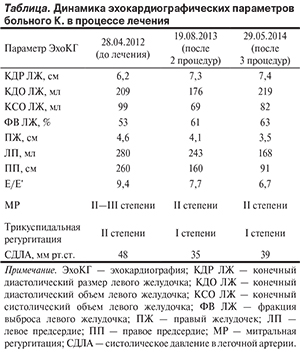
В результате серии интервенционных вмешательств отмечено существенное сокращение камер сердца, особенно правых, уменьшение степени регургитации на клапанах и легочной гипертензии (см. таблицу; см. рис. 2, б): Кроме того, на фоне длительной терапии амиодароном 200 мг/сут (с периодическим увеличением дозы до 400 мг/сут в связи с нарастанием желудочковой экстрасистолии) 12.02.14 отмечено восстановление синусового ритма, который сохраняется до настоящего времени (ноябрь 2014 г.); желудочковой экстрасистолии нет, сохраняется небольшое количество наджелудочковых экстрасистол. Данный факт рассматривается как весьма убедительное доказательство эффективности интервенционного лечения.
На фоне длительного приема гидроксихлорохина отмечено также снижение титра антикардиальных антител (к антигенам кардиомиоцитов 1:80, к антигенам волокон проводящей системы 1:160 при исходном титре 1:320 и более). Эпсилон-волна на ЭКГ не определяется, однако сохраняются неглубокие отрицательные зубцы Т во всех грудных отведениях (рис. 1, в).
Самочувствие пациента значительно улучшилось: одышка, слабость и перебои в работе сердца практически не беспокоят, повысилась толерантность к физическим нагрузкам, масса тела снизилась до 80 кг. Уменьшилась потребность в диуретиках (торасемид полностью отменен). Продолжается прием амиодарона, спиронолактона, лозартана, ривароксабана, β-адреноблокаторов и гидроксихлорохина.
Обсуждение
В представленном наблюдении пациент с умеренной АГ в анамнезе обратился к кардиологу в связи с появлением МА и возникшей при этом одышкой. Признаки дилатации всех камер сердца при ЭхоКГ позволили высказать предположение о наличии ДКМП. Дважды исключен коронарный атеросклероз, не получено убедительных данных, подтверждающих врожденные пороки сердца со сбросом слева направо, первичную легочную гипертензию. Высказывались предположения о хронической ТЭЛА, гипертоническом сердце, тахииндуцированной кардиомиопатии, однако диагноз оставался неясным.
На разных этапах рассматривалась возможность хирургического лечения (РЧА устьев легочных вен, протезирование МК).
Предпринятая, несмотря на выраженную атриомегалию, попытка электрической кардиоверсии не дала стойкого эффекта.
В ходе дальнейшего обследования выявлены стигмы возможного первичного (генетически детерминированного) поражения миокарда: признаки мезенхимальной дисплазии МК, повышенная трабекулярность ЛЖ, критерии АДПЖ. Не исключалась возможность аутоиммунного миокардита (клинически значимое повышение титров антикардиальных антител) при наличии тимомы. Но лишь выявление массивной тазовой АВМ позволило объяснить выраженную объемную перегрузку сердца, особенно правых его камер, при отсутствии клинически значимого снижения ФВ. Непосредственной причиной выраженной дилатации камер сердца явилась объемная перегрузка правых отделов вследствие патологического сброса большого объема крови из артерий непосредственно в притоки нижней полой вены.
В связи с этим отметим, что критерии АДПЖ имеют абсолютное значение лишь при отсутствии других заболеваний сердца, которые могут приводить к выраженной перегрузке ПЖ.
По-видимому, наличие гипо-, дискинезии и особенно микроаневризм ПЖ более специфично для АДПЖ (у представленного пациента этих признаков не было). В сомнительных случаях возрастает значение морфологической и генетической диагностики АДПЖ; кроме того, несомненную помощь в постановке диагноза оказывает выявление жировых включений в миокарде ПЖ (с помощью МРТ или МСКТ), хотя этот признак и не отнесен к критериям АДПЖ [1].
По сравнению с врожденными пороками сердца АВМ являются достаточно редкой причиной шунтирования крови. Данному пациенту не измеряли сердечный выброс, однако выявленная у него аномалия относится к своеобразной группе причин ХСН с высоким сердечным выбросом (более 8 л/мин или 3,9 л/мин/м2). Эта группа включает болезни Педжета (при поражении более 50% костей скелета), Рандю—Ослера и миеломную болезнь, при которых гемодинамически значимый сброс крови происходит на уровне мелких сосудов, а также тиреотоксикоз, анемии и септический шок. При тазовых АВМ симптомы ХСН могут быть единственным клиническим проявлением (при отсутствии более типичной дисфункции тазовых органов — боли, кровотечений, нарушений мочеиспускания и дефекации, почечной недостаточности). Ключом к постановке диагноза в нашем случае стала выраженная дилатация ветвей ЛА и нижней полой вены.
По сравнению с представленными в литературе описаниями необычным является поздний (50 лет) возраст появления развернутой клинической картины у пациента с массивной сосудистой аномалией. Практически полностью отсутствовали симптомы нарушения функции тазовых органов, типичные для АВМ подобной локализации, однако подобные ситуации неоднократно описаны. Можно предполагать, что объем сброса крови слева направо нарастал постепенно и долгие годы оставался не столь значительным, как это было выявлено в ходе настоящего обследования. Не вызывает, однако, сомнений врожденный характер патологического соустья. В свою очередь нарастание перегрузки венозной системы объемом приводило к дальнейшему увеличению объема шунтирования крови. Длительная компенсация может объясняться также относительно сохранным состоянием миокарда у пациента без атеросклероза и выраженного поражения сердца вследствие АГ: к срыву механизмов компенсации и быстрому прогрессированию симптомов привело лишь развитие МА. ХСН при этом была обусловлена несоответствием упавшего сердечного выброса и объема крови в системе полых вен.
Особенностями такой ХСН являются снижение периферического сосудистого сопротивления, увеличение венозного возврата, активация ренин-ангиотензин-альдостероновой системы с задержкой натрия и воды. Конечности, как правило, теплые, насыщение крови кислородом остается в пределах нормы. По данным ЭхоКГ типично выявление компенсаторной дилатации и гипертрофии как левых, так и правых камер сердца с нормальной ФВ. Основу медикаментозного лечения составляют диуретики, в то время как вазодилататоры могут приводить к ухудшению состояния.
Следует подчеркнуть, что у пациентов с АВМ развернутая картина ХСН отмечается редко (по некоторым данным, в 18% случаев [4]). Описаны гемодинамически значимые врожденные АВМ почек, легких, вены Галена, аортокавальные фистулы, ятрогенные (например, после гемодиализа, трансплантации почек, операций на позвоночнике) и посттравматические фистулы и пр. [5, 6]. Весьма характерно развитие ХСН в рамках синдрома Коудена, обусловленного мутациями в генах эндоглина (аctivin receptor-like kinase — ALK-1) и включающего врожденные геморрагические телеангиоэктазии и печеночные АВМ [7, 8].
В эксперименте был изучен характер морфологических изменений в миокарде при его длительной перегрузке объемом: к 21-й неделе отмечены гипертрофия кардиомиоцитов и гипофосфорилирование коннексина-43, однако не выявлено признаков некроза или воспаления [9]. С учетом этих данных высокие титры антикардиальных антител у пациента не могут рассматриваться как маркер вторичной воспалительной реакции в ответ на повреждение миокарда. У него также не выявлены признаки миастении, которая почти всегда наблюдается у пациентов с тимомой и аутоиммунным миокардитом. Среди пациентов с миастенией антитела к титину, белку калиевых каналов, рианодиновому рецептору выявляются с частотой от 12—15% до 60—80%; наихудший прогноз имеет ассоциированный с тимомой гигантоклеточный миокардит [10]. Однако миокардит может развиваться после резекции тимомы, что требует продолжения наблюдения за данным пациентом.
ХСН без радикального лечения АВМ может протекать тяжело и заканчиваться летально [11]. Выбор хирургических и интервенционных методов устранения сброса достаточно широк: алкогольная склеротерапия (малоэффективна при большом объеме сброса; возможно тромбообразование), эмболизация (в том числе интраоперационно [12]), комбинированная эмболосклеротерапия (с достижением полной ремиссии в 83,3%, 13]), имплантация стент-графта в сочетании с эмболизацией [14], хирургическое лечение (в том числе лапароскопическое [15]). Осложнения вмешательств включают очаговый некроз мочевого пузыря (4,5—8,3%), нарушения функции других тазовых органов, преходящую гемоглобинурию (22,7—54,5%) и легочную гипертензию, в том числе вследствие эмболии [12, 13], что делает выбор конкретной методики весьма непростым.
Периферические АВМ — сравнительно редкая патология. Они создают сложности не только для сосудистых хирургов, но и вызывают уникальные клинические проблемы, которые отчасти определяются их анатомическим расположением. Клинические проявления этих поражений чрезвычайно многообразны. Редкость этих поражений делает диагностический поиск очень трудным. При этом минимальный опыт большинства врачей в диагностике и лечении АВМ увеличивает масштабность проблемы, что часто приводит к неправильной диагностике, несоответствующим методам лечения, и, как следствие, плохим результатам лечения пациентов.
При выявлении крупных и гигантских АВМ хирургическое лечение связано с большой кровопотерей и высоким риском развития интраоперационых осложнений [16]. В связи с этим с учетом наличия современных эмболизатов, микрокатетеров и проводников эндоваскулярные методы лечения занимают приоритетные позиции при симптоматических и сложных периферических АВМ. Данный метод лечения обеспечивает безопасность и положительные лечебные результаты на длительный период с минимальным риском развития рецидива [17].
Тем не менее не стоит забывать и о междисциплинарном подходе и сочетании хирургических и эндоваскулярных методов лечения. Подобная тактика нередко применяется при сложных поражениях.
На примере данного клинического случая видно, что с помощью эндоваскулярного лечения удалось добиться уменьшения артериовенозного сброса и компенсации ХСН, однако тотальная окклюзия не достигнута с учетом наличия множественных мелких транзитных афферентов, сложных для эмболизации. В подобной ситуации требуется наблюдение с последующим решением вопроса о дальнейшей тактике лечения в случае рецидива сердечной недостаточности.



