Фатальные желудочковые аритмии по-прежнему остаются основной причиной внезапной сердечной смерти (ВСС), унося в экономически развитых странах до 2 человеческих жизней на 1000 населения в год [1]. ВСС может быть первым и единственным клиническим проявлением ишемической болезни сердца (ИБС), миокардита, гипертрофической или дилатационной кардиомиопатии (ДКМП) и других заболеваний [2, 3]. В настоящее время целый ряд клинических, инструментальных и лабораторных показателей рассматриваются в качестве предикторов желудочковых аритмий и ВСС. В этой связи многочисленные работы посвящены выявлению с помощью магнитно-резонансной томографии (МРТ) зон позднего накопления гадолиний-содержащего контрастного препарата в миокарде. Наличие таких зон ассоциировано с развитием аритмических осложнений у пациентов с дисфункцией миокарда желудочков ишемической и неишемической этиологии [3]. Выявляемым при МРТ сердца участкам позднего контрастирования соответствуют зоны некроза или фиброза миокарда, которые способны служить потенциальным субстратом для циркуляции волн re-entry при желудочковых тахикардиях (ЖТ) [4, 5]. В ряде работ продемонстрировано, что наличие рубца по данным МРТ, а также его выраженность и гетерогенность имеют значение как для возникновения спонтанных эпизодов ЖТ, так и для их индукции при проведении электрофизиологического исследования [6—8].
Согласно современным представлениям, активация аритмогенного субстрата, которым служит электрически нейтральная рубцовая зона, происходит под действием триггерных воздействий, одним из которых может быть воспаление. В современной литературе воспаление миокарда рассматривается как одно из ключевых патогенетических звеньев такого заболевания, как ДКМП. Развитие аутоиммунных реакций при этом является одним из основных механизмов, способствующих патологическому ремоделированию сердца. Большое число работ посвящено изучению роли аутоантител (ауто-АТ) к β1-адренорецептору и М2-холинорецептору в патогенезе ДКМП [9]. Частота выявления ауто-АТ к β1-адренорецептору в сыворотке больных ДКМП, по разным данным, варьирует от 26 до 60% [10, 11]. Их появление связывают с ухудшением сократительной функции миокарда левого желудочка (ЛЖ), повышением частоты развития желудочковых аритмий и более высоким риском ВСС. Экспериментальные данные свидетельствуют о способности ауто-АТ к β1-адренорецептору снижать плотность калиевых каналов кардиомиоцитов, вызывая появление ранних постдеполяризаций как потенциального триггера желудочковых аритмий [12].

Таким образом, данные литературы свидетельствуют о том, что наличие очагового фиброза миокарда является необходимым условием возникновения желудочковых аритмий. В то же время активация аутоиммунных механизмов может служить дополнительным пусковым фактором, активирующим аритмогенную зону. В связи с этим целью нашей работы была оценка возможных связей между очаговым фиброзом миокарда (по данным МРТ сердца), периферическими маркерами аутоиммунного воспаления и желудочковыми нарушениями ритма (ЖНР) у больных ДКМП.
Материал и методы
В исследование были включены 35 больных (20 мужчин и 15 женщин, средний возраст 44,2±12,1 года, группа ДКМП), данные клинико-инструментального обследования которых соответствовали клиническому диагнозу ДКМП. Диагноз ДКМП был установлен в соответствии с критериями Рабочей группы по кардиомиопатиям ВОЗ [13].
Клинико-инструментальное и лабораторное обследование включало общеклинический и биохимический анализы крови, общий анализ мочи, определение концентрации тироксина (Т4) и тиреотропного гормона в сыворотке крови, регистрацию электрокардиограммы (ЭКГ) в 12 отведениях, эхокардиографию (ЭхоКГ), суточное мониторирование ЭКГ по Холтеру, коронарографию (КГ).
У всех больных этой группы (табл. 1) регистрировались клинические проявления сердечной недостаточности, соответствующие II—IV функциональному классу по классификации NYHA. Длительность заболевания от момента клинического дебюта у пациентов группы ДКМП составила 1,25 (0,75; 3,0) года. Оценить истинную продолжительность заболевания в большинстве случаев не представлялось возможным в связи с предполагаемым протяженным по времени периодом субклинического снижения сократительной функции ЛЖ.

Результаты ЭхоКГ, проведенной у пациентов группы ДКМП, подтвердили наличие дилатированных камер сердца и снижение сократительной функции ЛЖ (конечный диастолический размер ЛЖ составил 7,1±0,8 см, конечный систолический размер ЛЖ 5,5±1,5 см, переднезадний размер правого желудочка 3,5±0,6 см, фракция выброса ЛЖ 37±11,3%). У 15 (42,9%) больных наблюдалось повышение давления в легочной артерии — в среднем 35,0 (21,5; 50) мм рт.ст.
 Для исключения ИБС как возможной причины расширения камер сердца всем больным проводили КГ, по результатам которой клинически значимых поражений коронарных артерий не выявлено. Исключение у пациентов этой группы гипертонической болезни, пороков сердца, а также связь клинического дебюта с респираторным заболеванием (у ряда пациентов) дали основание предположить воспалительную природу имеющейся ДКМП.
Для исключения ИБС как возможной причины расширения камер сердца всем больным проводили КГ, по результатам которой клинически значимых поражений коронарных артерий не выявлено. Исключение у пациентов этой группы гипертонической болезни, пороков сердца, а также связь клинического дебюта с респираторным заболеванием (у ряда пациентов) дали основание предположить воспалительную природу имеющейся ДКМП.
Обследование всех пациентов группы ДКМП проводилось на фоне медикаментозной терапии, включавшей ингибиторы ангиотензинпревращающего фермента (АПФ) или блокаторы рецепторов ангиотензина, β-адреноблокаторы, диуретики. Антиаритмические препараты и дигоксин на момент включения в исследование не получал никто (см. табл. 1).
Всем пациентам группы ДКМП помимо стандартного клинико-инструментального обследования выполняли МРТ сердца с контрастированием и определяли уровни антител (АТ) к β1-адренорецептору, М2-холинорецептору.
Вторая группа исследования была сформирована из 12 здоровых добровольцев (4 мужчин и 8 женщин, средний возраст 31,06±10,4 года), которые являлись группой сравнения при оценке уровня ауто-АТ.
Методика выполнения МРТ сердца с внутривенным контрастированием. МРТ сердца при синхронизации с ЭКГ выполнялась у всех пациентов группы ДКМП на сверхпроводящем магнитно-резонансном томографе Magnetom Avanto с напряженностью магнитного поля 1,5 Тл, с поверхностной радиочастотной катушкой для грудной клетки. Стандартный протокол исследования включал серии Т1-взвешенных изображений по методике Turbo Spin Echo (TR соответствовало интервалу R—R; ТЕ 25 см; толщина среза 8 мм; поле изображения 35—38 см; два усреднения; 10—12 срезов) для оценки анатомии исследуемой области серию исследований по методике кино-МРТ (True FISP: поле 35 см, толщина среза 8 мм, количество кадров в кинопетле от 12 до 16 в зависимости от частоты сердечных сокращений) в двух- и четырехкамерной проекциях по длинной оси и по короткой оси ЛЖ от основания до верхушки для оценки функции ЛЖ и массы и объема миокарда ЛЖ. Для проведения исследования с контрастированием вводили внутривенно контрастный препарат гадолиний — ДТПА в дозировке 0,15 ммоль/кг. Через 10 мин после введения препарата оценивали наличие позднего контрастирования с помощью специальной сегментированной последовательности inversion-recovery (IR) (TR=207 мс, ТЕ=4 мс, угол отклонения вектора намагниченности 40°, матрица 128×256, поле изображения 30 и 35 см, толщина среза 8 мм, количество усреднений 8). Время отклонения вектора намагниченности (TI) составляло, как правило, 240—300 мс (подбор проводили с помощью специальной программы TI-Scout). Оценку изображений выполняли по 17-сегментарной схеме на 3 срезах по короткой оси ЛЖ [14].
Для количественной оценки позднего контрастирования миокарда на каждом срезе в двухкамерной проекции по короткой оси ЛЖ с помощью ручного обведения определяли площадь контрастированного миокарда, результаты по каждому срезу затем суммировали. Для вычисления объема миокарда с поздним контрастированием гадолинием полученный результат умножали на толщину среза миокарда. Затем определяли процент пораженного миокарда по отношению к общему объему миокарда, вычисленному по результатам кино-МРТ.
Методика определения ауто-АТ к β1-адренорецептору и М2-холинорецептору. Всем пациентам группы ДКМП и лицам из группы здоровых добровольцев проводили определение уровня IgG и IgM к β1-адренорецептору и М2-холинорецептору. В ходе работы использовали линейные антигенные детерминанты, моделирующие 2-ю внеклеточную петлю β1-адренорецептора, 1-ю и 2-ю внеклеточную петлю М2-холинорецептора (табл. 2).
Использованные в работе полипептиды получены в лаборатории синтеза пептидов Института экспериментальной кардиологии ФГБУ «РКНПК» МЗ РФ. Для получения линейных полипептидов применяли твердофазный метод с использованием Fmoc-методологии. Полипептиды синтезированы в ручном варианте по стандартным протоколам твердофазного синтеза и после необходимых постсинтетических процедур очищены до чистоты не менее 95% с использованием обращенно-фазовой жидкостной хроматографии высокого разрешения (ОФ-ЖХВР).
 Для создания высокоэффективных синтетических антигенов, наиболее близко повторяющих структуру и антигенные свойства природного антигена — мускаринового рецептора, предприняты попытки получения двух новых конформационных синтетических антигенов — «химерных» молекул, в которых пептидные цепочки, соответствующие разным внеклеточным петлям этих белков, соединены дисульфидными связями. Кроме того, для получения искусственного антигена, наиболее близко повторяющего пространственную структуру 2-й внеклеточной петли β1-адренорецептора, в лаборатории генной инженерии Института экспериментальной кардиологии РКНПК рассчитана структура полипептида β25. Одним из факторов стабилизации этой молекулы являются две дисульфидные связи между двумя парами остатков цистеина Cys209—Cys215 и Cys199—Cys220. Химерные молекулы, представляющие собой несимметричные дисульфиды, и пептид β25, представляющий бициклический дисульфид, получены методами классической пептидной химии в растворе и очищены с помощью ОФ-ЖХВР. Структура пептидов подтверждена данными масс-спектрометрии и 1Н-ЯМР-спектроскопии; гомогенность пептидов — данными аналитической ЖХВР.
Для создания высокоэффективных синтетических антигенов, наиболее близко повторяющих структуру и антигенные свойства природного антигена — мускаринового рецептора, предприняты попытки получения двух новых конформационных синтетических антигенов — «химерных» молекул, в которых пептидные цепочки, соответствующие разным внеклеточным петлям этих белков, соединены дисульфидными связями. Кроме того, для получения искусственного антигена, наиболее близко повторяющего пространственную структуру 2-й внеклеточной петли β1-адренорецептора, в лаборатории генной инженерии Института экспериментальной кардиологии РКНПК рассчитана структура полипептида β25. Одним из факторов стабилизации этой молекулы являются две дисульфидные связи между двумя парами остатков цистеина Cys209—Cys215 и Cys199—Cys220. Химерные молекулы, представляющие собой несимметричные дисульфиды, и пептид β25, представляющий бициклический дисульфид, получены методами классической пептидной химии в растворе и очищены с помощью ОФ-ЖХВР. Структура пептидов подтверждена данными масс-спектрометрии и 1Н-ЯМР-спектроскопии; гомогенность пептидов — данными аналитической ЖХВР.
Определение ауто-АТ проводили стандартным непрямым иммуноферментным методом. Учет результатов реакции иммуноферментного анализа осуществляли на спектрофотометре «Immunotech LMA01» при длине волны λ=450 нм. Для проведения иммуноферментного анализа использованы реагенты, входящие в состав коммерческого тест-набора «АмерКард Анти-TmsA», применяемого для определения АТ к микросомальной фракции щитовидной железы в сыворотке крови человека (ТУ 9398-370-00228753-00).
Уровень искомых ауто-АТ определяли как отношение оптической плотности — ОП450 иммуноферментной реакции исследуемого образца к рассчитанной критической оптической плотности — ОПкрит., которая определялась по формуле: ОПкрит = ОПсред+ удвоенное стандартное отклонение, где ОПсред — среднеарифметический результат по всем исследуемым сывороткам крови пациентов.
Положительными считали образцы, отношение ОП которых к ОПкрит было больше или равно 1,0.
Статистическая обработка полученных результатов включала методы описательной статистики: вычисление средних, стандартных отклонений, а также медианы и 25-го и 75-го перцентилей, определение F-критерия Фишера. Сравнение групп осуществляли с помощью критерия Стьюдента для нормальных распределений, а также U-критерия Манна—Уитни для ненормальных распределений. Различия при р<0,05 считали статистически значимыми. Корреляционный анализ между переменными проводили по методу Спирмена. Ввод данных, их редактирование и статистический анализ осуществляли с помощью статистического пакета Статистика 8.
Результаты
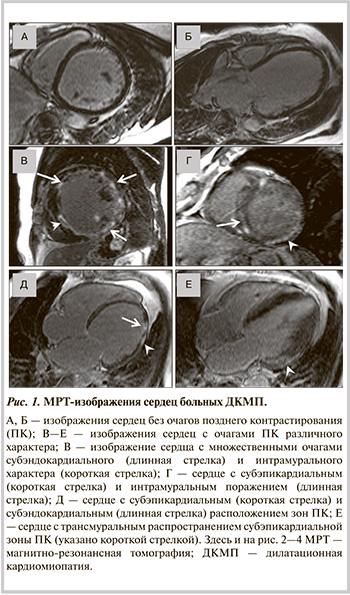
По данным МРТ, очаги позднего контрастирования выявлены у 15 из 35 (43%) больных ДКМП. Число пораженных сегментов у больных с феноменом позднего контрастирования колебалось от 2 до 17. Доля пораженного миокарда составляла 6,5—59%, в среднем 26,6% (12,3; 41,7), что указывало на тяжелое фиброзно-некротическое поражение ЛЖ. Отчетливых закономерностей в расположении очагов позднего контрастирования не прослеживалось, однако наиболее часто встречалось поражение базальных и средних сегментов боковой стенки ЛЖ и межжелудочковой перегородки. Обращает внимание различный характер участков позднего контрастирования: встречались интрамуральные, субэпикардиальные, трансмуральные и субэндокардиальные очаги (рис. 1).

У 2 из 15 (13,3%) больных отмечались очаги всех 4 типов, у 6 (40%) больных регистрировались интрамуральные, сочетающиеся с субэндокардиальными или субэпикардиальными зоны накопления контрастного вещества. Наиболее типичный субэпикардиальный тип накопления гадолиния обнаружен у 2 (13,3%) больных, еще у 5 (33,3%) субэпикардиальные очаги сочетались с трансмуральными. Необходимо отметить, что изолированный субэндокардиальный тип накопления контрастного вещества, характерный для поражения миокарда вследствие ИБС, ни у одного из больных обследованной группы не выявлялся. Субэндокардиальные очаги, обнаруженные у наших больных, сочетались с очагами других типов и топографически не соответствовали коронарным бассейнам, что свидетельствовало о поствоспалительном характере поражения миокарда.
 Таким образом, МРТ сердца с отсроченным контрастированием гадолиний-содержащим препаратом позволила в 43% случаев выявить очаги фиброза, а характер накопления контрастного вещества свидетельствовал о воспалительной природе поражения миокарда.
Таким образом, МРТ сердца с отсроченным контрастированием гадолиний-содержащим препаратом позволила в 43% случаев выявить очаги фиброза, а характер накопления контрастного вещества свидетельствовал о воспалительной природе поражения миокарда.
По результатам МРТ больные ДКМП были разделены на подгруппы в зависимости от наличия (n=15) или отсутствия (n=20) зон позднего контрастирования, проведено сопоставление клинико-инструментальных данных выделенных подгрупп.
В ходе этого сравнения обнаружено, что для больных с диагностированным при МРТ очаговым фиброзом миокарда характерны более высокие количественные проявления желудочковой эктопической активности по данным холтеровского мониторирования ЭКГ: 3643 (983; 8923) желудочковые экстрасистолы за сутки у лиц с очагами позднего контрастирования против 1091 (80; 2403) у лиц без очагов позднего контрастирования (р=0,047) (рис. 2, А).
В связи с тем что ЖНР у больных ДКМП оценивались не в условиях отмены лекарственных препаратов (β-адреноблокаторы), различия в медикаментозной терапии могли повлиять на достоверность различий по проявлениям желудочковой эктопической активности в подгруппах с очаговым фиброзом миокарда и без него. В связи с этим дополнительно проведена оценка влияния проводимой лекарственной терапии на количественные проявления желудочковых аритмий в указанных подгруппах. Сопоставление подгрупп с очаговым фиброзом миокарда и без него показало, что число больных, получавших β-адреноблокаторы в максимально переносимых дозах, в обеих группах оказалось сопоставимым: 86,7% в подгруппе с очаговым фиброзом и 90% в подгруппе без очагов позднего контрастирования (р=0,89).
В дальнейшем у всех больных группы ДКМП, а также у 12 здоровых добровольцев нами проанализирован уровень ауто-АТ к поверхностным мембранным рецепторам — β1 и М2 (рис. 3).
Чаще всего у больных ДКМП наблюдался повышенный уровень ауто-АТ класса IgG к β1-адренорецептору: АТ к пептидной последовательности β8 определялись в 68,6% случаев, к β25 — в 31,4%. Несколько реже в этой группе встречались больные с положительными АТ к М2-холинорецептору, в частности, IgG к последовательности MRI—MRIV выявлялись у 31,4% больных.
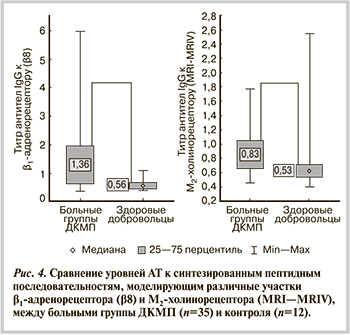
При сравнительном анализе уровней ауто-АТ среди пациентов с ДКМП и здоровых добровольцев статистически значимые различия получены только для АТ класса IgG к β8 — 1,36 (0,67; 1,96) против 0,56 (0,5; 0,73; p=0,0015) и класса IgG к MRI—MRIV — 0,83 (0,65; 1,05) против 0,63 (0,53; 0,71; p=0,032) (рис. 4).
Таким образом, у пациентов группы ДКМП в сыворотке выявляются АТ как к β1-адренорецептору, так и к М2-холинорецептору, уровень которых статистически значимо выше, чем у здоровых добровольцев.
Отдельное сопоставление аутоиммунных показателей в ранее выделенных подгруппах больных с очаговым фиброзом по данным МРТ и без него продемонстрировало, что уровень ауто-АТ класса IgG к β1-адренорецептору (β25) у пациентов с феноменом позднего контрастирования в миокарде достоверно выше, чем у больных без признаков позднего контрастирования, — 1,2 (0,79; 2,05) против 0,79 (0,55; 0,95; p=0,019) (см. рис. 2, Б). Эти наблюдения побудили нас к дополнительному проведению корреляционного анализа. В ходе этого анализа была подтверждена взаимосвязь между объемом очагового фиброза миокарда по данным МРТ сердца с контрастированием и ауто-АТ к β1-адренорецептору (β25): чем больше был объем пораженного миокарда, тем выше уровень IgG к полипептидной последовательности β25 (рис. 5). Кроме того, повышенный уровень АТ класса IgG к β1-адренорецептору (β25) оказался напрямую связан с количественными проявлениями ЖНР сердца у больных ДКМП: в ходе анализа выявлена сильная корреляция между уровнем ауто-АТ класса IgG к β25 и общим количеством желудочковых экстрасистол и тахикардий (r=0,71 и r=0,55 соответственно; p<0,05).
Таким образом, в ходе анализа выявлена связь между очаговым фиброзом миокарда по данным МРТ сердца с контрастированием, уровнем АТ к β1-адренорецептору, в частности, к синтезированной полипептидной последовательности β25, и ЖНР у больных с ДКМП.

Обсуждение
ЖНР сердца — один из ключевых факторов, определяющих прогноз жизни пациентов с ДКМП. В этой связи выявление факторов, ассоциированных с желудочковыми аритмиями, является необходимым для прогнозирования желудочковых аритмий и уточнения лечебных подходов. Субстратом, предрасполагающим к развитию желудочковых аритмий, по мнению ряда исследователей, служит крупноочаговый фиброз миокарда. В связи с этим возможность непосредственной оценки структуры миокарда и выявления участков фиброза с помощью содержащего гадолиний контрастного вещества позволила МРТ занять лидирующие позиции среди всех инструментальных методов визуализации в диагностике заболеваний сердца. Данные литературы свидетельствуют о неблагоприятной прогностической роли зон позднего контрастирования в развитии угрожающих жизни эпизодов аритмии у пациентов с систолической дисфункцией миокарда [14—17]. Связь между наличием зон позднего контрастирования и риском развития желудочковых аритмий у пациентов со сниженной ФВ ЛЖ как ишемической, так и неишемической этиологии подтверждена и в результате большого мета-анализа, включившего более 1000 больных [3].
Сходная ассоциация очагового фиброза миокарда и желудочковых аритмий продемонстрирована и в нашем исследовании: больные с участками накопления гадолиния в миокарде отличаются достоверно более высокими количественными проявлениями желудочковой эктопической активности. Вероятно, появление участков некроза и фиброза приводит к гетерогенности тканей миокарда, в том числе электрической, что может служить субстратом для возникновения и поддержания желудочковой экстрасистолии и тахикардии.
Интересным фактом стала выявленная тесная корреляция между долей миокарда с поздним контрастированием по данным МРТ, ЖНР, а также уровнем ауто-АТ к β1-адренорецептору, в частности, IgG к полипептидной последовательности β25. Согласно современным представлениям о роли инициирующих факторов в развитии нарушений ритма сердца, возникновение большинства ЖТ является результатом активации «спящего» аритмогенного субстрата в миокарде желудочков под действием пускового (триггерного) фактора в условиях, благоприятствующих этому процессу индивидуальных «модулирующих» внешних влияний на сердце [18—20]. Рубцовые участки сердца теряют способность к сокращению и становятся электрически нейтральными, в то время как в миокарде зон, «пограничных» рубцовым, возникает широкий спектр электрофизиологических нарушений. Как показали многочисленные исследования [18, 19, 21], аритмогенный субстрат ЖТ в большинстве случаев располагается на границе рубцового (электрически нейтрального) и жизнеспособного миокарда. Можно предположить, что у больных исследованной нами группы именно в этих участках могут располагаться зоны перифокального воспаления. При этом активность воспаления в этих участках миокарда может поддерживаться вследствие аутоиммунных механизмов, отражением которых служат циркулирующие ауто-АТ. Данная гипотеза подтверждена в ходе нашего исследования, обнаружившего сильную прямую корреляцию между долей миокарда с поздним контрастированием и уровнем IgG к β25.
Необходимо отметить, что связь очагового фиброза миокарда с уровнем ауто-АТ к β1-адренорецептору и ЖНР выявлена, несмотря на проводимую у больных ДКМП терапию β-адреноблокаторами. Хотя вполне возможно, что в условиях отмены препаратов подобные ассоциации были бы сильнее с учетом имеющихся в литературе данных о положительном эффекте терапии β-адреноблокаторами (карведилолом) на частоту возникновения желудочковых аритмий у больных с повышенными уровнями ауто-АТ к β1-адренорецептору [22].
В ходе выполненной нами работы оценивались уровни ауто-АТ не только к β1-адренорецептору, но и к М2-холинорецептору. В настоящее время роли этих ауто-АТ в развитии и поддержании ЖНР сердца в литературе уделяется гораздо меньше внимания. По данным проспективного исследования J. Pei и соавт., не обнаружено прогностического значения ауто-АТ к М2-холинорецептору в развитии ВСС [23]. В то же время у обследованных нами лиц с ДКМП зарегистрированы достоверно более высокие уровни ауто-АТ класса IgG к М2-холинорецептору (MRI–MRIV) по сравнению с группой контроля, однако корреляции как с наличием очагов фиброза, так и с выраженностью ЖНР сердца выявить не удалось.
Опираясь на результаты проведенного исследования, можно сделать вывод, что именно ауто-АТ к β1-адренорецептору в большей степени подходят на роль триггерного фактора, способного дополнительно модифицировать имеющийся аритмогенный субстрат — по-граничную рубцу зону с перифокальным воспалением — и вызывать развитие желудочковых аритмий.
Выводы
В сыворотке 68,6% больных дилатационной кардиомиопатией обнаруживаются аутоантитела класса IgG к β1-адренорецептору, у 31,4% больных — аутоантитела класса IgG к М2-холинорецептору.
Магнитно-резонансная томография сердца с контрастированием позволяет выявлять очаги позднего накопления гадолиния поствоспалительного характера у 43% больных дилатационной кардиомиопатией.
Наличие крупноочагового фиброза миокарда по данным магнитно-резонансной томографии наряду с выявлением аутоантител класса IgG к β1-адренорецептору тесно ассоциируется с наличием желудочковых нарушений ритма сердца у больных дилатационной кардиомиопатией. Это позволяет использовать данные магнитно-резонансной томографии сердца, а также уровень антител к β1-адренорецептору в качестве дополнительных маркеров в определении риска желудочковых нарушений ритма у лиц с дисфункцией левого желудочка, в том числе с дилатационной кардиомиопатией.
Статья написана в рамках проведения работ по Соглашению № 14.604.21.00.68 от 27.06.2014 ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2014—2020 гг.», уникальный идентификатор соглашения RFMEF160414X0068.



