Сахарный диабет (СД) — является частой сочетанной патологией у больных хронической сердечной недостаточностью (ХСН). Известно, что СД увеличивает риск развития сердечной недостаточности (СН) приблизительно в 2,5 раза [1]. Эпидемиологические исследования и данные международных клинических испытаний с участием больных СН свидетельствуют, что СД встречается в 20—25% всех случаев [2, 3].
Разумеется, СД является не безмолвным «свидетелем», а важнейшим «соучастником». Согласно результатам различных популяционных и клинических исследований, СД увеличивает риск смерти пациентов с СН в 1,29—3,19 раза [4, 5]. Механизмы негативного влияния СД на течение и прогноз ХСН являлись предметом изучения соответствующих исследований. Свойственные СД морфофункциональные и биохимические изменения миокарда, совокупность которых принято называть диабетической кардиомиопатией, сопровождаются как нарушениями диастолических процессов, так и снижением сократительной способности миокарда [6]. Выявлен целый ряд ассоциированных с СД факторов прогрессирования СН: хроническая гипергликемия [7], диабетическая нефропатия [5] и сердечно-сосудистая автономная нейропатия [8], инсулинорезистентность и дисфункция эндотелия [9], нарушения системы гемостаза [10] и гиперпродукция провоспалительных цитокинов [11].

Наименее изученной остается роль СД в патогенезе нарушений ритма сердца у больных СН. Следует принять во внимание, что причиной 2/3 всех случаев летальных исходов у больных СН II—III функционального класса (ФК) является внезапная смерть [12]. Основным механизмом внезапной смерти (до 85%) считаются желудочковые нарушения ритма [13]. При этом известно, что с СД ассоциирована более высокая распространенность нарушений ритма у больных, госпитализированных по поводу сердечно-сосудистой патологии [14]. Кроме того, СД является независимым фактором риска фибрилляции желудочков [15].
Гипогликемию можно считать наиболее известным проаритмогенным диабетическим фактором [16—18]. Экспериментальные данные свидетельствуют о том, что гипергликемия также может вызывать электрическую нестабильность желудочков [19]. У больных острым инфарктом миокарда, осложненным устойчивой желудочковой тахикардией или фибрилляцией желудочков, выявлена отчетливая связь между гипергликемией и больничной летальностью [20].
Спектр дисгликемии не ограничивается низкими и высокими уровнями глюкозы в крови. Немаловажным компонентом дисгликемии у больных СД является выраженность флуктуаций гликемии в течение определенного времени (вариабельность уровня глюкозы в крови) [21]. Имеются доказательства влияния вариабельности уровня глюкозы в крови на развитие сердечно-сосудистых осложнений при СД [22]. Поиск связи флуктуаций гликемии с нарушениями ритма сердца лег в основу проведенного нами исследования.
Цель исследования: оценить влияние вариабельности уровня глюкозы в крови в течение суток на желудочковую эктопическую активность у больных ХСН, страдающих СД 2-го типа.
Материал и методы
Проведено наблюдательное исследование, в которое включены 80 пациентов с ХСН, страдающих СД 2-го типа.

Диагноз ХСН устанавливали согласно критериям Российских национальных рекомендаций по диагностике и лечению (2009), диагноз СД — по критериям ВОЗ (1999). ФК ХСН определяли по результатам пробы с 6-минутной ходьбой. Морфофункциональные параметры сердца изучали методом эхокардиографии с помощью аппарата LOGIQ 5 EXPERT. Продолжительность наблюдения составила 6 мес.
Протокол исследования включал 3-кратное суточное холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ) с помощью системы Миокард-Холтер на визите включения, через 3 и 6 мес. В период между первым визитом и визитом 3-го мес 7 пациентов умерли. Причинами смерти явились: острое нарушение мозгового кровообращения — 1 больной; мезентериальный тромбоз — 1; терминальная стадия ХСН — 2; повторный острый ИМ — 3. Поэтому повторное мониторирование ЭКГ на визитах 3-го и 6-го мес проводили 73 пациентам.
 Самоконтроль уровня глюкозы в крови осуществлялся с помощью глюкометоров Accu-Check Active. Пациенты вели дневники самоконтроля уровня глюкозы в крови и гипогликемических состояний в течение всего времени исследования. В течение суток на фоне ХМ ЭКГ исследовали суточный профиль гликемии в 8 временны'х точках — перед основными приемами пищи, через 2 ч после основных приемов пищи, перед сном и в 3 ч ночи.
Самоконтроль уровня глюкозы в крови осуществлялся с помощью глюкометоров Accu-Check Active. Пациенты вели дневники самоконтроля уровня глюкозы в крови и гипогликемических состояний в течение всего времени исследования. В течение суток на фоне ХМ ЭКГ исследовали суточный профиль гликемии в 8 временны'х точках — перед основными приемами пищи, через 2 ч после основных приемов пищи, перед сном и в 3 ч ночи.
У 20 пациентов проводили комбинированное мониторирование, включающее непрерывное мониторирование уровня глюкозы с помощью аппарата CGMS System Gold MiniMed и ХМ ЭКГ.
Желудочковыми аритмиями высоких градаций (ЖАВГ) считали формы D—E желудочковых аритмий (ЖА) и 4—5-ю градации ЖА по классификации R.J. Myerburg [23], т.е. к ЖАВГ относили частые (более 30 в час) и очень частые (более 60 в час) преждевременные желудочковые комплексы, а также пароксизмы неустойчивой и устойчивой желудочковой тахикардии.
Для оценки суточной вариабельности уровня глюкозы в крови использовали показатель средней амплитуды гликемического размаха, MAGE (Mean Amplitude of Glycemic Excursions). Показатель MAGE рассчитывали как среднеарифметическое абсолютных значений разности уровня глюкозы соседних экстремумов, причем в расчете используются только абсолютные значения разности, превышающие одно стандартное отклонение от среднего уровня глюкозы в крови [24].
Общая характеристика пациентов изучаемой когорты на момент включения представлена в табл. 1. Пациенты получали стандартную терапию ХСН. Ингибиторы ангиотензинпревращающего фермента (АПФ) принимали 70 (87%) больных, антагонисты рецепторов к ангиотензину — 12 (15%), β-адреноблокаторы — 77 (96%), тиазиды — 49 (61%), петлевые диуретики — 34 (43%), антагонисты альдостерона — 50 (62%), дигоксин — 10 (12%). Специфические антиаритмические препараты не назначали. В структуре лечения СД 2-го типа на момент включения в исследование монотерапию метформином получали 3 (4%) больных, монотерапию производными сульфонилмочевины — 22 (27%), комбинацию метформина и сульфонилмочевины — 16 (20%), монотерапию инсулином — 10 (12%), комбинацию инсулина и пероральных гипогликемизирующих препаратов — 17 (21%); 12 (15%) пациентов находились на диетотерапии.
Статистическую обработку данных выполняли с помощью пакета прикладных программ Statistica 6.0. При описании количественных данных использовали медианы и интерквартильные интервалы. При анализе связи двух признаков применяли ранговую корреляцию по Спирмену. При анализе двух несвязанных групп использовали U-критерий Манна—Уитни. При сравнении частот бинарного признака в двух несвязанных группах применяли критерий χ2 Пирсона. При анализе зависимости бинарного признака от нескольких признаков использовали метод логистической регрессии. Критическим уровнем статистической значимости считали p<0,05.
Результаты
При ХМ ЭКГ на первом визите ЖАВГ были зарегистрированы у 22 пациентов. На визите 3-го мес ЖАВГ обнаружены у 3 из тех 22 больных, которые имели аритмии при первом мониторировании, а также у 11 пациентов, у которых ранее проведенное обследование аритмий не выявляло. На визите 6-го мес ЖАВГ выявлены у 9 больных, не имевших этих нарушений ритма в ходе мониторирований ЭКГ на предшествующих визитах. Таким образом, ЖАВГ в ходе 3-кратного ХМ выявлены у 42 (53%) пациентов (рис. 1).
Следует отметить, что в исследуемой когорте не было больных, осмотренных врачем-аритмологом и практически ни у кого из них не было жалоб, обусловленных ЖА. При том, что рассматриваемые нами нарушения ритма выявлены более чем у 50% пациентов. Результаты ХМ ЭКГ сопоставлены с данными дневников самоконтроля гликемии и толерантностью к физической нагрузке. Медиана и интерквартильные интервалы MAGE составили 3,7 (2,7; 4,9) ммоль/л, пробы с 6-минутной ходьбой — 283 (180; 320) м. В ходе анализа зависимости между наличием ЖАВГ и показателями вариабельности уровня глюкозы в крови и тяжести СН методом логистической регрессии (табл. 2) выяснилось, что выраженные суточные флуктуации гликемии (MAGE>5 ммоль/л) увеличивали риск появления желудочковых нарушений ритма в 2,3 раза (р=0,04). Проаритмический эффект значительных колебаний уровня глюкозы в крови оказался сопоставим по силе с повышением тяжести СН: переход от одного ФК к другому сопровождался увеличением риска развития ЖА в 1,7 раза (p=0,04).
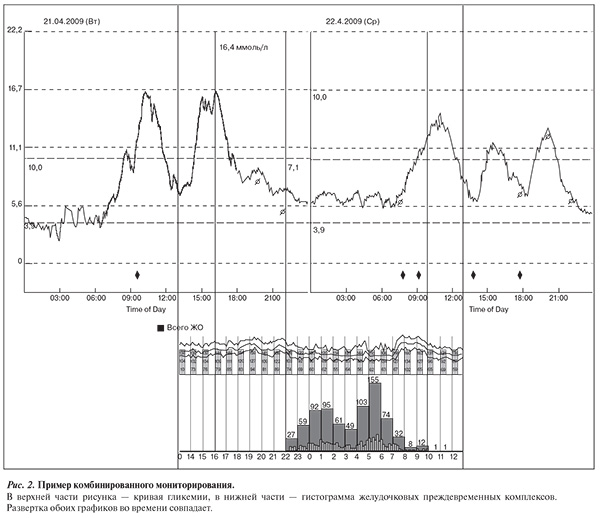
Комбинированное мониторирование (ХМ ЭКГ+непрерывное мониторирование уровня глюкозы в крови) дает возможность сопоставить кривые гликемии с гистограммами нарушений ритма сердца (рис. 2), а также позволяет более корректно оценить связь аритмий с показателями суточной вариабельности уровня глюкозы в крови по сравнению с анализом дневников самоконтроля.
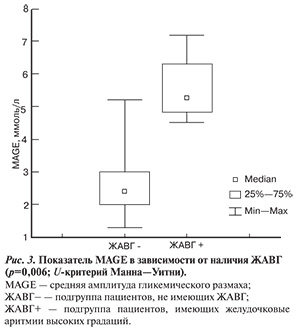 Результаты комбинированного мониторирования подтвердили наличие ассоциации между выраженностью суточных колебаний уровня глюкозы в крови и желудочковой эктопической активностью. Обнаружена достоверная корреляция между уровнем MAGE и числом преждевременных желудочковых комплексов: r=0,54; p=0,2 (ранговая корреляция по Спирмену). В группе пациентов с ЖАВГ показатель MAGE оказался достоверно выше, чем у пациентов без ЖА в день мониторирования — 5,3 ммоль/л (4,9; 6,3) против 2,4 ммоль/л (2,0; 3,0) соответственно, р=0,006 (рис. 3).
Результаты комбинированного мониторирования подтвердили наличие ассоциации между выраженностью суточных колебаний уровня глюкозы в крови и желудочковой эктопической активностью. Обнаружена достоверная корреляция между уровнем MAGE и числом преждевременных желудочковых комплексов: r=0,54; p=0,2 (ранговая корреляция по Спирмену). В группе пациентов с ЖАВГ показатель MAGE оказался достоверно выше, чем у пациентов без ЖА в день мониторирования — 5,3 ммоль/л (4,9; 6,3) против 2,4 ммоль/л (2,0; 3,0) соответственно, р=0,006 (рис. 3).
У пациентов с MAGE>5 ммоль/л ЖАВГ регистрировали в 43% случаев, при MAGE <5 ммоль/л — в 8% (р=0,02; критерий χ2 Пирсона).
Выводы
Высокая вариабельность суточной гликемии является значимым проаритмогенным фактором у больных сердечной недостаточностью, страдающих сахарным диабетом.
Средняя амплитуда гликемического размаха (MAGE) более 5 ммоль/л является предиктором возникновения желудочковых нарушений ритма высоких градаций.



