Хроническая сердечная недостаточность (ХСН) по-прежнему является одной из наиболее актуальных проблем современной кардиологии, несмотря на значительные успехи, достигнутые в диагностике, лечении и профилактике данного заболевания за последние два десятилетия. По данным эпидемиологических исследований [1, 2], заболеваемость ХСН в странах Западной Европы и США варьирует от 1,9 до 2,5%. Эпидемиологические исследования, выполненные в Российской Федерации (РФ) в течение последних 10 лет [3—5], свидетельствуют, что распространенность ХСН в нашей стране еще выше и составляет 7% (7,9 млн человек), при этом заболеваемость ХСН неуклонно возрастает (в среднем на 1,2 человека на 1000 населения в год).
Обычно ХСН и тяжесть ее прогноза ассоциируют со снижением сократительной способности сердца, т. е. с систолической дисфункцией левого желудочка (ЛЖ), которую чаще всего оценивают по величине фракции выброса (ФВ) ЛЖ. Однако ряд научных исследований показал, что у многих больных с ХСН имеется нормальная (>50%) или незначительно сниженная (40—50%) ФВ ЛЖ. Так, по данным обсервационного популяционного исследования ЭПОХА-О-ХСН [6], среди всех больных с ХСН, верифицированной по Фрамингемским критериям, у 56,8% ФВ ЛЖ >50%, а у 85,6% — >40%. В таких ситуациях целесообразно говорить о ХСН с сохраненной ФВ ЛЖ.
Выделение данной формы ХСН вполне оправдано, поскольку прогноз у больных с ХСН с сохраненной ФВ ЛЖ такой же, как и при ХСН со сниженной ФВ ЛЖ. При этом смертность больных с ХСН с сохраненной ФВ ЛЖ из года в год существенно не меняется, в то время как смертность больных с ХСН со сниженной ФВ ЛЖ за последние годы несколько уменьшилась.
Для верификации диагноза ХСН помимо выявления соответствующей клинической симптоматики необходимо подтвердить дисфункцию сердца в покое. Первостепенная роль в решении этой задачи отводится трансторакальной эхокардиографии (ЭхоКГ) с допплерографией (ДГ) в силу простоты выполнения, безопасности и повсеместной распространенности этой визуализирующей методики. При несомненных достоинствах ЭхоКГ имеет некоторые ограничения — недостаточная информативность (особенно на ранних стадиях ХСН) и зависимость результата исследования от квалификации выполняющего его врача. Поскольку клинические проявления ХСН недостаточно специфичны, а при ЭхоКГ не всегда удается выявить клинически значимые нарушения функции ЛЖ, то при подозрении на ХСН в качестве альтернативного диагностического подхода возможно определение в крови биохимических маркеров, концентрация которых возрастает при органических поражениях сердца.
Материал и методы
В одномоментном исследовании приняли участие 140 человек, из них 105 больных с ХСН и 35 пациентов группы контроля. Критериями включения в исследование считали: 1) клинические проявления ХСН в пределах I—II функционального класса (ФК) по классификации NYHA в стадии компенсации; 2) сумму баллов по Шкале оценки клинического состояния (ШОКС) не менее 3; 3) отсутствие изменений базовой медикаментозной терапии в предшествующий месяц. Критериями исключения из исследования являлись: 1) ХСН III—IV ФК по NYHA; 2) врожденные и приобретенные пороки сердца; 3) острый коронарный синдром, острое нарушение мозгового кровообращения и транзиторная ишемическая атака в предшествующие 6 мес; 4) нарушения ритма и проводимости сердца (постоянная форма фибрилляции предсердий, синдром слабости синусного узла, атриовентрикулярная блокада II и III степени); 5) хроническая болезнь почек выше III стадии; 6) тромбоэмболия легочной артерии в анамнезе; 7) злокачественные новообразования в анамнезе; 8) хроническая обструктивная болезнь легких; 9) хронический алкоголизм и наркомания; 10) острые инфекционные заболевания на момент включения в исследование; 11) ожирение (индекс массы тела ≥30 кг/м2); 12) сахарный диабет (СД) 1-го типа; 13) беременность и ранний послеродовой период.
Диагноз ХСН верифицировали при наличии у пациента двух ключевых критериев: 1) характерных симптомов ХСН (одышка, утомляемость, ограничение физической активности, отеки лодыжек); 2) объективных признаков дисфункции сердца в покое, о наличии которых судили по данным ЭхоКГ, рентгенографии органов грудной клетки и по содержанию в крови N-концевого натрийуретического пептида (NT-proBNP) >125 пг/мл. Тяжесть клинических проявлений ХСН стратифицировали по данным ШОКС [7] и теста с 6-минутной ходьбой [8].
В контрольную группу включили практически здоровых лиц в возрасте 18 лет и старше, у которых по данным ЭхоКГ, рентгенографии органов грудной клетки отсутствовали объективные признаки дисфункции сердца в покое, а уровень NT-proBNP не превышал 30 пг/мл.
Всем обследуемым проводили трансторакальную ЭхоКГ и ДГ (ультразвуковая система Phillips IE 33) с использованием секторного мультичастотного датчика S5—1. ФВ ЛЖ рассчитывали в В-режиме при помощи бипланового метода дисков (модифицированный метод Симпсона). У больных с ХСН при ФВ ЛЖ ≥50% сократительную функцию ЛЖ считали сохраненной; при ФВ ЛЖ ≤40% — сниженной; ФВ ЛЖ в интервале 41—49% рассматривали как пограничную.
Кроме того, у всех обследуемых оценивали содержание в крови натрийуретических пептидов (NT-proBNP, ANP), адипонектина, галектина-3, пентраксина-3 и ростового фактора дифференцировки 15-го типа РФД-15 методом иммуноферментного анализа на иммунохимическом анализаторе.
Среди больных с ХСН преобладали мужчины — 68 (65%). Средний возраст пациентов составил 58±14 лет. Длительность ХСН в среднем составила 24±18 мес. Этиологический генез ХСН представлен ишемической болезнью сердца (ИБС) — 35 (33%) больных, артериальной гипертонией (АГ) — 70 (67%). Распределение больных с ХСН по ФК в соответствии с классификацией NYHA было следующим: I ФК — 72%, II ФК — 28%. Большинство пациентов получали стандартную терапию ХСН: ингибиторы ангиотензинпревращающего фермента (АПФ) — 76%, β-адреноблокаторы — 72%, диуретики — 100%, статины — 80% пациентов.
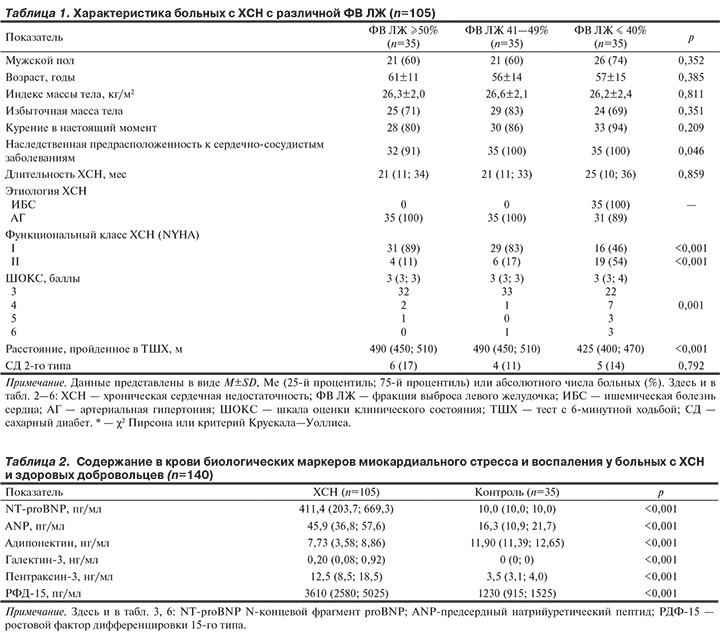
В зависимости от ФВ ЛЖ больные с ХСН были распределены на 3 группы: со сниженной (≤40%, n=35), пограничной (41—49%, n=35) и сохраненной (≥50%, n=35) ФВ ЛЖ. Характеристика больных с ХСН в зависимости от ФВ ЛЖ представлена в табл. 1.
Основной причиной развития ХСН у пациентов с сохраненной и пограничной ФВ ЛЖ была АГ. Клинические проявления ХСН в большинстве случаев соответствовали I ФК (по классификации NYHA). Характеристики пациентов обеих групп оказались сопоставимыми. При попарном сравнении статистически значимых различий между данными группами не выявлено.
В отличие от предыдущих групп больные со сниженной ФВ ЛЖ имели более развернутую клиническую картину ХСН. Основной причиной ХСН являлись ИБС и постинфарктный кардиосклероз; 46% больных были подвергнуты чрескожным коронарным вмешательствам. Обращает внимание высокая коморбидность: у 90% больных имелась сопутствующая АГ. Тяжесть клинических проявлений ХСН у этих пациентов была умеренной: около 50% из них имели II ФК (NYHA), у 1/3 больных оценка по ШОКС составила 4 баллов и более.

Статистическая обработка данных выполнена при помощи статистической программы SPSS 21.0. Вид распределения количественных признаков анализировали при помощи теста Колмогорова—Смирнова. При параметрическом распределении признака вычисляли среднее (M) и стандартное отклонение (SD); результаты представлены как M±SD. При непараметрическом распределении признака вычисляли медиану (Me) и интерквартильный размах (25-й процентиль; 75-й процентиль); результаты представлены как Ме (25%; 75%). Для сравнения двух групп использовали критерий Манна-Уитни для количественных переменных, двусторонний точный тест Фишера или χ² Пирсона – для качественных. Для сравнения трех групп применяли критерий Крускала—Уоллиса для количественных переменных и c2 Пирсона — для качественных. Взаимосвязи между количественными переменными оценивали при помощи корреляционного анализа Спирмена и многофакторного линейного регрессионного анализа. Для оценки диагностической значимости биохимических маркеров применяли ROC-анализ. В качестве критерия диагностической значимости рассчитывали площадь под ROC-кривой. Чувствительность и специфичность показателей определяли при помощи таблиц сопряженности 2×2. Статистически значимыми считали различия при двустороннем p<0,05.
Результаты
У больных с ХСН уровни всех биохимических маркеров (за исключением адипонектина) были достоверно выше, чем в контрольной группе (табл. 2). При этом в группе контроля средний уровень NT-proBNP не превышал 10 пг/мл (минимальная определяемая концентрация), а галектина-3 был равен нулю.
ROC-анализ показал, что все изученные биохимические маркеры обладают диагностической значимостью в отношении ХСН. При этом определение NT-proBNP, ANP, галектина-3, пентраксина-3 и РФД-15 наиболее информативно для подтверждения диагноза ХСН, а адипонектина, напротив, для исключения. Так, площадь под ROC-кривой составила 1,0 для NT-proBNP, ANP и пентраксина-3; 0,943 — для галектина-3 и 0,988 — для РФД-15 (р<0,001 для всех маркеров). При использовании адипонектина для исключения ХСН площадь под ROC-кривой составила 0,999 (р<0,001).
Среди больных с ХСН наиболее высокий уровень NT-proBNP, ANP, галектина-3, пентраксина-3 и РФД-15 оказался у лиц со сниженной ФВ ЛЖ (табл. 3). Содержание адипонектина, наоборот, было выше у больных с ХСН с сохраненной ФВ ЛЖ. Несмотря на то что у больных с ХСН содержание всех биохимических маркеров (кроме адипонектина) оказалось наиболее низким при сохраненной ФВ ЛЖ, оно, тем не менее, было значительно выше, чем у здоровых добровольцев (р<0,001 для всех маркеров).
Корреляционный анализ обнаружил статистически значимые сильные корреляции (р<0,001 для всех маркеров) между ФВ ЛЖ и содержанием всех биохимических маркеров, при этом между ФВ ЛЖ и уровнем адипонектина выявлена прямая взаимосвязь (r=0,862), а между ФВ ЛЖ и остальными биохимическими маркерами — обратная (r от –0,858 до –0,901).
Поскольку у больных с ХСН отмечалась тесная корреляция уровней всех биохимических маркеров с ФВ ЛЖ, для уточнения наиболее прогностически значимых ассоциаций выполнили многофакторный линейный регрессионный анализ (метод шагового отбора), в который включили все 6 биохимических маркеров. В итоговой многофакторной регрессионной модели оказались 2 переменные, очередность включения которых в модель была следующей: пентраксин-3, адипонектин (табл. 4).
Из табл. 4 следует, что одна только переменная «пентраксин-3» объясняет 80% вариаций зависимой переменной — величины ФВ ЛЖ (R2=0,803). Модель 2, в которую добавляется переменная «адипонектин», увеличивает R2, а значит, и уровень объяснения вариации до 0,817, или всего на 1%. Таким образом, основная доля вариации величины ФВ ЛЖ у больных с ХСН объясняется переменной «пентраксин-3».
Как видно из табл. 5, коэффициенты уравнения регрессии для переменной «пентраксин-3» имеют отрицательные значения, а для переменной «адипонектин» — положительные, что указывает на разное направление связи между предикторами и зависимой переменной: чем выше уровень пентраксина-3, тем ниже ФВ ЛЖ; чем выше уровень адипонектина, тем выше ФВ ЛЖ.
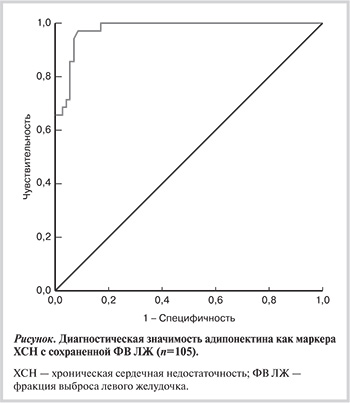
ROC-анализ подтвердил диагностическую значимость адипонектина как маркера ХСН с сохраненной ФВ ЛЖ (см. рисунок). Так, уровень адипонектина более 8,3 нг/мл прогнозировал наличие у больных с ХСН ФВ ЛЖ ≥50% с чувствительностью 94,3% и специфичностью 92,9% (площадь под кривой 0,977 при 95% доверительном интервале — ДИ от 0,954 до 0,999; р<0,001).
ROC-анализ не подтвердил диагностическую значимость ни одного показателя как маркера ХСН с пограничной ФВ ЛЖ.
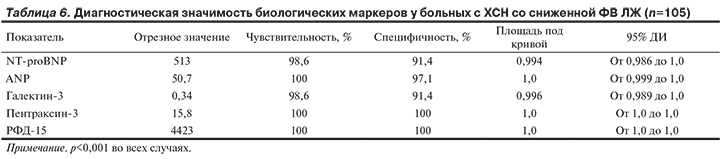
ROC-анализ подтвердил диагностическую значимость NT-proBNP, ANP, галектина-3, пентраксина-3 и РФД-15 как маркеров ХСН со сниженной ФВ ЛЖ (табл. 6). При этом диагностическая значимость всех биохимических маркеров у больных с ХСН со сниженной ФВ ЛЖ оказалась чрезвычайно высокой, но наибольшей диагностической ценностью с максимальными значениями чувствительности и специфичности обладали пентраксин-3 и РФД-15.
Обсуждение
В настоящее время полностью доказана тесная взаимосвязь между содержанием натрийуретических пептидов (НУП) в крови и тяжестью дисфункции сердца (в первую очередь ЛЖ), что позволило рекомендовать определение концентрации данных пептидов в качестве лабораторного маркера ХСН.
В нашей работе была изучена диагностическая значимость NT-proBNP и ANP при ХСН с различной ФВ ЛЖ. Содержание в крови обоих биохимических маркеров у больных с ХСН оказалось существенно выше, чем в контрольной группе. При этом концентрации данных маркеров оказались существенно выше у больных с ХСН со сниженной ФВ ЛЖ, что совпадает с результатами недавно выполненных исследований [9—12], в том числе крупного регистра [12] с участием почти 100 тыс. больных с диагнозом ХСН, установленным в соответствии с Фрамингемскими критериями.
 В то же время в ряде исследований [13—15] было продемонстрировано, что у больных с ХСН с сохраненной ФВ ЛЖ содержание NT-proBNP значительно выше, чем у здоровых лиц, и коррелирует с тяжестью диастолической дисфункции ЛЖ. В исследовании CHARM [13] многофакторный анализ показал, что уровни NT-proBNP >600 пг/мл (относительный риск — ОР 5,93 при 95% ДИ от 2,21 до 15,92; p=0,0004), наряду с уровнем BNP >100 пг/мл (ОР 6,24 при 95% ДИ от 2,42 до 16,09; p=0,0002) и наличием СД (ОР 2,75 при 95% ДИ от 1,12 до 6,76; p=0,03) являются независимыми предикторами развития диастолической дисфункции ЛЖ у больных с ХСН с сохраненной ФВ ЛЖ. В этом испытании участвовал 181 больной с ХСН с ФВ ЛЖ >40%, у 40% из них имелась диастолическая дисфункция ЛЖ легкой, умеренной или тяжелой степени.
В то же время в ряде исследований [13—15] было продемонстрировано, что у больных с ХСН с сохраненной ФВ ЛЖ содержание NT-proBNP значительно выше, чем у здоровых лиц, и коррелирует с тяжестью диастолической дисфункции ЛЖ. В исследовании CHARM [13] многофакторный анализ показал, что уровни NT-proBNP >600 пг/мл (относительный риск — ОР 5,93 при 95% ДИ от 2,21 до 15,92; p=0,0004), наряду с уровнем BNP >100 пг/мл (ОР 6,24 при 95% ДИ от 2,42 до 16,09; p=0,0002) и наличием СД (ОР 2,75 при 95% ДИ от 1,12 до 6,76; p=0,03) являются независимыми предикторами развития диастолической дисфункции ЛЖ у больных с ХСН с сохраненной ФВ ЛЖ. В этом испытании участвовал 181 больной с ХСН с ФВ ЛЖ >40%, у 40% из них имелась диастолическая дисфункция ЛЖ легкой, умеренной или тяжелой степени.
В нашем исследовании содержание NT-proBNP >513 пг/мл и ANP >50,7 пг/мл с чувствительностью 98,6 и 100% и специфичностью 91,4 и 97,1% соответственно указывало на наличие сниженной ФВ ЛЖ у больных с ХСН.
РФД-15 — это биохимический маркер семейства цитокинов, который участвует в миокардиальном стрессе, регуляции дифференцировки клеток и реконструкции миокарда. Он индуцируется в кардиомиоцитах в ответ на метаболический стресс (например, при ИБС или АГ) и является независимым предиктором гипертрофии миокарда ЛЖ.
Поскольку гипертрофия и интерстициальный фиброз миокарда ЛЖ служат гистологическими признаками ХСН с сохраненной ФВ ЛЖ, то повышение уровня РФД-15 в крови может отражать тяжесть заболевания у пациентов данной категории.
В нашей работе уровень РФД-15 был существенно выше у больных с ХСН со сниженной, а не сохраненной ФВ ЛЖ. Более того, ROC-анализ показал, что уровни РФД-15 >4423 пг/мл с чувствительностью и специфичностью, равными 100%, обладают диагностической значимостью в отношении ХСН со сниженной ФВ ЛЖ.
Галектин-3 — биохимический маркер, изучению роли которого при ХСН в последнее время уделяется большое внимание. Галектин-3 представляет собой белок, участвующий в адгезии, активации, росте и дифференцировке клеток, в активации фибробластов и апоптозе. Известно несколько типов клеток, которые экспрессируют галектин-3, в том числе нейтрофилы, макрофаги, тучные клетки, фибробласты и остеокласты. Галектин-3 принимает участие в формировании фиброза в различных органах (в том числе в сердце) и в процессах ремоделирования сердца, что способствует возникновению и прогрессированию систолической дисфункции ЛЖ. Результаты многочисленных исследований указывают на то, что у больных с ХСН галектин-3 обладает, главным образом, прогностической, а не диагностической значимостью. Так, повышенный уровень галектина-3 в крови ассоциируется с неблагоприятными исходами у больных как с острой [16], так и хронической [17] сердечной недостаточностью, причем прогностическая ценность галектина-3 превосходит таковую NT-proBNP.
Как показала данная работа, у больных с ХСН уровень галектина-3 выше, чем у здоровых лиц. Однако если в нашем исследовании содержание галектина-3 оказалось выше у больных с ХСН со сниженной ФВ ЛЖ, то в других работах различий по уровню галектина-3 между больными с ХСН с сохраненной и сниженной ФВ ЛЖ выявлено не было. Например, в исследовании R.A. De Boer и соавт. [18] содержание галектина-3 у больных с ХСН с сохраненной (n=114) и сниженной (n=368) ФВ ЛЖ было практически одинаковым, при том, что содержание BNP и NT-proBNP было значительно выше у больных с ХСН со сниженной ФВ ЛЖ. Еще в одном исследовании [19] установлено, что содержание галектина-3 одинаково у больных с ХСН с сохраненной и сниженной ФВ ЛЖ — 23±9 против 22±11 нг/мл соответственно (р=0,37). В нашей же работе уровень галектина-3 >0,34 нг/мл являлся маркером ХСН со сниженной ФВ ЛЖ с чувствительностью 98,6% и специфичностью 91,4%.
Пентраксины — это семейство белков с циклической пентамерной структурой и способностью связывать определенные вещества зависимым от кальция образом. Наиболее известными и хорошо изученными представителями данного семейства являются С-реактивный белок и сывороточный амилоид Р. Пентраксин-3 был открыт относительно недавно и пока изучен мало. Его вырабатывают различные клетки (преимущественно эндотелиальные и гладкомышечные, а также макрофаги) в ответ на воздействие воспалительных стимулов [20]. Считается, что уровень пентраксина-3 более эффективно, чем любой другой острофазовый белок, отражает локальное сосудистое воспаление. Доказано, что уровень пентраксина-3 значительно повышен у лиц с метаболическим синдромом и субклиническим атеросклерозом [21]. Повышение концентрации пентраксина-3 в плазме крови ассоциируется исключительно с наличием воспаления в артериальной стенке и не связано ни с одним из известных факторов риска развития сердечно-сосудистых заболеваний. Имеются данные, что у больных с ХСН пентраксин-3 обладает прогностической значимостью; его повышенный уровень может быть предиктором неблагоприятного прогноза [21].
В нашем исследовании содержание пентраксина-3 у больных с ХСН было выше, чем в контрольной группе, а при ХСН со сниженной ФВ ЛЖ выше, чем при сохраненной. Как показал анализ данных, пентраксин-3 оказался единственным из изученных нами биохимических маркеров, который в наибольшей степени ассоциирован с ФВ ЛЖ у больных с ХСН и объясняет 80% вариаций ее значений. ROC-анализ показал, что у больных с ХСН уровни пентраксина-3 >15,8 нг/мл
с чувствительностью и специфичностью, равными 100%, указывают на наличие сниженной ФВ ЛЖ. Таким образом, среди 5 биохимических маркеров, обладающих диагностической значимостью в отношении ХСН со сниженной ФВ ЛЖ, по данным нашей работы, позиция пентраксина-3 выглядит наиболее убедительно и, вероятно, именно его определение следует предпочесть другим маркерам.
Адипонектин — гормон, который синтезируется и секретируется белой жировой тканью, преимущественно адипоцитами висцеральной области. Адипонектин регулирует энергетический гомеостаз, препятствует формированию фиброза и гипертрофии миокарда, дает противовоспалительный и антиатерогенный эффекты. При ожирении отмечается снижение активности и количества адипонектина в крови. Предполагают, что с нарушением секреции адипонектина может быть связано развитие СД 2-го типа и инсулинорезистентности. Снижение уровня адипонектина в крови ассоциируется с дисфункцией эндотелия и окислительным стрессом.
В отличие от остальных изученных нами биохимических маркеров, содержание адипонектина при ХСН ниже, чем у здоровых лиц. Об этом свидетельствуют не только полученные нами данные, но и результаты небольшого исследования случай—контроль [22], в котором участвовали 25 больных с ХСН с диастолической дисфункцией ЛЖ и ФВ ЛЖ 50—70% и 25 пациентов без диастолической дисфункции ЛЖ, сопоставимых по возрасту и полу. У больных с ХСН с диастолической дисфункцией ЛЖ содержание в крови адипонектина оказалось значительно ниже, чем в группе контроля — 4,4 (3,4; 8,0) против 12,7 (6,2; 18,7) мкг/мл (p=0,001). Многофакторный анализ показал, что наличие диастолической дисфункции ЛЖ было независимо ассоциировано с содержанием адипонектина (р<0,001) и индексом массы тела (р<0,05), причем корреляции между низким содержанием адипонектина и диастолической дисфункцией ЛЖ не зависели от возраста, индекса массы тела, наличия СД и АГ.
У больных с ХСН адипонектин в настоящее время изучен недостаточно. Вместе с тем имеются данные [23], что при ИБС низкий уровень адипонектина ассоциируется с диастолической дисфункцией ЛЖ, хотя корреляции между содержанием адипонектина и ФВ ЛЖ в этой работе были статистически незначимыми как у мужчин, так и у женщин. По данным обсервационных исследований [24, 25], низкие уровни адипонектина ассоциируются с развитием гипертрофии и ремоделированием ЛЖ. В экспериментах на животных показано, что у мышей гипоадипонектинемия при диастолической ХСН вследствие АГ усиливает гипертрофию и диастолическую дисфункцию ЛЖ [26].
В нашей работе адипонектин оказался единственным биохимическим маркером, продемонстрировавшим диагностическую ценность в отношении ХСН с сохраненной ФВ ЛЖ. Так, при уровне адипонектина более 8,3 нг/мл можно прогнозировать наличие у больных с ХСН с сохраненной ФВ ЛЖ с чувствительностью 94,3% и специфичностью 92,9%. Кроме того, по результатам многофакторного анализа адипонектин наряду с пентраксином-3 обнаружил наиболее сильные взаимосвязи с ФВ ЛЖ у больных с ХСН.
Заключение
В нашем исследовании были изучены уровни биохимических маркеров воспаления (адипонектин, пентраксин-3) и миокардиального стресса (натрийуретические пептиды, галектин-3, РДФ или ростовый фактор дифференцировки-15) у больных с хронической сердечной недостаточностью и определена их диагностическая ценность.
Результаты исследования продемонстрировали повышение уровней биохимических маркеров (NT-proBNP или N-концевой фрагмент мозгового натрийретического пептида, ANP, пентраксина-3, галектина-3, ростового фактора дифференцировки-15). NT-proBNP или N-концевой фрагмент мозгового натрийуретического пептида, ANP, галектин-3, пентраксин-3 и ростовой фактор дифференцировки-15у пациентов с хронической сердечной недостаточностью по сравнению с контрольной группой.
У больных с хронической сердечной недостаточностью были обнаружены сильные взаимосвязи между фракцией выброса левого желудочка и уровнями биохимических маркеров. При этом наиболее сильные ассоциации с фракцией выброса левого желудочка были выявлены у пентраксина-3 и адипонектина.
По результатам исследования все изученные биохимические маркеры обладают диагностической ценностью у пациентов с хронической сердечной недостаточностью. N-концевой предшественник мозгового натрийуретического пептида, ANP, галектин-3, пентраксин-3 и ростовой фактор дифференцировки-15 являются маркерами хронической сердечной недостаточности со сниженной фракцией выброса левого желудочка; адипонектин — маркером хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка. Ни один из изученных биохимических маркеров не продемонстрировал диагностической значимости в отношении хронической сердечной недостаточности с пограничной фракцией выброса левого желудочка.



