В последнее десятилетие в клинической медицине сформировалось специализированное направление по использованию так называемых биомаркеров в диагностике заболевания, прогнозированию его течения и контролю эффективности проводимого лечения. С этой целью у больных с сердечной недостаточностью (СН) широко используется измерение уровней натрийуретических пептидов. Одним из перспективных маркеров в последнее время считался полипептид апелин. Этот полипептид обнаружен при исследовании одного из рецепторов группы серпинов, весьма похожего на рецептор ангиотензина II 1-го типа. Гомология этих рецепторов составляет почти 50%, однако ангиотензин не взаимодействовал с ним [1]. В 1998 г. K. Tatemoto и соавт. выделили лиганд для этого рецептора и назвали его апелином. Изначально апелин синтезируется как пропептид, состоящий из 77 аминокислот, который под действием пептидаз делится на более короткие фрагменты (из 39, 19, 13, 12 аминокислот и др.) [2]. Доказано, что низкомолекулярные апелины обладают большей биологической активностью в отношении сердечно-сосудистой системы, в то же время пептиды короче 12 аминокислот становятся биологически инертными [3].
В настоящий момент система апелин—APJ рассматривается как антагонист ренин-ангиотензин-альдостероновой системы (РААС). Она представлена практически во всех органах и тканях млекопитающих. Высокие уровни экспрессии апелина и APJ обнаружены в эндотелии и гладких мышечных клетках сосудов, миокарде и эндокарде [4]. Апелин оказывает влияние на гомеостаз жидкости, метаболизм глюкозы и жиров, ангио- и канцерогенез. Доказана его благотворная роль при постишемических реперфузионных повреждениях [5]. Пептид проявляет свойства артериального и венозного вазодилататора, действуя через NO-зависимый и простациклиновый механизмы [6]. Наиболее значительным представляется его инотропное действие, по мнению ряда авторов, самое мощное из инотропных агентов, известных на сегодняшний день [7].
Инотропный эффект апелина обусловлен активацией Na+/H+-обменника сарколеммы и кальциевых насосов саркоплазматической сети [8]. Активно изучается роль пептида в развитии СН. Проведено несколько исследований для оценки изменения уровней апелина в крови больных хронической сердечной недостаточностью (ХСН) [9—12].
Данные по изменению концентрации апелина в крови на разных стадиях ХСН противоречивы. Поэтому целью нашего исследования являлась оценка уровня апелина-12 в крови больных ХСН различных функциональных классов (ФК) при ишемической болезни сердца (ИБС) и дилатационной кардиомиопатии (ДКМП) по сравнению с N-концевым предшественником натрийуретического пептида (NT-proBNP).
Материал и методы
В исследование были включены 108 больных (77 мужчин и 32 женщины) в возрасте от 23 до 82 лет (средний возраст 56 лет) ИБС и ДКМП и развившейся на этом фоне ХСН I—IV ФК. Средняя фракция выброса (ФВ) составила 32,2±8,63% (см. таблицу).
В протокол не включали больных с тяжелыми сопутствующими соматическими патологиями (печеночная и почечная недостаточность, онкологические и ревматологические заболевания, хроническая обструктивная болезнь легких, хронические гепатиты); лица, в течение последних 3 мес перенесшие острое нарушение мозгового кровообращения, тромбоэмболию легочной артерии или острый коронарный синдром. Из исследования также исключали пациентов, у которых причина ХСН не была обусловлена ДКМП или ИБС (тяжелые клапанные пороки, перикардиты, гипертоническое сердце и т.п.) и больных тиретоксикозом или сахарным диабетом.
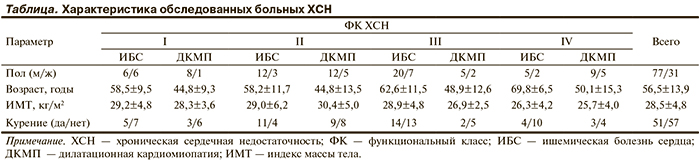
Группа контроля состояла из 40 человек (17 мужчин и 23 женщины) и условно делилась на 2 подгруппы: от 18 до 35 лет (25 человек, средний возраст 26±2,7 года) и старше 35 лет (15 человек, средний возраст 57,5±9,7 года).
Образцы крови брали у больных однократно натощак, сразу после поступления в стационар и первичного осмотра врачом с оценкой тяжести недостаточности по ФК до назначения медикаментозной, в том числе внутривенной диуретической терапии. Кровь из локтевой вены в количестве 10 мл помещали в пробирку, содержащую раствор ЭДТА (из расчета 2 мг/мл крови). Пробирку центрифугировали в течение 10 мин со скоростью 3500 об/мин при температуре +4 °С. Надосадочную жидкость в объеме 0,5 мл разливали в отдельные микропробирки типа Eppendorf, замораживали и хранили при температуре -70 °С.
Уровень апелина-12 определялся микропланшетным фотометром Sunrise и автоматичеcким микропланшетным промывателем Columbus M12/4CH с помощью тест-системы Apelin-12. Линейный диапазон измерений составил 0,08—1,55 нг/мл. Концентрацию NT-proBNP определяли на автоматическом анализаторе Cobas e411 электрохемилюминисцентным способом набором реагентов proBNPII. Диапазон измерений прибора был 5—35000 пг/мл (0,6—4130 пмоль/л).
Для оценки систолической функции сердца и исключения тяжелой клапанной патологии всем больным в день поступления в стационар проводили эхокардиографию (ЭхоКГ) с оценкой по методу Симпсона ФВ, конечного систолического (КСО, мл) и конечного диастолического объема (КДО, мл). Исследование проводили на аппарате Philips iE-33 кардиологическим датчиком S5-1.
Статистическую обработку данных выполняли с помощью программ Excel и Statistica 6.0. Переменные сравнивали с помощью непарного t-критерия Стьюдента при нормальном распределении и при помощи критерия Манна—Уитни при непараметрическом распределении. Тест на нормальность распределения проводили с помощью критерия Шапиро—Уилка. Критерием статистической значимости считали уровень p<0,05.
Результаты
Средний уровень апелина-12 у здоровых добровольцев составил 0,86±0,22 нг/мл, притом в подгруппе молодых — 0,9±0,23 нг/мл, а в подгруппе старше 35 лет — 0,78±0,19 нг/мл (p=0,058). У больных ХСН с I по IV ФВ средние концентрации апелина-12 в крови были 0,8±0,35, 0,81±0,29, 0,68±0,38 и 0,82±0,35 нг/мл соответственно (p>0,05).
Не различались также концентрации апелина у больных ХСН различной этиологии: ИБС и ДКМП (0,81±0,34 и 0,7±0,34 нг/мл соответствнно; p=0,1). Статистически значимые различия прослеживались лишь при сравнении концентраций апелина у пациентов с ХСН III ФК и контрольной подгруппой молодых (0,68±0,38 и 0,9±0,23 нг/мл соответственно; p=0,006), а также больных ДКМП и молодыми добровольцами (0,7±0,34 и 0,9±0,23 нг/мл соответственно; p=0,004).

В то же время уровни NT-proBNP у всей контрольной группы были ниже 100 пкг/мл, а средние концентрации у больных I—IV ФК составили 1002±688, 1367±992, 3365±2176 и 6572±4334 пкг/мл. Статистически значимых отличий концентраций NT-proBNP не было лишь при сравнении I и II ФК (p=0,12), что может быть объяснено несколько условными клиническими границами между этими классами; во всех остальных случаях различия были статистически высокозначимыми (p<0,001). Таким образом, в нашем исследовании NT-proBNP хорошо отражал тяжесть СН (см. рисунок).
Не отмечались корреляции между уровнем апелина-12 и ФВ левого желудочка — ЛЖ (r=0,16; p=0,13), КДО (r=0,14; p=0,15) и КСО (r=-0,12; p=0,22). Не наблюдалось также корреляции между концентрациями апелина-12 и NT-proBNP в плазме крови (r=-0,07; p=0,49); возрастом (r=0,12; p=0,19), полом, курением и индексом массы тела.
Обсуждение
Итак, нами не получено подтверждения того, что апелин-12 может быть использован в качестве маркера для выявления и оценки тяжести СН. Наши данные совпадают с результатами работы K.H. Miettinen [13]. Авторы сравнили средние концентрации апелина в плазме крови у здоровых добровольцев (n=14; возраст от 20 до 53 лет) и больных ХСН, вызванной ДКМП (n=65; средний возраст 53±12 лет; в основном I—II ФК). Концентрации апелина в этих группах статистически значимо не различались — 24,1 (19,0—28,7) пкг/мл против 26,5 (3,4—97,9) пкг/мл (p>0,05). В то же время в исследовании J.P. Goetze [14] концентрация апелина в плазме (0,49 нг/мл) в контрольной группе (n=26; средний возраст 67 лет) в 2,1 раза превышала этот показатель у больных ХСН (p<0,01).
Причин отрицательного результата может быть несколько. Как мы уже упоминали, в некоторых работах указывают на повышение концентрации апелина в крови при легкой степени СН с достижением максимума у больных СН средней тяжести и последующим снижением уровня пептида у пациентов с тяжелой СН. Таким образом, у больных легкой и тяжелой ХСН имелись примерно одинаковые концентрации апелина, что затрудняет его использование в качестве маркера СН. Вторая причина скрывается в механизмах экспрессии апелина. Дело в том, что системы апелин—APJ и РААС тесно связаны между собой и повышение активности одной влечет неизменное снижение активности другой. В экспериментальных исследованиях доказано, что связывание апелина со своим рецептором тормозит образование ангиотензина II, а фармакологическая блокада его рецепторов 1-го типа сопровождается повышением выработки апелина и APJ. Ангиотензинпревращающий фермент, как эндокарбоксипептидаза, разрушает пептид, отщепляя последовательно по одной аминокислоте с С-конца [15, 16].
В свое исследование мы включали пациентов, чаще всего длительно получавших базовую терапию, в том числе ингибиторы ангиотензинпревращающего фермента или сартаны. Поэтому степень активности РААС у всех больных была разной, что не могло не повлиять на экспрессию апелина.
Отдельно стоит упомянуть о методике определения пептида в крови. Обращает на себя внимание то, что в разных работах средние концентрации апелина в плазме даже в контрольных группах резко различались и колебались в пределах от 90 до 3580 пкг/мл (т.е. более чем в 40 раз!) [17]. Эти разногласия могут быть обусловлены как несовершенством используемых тест-систем (низкая специфичность к апелину), так и неполной экстракцией апелинов из плазмы. Производители тест-систем также обращают внимание на возможные перекрестные реакции между апелинами 12, 13 и 36.
Заключение
Нами не получено достаточных оснований, позволяющих использовать уровень апелина-12 в качестве средства выявления хронической сердечной недостаточности и контроля тяжести заболевания, что не исключает исследования этого пептида как потенциального инотропного средства.



