В ряде исследований установлена связь между повышенной частотой сердечных сокращений (ЧСС), а также сердечно-сосудистой заболеваемостью и смертностью. На основе их выводов сформулирована гипотеза о том, что снижение ЧСС окажется полезным у пациентов с сердечно-сосудистыми заболеваниями. С патофизиологической точки зрения снижение ЧСС наиболее оправдано у пациентов с ишемической болезнью сердца (ИБС) или сердечной недостаточностью [1]. Показано, что более высокая ЧСС негативно влияет на сердечно-сосудистую систему, способствуя развитию ишемии миокарда, желудочковых аритмий, увеличению сосудистого окислительного стресса, дисфункции эндотелия и прогрессированию атеросклероза [2]. Между тем причинно-следственные связи между ЧСС и продолжительностью жизни, особенно у здоровых лиц, не установлены. Поэтому представляет интерес проспективное исследование последствий пожизненного фармакологического снижения ЧСС на продолжительность жизни у экспериментальных животных. Мыши получали плацебо или селективный ингибитор If-каналов ивабрадин в дозе 50 мг/кг/сут с питьевой водой, начиная от 12-й недели жизни до смерти. Среднее снижение ЧСС составляло 14%, что сопровождалось увеличением средней продолжительности жизни на 6,2% (р=0,01) [3]. Эти новые данные подтверждают и дополняют существовавшие ранее представления о целесообразности урежения ЧСС, в том числе о позитивной роли ивабрадина.
В настоящей работе представлены результаты новых исследований с применением ивабрадина (кораксан, «Servier», Франция) по утвержденным показаниям, рассматриваются возможные плейотропные эффекты этого препарата.
ИБС. Традиционные антиангинальные препараты β-адреноблокаторы и недигидропиридиновые антагонисты кальция эффективно снижают ЧСС, но оказывают ряд других клинических эффектов, которые могут оказаться нежелательными для некоторых пациентов. Ивабрадин — препарат, специально разработанный для урежения ЧСС без других влияний на сердечно-сосудистую и другие системы организма. Однако фармакологическое действие ивабрадина не ограничивается простым уменьшением ЧСС [4]. Например, в экспериментальных условиях и у человека удалось показать антиатеросклеротическое действие ивабрадина, механизм развития которого требует дальнейшего изучения [5]. У больных с хронической сердечной недостаточностью (ХСН) и синусовым ритмом с ЧСС более 70 уд/мин через 12 мес лечения ивабрадином отмечалось значительное (р<0,001) увеличение растяжимости аорты и снижение индекса ее жесткости (р<0,001) [6], что позволяет говорить об ангиопротективном действии препарата.
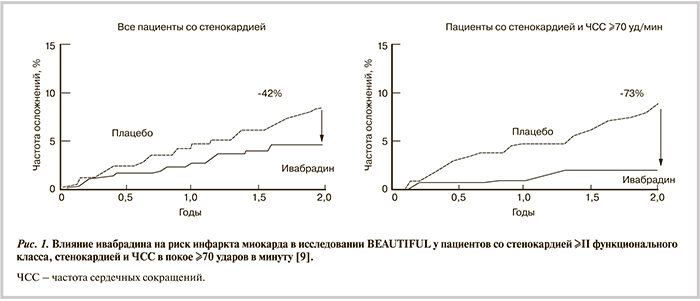
Предупреждение инфаркта миокарда (ИМ) является стратегической целью лечения больных со стабильной ИБС [7]. В рандомизированном двойном слепом плацебо-контролируемом исследовании BEAUTIFUL участвовали пациенты с ИБС и фракцией выброса (ФВ) левого желудочка (ЛЖ) менее 40% [8]. В дополнение к стандартной терапии, в 87% случаев включавшей β-адреноблокаторы, 5479 пациентов получали ивабрадин по 5—7,5 мг 2 раза в день, 5438 — плацебо. В подгруппе пациентов с ЧСС ≥70 уд/мин лечение ивабрадином снижало частоту госпитализации с фатальным и нефатальным ИМ (относительный риск — ОР 0,64 при 95% доверительном интервале — ДИ от 0,49 до 0,84; р=0,001) и коронарной реваскуляризации (ОР 0,70 при 95% ДИ от 0,52 до 0,93; р=0,016). Более того, у пациентов со стенокардией ≥II функционального класса по классификации Канадского сердечно-сосудистого общества ивабрадин снижал суммарный риск событий первичной конечной точки (сердечно-сосудистая смерть, госпитализация с фатальным и нефатальным ИМ или сердечная недостаточность) на 24% (ОР 0,76 при 95% ДИ от 0,58 до 1,00) и госпитализации с ИМ — на 42% (ОР 0,58 при 95% ДИ от 0,37 до 0,92). У пациентов с ЧСС ≥70 уд/мин отмечалось снижение частоты госпитализации с ИМ на 73% (ОР 0,27 при 95% ДИ от 0,11 до 0,66) и коронарной реваскуляризации на 59% (ОР 0,41 при 95% ДИ от 0,17 до 0,99) [9] (рис. 1). Механизм указанного явления не был точно установлен.
В исследовании SIGNIFY у больных со стабильной ИБС без клинических проявлений ХСН не удалось получить подобных результатов [10, 11], что могло быть связано с применением не рекомендованной дозы ивабрадина 10 мг 2 раза в день в дополнение к β-адреноблокаторам, комбинаций ивабрадина с верапамилом и дилтиаземом. EMA (European Medicines Agency) уточнило, что ивабрадин может использоваться в дозах 2,5—7,5 мг 2 раза в день для облегчения симптомов у пациентов со стабильной ИБС [12].
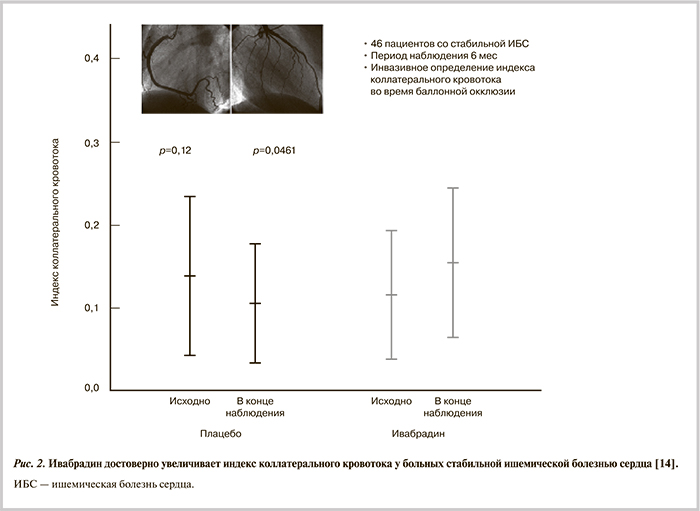
Известно, что большой размер ИМ отрицательно влияет на прогноз у пациентов, а уменьшение зоны некроза может достигаться не только путем сокращения времени коронарной окклюзии, но и с помощью стимуляции коллатерального кровотока в миокарде [13]. Касательное напряжение сдвига является основным триггером роста коллатералей и модулируется продлением диастолы. S. Gloekler и соавт. [14] проверили гипотезу о том, что ивабрадин, селективно урежающий ритм сердца, способен значительно усилить функцию коронарных коллатералей. Пациентам со стабильной формой ИБС, получающим стандартную терапию, дополнительно назначали ивабрадин (от 2,5 до 7,5 мг 2 раза в сутки для достижения ЧСС 60 уд/мин в покое) или плацебо. В течение 6 мес терапии средняя ЧСС в покое в группе ивабрадина оказалась существенно меньше, чем в контрольной группе (р=0,0089). Пациенты подвергались инвазивному исследованию в динамике с определением индекса коллатерального кровотока во время баллонной окклюзии артерии. В группе плацебо индекс коронарного кровотока имел тенденцию к снижению с 0,140±0,097 в исходном состоянии до 0,109±0,067 к концу контролируемой терапии (p=0,12), тогда как под действием ивабрадина он увеличивался с 0,107±0,077 до 0,152±0,090 (p=0,0461) (рис. 2). В результате разнонаправленной динамики изменений индекса коллатерального кровотока через 6 мес в группе плацебо (−0,031±0,090) и ивабрадина (+0,040±0,094) различие средних значений показателя оказалось статистически значимым (p=0,0113). Авторы работы полагают, что снижение ЧСС с помощью ивабрадина положительно влияет на функцию коронарных коллатералей у пациентов со стабильной ИБС. Примечательно, что ранее этим же исследователям не удалось показать, что урежение ЧСС с помощью β-адреноблокаторов повышает индекс коллатерального кровотока [15]. Такой результат объяснили вазоконстрикторным эффектом β-адреноблокаторов.
Как правило, рост ЧСС сопровождается увеличением функции сердца. Однако при патологических состояниях, таких как ИМ и сердечная недостаточность, повышение ЧСС может оказывать отрицательное влияние, поскольку уменьшает время диастолического наполнения ЛЖ и перфузии миокарда, но увеличивает потребность миокарда в кислороде. Следовательно, снижение ЧСС представляется целесообразным для достижения кардиопротективного эффекта и поддержания функции сердца [16].
Р. Kleinbongard и соавт. [17] моделировали ИМ у мышей путем окклюзии коронарной артерии, оценивая кардиопротективное действие ивабрадина в дозе 1,7 мг/кг внутривенно. В части случаев отрицательный хронотропный эффект ивабрадина устраняли с помощью электрической стимуляции левого предсердия. В контрольной группе размер ИМ составлял 39±5%, в группе применения ивабрадина — 17±4% (р<0,05), при сочетании действия ивабрадина с электрокардиостимуляцией — 20±5% (р<0,05) от зоны риска развития некроза. Ивабрадин увеличивал долю жизнеспособных кардиомиоцитов после создания ишемии/реперфузии (25±2% против 10±1% в контроле), уменьшал внутриклеточное (р<0,05) и внеклеточное (р<0,001) образование активных форм кислорода и их экстрамитохондриальное накопление (р<0,001), увеличивал производство аденозинтрифосфата в митохондриях (р=0,01) и способность к удержанию кальция (р<0,05) по сравнению с контролем. Эти данные показывают, что ивабрадин уменьшает размер ИМ и улучшает жизнеспособность кардиомиоцитов желудочков независимо от снижения ЧСС посредством определенных авторами исследования механизмов.
В другом исследовании S.L. Chen и соавт. [18] оценивали действие ивабрадина (10 мг/кг/сут) у мышей с экспериментальным сахарным диабетом. Через 3 мес терапии ивабрадин по сравнению с контролем (изотонический раствор натрия хлорида) значительно улучшал функцию сердца по данным эхокардиографии путем ослабления апоптоза, ингибировал экспрессию и активность матриксной металлопротеиназы-2, способной дестабилизировать атеросклеротические бляшки. Авторы работы обсуждают перспективы клинического применения ивабрадина у пациентов с сахарным диабетом.
Реваскуляризация миокарда посредством аортокоронарного шунтирования на протяжении нескольких десятилетий остается признанным методом лечения больных ИБС, однако последующая медикаментозная терапия продолжает изучаться и совершенствоваться [19]. Достаточно неожиданными представляются результаты ретроспективного анализа данных исследования IMAGINE, в котором оценивался эффект квинаприла у 2553 пациентов с ФВ ЛЖ более 40% и стабильной гемодинамикой после планового аортокоронарного шунтирования [20]. При лечении 1709 (76,5%) пациентов применялись β-адреноблокаторы, которые при медиане наблюдения 33 мес не снижали риск развития сердечно-сосудистых осложнений (смерть, остановка сердца, ИМ, коронарная реваскуляризация, стенокардия, требующая госпитализации, инсульт или госпитализация по поводу сердечной недостаточности) (ОР 0,97 при 95% ДИ от 0,74 до 1,27) и даже документированной стенокардии (ОР 0,85 при 95% ДИ от 0,61 до 1,19).
В настоящее время еще мало данных об эффективности применения ивабрадина при реабилитации пациентов, перенесших аортокоронарное шунтирование. S. Marazia и соавт. [21] рандомизировали таких пациентов для стандартного лечения с использованием бисопролола по 2,5—3,75 мг 1 раз в день (n=43) или приема ивабрадина по 5 мг 2 раза в день в дополнение к стандартной терапии, включавшей бисопролол в дозе 1,25 мг 1 раз в день (n=38). В группе стандартной терапии бисопрололом среднее расстояние, пройденное в тесте с 6-минутной ходьбой, увеличивалось с 215±53 м в исходном состоянии до 347±42 м через 3 мес после выписки, доля больных с нормальной диастолической функцией ЛЖ снижалась с 23 до 16%, а средняя ФВ ЛЖ повышалась с 57±3 до 59±3% соответственно. В группе терапии с использованием ивабрадина и бисопролола среднее расстояние, пройденное в тесте с 6-минутной ходьбой, увеличивалось со 180±91 м в исходном состоянии до 370±55 м через 3 мес после выписки, доля больных с нормальной диастолической функцией ЛЖ повышалась с 24 до 79%, а средняя ФВ ЛЖ увеличивалась с 57±3 до 66±3% соответственно. Добавление ивабрадина к низкой дозе бисопролола при реабилитации больных, перенесших аортокоронарное шунтирование, позволяет улучшить их функциональное состояние, систолическую и диастолическую функции ЛЖ.
Чрескожное коронарное вмешательство (ЧКВ) — наиболее распространенный способ реваскуляризации миокарда [19]. К. Werdan и соавт. [22] провели ретроспективный анализ данных проекта ADDITIONS, в котором 2330 пациентам со стабильной ИБС, получавшим стандартную терапию, включавшую β-адреноблокаторы, дополнительно назначали ивабрадин по 5—7,5 мг 2 раза в день с оценкой результатов через 4 мес. У 51,4% участников исследования в анамнезе было ЧКВ и у них, как и у больных, ранее не подвергавшихся реваскуляризации миокарда, значительно снижались число приступов стенокардии с 1,9±2,4 до 0,5±1,5 в неделю (р<0,0001), частота применения нитратов для купирования стенокардии — с 2,7±3,7 до 1,0±1,9 раза в неделю (р<0,0001) соответственно. В группах перенесших и не перенесших ЧКВ наблюдалось аналогичное уменьшение функционального класса стенокардии, улучшение качества жизни, а также эффективности и переносимости терапии с использованием ивабрадина по оценке лечащих врачей. Ивабрадин является эффективным и хорошо переносимым антиангинальным препаратом у больных со стабильной стенокардией, возникающей после ЧКВ.
В пилотном исследовании E. Gerbaud и соавт. [23] участвовали 124 больных с ИМ с подъемом сегмента ST, подвергавшихся первичному ЧКВ. После ЧКВ пациенты получали стандартную терапию, включавшую бисопролол, которая в половине случаев дополнялась ивабрадином (5 мг 2 раза в день) для достижения ЧСС в покое менее 60 уд/мин. Через 3 мес терапии индекс конечного диастолического объема ЛЖ в группе ивабрадина оказался меньше, чем в контрольной группе (р=0,04), а индекс конечного систолического объема не изменялся у получавших и увеличивался у не получавших ивабрадин (р=0,01). В итоге в группе ивабрадина по сравнению с контрольной группой происходило значительное повышение ФВ ЛЖ (р=0,04). После успешной реперфузии у пациентов с ИМ с подъемом сегмента ST возможно ограничение ремоделирования и улучшение функции ЛЖ при добавлении ивабрадина к общепринятой терапии.
Недавно опубликованы результаты другого пилотного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования ивабрадина у больных с острой стадией ИМ с подъемами сегмента ST [24]. После успешного первичного ЧКВ пациенты с синусовым ритмом >80 уд/мин и систолическим артериальным давлением (АД) >90 мм рт.ст. получали внутривенно ивабрадин (n=82) (болюс 5 мг в течение 30 с, затем инфузия 5 мг в течение 8 ч) или плацебо (n=42). Ожидаемое урежение ЧСС под действием ивабрадина не приводило к изменению АД. При этом уже через 1 день по данным эхокардиографии наблюдались различия конечного диастолического (87,1±28,2 мл против 117,8±21,4 мл; р=0,01) и конечного систолического (42,5±19,0 мл против 59,1±11,3 мл; р=0,03) объемов ЛЖ в группах ивабрадина и плацебо соответственно. По мнению авторов, необходимы дальнейшие исследования с целью изучения влияния ивабрадина на размер ИМ, функцию ЛЖ и клинические исходы у пациентов данной категории.
Клиническая эффективность и безопасность ивабрадина в дозах 2,5—7,5 мг 2 раза в день в составе комплексного лечения больных ИБС соответствует действующим рекомендациям [7, 12]. К сожалению, у таких пациентов даже при лечении β-адреноблокаторами ЧСС в покое может превышать 70 уд/мин примерно в 50% случаев. При этом частота назначения ивабрадина остается низкой [25]. В этой связи публикация результатов новых клинических исследований ивабрадина привлекает внимание заинтересованных специалистов.
ХСН. Повышенная ЧСС в покое, рассматривавшаяся у больных с ХСН в качестве компенсаторного механизма, в настоящее время признается маркером неблагоприятного исхода ХСН. β-Адреноблокаторы способны улучшать результаты лечения ХСН, но оказывают не всегда благоприятное влияние за пределами уменьшения ЧСС. Ивабрадин продемонстрировал эффективность в снижении риска повторных госпитализаций и смертельных исходов у больных с ХСН [26]. Результаты SHIFT — наиболее успешного исследования ивабрадина при систолической ХСН — продолжают анализироваться. Ниже представлены основные положения трех таких недавних сообщений.
J.S. Borer и соавт. [27] показали, что лечение ивабрадином наиболее тяжелых пациентов с ХСН (ФВ ЛЖ ≤20% и ХСН IV функционального класса) не менее успешно, чем других участников исследования. Применение ивабрадина при тяжелой ХСН сопровождалось снижением ОР комбинированной первичной конечной точки (сердечно-сосудистая смерть или госпитализация в связи с обострением ХСН) на 16%, смерти от всех причин (на 22%), сердечно-сосудистой смерти (на 22%), смерти от ХСН (на 37%) и госпитализации по поводу ХСН (на 17%). Функциональный класс ХСН по классификации Нью-Йоркской ассоциации сердца улучшался у 38% больных в группе ивабрадина и у 29% в группе плацебо (р=0,009). У 272 пациентов с тяжелой ХСН и ЧСС в покое ≥75 уд/мин ивабрадин уменьшал суммарную частоту событий первичной конечной точки на 25% (р=0,045), госпитализаций по поводу ХСН — на 30% (р=0,042), сердечно-сосудистой смерти — на 32% (р=0,034). Профиль безопасности ивабрадина при тяжелой ХСН не отличался от такового в проекте SHIFT в целом. Авторы работы полагают, что снижение ЧСС с помощью ивабрадина безопасно и способно улучшать клинические исходы при любой тяжести ХСН.
Низкий уровень систолического АД ассоциируется с плохим прогнозом у больных с ХСН и затрудняет применение большинства рекомендованных препаратов. Еще в одном субанализе результатов исследования SHIFT оценивались эффективность и безопасность ивабрадина в зависимости от исходного систолического АД [28]. Снижение ОР сердечно-сосудистой смерти или госпитализации в связи с обострением ХСН у получавших ивабрадин оказалось аналогичным в группах с систолическим АД <115 мм рт.ст. (ОР 0,84 при 95% ДИ от 0,72 до 0,98), от 115 до 129 мм рт.ст. (ОР 0,86 при 95% ДИ от 0,72 до 1,03) и ≥130 мм рт.ст. (ОР 0,77 при 95% ДИ от 0,66 до 0,92; р=0,68 для взаимодействия). Профиль безопасности ивабрадина не различался в подгруппах с тремя выбранными уровнями систолического АД. По мнению исследователей, эффективность и безопасность ивабрадина не зависят от систолического АД у больных с ХСН, что важно учитывать при выборе терапии для пациентов с низким АД и повышенной ЧСС.
В третьем подгрупповом исследовании в рамках проекта SHIFT изучалось влияние ивабрадина (n=298) по сравнению с плацебо (n=304) на ритм сердца по результатам суточного холтеровского мониторирования электрокардиограммы исходно и через 8 мес после рандомизации [29]. У пациентов с исходной ЧСС ≥70 уд/мин дозу ивабрадина титровали до 7,5 мг 2 раза в день. Брадикардитическое действие ивабрадина сопровождалось благоприятным повышением вариабельности ритма сердца без существенного увеличения вероятности возникновения наджелудочковой или желудочковой аритмии. Через 8 мес терапии у 21,3% больных в группе ивабрадина против 8,5% в группе плацебо зарегистрирован ≥1 эпизод ЧСС <40 уд/мин (р<0,0001), но не наблюдалось эпизодов ЧСС <30 уд/мин. Лишь у 3 (1,2%) пациентов, получавших ивабрадин, и 4 (1,6%) больных в группе плацебо отмечались интервалы RR электрокардиограммы >2,5 с, а интервалов RR >3 с при лечении ивабрадином не выявлено.
ХСН преимущественно встречается у пожилых пациентов и в клинической практике приходится экстраполировать на них выводы исследований, проведенных у гораздо более молодых больных. Выбор терапии ХСН и ее потенциальная выгода у пожилых людей в значительной степени зависят от неизбежной полипрагмазии и сопутствующей патологии. У крайне ослабленных больных старческого возраста улучшение качества жизни часто становится для них приоритетным. Ивабрадин, селективно урежающий ЧСС и отличающийся хорошей переносимостью, улучшающий прогноз у пациентов с систолической ХСН и синусовым ритмом, может рассматриваться в качестве одного из средств лечения пожилых пациентов [30].
Наиболее обосновано назначение ивабрадина больным с ХСН в дополнение к β-адреноблокатору. Участники исследования SHIFT получали рекомендованные для лечения ХСН β-адреноблокаторы: карведилол (n=2596), бисопролол (n=1483), метопролол (n=1424), реже небиволол (n=197) и эффективность лечения ивабрадином не зависела от варианта этой фоновой терапии [31]. Необходимо отметить, что в начале терапии ХСН β-адреноблокаторами, а также при титровании их дозы актуальна проблема переносимости препаратов данного класса. В проспективном открытом нерандомизированном исследовании у 69 больных с систолической ХСН добавление ивабрадина к карведилолу облегчало титрование дозы β-адреноблокатора, сопровождалось увеличением расстояния, пройденного в тесте с 6-минутной ходьбой (р<0,05), и ФВ ЛЖ (р<0,05) [32]. Полученные результаты заслуживают проверки в проспективном двойном слепом рандомизированном исследовании.
S. Ordu и соавт. [33] исследовали влияние терапии ивабрадином (10—15 мг в день) по сравнению с контрольной группой у 98 амбулаторных больных с систолической ХСН на уровень некоторых биомаркеров в крови. Через 6 мес лечения наряду со значительным уменьшением ЧСС и функционального класса ХСН в группе ивабрадина также отмечалось снижение уровня N-концевого предшественника мозгового натрийуретического гормона (с 1353±1453 до 718±835 пг/мл; р<0,001) и цистатина-C (с 2,10±0,73 до 1,50±0,44 мг/л; р<0,001).
Ивабрадин входит в группу фармакологических средств, способных снижать смертность больных с систолической ХСН [34]. Только два современных препарата (LCZ696 и ивабрадин) рассматриваются в качестве перспективных у пациентов с ХСН и сохраненной ФВ ЛЖ [35].
Поскольку симптомы ХСН с сохраненной ФВ ЛЖ, как правило, возникают при физической нагрузке, оптимизация времени диастолического наполнения путем снижения ЧСС может предупреждать появление симптомов.
В двойном слепом исследовании пациентов с ХСН и сохраненной ФВ ЛЖ рандомизировали для приема ивабрадина по 5 мг 2 раза в день (n=30) или плацебо (n=31). Через 7 дней терапии в группе ивабрадина отмечалось увеличение переносимости физической нагрузки (5,7±1,9 против 4,2±1,8 метаболических единиц до начала лечения соответственно; р=0,001) и пикового потребления кислорода (17,0±3,3 против 14,0±6,1 мл/мин/кг исходно соответственно; р=0,001) с одновременным улучшением показателей диастолической функции ЛЖ [36]. Подобные результаты получены другими исследователями [37].
Убедительно доказанные эффективность и хорошая переносимость ивабрадина при лечении пациентов с ХСН и синусовым ритмом >70 уд/мин способствуют увеличению частоты его назначения [38, 39]. Ивабрадин одобрен Управлением США по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) для снижения риска госпитализации по поводу прогрессирования ХСН [40]. В США ивабрадин показан находящимся в стабильном состоянии пациентам с ХСН и синусовым ритмом с ЧСС ≥70 уд/мин при использовании максимально переносимых доз β-адреноблокаторов.
Селективное урежение ЧСС может оказаться полезным в терапевтических областях за пределами тех, в которых ивабрадин ранее продемонстрировал клиническую эффективность [26]. Известно позитивное влияние ивабрадина у пациентов, которые перенесли реваскуляризацию миокарда, обусловленное отсутствием негативного влияния на функции сердца в сочетании с улучшением коронарного, в том числе коллатерального кровотока.



