В настоящее время доказано участие галектина-3 в сложном патогенетическом каскаде развития и прогрессирования хронической сердечной недостаточности (ХСН). Многочисленные эксперименты на моделях животных, большие когортные исследования продемонстрировали исключительную прогностическую роль галектина-3 [1—3], что нашло отражение и в ряде клинических рекомендаций по диагностике и лечению ХСН, в которых определение уровня галектина-3 в плазме крови рассматривается в качестве дополнительного критерия стратификации риска [4].
В то же время малоизученными остаются аспекты взаимо-связи маркеров фиброза с другими патогенетическими маркерами ХСН: показателями окислительного стресса (ОС), воспаления, дисфункции почек (ДП), миокардиального стресса, матриксного ремоделирования.
В свою очередь современный этап научных достижений обусловливает необходимость мультидисциплинарного и персонализированного подхода к пациенту при выборе диагностического алгоритма и оптимальной тактики лечения, поэтому проблема мультимаркерной концепции в оценке развития и прогрессирования ХСН является востребованной мировым научным сообществом [5].
Цель исследования — оценить взаимосвязи уровня галектина-3 и маркеров ОС, ДП у пациентов с различной тяжестью ХСН.
Материал и методы
В проспективное исследование были включены 157 пациентов с ХСН ишемической этиологии, документированным перенесенным инфарктом миокарда (ИМ) давностью не менее 6 мес. Критериями исключения были сахарный диабет, заболевания печени и почек, гемодинамически значимые пороки сердца. Диагностику и лечение ХСН проводили согласно Национальным рекомендациям 2013 г. [6]. В зависимости от функционального класса (ФК) по классификации NYHA пациенты были разделены на 3 группы: в 1-ю группу включены 60 пациентов с ХСН II ФК, во 2-ю группу — 52 пациента с ХСН III ФК, в 3-ю группу — 45 пациентов с ХСН IV ФК (табл. 1).
Концентрацию биомаркера фиброза миокарда — галектина-3 в плазме крови определяли иммуноферментным методом.
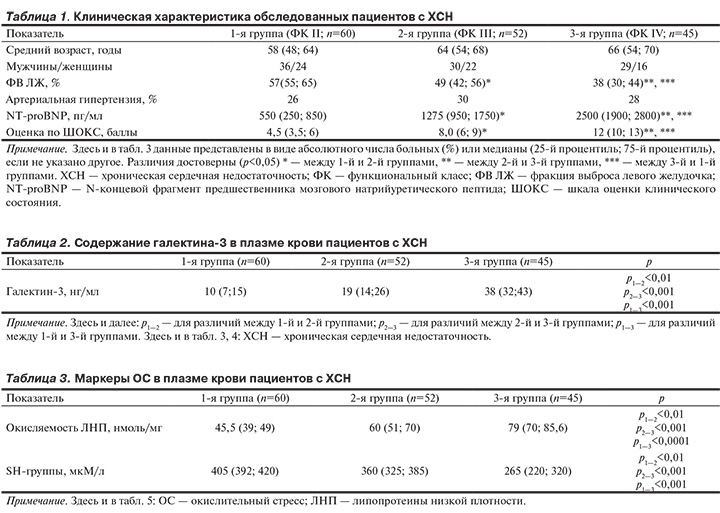
Процесс плазменного ОС у пациентов с ХСН диагностировали по уровню окисляемости липопротеинов низкой плотности (ЛНП) и содержанию антиоксиданта — SH-групп.
Функцию почек оценивали путем расчета скорости клубочковой фильтрации (СКФ) с использованием формулы CKD-EPI, а также по концентрации в плазме крови мочевой кислоты (МК) и цистатина-С, определяемого методом иммуноферментного анализа. Все изучаемые показатели оценивали при включении пациентов в исследование.
Статистическую обработку полученных данных проводили с использованием пакета прикладных программ Statistica 6,0. Применяли непараметрические методы статистического анализа. Данные представлены в виде медианы и межквартильного интервала — Ме (25-й процентиль; 75-й процентиль). Для сравнения групп использовали критерий Манна—Уитни. Корреляционный анализ проводили по методу Спирмена. Силу корреляции определяли по величине коэффициента корреляции (r): r<±0,29 — слабая корреляция, r=±0,30—0,69 — умеренная, r>±0,7 — сильная. Различия между группами считали достоверными при p<0,05.
Результаты
Уровень галектина-3 достоверно различался у пациентов с разными ФК; самый высокий показатель наблюдался в группе пациентов с ХСН IV ФК (табл. 2).
Концентрация галектина-3 в плазме крови у обследуемых пациентов ассоциировалась с тяжестью ХСН. При корреляционном анализе во всех группах отмечалась достоверная положительная связь содержания галектина-3 в плазме крови с оценкой по Шкале оценки клинического состояния (ШОКС), сила которой возрастала от 1-й группы к 3-й: r1=0,27, r2=0,36, r3=0,52 соответственно (p<0,05).
При оценке плазменного ОС у пациентов 2-й и 3-й групп по сравнению с показателями 1-й группы отмечалось увеличение окисленных ЛНП соответственно на 32% (p<0,05) и 73% (p<0,001). Кроме того, выявлялось одновременное снижение концентрации плазменного антиоксиданта — SH-групп у всех обследуемых пациентов (табл. 3). При этом их содержание у пациентов 2-й и 3-й групп по сравнению с показателями 1-й группы было ниже на 11% (p<0,05) и 34,6% (p<0,001) соответственно. У пациентов 1—3-й групп наблюдались сильные отрицательные корреляции в паре SH-группы — окисляемость ЛНП (r1=–0,77, r2= –0,86, r3=0,85 соответственно; p<0,05).

Основные параметры, характеризующие функцию почек, представлены в табл. 4.
СКФ у пациентов 2-й и 3-й групп была достоверно ниже, чем у лиц 1-й группы (см. табл. 4), на 16,5% (p<0,05) и 55,5% (p<0,001) соответственно. При этом СКФ <60 мл/мин/1,73 м2 наблюдалась у 18% пациентов 1-й группы, у 44% во 2-й группе и 93% в 3-й группе обследуемых.
Концентрация МК у пациентов с различными ФК ХСН достоверно отличалась (см. табл. 4). Этот показатель в 3-й группе превышал таковой в 1-й группе на 64,7%, во 2-й группе – на 34,9%.
Содержание цистатина-С в плазме крови у пациентов с ХСН достоверно отличалось в группах обследуемых (см. табл. 4), при этом максимальные значения регистрировались у пациентов с самыми высокими оценками по ШОКС.
При корреляционном анализе выявлены сильные и умеренные связи в парах галектин-3 — цистатин-С, галектин-3 — маркеры ОС (окисленные ЛНП, SH-группы), галектин-3 — СКФ. В паре галектин-3 — креатинин наблюдались лишь слабые положительные корреляции (табл. 5).
Кроме того, были выявлены достоверные корреляции между активностью ОС и маркерами ДП: между окисляемостью ЛПП и цистатином-С во 2-й и 3-й группах пациентов (r2=0,35; р<0,05 и r3=0,44; р<0,05 соответственно), а также в паре окисляемость ЛНП — МК (r2=0,42; р<0,01 и r3=0,48; р<0,01 соответственно).
Обсуждение
Согласно современным данным, галектин-3 является одним из наиболее перспективных патогенетических маркеров ХСН, продемонстрировавших свою прогностическую значимость [7]. Единичные исследования посвящены оценке взаимосвязи разных патогенетических маркеров у пациентов с ХСН. Так, в работе G. Toprak и соавт. при сравнении 2 групп пациентов с ХСН ишемической этиологии и вызванной дилатационной кардиомиопатией выявлены достоверные различия по концентрации галектина-3, при этом степень активации ОС и воспаления были сопоставимы [8]. В то же время, согласно нашим результатам, у пациентов с ХСН ишемической этиологии уровень галектина-3 тесно коррелировал с показателями ОС, причем сила корреляций нарастала с увеличением ФК. С патогенетической точки зрения взаимо-связи галектина-3 и ОС можно объяснить, тем, что галектин-3 in vitro способствует модификации (свободнорадикальному окислению) ЛНП и их рецепторному захвату, что может вести к активации атерогенеза [9]. Кроме того, согласно данным J. Madrigal-Matute и соавт., уровень галектина-3 у пациентов с бессимптомным каротидным атеросклерозом превышал аналогичный показатель у пациентов без атеросклероза и достоверно коррелировал с NADH-оксидазой. В свою очередь, у пациентов с периферическим атеросклерозом плазменный уровень галектина-3, превышающий значение медианы в обследованной когорте, был ассоциирован с увеличением риска сердечно-сосудистой смертности в течение 5-летнего периода наблюдения [10]. Таким образом, взаимосвязь галектина-3 с параметрами ОС можно рассматривать как один из возможных механизмов прогрессирования атерогенеза. В нашей работе также установлено, что достоверное снижение концентрации основного антиоксиданта — SH-групп белков в значительной мере способствует выраженной активации ОС, особенно у пациентов с тяжелым течением ХСН. Это подтверждается наличием сильных отрицательных корреляций между окисляемостью ЛНП и содержанием SH-групп.
В последние годы большое значение придается оценке функции почек у пациентов с ХСН, так как ее ухудшение является независимым неблагоприятным прогностическим фактором. Для определения СКФ у пациентов с ХСН применялась формула CKD-EPI, которая, согласно последним данным, является наиболее прогностически значимой, в особенности при включении в расчет уровня цистатина-С [11]. В ряде оригинальных исследований демонстрировались достоверные связи между уровнем галектина-3 и отдельными маркерами ДП [12], в свою очередь, нами были установлены корреляции уровней галектин-3 — МК, а также выявлена взаимосвязь ДП с активностью плазменного ОС у пациентов с тяжелой ХСН.
Таким образом, полученные результаты показали, что в процесс формирования кардиоренального синдрома (КРС) у пациентов с ХСН ишемической этиологии могут быть вовлечены маркеры фиброза, в частности галектин-3, ОС. Кроме того, наличие достоверных корреляций между показателями ОС и маркерами ДП у пациентов с ХСН III и IV ФК может свидетельствовать о том, что выраженный ОС способствует прогрессированию ДП в данной когорте. В то же время наличие достоверных корреляций между уровнем галектина-3 и параметрами ДП (цистатин-С, СКФ, МК) у пациентов с ХСН различных ФК демонстрирует возможное участие этого биомаркера в патогенезе кардиоренального синдрома на разных этапах развития и прогрессирования ХСН ишемической этиологии. Несомненно, только фундаментальные патогенетические модели позволят оценить вклад различных факторов в указанные процессы. Так, разными авторами обсуждаются возможные механизмы развития КРС при ХСН: например, активные формы кислорода по сложным каскадным путям вызывают активацию фактора транскрипции NF-κb, который усиливает экспрессию генов, индуцирующих интерстициальный фиброз почек и воспаление [13]. В данном исследовании с клинической точки зрения оценивались взаимосвязи сложной патогенетической оси: фиброз — ОС — ДП. Действительно, патогенетически обоснованная биомаркер-управляемая стратегия в кардиологии только начинает развиваться, в отличие, например, от онкологической практики, в которой широко применяется как учеными, так и клиницистами [14].
Заключение
Концентрация галектина-3 в плазме крови достоверно коррелирует с показателями дисфункции почек: цистатином-С, мочевой кислотой и скоростью клубочковой фильтрации у пациентов с хронической сердечной недостаточностью ишемической этиологии различных функциональных классов. Высокая степень корреляции во всех группах отражает универсальность этой взаимосвязи в целом в изучаемой когорте пациентов. В то же время остается неясной роль галектина-3: является ли он медиатором или маркером в развитии и прогрессировании дисфункции почек; безусловно, необходимы исследования с созданием экспериментальных патогенетических моделей.
Уровень галектина-3 положительно коррелирует с плазменным уровнем окисленных липопротеинов низкой плотности, в свою очередь отмечается отрицательная взаимосвязь с антиоксидантным компонентом плазмы — SH-группами, что свидетельствует о его участии в процессах плазменного окислительного стресса у пациентов, перенесших инфаркт миокарда.
Таким образом, галектин-3 сопряжен с процессами не только фиброза, но и окислительного стресса, и с прогрессированием дисфункции почек у пациентов с хронической сердечной недостаточностью, перенесших инфаркт миокарда.
Определение комплекса биомаркеров при хронической сердечной недостаточности раскрывает патогенетические звенья сердечно-сосудистого континуума и позволяет проводить персонализированную оценку состояния пациентов.



