Хроническая сердечная недостаточность (ХСН) является естественным финалом всех сердечно-сосудистых заболеваний (ССЗ). Распространенность ХСН в Российской Федерации составляет 4,5%, что соответствует 5 млн пациентов [1]. При этом прогноз декомпенсации функции сердца остается неблагоприятным. Даже на фоне оптимальной медикаментозной терапии риск смерти пациентов в течение первого года наблюдения составляет 9,2%, 3 лет — 21,7%, и 5 лет — 36,7% [2]. Основными причинами смерти пациентов с ХСН со сниженной фракцией выброса (ФВ) левого желудочка (ЛЖ) являются декомпенсация сердечной деятельности, внезапная сердечная смерть (ВСС) и смерть от других причин, так как большинство пациентов с клинически выраженной ХСН имеют большое количество опасных сопутствующих заболеваний. По данным исследования MERIT-HF, у пациентов с II функциональным классом (ФК) по классификации NYHA 64% смертей носили внезапный характер, и даже пациенты, находящиеся в наиболее тяжелом состоянии (IV ФК), в 33% случаев умирали внезапно [3] (рис. 1).
Под ВСС подразумевают ненасильственную смерть вследствие заболевания сердца, когда остановка кровообращения развилась в течение 1 ч от момента манифестации острых симптомов, и ей предшествовала внезапная потеря сознания. Обычно под ВСС подразумевают смерть из-за нарушений ритма и проводимости сердца — в первую очередь, из-за желудочковой тахикардии (ЖТ) или фибрилляции желудочков (ФЖ). При этом ЖТ/ФЖ может быть первичной причиной смерти, а может быть только проявлением инфаркта миокарда (ИМ) или тромбоэмболии легочной артерии (ТЭЛА), приведших к смерти.
Общая характеристика ВСС при ХСН. В большинстве случаев под ВСС подразумевается наличие фатальных нарушений ритма сердца, хотя это весьма упрощенный взгляд на ситуацию. Это связано с тем, что более чем у 90% больных с клинически выраженной ХСН II—IV ФК выявляются желудочковые нарушения ритма сердца (ЖНРС) — парные желудочковые экстрасистолы или пробежки желудочковой тахикардии. При 48-часовом контроле электрокардиограммы (ЭКГ) подобные ЖНРС выявляются у всех пациентов с ХСН и сниженной ФВ ЛЖ [4]. Среди больных с ХСН частота ВСС составляет 42,6%, при этом у умерших в стационаре — 20,4%, в амбулаторных условиях — 72,2% [5]. Анализ основных причин смерти больных с ХСН по результатам 17 рандомизированных клинических исследований (РКИ) представлен в табл. 1. Были проанализированы данные почти 40 000 больных с ХСН в исследованиях 1987—2011 гг. В зависимости от тяжести декомпенсации и проводимого лечения годичная смертность колебалась от 7,5 до 64% (в среднем 13,8%). Большинство пациентов умирали от ССЗ (86,8%), из которых наиболее частыми были ВСС и декомпенсация ХСН, при небольшой частоте (5,9%) острого инфаркта миокарда (ОИМ). Частота ВСС составила 41,2%, смерти в результате прогрессирования ХСН — 35,3% (соотношение 1,16) [6].
Наиболее подробный анализ причин смерти больных с ХСН проводился по результатам исследования ATLAS, в котором 3164 пациента с ХСН II—IV ФК с ФВ ЛЖ ≤30%, рандомизированных в группы лечения малой и большой дозами лизиноприла, наблюдались в течение 5 лет [7]. В этом исследовании причину смерти (всего 1354) устанавливали независимые эксперты по данным карт пациентов, а отдельным пациентам была выполнена аутопсия, позволившая точно определить причины смерти. Под ВСС в исследовании ATLAS подразумевали внезапную сердечно-сосудистую смерть, не связанную с диагностированным острым сердечно-сосудистым осложнением — ССО (ОИМ, ТЭЛА и т.д.). Подобная классификация отличается от современной, так как в настоящее время внезапно возникшую смерть из-за ОИМ также относят к ВСС [8], но разделение, использованное в исследовании ATLAS, удобно для различия механизмов, лежащих в основе ВСС. Оно позволяет дифференцировать ВСС из-за ОИМ, осложнившегося разрывом сердца или аритмией, от первичной (истинной) аритмической смерти. Частота ВСС, по мнению экспертов, составила 42,6%, а смерти в результате прогрессирования декомпенсации — 32,1%, не различаясь существенно в зависимости от ишемической или неишемической этиологии ХСН. Группа пациентов, которым была проведена аутопсия (n=171), не отличалась по клиническим и инструментальным характеристикам от общей популяции обследованных. Как видно из табл. 2, при аутопсии картина кардинально менялась: при ишемической ХСН больные наиболее часто умирали от ОИМ (31,7%), и даже при неишемической этиологии острые коронарные осложнения были обнаружены в 17,6% случаев (3-я по частоте причина смерти). При этом из 47 пациентов с ОИМ у 32 (68%) смерть была внезапной. Из 15 случаев смерти от прогрессирования ХСН после ОИМ диагноз коронарной патологии был предположен лишь в 6 (40%).
Результаты исследования ATLAS следует оценивать с осторожностью. Во-первых, исследование проводилось с 1992 по 1997 г. до широкого применения β-адреноблокаторов и антагонистов минералокортикоидных рецепторов (АМКР) в лечении пациентов с ХСН. Во-вторых, причины смерти у пациентов после ОИМ отличаются в зависимости от сроков, прошедших после острого коронарного осложнения, а в исследование ATLAS включались также пациенты с ранними (до 2 мес) сроками после ОИМ.
Тот факт, что в значительной части случаев ВСС причиной является не первичное аритмическое осложнение, подтверждают данные аутопсии 382 пациентов, умерших внезапно после вызова скорой медицинской помощи в Москве в 2007—2008 гг. [9]. Отсутствие морфологических признаков поражения сердца отмечено у 42% пациентов, в то время как признаки острых коронарных изменений обнаружены у 32%, а тромбоэмболические осложнения — у 17%. Более 50% больных, умерших внезапно, имели тяжелые сопутствующие не-ССЗ. В частности, из 160 пациентов у 64 (16,6% всех смертей) причинами смерти могли быть пневмонии и злокачественные образования, что снижает число истинной аритмической смерти до 25,1%. Аналогичные данные представлены и в анализе выживаемости 960 пациентов, наблюдавшихся в клинике сердечной недостаточности в Барселоне [10]. Истинная аритмическая ВСС диагностирована у 16% пациентов, в то время как не-ССЗ привели к смерти 16,8%, а у 7,7% несомненная причина летального исхода не была установлена.
Аналогично в анализе результатов аутопсий 398 больных, умерших в исследовании VALIANT, среди 105 пациентов с клиническим диагнозом ВСС ее истинно аритмический генез подтвержден лишь у 51,4% [11].
Следует отметить, что частота ВСС не отличается и в зависимости от ишемической и неишемической этиологии ХСН, и это подтверждается анализом опубликованного недавно исследования EVEREST [12].
Таким образом, хотя ВСС является причиной смерти около 40% пациентов с ХСН, проведение аутопсии позволяет почти у 50% таких пациентов исключить ее аритмический характер, более того, у 1/4 больных клинически невозможно установить очевидную причину смерти [13]. Во многих из этих случаев сопутствующее не-ССЗ может затруднять выявление истинной причины смерти. Тем не менее около 25% пациентов с ХСН умирают в результате нарушений ритма сердца, что делает проблему профилактики ВСС весьма актуальной [14].
Характеристика фатальных аритмий. Один из наиболее сложных вопросов — характеристика нарушений ритма и проводимости, лежащих в основе ВСС. Изучению этого вопроса было посвящено классическое исследование A. Bayés de Luna и соавт. [15]. Они проанализировали 157 ВСС, произошедших во время холтеровского мониторирования ЭКГ (ХМ ЭКГ). Пациентов с острым коронарным синдромом (ОКС) и нестабильным клиническим состоянием в исследование не включали. По данным работы, причиной смерти 83,5% пациентов были ЖТ и ФЖ (torsade de pointes — 12,7%, первичная ФЖ — 8,3%, трансформация ЖТ в ФЖ — 62,5%). В 16,5% случаев больные умирали вследствие брадиаритмий. Обращает внимание высокий процент ВСС из-за тахикардии типа torsade de pointes, что могло быть связано с проводившейся агрессивной антиаритмической терапией у большинства из них. Что касается 70,8% пациентов с ФЖ и с ЖТ, трансформировавшейся в ФЖ, то в основном это были больные с ССЗ, в том числе с низкой ФВ ЛЖ и ХСН. Из-за того, что данные были собраны из разных клиник, не всем пациентам выполнялись аутопсии и не у всех пациентов имелась информация о динамике сегмента ST в процессе ХМ ЭКГ, у исследователей не было возможности выявить реальный процент истинно аритмической ЖТ/ФЖ и аритмий, связанных с ОКС.
У 16,5% пациентов причиной ВСС были брадиаритмии, при этом все эти пациенты имели ССЗ. В подгруппе из 15 наиболее тщательно проанализированных случаев, у 11 пациентов брадиаритмия (чаще всего электромеханическая диссоциация) была связана с острыми изменениями сегмента ST, у 2 была предположительно ятрогенная атриовентрикулярная блокада, и у одного — синоаурикулярная блокада, не связанная с приемом препаратов [16].
Еще один анализ нарушений ритма и проводимости был выполнен у больных, перенесших ОИМ и имевших ФВ ЛЖ ≤40%, в исследовании CARISMA, в котором 297 пациентам были имплантированы петлевые регистраторы ЭКГ в ранние сроки после ОИМ. Средняя длительность наблюдения за пациентами составила 1,9±0,5 года. За время наблюдения умерли 36 человек [17], ЭКГ в момент смерти была известна у 16 из них [18]. Анализ ЭКГ показал, что у 8 пациентов в момент смерти имелись желудочковые нарушения ритма сердца, а у 8 — брадиаритмии. ВСС была у 7 из 16 пациентов, у 6 она была связана с ФЖ, у одного — с брадикардией (табл. 3). Следует также отметить, что в ходе исследования 15 пациентам была проведена имплантация электрокардиостимуляторов (ЭКС) в связи выявленными с нарушениями проводимости, а 56 – имплантируемых кардиовертеров-дефибрилляторов (ИКД) (45 пациентам с целью первичной профилактики ВСС, а 11 – в связи с вторичной профилактикой ВСС) [19].
Анализ всех нарушений ритма [19] и проводимости у пациентов, включенных в исследование CARISMA, показал, что у 137 (46%) из 297 пациентов были зарегистрированы эпизоды нарушений ритма сердца и проводимости (в 86% случаев бессимптомные). После исключения из анализа фибрилляции предсердий (ФП) зафиксирован 361 эпизод нарушений ритма и проводимости. При этом лишь 103 (28,5%) были связаны с ЖТ/ФЖ, а 124 (34,4%) с атриовентрикулярной блокадой и 134 (37,1%) с брадиаритмиями.
Связь нарушений ритма и ремоделирования сердца при ХСН. В исследованиях, выполненных в 80-е годы XX века, риск сердечно-сосудистой смерти был прямо связан с величиной ФВ ЛЖ [20]. Как видно из рис. 2, смертность начинает постепенно повышаться при ФВ ЛЖ ≤60%, крутизна подъема кривой постоянно увеличивается, достигая максимума при снижении ФВ ЛЖ ≤30%, что позволило использовать этот критерий для отбора пациентов во многие исследования по профилактике ВСС (MADIT, MADIT II, MADIT CRT).
Однако не во всех случаях именно снижение ФВ ЛЖ ≤30% считается критерием нарушений гемодинамики. Многим исследователям эта цифра кажется слишком заниженной. Так, в анализе нашей группы, проводившемся в 80-е годы XX века, «взрывной» рост частоты опасных для жизни ЖНРС был отмечен у пациентов с ФВЛЖ <40%, и снижение ФВ ЛЖ коррелировало с выраженностью аритмий (n=190; r=0,57; p<0,001). И этот же критерий сниженной систолической функции сердца использовался в программах CHARM, PEP-CHF и SIGNIFY [21—23]. Однако еще более часто границей выраженного ухудшения гемодинамики считается ФВ ЛЖ ≤35%, при которой реально ухудшается прогноз у больных с декомпенсированной ишемической болезнью сердца (ИБС) и неишемическими кардиомиопатиями [24—26]. Мы сознательно приводим ссылки как на классические исследования 20—30-летней давности, так и на протоколы ХХI века, чтобы исключить влияние сопутствующей терапии на трактовку «снижения систолической функции сердца» и «серьезных нарушений гемодинамики». В частности, наша группа провела анализ 8-летнего риска смерти пациентов с ХСН, находившихся на лечении в отделе заболеваний миокарда и сердечной недостаточности Института клинической кардиологии им. А.Л. Мясникова РКНПК с 2002 по 2006 гг. Проведенный ROC-анализ показал, что ФВ ЛЖ ≤35% выделяет пациентов с ХСН и высоким (выше на 63%; р<0,001) относительным риском (ОР) смерти при оптимальном соотношении чувствительности и специфичности [2].
 Таким образом, можно констатировать выбор различных критериев по величине ФВ ЛЖ для проведения исследований по профилактике смерти (в том числе ВСС) у пациентов с ХСН:
Таким образом, можно констатировать выбор различных критериев по величине ФВ ЛЖ для проведения исследований по профилактике смерти (в том числе ВСС) у пациентов с ХСН:
- исследования по применению β-адреноблокаторов проводились у больных с ФВ ЛЖ <40% (CIBIS-II, MERIT-HF); ФВ ЛЖ <35% (US Carvedilol, BEST) и ФВ ЛЖ <25% (COPERNICUS);
- исследования с антиаритмическими препаратами при ФВ ЛЖ <40% (CHF-STAT) или ФВ ЛЖ <35% (GESICA, ANDROMEDA, SCD-HeFT);
- исследования с имплантацией кардиовертера-дефибриллятора при ФВ ЛЖ <35% (SCD-HeFT, COMPANION) и ФВ ЛЖ <30% (MADIT, MADIT II);
- исследования, изучавшие сердечную ресинхронизирующую терапию (СРТ) при ФВ ЛЖ <40% (REVERSE), ФВ ЛЖ <35% (CARE-HF, COMPANION), ФВ ЛЖ ≤30% (MADIT-CRT, RAFT).
Необходимо напомнить, что в исследовании CORONA по применению статинов в лечении ХСН ишемической этиологии применялось даже два критерия: ФВ ЛЖ <40% при III—IV ФК и ФВ ЛЖ <35% при II ФК ХСН.
Вопрос о связи нарушений гемодинамики и ЖНРС при ХСН подробно изучался и нашей группой. Было продемонстрировано достоверное увеличение количества и градаций ЖНРС у больных с ХСН при снижении ФВ ЛЖ менее 40%. Между градациями ЖНРС и ФВ ЛЖ была выявлена достоверная обратная корреляция (r=– 0,58; р<0,01), а между ЖНРС и давлением заклинивания легочной артерии — достоверная позитивная корреляция (r=0,66; p<0,001). В дальнейшем была предпринята попытка понять, насколько тесной и «двусторонней» является эта связь, возможно ли, существенно улучшая показатели гемодинамики, достоверно повлиять на ЖНРС и наоборот, уменьшая выраженность аритмий, рассчитывать на нормализацию гемодинамики [27]. Ответы на оба вопроса оказались отрицательными. При 24—48-часовой внутривенной капельной инфузии нитроглицерина и допамина давление заклинивания легочной артерии стабильно снижалось с 26 до 17 мм рт.ст. и сердечный индекс рос с 2,2 до 2,8 л/мин/м2, но это никак не влияло на количество и характер ЖНРС. В то же время стойкий антиаритмический эффект (снижение ЖНРС на 90%), достигнутый у 61% больных с ХСН при лечении этмозином и у 83% этацизином, не сопровождался улучшением гемодинамики, что может быть следствием кардиодепрессивного действия антиаритмических препаратов [28].
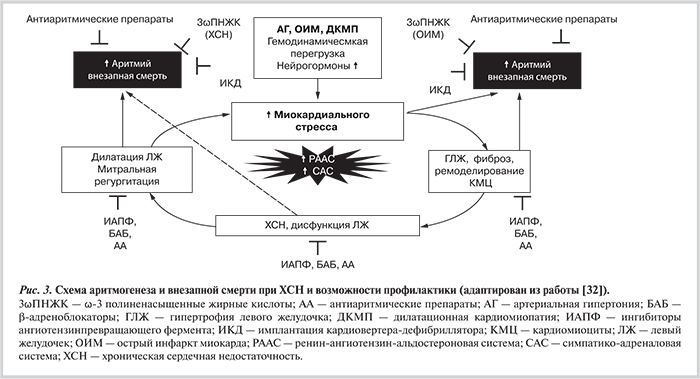
Стало очевидно, что нарушения гемодинамики только запускают аритмический субстрат, а при прогрессировании болезни являются лишь «зеркалом» структурного ремоделирования сердца при ХСН. Как было продемонстрировано в UK-Heart Study, риск внезапной смерти был достоверно выше при увеличении размеров сердца (кардиоторакальный индекс >0,52) [29]. В исследовании LIFE была обнаружена связь риска ВСС с гипертрофией ЛЖ, определявшейся по ЭКГ [30]. Еще более интересные данные были получены при анализе исследования VALIANT: при постинфарктной ХСН риск смерти (включая внезапную) растет пропорционально увеличению массы миокарда ЛЖ и относительной толщины стенок (концентрическая гипертрофия миокарда) [31]. Это позволяет предположить, что риск ВСС у больных с ХСН начинается задолго до выраженной дилатации сердца и может быть связан с целым рядом дополнительных механизмов (рис. 3).
 Как видно, гемодинамическая перегрузка вместе с начинающейся активацией нейрогормонов за счет повышения миокардиального стресса стимулируют возможность повышения эктопической активности еще до выявления структурного ремоделирования сердца. По мере прогрессирования болезни при концентрическом, затем эксцентрическом ремоделировании шансы на появление опасных для жизни аритмий и риск ВСС значительно возрастают. Таким образом, антиаритмические препараты, гарантирующие электрическую стабильность миокарда, могут иметь ограниченную эффективность на начальном этапе ремоделирования сердца. Аналогично и успехи постановки ИКД, предупреждающего переход ЖТ в ФЖ и снижающего риск ВСС, могут уменьшаться с прогрессированием ХСН. В то же время методы лечения, способствующие обратному ремоделированию сердца (прежде всего нейрогормональные модуляторы), несмотря на отсутствие электрофизиологических механизмов, способны уменьшать аритмогенез и риск ВСС. Подобный же механизм действия можно предположить и при использовании СРТ у больных с широким комплексом QRS, прежде всего при блокаде левой ножки пучка Гиса, когда эффективность медикаментозного лечения минимальна. И, наконец, эфиры ω3-полиненасыщенных жирных кислот (ПНЖК), выступающих в качестве мембранопротектора, также способны снижать риск ВСС, причем эффект этих препаратов может даже усиливаться с прогрессированием ремоделирования как структурного, так и следующего за ним — электрического.
Как видно, гемодинамическая перегрузка вместе с начинающейся активацией нейрогормонов за счет повышения миокардиального стресса стимулируют возможность повышения эктопической активности еще до выявления структурного ремоделирования сердца. По мере прогрессирования болезни при концентрическом, затем эксцентрическом ремоделировании шансы на появление опасных для жизни аритмий и риск ВСС значительно возрастают. Таким образом, антиаритмические препараты, гарантирующие электрическую стабильность миокарда, могут иметь ограниченную эффективность на начальном этапе ремоделирования сердца. Аналогично и успехи постановки ИКД, предупреждающего переход ЖТ в ФЖ и снижающего риск ВСС, могут уменьшаться с прогрессированием ХСН. В то же время методы лечения, способствующие обратному ремоделированию сердца (прежде всего нейрогормональные модуляторы), несмотря на отсутствие электрофизиологических механизмов, способны уменьшать аритмогенез и риск ВСС. Подобный же механизм действия можно предположить и при использовании СРТ у больных с широким комплексом QRS, прежде всего при блокаде левой ножки пучка Гиса, когда эффективность медикаментозного лечения минимальна. И, наконец, эфиры ω3-полиненасыщенных жирных кислот (ПНЖК), выступающих в качестве мембранопротектора, также способны снижать риск ВСС, причем эффект этих препаратов может даже усиливаться с прогрессированием ремоделирования как структурного, так и следующего за ним — электрического.
Профилактика ВСС при ХСН. Методы профилактики ВСС можно условно разделить на использование основных способов лечения ХСН (ингибиторы ангиотензинпревращающего фермента — АПФ, АМКР, β-адреноблокаторы, контроль уровня калия и коррекция диуретической терапии, СРТ (у пациентов с расширенным комплексом QRS) и применение специальных видов лечения (антиаритмические препараты, ИКД).
Сначала мы обсудим основные методы лечения ХСН, а затем — использование специальных методов. Будет обсуждаться как возможность снижения ВСС, так и риска общей смерти, так как по-настоящему эффективным средством можно считать только препарат или медицинский прибор, снижающий оба эти показателя.
Для лечения ХСН в середине XX века использовали диуретики и сердечные гликозиды, при этом 6-месячный риск общей смерти пациентов III—IV ФК был около 40% [33]. Первым добавлением к этим препаратам стали ингибиторы АПФ, которые снижают риск смерти от ССЗ, внезапной сердечной смерти и смерти от всех причин у пациентов с ХСН за счет уменьшения активации ренин-ангиотензиновой системы (см. рис. 3) и снижения риска развития гипокалиемии на фоне приема диуретиков. По данным мета-анализа 15 исследований c участием 15 104 пациентов с ХСН и постинфарктным кардиосклерозом [34], ингибиторы АПФ снижают общую (ОР 0,83 при 95% доверительном интервале — ДИ от 0,71 до 0,97), сердечно-сосудистую (ОР 0,82 при 95% ДИ от 0,69 до 0,97) и внезапную сердечную смертность (ОР 0,80 при 95% ДИ от 0,70 до 0,92).
Другим классом препаратов, введенных в схему лечения пациентов с ХСН, были β-адреноблокаторы. Эффект этих препаратов связан с блокадой симпатико-адреналовой системы, что приводит к обратному ремоделированию сердца, уменьшению неблагоприятного влияния катехоламинов на сердце (см. рис. 3). По данным мета-анализа 30 исследований с участием 24 779 пациентов по применению β-адреноблокаторов у пациентов с ХСН [35], риск ВСС снижается на 31% (ОР 0,69 при 95% ДИ от 0,62 до 0,77; p<0,00001), риск сердечно-сосудистой смерти снижается на 29% (ОР 0,71 при 95% ДИ от 0,64 до 0,79; p<0,00001), риск смерти от всех причин снижается на 33% (ОР 0,67 при 95% ДИ от 0,59 до 0,76; p<0,00001).
Третьей группой препаратов, введенных в схемы лечения пациентов с ХСН, были антагонисты альдостероновых рецепторов, которые уменьшают обратное ремоделирование миокарда (см. рис. 3), за счет чего уменьшается риск ВСС. По данным исследования RALES [36], у пациентов с ХСН III—IV ФК применение спиронолактона снижает риск смерти на 30% (ОР 0,70 при ДИ от 0,60 до 0,82; p<0,001), сердечно-сосудистой смерти от всех причин на 31% (ОР 0,69 при ДИ от 0,58 до 0,82; p<0,001), ВСС на 29% (ОР 0,71 при ДИ от 0,54 до 0,95; p=0,02). В исследовании EMPHASIS-HF [26] эплеренон снижал риск смерти от всех причин на 22% (ОР 0,78 при ДИ от 0,64 до 0,95; p=0,01), при этом не было достоверного снижения ВСС.
Использование комбинации ингибитора АПФ (при непереносимости антагонистов рецепторов ангиотензина II), β-адреноблокаторов и АМКР позволяет значительно снизить риск смерти от всех причин и ВСС. Например, в исследовании CARE HF [37] в группе медикаментозного лечения пациентов с систолической ХСН III—IV ФК и QRS ≥120 мс риск смерти от всех причин в течение 12 мес составлял 12,8%, в то время как в группе контроля исследования CONSENSUS (терапия дигоксином и диуретиками) риск смерти составлял 40% [33].
У пациентов с QRS >120 – 150 мс (чаще с наличием блокады левой ножки пучка Гиса) в дополнение к оптимальной медикаментозной терапии в последние десятилетия используется СРТ, позволяющая дополнительно снизить риск смерти в этой группе пациентов.
Мало назначить лекарства, следует корректно титровать дозы препаратов, контролировать электролиты крови, в первую очередь, уровень калия. В основных исследованиях по изучению ингибиторов АПФ стремились к титрованию максимальных доз препаратов. В исследовании ATLAS [38] было проведено сравнение эффективности большой и малой доз ингибитора АПФ лизиноприла, показавшее, что в группе большой дозы отмечалось достоверно большее снижение риска госпитализации из-за ХСН. Анализ основных исследований по применению β-адреноблокаторов показал, что не достижение целевой дозы, а снижение частоты сердечных сокращений (ЧСС) при синусовом ритме менее 70 уд/мин является критерием эффективности терапии [39]. В последние годы у пациентов с синусовым ритмом в добавление к β-адреноблокаторам исследовался новый препарат — блокатор If-тока ивабрадин. Этот препарат снижает ЧСС за счет непосредственного действия на If-токи в синусном узле, не влияет на функцию атриовентрикулярного узла. Эффективность ивабрадина у пациентов с ХСН со сниженной ФВ ЛЖ была изучена в исследовании SHIFT [40], в котором участвовали 6505 пациентов с ХСН, ФВ ЛЖ ≤35%, синусовым ритмом и ЧСС в покое ≥70 уд/мин. Пациенты были рандомизированы на испытуемую группу (стандартная терапия + ивабрадин) и группу контроля (стандартная терапия: 93% — ингибитор АПФ, 90% — β-адреноблокаторы, 60% — АМКР). Исследование показало, что у пациентов с ЧСС выше 75 уд/мин риск достижения «первичной конечной точки» (сердечно-сосудистая смерть или госпитализация из-за ХСН) был на 18% достоверно выше, чем у пациентов с ЧСС в покое ниже 75 уд/мин (ОР 0,82 при 95% ДИ от 0,75 до 0,90; p<0,0001). Специального анализа по эффективности ивабрадина в предотвращении ВСС не проводилось, но с учетом влияния на сердечно-сосудистую смертность и госпитализацию из-за ХСН этот препарат допускается к использованию европейскими рекомендациями по лечению ХСН [41] у пациентов с ФВЛЖ ≤ 35% на фоне синусового ритма с ЧСС ≥70 уд/мин на фоне терапии β-адреноблокаторами (IIa, B). В рекомендациях указано также на целесообразность назначения этого препарата при противопоказаниях к назначению β-адреноблокаторов и частоте синусового ритма >70 уд/мин (IIb, C).
Последней группой препаратов, которую следует отметить, обсуждая вопрос о профилактике ВСС у пациентов с ХСН, являются ПНЖК. По данным эпидемиологических исследований, низкое содержание ПНЖК является фактором риска ВСС (см. рис. 3) [42]. В исследовании GISSI-HF применение ПНЖК снижало риск смерти от всех причин на 9% (ОР 0,91 при 95% ДИ от 0,883 до 0,998; p=0,041), риск госпитализации из-за аритмий на 28% (p=0,01) и достижения «комбинированной точки» (смерть или желудочковые нарушения ритма сердца) на 18% (p=0,009) [43, 44].
Ингибиторы АПФ, β-адреноблокаторы, АМКР снижают риск ВСС за счет блокады гиперактивации нейрогуморальных систем и обратного ремоделирования ЛЖ [7]. С учетом того, что у пациентов с ХСН, находящихся только на терапии ингибитором АПФ, остается достаточно высокий риск ВСС из-за острого коронарного события (42%) [38], была выдвинута гипотеза, согласно которой применение статинов позволит снизить риск смерти пациентов с ХСН. Эта гипотеза была проверена в исследовании CORONA [45], которое проводилось у пожилых пациентов с ХСН, вызванной ИБС (ФВ ЛЖ 35—40%, ФК II—IV), находившихся на оптимальной терапии β-адреноблокаторами (75%), ингибиторами АПФ (91%) и АМКР (39%). По данным исследования CORONA, статины не снижают общую и внезапную смертность у пациентов данной категории, но достоверно снижают риск госпитализации. Данные исследования CORONA были подтверждены и во втором исследовании по применению статинов у пациентов с ХСН (GISSI-HF) [46], в которое были включены 4574 пациента старше 18 лет (средний возраст 68 лет) с ХСН II—IV ФК, находящихся на оптимальной медикаментозной терапии. В исследование включались пациенты как с систолической, так и с диастолической ХСН, почти у 10% из них имелась ФВ ЛЖ >40%, а средняя ФВ ЛЖ была 33%. В исследованиях по применению ИКД [47—49] было показано, что статины снижают риск достижения «комбинированной точки» (смерть или срабатывание ИКД из-за ЖТ и/или ФЖ). В мета-анализе исследований с участием пациентов с ИКД было показано, что статины снижают риск срабатываний ИКД на 45% (p=0,02) [50]. На основании анализа ряда плацебо-контролируемых проспективных исследований по применению статинов у пациентов с ХСН M.J. Lipinski и соавт. установили, что розувастатин, аторвастатин и симвастатин оказывают разное влияние у пациентов с ХСН. Было показано, что применение аторвастатина и симвастатина приводит к достоверному увеличению ФВ ЛЖ, а применение аторвастатина также уменьшает риск смерти от всех причин (ОР 0,39; p=0,004) и риск госпитализации из-за ХСН (ОР 0,30; p<0,00001), в то время как розувастатин не дает таких эффектов [51]. Правда следует учитывать, что если розувастатин исследовался в крупных РКИ, то аторвастатин и симвастатин только в небольших (до 100 человек) работах.
Второй группой средств для профилактики ВСС являются антиаритмические препараты и ИКД, которые в первую очередь влияют на аритмические причины ВСС. Следует помнить, что часть антиаритмических препаратов (соталол, амиодарон) также могут снижать риск развития повторного ОИМ, а эффекты от ИКД зависят от того, как будет запрограммирован конкретный прибор. За годы использования имплантированных приборов изменился способ имплантации. Для имплантации первых приборов требовались торакотомия и наркоз, а в настоящее время большинство операций проводят под местной анестезией с размещением прибора в подкожно-жировой клетчатке подключичной области. Появилась возможность помимо кардиоверсии проводить сверхчастую программную стимуляцию для купирования ЖТ. В специальных исследованиях было проверены эффекты разных способов программирования на риски срабатывания ИКД и смерти [52], показавшие, что способ программирования влияет как на количество срабатываний ИКД, так и на риск смерти пациента с имплантированным прибором.
После исследования CAST [53], показавшего, что применение антиаритмических препаратов Ic класса увеличивает риск смерти пациентов с недавним ОИМ, исследования с препаратами I класса у пациентов с ХСН не проводились, а препараты этого класса были запрещены к приему у пациентов с ХСН и больных ИБС. В настоящее время у пациентов с ХСН используются препараты дофетилид, амиодарон и соталол, при этом в России зарегистрированы только амиодарон и соталол.
После исследования CASCADE [54], показавшего, что у пациентов, перенесших успешную реанимацию по поводу ФЖ, не связанной с ОКС, эмпирическое применение амиодарона приводит к меньшему риску ВСС и смерти от всех причин по сравнению с подбором антиаритмической терапии другими препаратами под контролем эндокардиального электрофизиологического исследования (ЭФИ) или ХМ ЭКГ, основным препаратом для вторичной профилактики ВСС стал амиодарон.
Применение амиодарона для вторичной профилактики ВСС по сравнению с применением ИКД было проверено в исследованиях AVID, CIDS и CASH. По данным мета-анализа этих исследований [55], ИКД эффективнее амиодарона снижает риск ВСС (ОР 0,50 при 95% ДИ от 0,37 до 0,67; p<0,0001) и общей смертности (ОР 0,72 при 95% ДИ от 0,60 до 0,87; p=0,0006). В рекомендациях Европейского общества кардиологов по лечению желудочковых аритмий от 2006 г. [56] для вторичной профилактики ВСС рекомендована имплантация ИКД, а в случае невозможности применения ИКД показано использование амиодарона, соталола и β-адреноблокаторов (класс IIB, С) (табл. 4). Включение в рекомендации по вторичной профилактике ВСС соталола связано с результатами исследования ESVEM [57], показавшего, что у пациентов с устойчивой ЖТ или успешной реанимацией из-за ВСС применение соталола по сравнению с антиаритмическими препаратами I класса связано с меньшим риском рецидива ЖТ и меньшим риском смерти. Следует учитывать, что в этом исследовании не проводилось прямое сравнение препаратов, а делался подбор антиаритмической терапии у 50% пациентов при помощи ХМ ЭКГ, а у других 50% — при помощи эндокардиального ЭФИ. Основной целью исследования было сравнение двух тактик (ХМ ЭКГ и эндокардиальное ЭФИ) для подбора антиаритмической терапии и сделан основной вывод — две тактики равны между собой [58]. Следует отметить, что у большинства пациентов в анамнезе имелись ИМ (у 80% в группе эндокардиального ЭФИ и у 83% в группе ХМ ЭКГ) и низкая ФВ ЛЖ (33 и 30% соответственно). По современным представлениям, таким пациентам нельзя давать антиаритмические препараты I класса.
Эффективность амиодарона для первичной профилактики ВСС и сердечно-сосудистой смерти проанализирована в мета-анализе, опубликованном в 1997 г. [59]. Мета-анализ показал, что применение амиодарона снижает риск смерти от ССЗ на 29% (p<0,0003), от всех причин — на 13% (p<0,03). Не во всех исследованиях, приведенных в мета-анализе, использовались β-адреноблокаторы. В тех исследованиях, в которых контролем было плацебо, амиодарон оказывал меньший эффект на снижение смертности. В исследовании SCDHF [60] была проверена гипотеза, что амиодарон снижает риск смерти у пациентов с ФВ ЛЖ ≤35%, ХСН II—III ФК, находящихся на оптимальной медикаментозной терапии (ингибитор АПФ или антагонист рецепторов ангиотензина II 97%, β-адреноблокаторы 69%, спиронолактон 20%). В этом исследовании 2521 пациент был рандомизирован в группы ИКД (n=829), амиодарона (n=845) и плацебо (n=847). Длительность наблюдения за пациентами составила 45,5 мес. Сравнение амиодарона и плацебо проводилось по принципу двойного слепого исследования. Исследование SCDHF показало, что амиодарон не влияет на общую и сердечно-сосудистую смертность у пациентов с систолической ХСН (ОР 1,06 при 95% ДИ от 0,86 до 1,30; p=0,53). Подгрупповой анализ показал, что амиодарон увеличивает риск смерти на 44% по сравнению с плацебо у пациентов с III ФК.
До недавнего времени проводились попытки использовать новый препарат дронедарон для лечения пациентов с ХСН. В исследовании ANDROMEDA [61] у пациентов с систолической дисфункцией и III—IV ФК по классификации NYHA применение дронедарона по сравнению с плацебо увеличивало риск смерти пациентов. В исследовании PALAS [62] (3236 пациентов с постоянной формой ФП, из них 680 пациентов с ФВ ЛЖ ≤40% и 265 пациентов с III фк по NYHA) применение дронедарона увеличивало риск достижения «комбинированной точки» (инсульт, ОИМ, системная эмболия или смерть от любых причин) по сравнению с плацебо. После исследований ANDROMEDA и PALAS применение дронедарона было запрещено у больных с ХСН и у пациентов с постоянной формой ФП независимо от наличия ХСН.
Последним препаратом, который стоит отметить, является соталол — препарат III класса с β-блокирующими свойствами. В состав соталола входят два изомера: D-изомер, обусловливающий в основном антиаритмический эффект препарата III класса, и L-изомер, обусловливающий в основном β-блокирующий эффект. Важно не путать соталол с очищенной D-формой соталола, которая в настоящее время не используется, так как, по данным исследования SWORD [63], прием препарата увеличивал риск смерти пациентов после ОИМ по сравнению с плацебо. D-форма соталола в настоящее время не используется, а последующий анализ будет касаться D,L-соталола. В работе D.G. Julian и соавт. [64] у 1456 пациентов после недавнего ОИМ (начало лечения через 5—14 дней после ОИМ) соталол не влиял на риск смерти в течение 12 мес наблюдения. При этом у пациентов на фоне приема соталола на 16% реже возникали повторные ИМ (плацебо 5,9%, соталол 3,5%; p<0,05). Недостатком исследования было то, что не проводилось титрование соталола, а он сразу давался в фиксированной дозе 320 мг. Известно, что проаритмические эффекты соталола возникают в первые дни после назначения, и медленное титрование и подбор индивидуальной дозы с учетом длительности интервалов QT и QTc снижают риск проаритмических эффектов [65]. Субанализ работы D.G. Julian показал, что за вычетом первых 25 дней, в течение которых при приеме соталола риск смерти был таким же, как в группе плацебо, соталол достоверно снижал риск смерти пациентов на 32% (p=0,009). Отсутствие крупных РКИ привело к тому, что соталол не рекомендован к приему у пациентов с ХСН и к эмпирическому приему у пациентов после ОИМ. При этом препарат можно использовать для профилактики ФП у пациентов без ХСН и у пациентов с частыми разрядами ИКД при условии, что у пациента нет выраженного снижения ФВ ЛЖ и выраженных клинических проявлений ХСН. Назначение соталола всегда требует госпитализации и титрования дозы. Эффективность и безопасность соталола по сравнению с метопрололом в профилактике ЖТ и ФЖ у пациентов с ИКД были проверены в небольшом исследовании K. Kettering и соавт. [66]. В исследовании участвовали 100 пациентов, рандомизированных на группы метопролола и соталола. Длительность наблюдения за пациентами составила 728 дней. У 33 пациентов в группе мето-пролола и 30 в группе соталола был хотя бы один эпизод ЖТ/ФЖ, при котором потребовалось срабатывание ИКД (p=0,68). В течение исследования умерли 8 пациентов в группе метопролола и 6 пациентов в группе соталола (p=0,43). Выводом исследования было то, что метопролол так же эффективен, как соталол, в профилактике ЖТ, при которой требуется срабатывание ИКД.
Эффективность амиодарона, соталола и β-адреноблокаторов в профилактике ЖТ у пациентов с ИКД была оценена в более крупном РКИ OPTIC [67] у пациентов с ИКД, поставленными для вторичной и первичной профилактики при условии, что на ЭФИ была индуцирована ЖТ. При наблюдении в течение 12 мес было 38,5% срабатываний ИКД на фоне лечения β-адреноблокаторами, 10,3% — амиодароном и 24,3% — соталолом. При сравнении эффективности сочетания амиодарона и β-адреноблокаторов и изолированного применения β-адреноблокаторов риск срабатываний ИКД был на 73% (ОР 0,27 при 95% ДИ от 0,14 до 0,52; p<0,01) и на 57% ниже, чем на фоне приема соталола (ОР 0,43 при 95% ДИ от 0,22 до 0,85; p=0,02).

После первой имплантации в феврале 1980 г. началось клиническое применение ИКД в профилактике ВСС. Был проведен ряд исследований по оценке эффективности ИКД у пациентов, переживших успешную реанимацию по поводу устойчивой ЖТ или ФЖ. По данным мета-анализа этих исследований, ИКД по сравнению с амиодароном снижает риск ВСС на 50%, а общую смертность — на 28% [55].
Учитывая, что в 1/3 случаев ВСС возникает без свидетелей и что эффект от реанимации по поводу ВСС невысокий, в последние 20 лет стали большое внимание уделять исследованиям по первичной профилактики ВСС. Эффект от применения ИКД у пациентов с ХСН для первичной профилактики ВСС был изучен в 2 крупных исследованиях — MADIT II [68] и SCDHF [60]. В исследовании MADIT II участвовали 1232 пациента с ХСН, ИМ (давностью не менее 1 мес) в анамнезе и ФВ ЛЖ ≤30%. В исследование SCDHF включались пациенты с ИБС и ХСН неишемического генеза, II—III ФК с ФВ ЛЖ ≤35%. В обоих исследованиях 70% пациентов получали β-адреноблокаторы и более 80% — ингибиторы АПФ или антагонисты рецепторов ангиотензина II. По данным исследования MADIT II, ИКД снижает риск смерти на 31% (ОР 0,69 при 95% ДИ от 0,51 до 0,93; p=0,016), а по данным исследования SCDHF — на 23% (ОР 0,77 при 97,5% ДИ от 0,62 до 0,96; p=0,007). Эффективность применения ИКД в первичной профилактике ВСС была подтверждена также в мета-анализе, включившем 10 исследований по применению ИКД для первичной профилактики ВСС [69]. По данным мета-анализа, применение ИКД снижает общую смертность на 25% (p=0,003).
При отборе пациентов по уровню ФВ ЛЖ и наличию ОИМ в анамнезе или по ФВ ЛЖ и наличию ХСН II—III ФК только у 30% пациентов происходит срабатывание ИКД, при этом срабатывания по причине ЖТ/ФЖ возникают у 20% пациентов. Эти данные послужили поводом для поиска дополнительных способов отбора пациентов для имплантации ИКД, но до настоящего времени такие критерии не выявлены.
Следует остановиться на причине того, почему в показаниях к имплантации ИКД у пациентов после ОИМ указано, что надо брать пациентов не ранее чем через 40 дней после события. Подобная рекомендация появилась после исследования DINAMIT [70]. В нем участвовали 674 пациента с ФВ ЛЖ ≤35%, у которых ОИМ произошел в сроки от 6 до 40 дней до включения и наличием одного из двух критериев: высокая ЧСС покоя (≥80 уд/мин) или низкая вариабельность синусового ритма (SDNN ≤70 мс). β-Адреноблокаторы получали 87% пациентов, ингибиторы АПФ — 91%, антиагреганты — 92%, гиполипидемические препараты — 78%. Пациенты были рандомизированы на группы ИКД и медикаментозной терапии, длительность наблюдения составила 30 мес. Не было выявлено разницы в риске смерти пациентов группы ИКД и контроля. В исследовании IRIS [71] участвовали 898 пациентов с ранними сроками после ОИМ (5—31-й день), ФВ ЛЖ ≤40% и ЧСС ≥90 уд/мин или неустойчивой ЖТ с ЧСС ≥150 уд/мин по данным ХМ ЭКГ. Пациенты были рандомизированы на группы ИКД и плацебо, длительность наблюдения составила 37 мес. Результат был таким же, как в исследовании DINAMIT. В группе ИКД и контроля (оптимальная медикаментозная терапия) не было различий по общей смертности. Как в исследовании DINAMIT, так и в IRIS снижался риск ВСС, но при этом в группе ИКД повышался риск невнезапной сердечно-сосудистой смерти. Последнее объяснимо, если вспомнить данные исследования ATLAS, согласно которому, в большом числе случаев при клиническом диагнозе ВСС ее причиной является не ФЖ или ЖТ, не связанная с ССО, а ОИМ или другие ССО (ТЭЛА, острое нарушение мозгового кровообращения). В первый год после ОИМ риск развития повторных ССО максимальный, что, по всей видимости, является причиной отсутствия эффективности ИКД в снижении риска смерти. Возникает вопрос, откуда в рекомендациях цифра 40 дней? Дело в том, что в исследованиях MADIT II и SCDHF участвовали пациенты со сроками ОИМ не менее 40 дней. При этом временной анализ MADIT II показал, что ИКД оказывал эффект только у пациентов со сроками ОИМ не менее 18 мес, а средний период от ОИМ до имплантации ИКД в исследовании был 6,8 года [72].
Важным является также вопрос о показаниях к ИКД в зависимости от функционального класса ХСН. Следует отметить, что у пациентов без показаний к СРТ применение ИКД при наличии IV ФК по классификации NYHA не изучалось. Из этого можно заключить, что пациенты с IV ФК нуждаются в компенсации ХСН перед имплантацией ИКД. Данные исследований по эффективности ИКД у пациентов с I—III ФК не однозначны. В подгрупповом анализе исследования MADIT II было показано, что ИКД оказывает достоверный эффект у пациентов с I ФК и не оказывает достоверного эффекта у пациентов с ≥II ФК. В то же время в исследовании SCDHF ИКД оказывал эффект у пациентов с II ФК и не оказывал у пациентов с III ФК. Сложность состоит в том, что есть определенная условность в определении ФК по классификации NYHA. Так, по данным исследования, проведенного в НИИ кардиологии, было показано, что оценка ФК ХСН тремя независимыми экспертами совпадает лишь в 69% случаев [73].
Следующим вопросом в определении показаний к имплантации ИКД является ФВ ЛЖ. Так, в исследование MADIT II включали пациентов с ОИМ в анамнезе и ФВ ЛЖ ≤30%, а в исследование SCDHF — с ХСН, как ишемической, так и неишемической этиологии с ФВ ЛЖ ≤35%. Вызывает вопросы эффективность ИКД у пациентов с ФВ ЛЖ >35%. По данным мета-анализа [55], у пациентов с ФВ ЛЖ ≥35% эффект от ИКД для вторичной профилактики был равен эффекту амиодарона, в то время как при ФВ ЛЖ ≤35% эффект от ИКД был выше, чем от лечения амиодароном. Последнее может быть связано как с большей эффективностью амиодарона у пациентов с ФВ ЛЖ ≥35%, так и с меньшей эффективностью ИКД у пациентов с ФВ ЛЖ >35%.
У пациентов с ВСС и ФВ ЛЖ >35% эффективность ИКД для первичной профилактики изучалась в исследовании MUSTT [74], на основании которого выработано одно из показаний к ИКД в американских рекомендациях по лечению нарушений ритма сердца [75]. В исследовании MUSTT пациентам с ОИМ в анамнезе и ФВ ЛЖ ≤40% делали эндокардиальное ЭФИ и в случае индукции устойчивой ЖТ подбирали антиаритмическую терапию под контролем ЭФИ. В ходе исследования отдельным пациентам были имплантированы ИКД. При анализе выживаемости было выявлено, что летальность в группе ИКД составила 10%, а в группе медикаментозной терапии – 28%. Ограничением результатов MUSTT было отсутствие рандомизации на группы антиаритмической терапии и ИКД и то, что 20% пациентов получали антиаритмические препараты I класса, применение которых у пациентов с ИБС в настоящее время недопустимо. С учетом того, что критерием включения в исследование была ФВ ЛЖ ≤40% и индукция ЖТ при эндокардиальном ЭФИ, в рекомендациях AHA/ACC указано, что имплантация ИКД показана пациентам после ОИМ с ФВ ЛЖ ≤40%, наличием неустойчивых ЖТ и индукцией устойчивой ЖТ по данным эндокардиального ЭФИ (I, B).
У больных с ХСН с сохраненной функцией ЛЖ (ФВ ЛЖ 45—50%) риск ВСС ниже, чем у больных с ХСН и систолической дисфункцией [76]. Сейчас проводится поиск предикторов ВСС у пациентов с ФВ ЛЖ >35%. Возможно, за счет выявления подобных предикторов удастся выделить среди пациентов с ХСН и сохранной ФВ ЛЖ тех лиц, которые нуждаются в имплантации ИКД с целью первичной профилактики ВСС. В настоящее время имплантация ИКД показана пациентам с ХСН и сохранной ФВ ЛЖ, которые перенесли реанимацию из-за ВСС, или у них регистрировалась устойчивая ЖТ.



