Хроническая сердечная недостаточность (ХСН) — частое, тяжелое, прогностически неблагоприятное следствие сердечно-сосудистых заболеваний [1]. Значение этой проблемы возрастает из-за улучшения качества диагностики, старения населения, увеличения числа пациентов с гипертонической болезнью (ГБ), ишемической болезнью сердца (ИБС), переживших инфаркт миокарда (ИМ). Несмотря на появление новых классов лекарственных средств, достаточно редки сообщения об улучшении прогноза при фармакотерапии ХСН [2].
 Современные методы диагностики позволяют определять нарушения геометрии и функции сердца, выяснять их причины и механизмы развития, оценивать органопротективное влияние проводимой терапии [3]. В повседневной практике недостаточно внимания уделяется функциональному состоянию организма — резерву его регуляторных и адаптивных реакций, направленных на поддержание гомеостаза [4].
Современные методы диагностики позволяют определять нарушения геометрии и функции сердца, выяснять их причины и механизмы развития, оценивать органопротективное влияние проводимой терапии [3]. В повседневной практике недостаточно внимания уделяется функциональному состоянию организма — резерву его регуляторных и адаптивных реакций, направленных на поддержание гомеостаза [4].
Многочисленные исследования отражают достоверную связь между состоянием вегетативной нервной регуляции и смертностью от сердечно-сосудистых причин, в том числе внезапной сердечной смертью (ВСС) у больных с ХСН. Нарастающий симпатико-парасимпатический дисбаланс, выражающийся в снижении парасимпатического и повышении симпатического тонуса, часто провоцирует фатальные желудочковые аритмии [5].
Известные предикторы сердечно-сосудистых осложнений (ССО) — фракция выброса (ФВ) левого желудочка (ЛЖ), конечный диастолический размер (КДР) ЛЖ [6], низкая вариабельность ритма сердца [7], повышенная частота сердечных сокращений (ЧСС) в покое [8], поздние потенциалы желудочков [9], увеличенная дисперсия интервала QT [10], альтернация зубца Т [11] – недостаточно чувствительны и специфичны. Характеризуя отдельные структурные и функциональные показатели системы кровообращения, они не обладают необходимым интегративным потенциалом.
 Выявление наиболее уязвимой категории пациентов с ГБ и ИБС для определения рациональной тактики лечения — важная задача, решение которой может способствовать улучшению прогноза при ХСН. Следовательно, поиск новых информативных диагностических тестов, комплексно и объективно оценивающих функциональное состояние организма, определяющих риск развития ССО, представляется актуальным.
Выявление наиболее уязвимой категории пациентов с ГБ и ИБС для определения рациональной тактики лечения — важная задача, решение которой может способствовать улучшению прогноза при ХСН. Следовательно, поиск новых информативных диагностических тестов, комплексно и объективно оценивающих функциональное состояние организма, определяющих риск развития ССО, представляется актуальным.
Цель исследования — определение значения оценки регуляторно-адаптивного статуса (РАС) в прогнозе ССО при ХСН III функционального класса (ФК).
Материал и методы
В исследовании участвовали 100 больных (50 мужчин и 50 женщин, возраст 57,3±21,7 года), соответствовавших критериям включения. После назначения комплексной терапии квинаприлом (аккупро, «Pfizer», США) в дозе 10 мг/сут, торасемидом (диувер, «Pliva», Хорватия) в дозе 5 мг/сут, спиронолактоном (верошпирон, «Gedeon Richter», Венгрия) в дозе 25 мг/сут систолическое артериальное давление сохранялось на уровне ≥140 мм рт.ст. и/или диастолическое артериальное давление ≥90 мм рт.ст. Больных рандомизировали для лечения метопрололом сукцинатом (беталок ЗОК, «АstraZeneсa», Швеция) или ивабрадином (кораксан, «Servier», Франция). Начальная доза метопролола сукцината составляла 12,5 мг/сут (в один прием), ивабрадина — 10 мг/сут (в 2 приема). Дозы титровали с интервалом 2—4 нед до 75—100 и 15 мг/сут соответственно с учетом индивидуальной субъективной переносимости и показателей гемодинамики (табл. 1).
Критерии включения: ХСН III ФК по классификации Нью-Йоркской ассоциации сердца на основании оценки клинических симптомов и теста с 6-минутной ходьбой — ТШХ (151—300 м) на фоне ГБ III стадии и/или ИБС с нарушенной систолической функцией ЛЖ (ФВ ЛЖ <55%), отсутствие в течение предшествующих 10 дней приема любого из препаратов тестируемых групп, письменное согласие на участие в исследовании.
Критерии исключения: острые церебральные и коронарные осложнения в ближайшие 12 мес, хронические фибрилляция и трепетание предсердий, атриовентрикулярная блокада II—III степени, полная блокада ножек пучка Гиса, манифестирующий синдромом Вольфа—Паркинсона—Уайта, синдром слабости синусного узла, кардио- и нейрохирургические вмешательства в анамнезе, дыхательная, почечная и печеночная недостаточность, злокачественные новообразования, аутоиммунные заболевания в фазе обострения, декомпенсированные эндокринные расстройства, алкогольная и наркотическая зависимость.
 Исследование одобрено локальным Этическим комитетом ГБОУ ВПО «Кубанский государственный медицинский университет» МЗ России.
Исследование одобрено локальным Этическим комитетом ГБОУ ВПО «Кубанский государственный медицинский университет» МЗ России.
Исходно и через 6 мес терапии выполняли следующие исследования:
- проба сердечно-дыхательного синхронизма (СДС) — на аппарате ВНС МИКРО с системой для количественной оценки РАС организма [12] и определения индекса РАС (индекс РАС = диапазон синхронизации/длительность развития СДС на минимальной границе х 100). Индекс РАС: 100 и более — РАС высокий; 99—50 — хороший, 49—25 — удовлетворительный; 24—10 — низкий; 9 и менее — неудовлетворительный [13];
- эхокардиография (ЭхоКГ) на ультразвуковом аппарате ALOKA SSD 5500 (Япония) датчиком 3,25 МГц по стандартной методике для определения структурного и функционального состояния миокарда [14];
- тредмилометрия с оценкой на аппарате SHILLER CARDIOVIT CS 200 по протоколу Bruce, включавшая 4 ступени нагрузок по 3 мин каждая, для оценки толерантности к физической нагрузке (двойное произведение, максимальная нагрузка), максимального потребления кислорода (VO2mах) при нагрузке и выявления скрытой коронарной недостаточности [15];
- ТШХ по стандартному протоколу для оценки ФК ХСН [16].
Статистическую обработку данных исследования проводили с помощью пакета программ Statistica (версия 6.0) с расчетом средней арифметической (М), стандартного отклонения средней арифметической (SD), коэффициента Стьюдента (t), критерия Колмогорова—Смирнова [17]. Анализировали данные больных, полностью выполнивших протокол исследования. Различия считали статистически значимыми при p<0,05.
Результаты
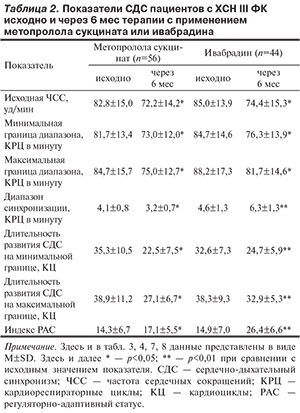
По данным пробы СДС на фоне терапии с применением метопролола сукцината увеличивался индекс РАС (на 19,5%), уменьшались исходная ЧСС (на 12,9%), минимальная (на 10,7%) и максимальная границы диапазона синхронизации (на 11,5%), диапазон синхронизации (на 26,8%), длительность развития СДС на минимальной (на 36,3%) и максимальной (на 30,3%) границах. Наблюдавшиеся изменения отражали умеренную позитивную динамику РАС. В результате терапии с применением ивабрадина увеличивались диапазон синхронизации (на 37%), индекс РАС (на 77,2%), уменьшались исходная ЧСС (на 12,5%), минимальная (на 9,9%) и максимальная границы диапазона синхронизации (на 7,3%), длительность развития СДС на минимальной (на 24,2%) и максимальной (на 14,1%) границах. Такие изменения указывали на значительное повышение РАС (табл. 2).
По данным ЭхоКГ, на фоне терапии с применением метопролола сукцината увеличивались ФВ ЛЖ (на 10,4%), пиковая скорость трансмитрального диастолического потока Е — VЕ (на 8,3%), отношение пиковых скоростей трансмитральных диастолических потоков Е и А — VЕ/VА (на 14,9%), уменьшались КДР ЛЖ (на 6,8%), пиковая скорость трансмитрального диастолического потока А — VА (на 6,8%), время замедления трансмитрального диастолического потока Е — DTЕ (на 12,1%), время изоволюметрического расслабления — IVRT ЛЖ (на 14,3%), не изменялись толщина задней стенки (ЗС) ЛЖ и межжелудочковой перегородки (МЖП), переднезадний размер левого предсердия (ЛП). Указанные сдвиги демонстрировали умеренную положительную динамику структурных и функциональных показателей сердца. В результате терапии с применением ивабрадина увеличивались ФВ ЛЖ (на 14,1%), VЕ (на 6,1%), VЕ/VА (на 15,2%), уменьшались КДР ЛЖ (на 7,6%), переднезадний размер ЛП (на 4,8%), VА (на 6,7%), DTЕ (на 13,6%), IVRT ЛЖ (20,9%), не изменялись толщина ЗС ЛЖ и МЖП. Регистрировавшиеся сдвиги отражали большее по сравнению с метопролола сукцинатом положительное влияние ивабрадина на структуру и функцию сердца (табл. 3).
 На фоне терапии с применением метопролола сукцината увеличивались максимальная нагрузка (на 14,3%), VO2mах при нагрузке (на 18,8%), расстояние, пройденное при ТШХ (на 32,8%), уменьшалось двойное произведение (на 9,2%), у 11 пациентов уменьшался ФК ХСН с III до II. В результате терапии с применением ивабрадина увеличивались максимальная нагрузка (на 15,3%), VO2mах при нагрузке (на 21,9%), расстояние, пройденное при ТШХ (на 56%), уменьшалось двойное произведение (на 11,4%), у 10 обследованных пациентов уменьшался ФК ХСН с III до II. Следовательно, при обоих вариантах терапии отмечалось повышение толерантности к физическим нагрузкам (табл. 4).
На фоне терапии с применением метопролола сукцината увеличивались максимальная нагрузка (на 14,3%), VO2mах при нагрузке (на 18,8%), расстояние, пройденное при ТШХ (на 32,8%), уменьшалось двойное произведение (на 9,2%), у 11 пациентов уменьшался ФК ХСН с III до II. В результате терапии с применением ивабрадина увеличивались максимальная нагрузка (на 15,3%), VO2mах при нагрузке (на 21,9%), расстояние, пройденное при ТШХ (на 56%), уменьшалось двойное произведение (на 11,4%), у 10 обследованных пациентов уменьшался ФК ХСН с III до II. Следовательно, при обоих вариантах терапии отмечалось повышение толерантности к физическим нагрузкам (табл. 4).
Таким образом, комплексная терапия с применением метопролола сукцината при ХСН III ФК улучшала структурные и функциональные параметры ЛЖ. Повышение толерантности к физической нагрузке сочеталось с повышением РАС. Клинические эффекты комплексной терапии с применением ивабрадина при ХСН III ФК оказались сопоставимыми с таковыми при действии метопролола сукцината.
 В процессе терапии с применением метопролола сукцината побочные эффекты возникали в 3,6% случаев (нарушение половой функции у 2 больных), что не приводило к исключению из исследования. При лечении ивабрадином в 2,3% случаев (1 пациент) патологические зрительные феномены (фотопсии) явились причиной отказа от участия в исследовании.
В процессе терапии с применением метопролола сукцината побочные эффекты возникали в 3,6% случаев (нарушение половой функции у 2 больных), что не приводило к исключению из исследования. При лечении ивабрадином в 2,3% случаев (1 пациент) патологические зрительные феномены (фотопсии) явились причиной отказа от участия в исследовании.
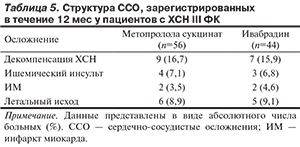
Для оценки прогностического значения РАС анализировали осложнения, возникавшие у обследованных в течение последующих 12 мес контролируемой терапии. Величину основного интегрирующего показателя пробы СДС — индекса РАС сопоставляли с числом госпитализаций из-за декомпенсации ХСН, острых церебральных или коронарных осложнений, летальных исходов вследствие сердечно-сосудистых причин. Не наблюдалось существенных различий по частоте каждого отдельного осложнения в группах метопролола сукцината и ивабрадина (табл. 5), что может быть связано с малым числом наблюдений.
По мере уменьшения индекса РАС у больных с ХСН отмечалось увеличение частоты развития осложнений: наибольшее число ишемических инсультов, ИМ и летальных исходов развивалось у пациентов с низкими (24—10) и неудовлетворительными (9 и менее) исходными значениями показателя (табл. 6).
Таким образом, у больных с систолической ХСН на фоне терапии с применением β-адреноблокатора или ингибитора If-каналов, оказывавших сопоставимое позитивное влияние на РАС, частота развития ССО в группах сравнения не различалась. Полученные данные свидетельствуют в пользу одинакового влияния двух применявшихся схем медикаментозной терапии на прогноз ХСН при ГБ и/или ИБС.
При анализе основных исходных показателей пациентов с ССО оказались меньше индекс РАС (на 42,5%), ФВ ЛЖ (на 13,6%), максимальная нагрузка (на 33,3%), VO2max при нагрузке (на 26%); больше КДР (на 6,2%) в отсутствие различий по VЕ/VА. Полученные данные отражают исходно худшее структурно-функциональное состояние сердца, более низкие РАС и толерантность к нагрузке пациентов с осложнениями (табл. 7).
 Из 11 умерших пациентов с ХСН III ФК ВСС регистрировалась в 9 случаях (81,8%). Необходимо отметить, что у внезапно умерших больных наблюдалось достоверное отличие лишь одного показателя — у них оказался ниже индекс РАС (на 28,7%). Существенно не различались КДР, ФВ ЛЖ, VЕ/VА, максимальная нагрузка, VO2max при нагрузке (табл. 8).
Из 11 умерших пациентов с ХСН III ФК ВСС регистрировалась в 9 случаях (81,8%). Необходимо отметить, что у внезапно умерших больных наблюдалось достоверное отличие лишь одного показателя — у них оказался ниже индекс РАС (на 28,7%). Существенно не различались КДР, ФВ ЛЖ, VЕ/VА, максимальная нагрузка, VO2max при нагрузке (табл. 8).
Полученные данные согласуются с результатами традиционных диагностических тестов, отражают независимое значение оценки РАС в прогнозе ССО при ХСН III ФК со сниженной систолической функцией ЛЖ. Исходно неудовлетворительный РАС, как следствие резко выраженного симпатико-парасимпатического дисбаланса, ассоциировался с повышенным риском ВСС.
Обсуждение
В связи с постарением населения промышленно развитых стран ХСН становится одной из основных составляющих заболеваемости и смертности от патологии сердечно-сосудистой системы [18]. ХСН, возникшая вследствие различных причин, диагностируется не менее чем у 6,5 млн человек в Европе [19]. На 75% выросла доля больных, у которых ХСН является следствием ГБ и ИБС [20]. Смертность при ХСН сравнима со смертностью от злокачественных новообразований — примерно 60% больных умирают в течение первых 5 лет после верификации диагноза [21]. По данным Фрамингемского исследования, в течение 5 лет умирают 75% мужчин и 62% женщин с ХСН. У 50% таких больных регистрируется рефрактерность к проводимой терапии. Другие 50% умирают внезапно, в результате злокачественных желудочковых тахиаритмий. ВСС чаще встречается при ХСН II—III ФК, когда ее доля составляет 30—80%, и существенно реже встречается у больных с ХСН IV ФК (5—30%) [22].
ХСН служит одной из наиболее частых причин госпитализации. В США от 5 до 10% всех госпитализаций связано именно с ХСН [23]. Среди пожилых пациентов ХСН — самая частая причина госпитализации. В Европе ХСН является прямой или косвенной причиной до 70% всех госпитализаций больных старше 70 лет. Ежегодно госпитализируется 20—30% больных с ХСН, причем около 33% из них повторно поступают в стационар в течение 6—12 мес [24].
 Данные, полученные у больных с нелеченной тяжелой дисфункцией ЛЖ, позволили по-новому взглянуть на патофизиологию прогрессирования ХСН и развитие ССО. В появлении и усугублении симптомов ХСН основное значение имеет гиперактивация симпатической части вегетативной нервной системы, которая наряду с повышением активности ренин-ангиотензин-альдостероновой системы приводит к задержке ионов натрия и воды, вазоконстрикции и систолической дисфункции ЛЖ [25].
Данные, полученные у больных с нелеченной тяжелой дисфункцией ЛЖ, позволили по-новому взглянуть на патофизиологию прогрессирования ХСН и развитие ССО. В появлении и усугублении симптомов ХСН основное значение имеет гиперактивация симпатической части вегетативной нервной системы, которая наряду с повышением активности ренин-ангиотензин-альдостероновой системы приводит к задержке ионов натрия и воды, вазоконстрикции и систолической дисфункции ЛЖ [25].
Несмотря на снижение ФВ ЛЖ, гиперактивация симпатической и ренин-ангиотензин-альдостероновой системы не только поддерживает артериальное давление в пределах нормы, но и способствует его росту вследствие повышения периферического сосудистого сопротивления. Общий объем жидкости в организме повышается вследствие ее скопления в межклеточном пространстве. Эффективный почечный кровоток значительно снижается из-за выраженного спазма почечных артерий. В результате еще больше увеличиваются концентрация в плазме норадреналина, активность ренина, альдостерона, предсердного натрийуретического пептида. Нарастающий симпатико-парасимпатический дисбаланс повышает риск развития злокачественных желудочковых аритмий и, как следствие, ВСС [26].
Очевидно, что современные лабораторные и инструментальные диагностические тесты для достаточной чувствительности и специфичности должны учитывать не только динамику органных поражений, но и способность организма к регуляции и адаптации. Так как любой регуляторно-адаптивный сдвиг — это, в первую очередь, многоуровневая реакция вегетативной нервной системы, при оценке функционального состояния организма необходимо исходить из представлений о комплексном взаимодействии вегетативных функций, их взаимосвязи с окружающей средой.
Для объективной количественной оценки РАС применялась проба СДС, учитывающая взаимодействие двух важнейших функций вегетативного обеспечения — сердечной и дыхательной. Проба основана на тесной функциональной связи центральных механизмов ритмогенеза сердца и дыхания, возможности произвольного управления ритмом дыхания, участии многоуровневых афферентных и эфферентных структур центральной нервной системы [27].
О повышении РАС человека свидетельствуют расширение диапазона синхронизации, уменьшение времени его развития на минимальной и максимальной границах, увеличение индекса РАС. Так как регуляторно-адаптивные возможности опосредуются взаимодействием двух отделов вегетативной нервной системы — симпатического и парасимпатического, РАС при ХСН объективно и количественно отражает выраженность вегетативной дисфункции и органных нарушений [28].
В соответствии с полученными данными обе схемы комплексной терапии с применением метопролола сукцината или ивабрадина в равной степени улучшали структурное и функциональное состояние миокарда, повышали толерантность к физической нагрузке, снижали нейрогуморальную гиперактивацию. При этом схема, включавшая ивабрадин, в большей степени положительно влияла на РАС. На фоне сопоставимых клинических эффектов в двух группах пациентов регистрировалось одинаковое количество осложнений. Частота госпитализации в связи с декомпенсацией ХСН, ишемического инсульта, ИМ, летального исхода повышалась при низком и неудовлетворительном исходном РАС. Исходно неудовлетворительный РАС ассоциировался с повышенным риском ВСС.
Результаты исследования согласуются с новыми положениями Европейских рекомендаций по диагностике и лечению острой и ХСН (версия 2012 г.) [29] и Национальных рекомендаций по диагностике и лечению ХСН (версия 2013 г.) [30], в которых ивабрадин рассматривается в качестве альтернативы β-адреноблокаторам.
Выводы
- Регуляторно-адаптивный статус как объективный количественный показатель тяжести органных нарушений может применяться в оценке эффективности фармакотерапии и прогноза сердечно-сосудистых осложнений при хронической сердечной недостаточности III функционального класса.
- Исходно неудовлетворительный регуляторно-адаптивный статус как следствие выраженной вегетативной дисфункции при хронической сердечной недостаточности III функционального класса ассоциируется с внезапной сердечной смертью.



