Инсульт вследствие высокой распространенности и тяжелых последствий представляет важнейшую медико-социальную проблему. Продолжительность жизни пациента, перенесшего первый инсульт, составляет в среднем 8,8 года, а в случае развития повторного инсульта или инфаркта миокарда (ИМ) этот показатель может уменьшаться до 3,9 года. При этом у пациентов после впервые возникшего инсульта риск повторных острых нарушений мозгового кровообращения повышен в 9 раз, а риск развития ИМ, включая внезапную сердечную смерть (ВСС), — в 2—3 раза [1, 2].
Известен ряд предикторов сердечно-сосудистых осложнений (ССО) в отдаленные сроки после инсульта, таких как пожилой возраст, мужской пол, курение, артериальная гипертензия (АГ), мультифокальный атеросклероз, фибрилляция предсердий (ФП), сахарный диабет, выраженность неврологических расстройств и т.д. [3]. Активно изучается состояние вариабельности ритма сердца (ВРС) как фактора риска ВСС и коронарных осложнений у пациентов с ишемическим инсультом (ИИ) [4, 5]. Кроме того, для прогнозирования ССО после ИИ применялся ряд стандартных моделей [6]. Однако Фрамингемская шкала, с успехом используемая в кардиологической практике, не позволила обнаружить ассоциации между расчетным риском и частотой развития повторного инсульта, так как не учитывает специфические факторы риска развития ИИ — ФП, каротидный атеросклероз [7]. Другие шкалы основывались на изучении ограниченного контингента пациентов (не включались больные с кардиоэмболическим или повторным инсультом) и небольшой длительности наблюдения (1—2 года) [6, 8], тогда как риск развития повторных инсультов и всех ССО сохраняется повышенным на протяжении 10 лет и более после ИИ [9].
В настоящее время, несмотря на достижения превентивной медицины и разработку единой стратегии вторичной профилактики после ИИ, прогноз у больного остается хуже ожидаемого [4, 10]. Для более результативного планирования мероприятий по профилактике ССО необходим интегративный поиск предикторов высокого риска развития ССО в отдаленном постинсультном периоде.
 Цель данного исследования заключалась в установлении прогностических факторов ССО после ИИ.
Цель данного исследования заключалась в установлении прогностических факторов ССО после ИИ.
Материал и методы
В проспективное когортное наблюдательное исследование включали пациентов, последовательно поступивших во 2-е неврологическое отделение ФГБНУ НЦН. Критерии включения: мужчины и женщины в возрасте 20—85 лет; ИИ в первые 20 сут заболевания; синусовый ритм сердца; подписанное информированное согласие. Критерии отказа от включения: постоянная форма ФП, искусственный водитель ритма, деменция, онкологические заболевания, тяжелая соматическая патология, отсутствие возможности связи для поддержания контакта с пациентом или его родственниками.
Протокол исследования одобрен локальным Этическим комитетом ФГБНУ НЦН.
Всего в наблюдение были включены 148 человек, из них 94 (64%) мужчины и 54 (36%) женщины, возраст пациентов на момент включения в исследование варьировал от 22 до 83 лет, медиана — 60 (52; 68) лет.
На стационарном этапе было проведено детальное обследование. Клинический диагноз, включая определение патогенетического подтипа инсульта, базировался на данных анамнеза, результатах клинико-инструментального исследования с оценкой неврологического, кардиологического и соматического статуса, лабораторных тестов.
Всем больным выполнена магнитно-резонансная либо компьютерная томография головы, с напряженностью магнитного поля 1,5 Т. Оценивали величину и локализацию ишемического очага. При наличии 3 церебральных ишемических очагов и более поражение мозга считали множественным.
Состояние брахиоцефальных артерий (БЦА) исследовали методом дуплексного сканирования. Оценивали наличие, характер и степень выраженности структурных изменений артерий (увеличение толщины интимы—медии, атеросклеротическое поражение, деформации, патологическая извитость). Гемодинамически значимыми считали стенозы, превышающие 70% диаметра просвета артерии.
Степень выраженности неврологического дефицита определяли с помощью Скандинавской шкалы, на которой 0 соответствует максимально выраженным расстройствам, а 60 баллов — отсутствию неврологического дефицита. Степень функциональной состоятельности и выраженности нарушений жизнедеятельности по окончании острого периода инсульта оценивали с помощью модифицированной шкалы Рэнкин, в которой оценка варьирует от 0 (отсутствие неврологической симптоматики) до 5 баллов (прикованные к постели пациенты, нуждающиеся в постоянной заботе и внимании).
Всем больным выполнена трансторакальная эхокардиография с оценкой состояния камер и клапанов сердца, систолической и диастолической функции левого желудочка (ЛЖ).
Холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ) осуществляли с использованием портативного регистратора с непрерывной трехканальной записью ЭКГ в течение 24 ч. С помощью ХМ выявляли нарушения, сопряженные с повышенным риском развития ССО: пароксизмальную форму ФП, желудочковую экстрасистолию (ЖЭ), пароксизмальную желудочковую тахикардию (ЖТ), брадиаритмии (синоатриальная блокада II степени, атриовентрикулярная блокада II степени, синусовые паузы более 3 с), эпизоды безболевой ишемии миокарда. Частые одиночные, парные, групповые ЖЭ, пароксизмы ЖТ относили к категории желудочковых аритмий (ЖА) высоких градаций. Выполняли также временной и спектральный анализ ВРС. Изучали SDNN — стандартное отклонение кардиоинтервалов (мс); SDNNi — среднее 5-минутных стандартных отклонений кардиоинтервалов, вычисленных за 24 ч (мс); pNN50 — число пар кардиоинтервалов с разностью более 50 мс, выраженное в процентах от общего числа кардиоинтервалов в массиве. Проводили анализ спектральных характеристик ВРС, таких как мощность (мс2) в диапазоне высокочастотных колебаний (ВЧ, 0,15—0,4 Гц), низкочастотных колебаний (НЧ, 0,04—0,15 Гц) и очень низкочастотных колебаний (0,003—0,04 Гц).
 В период стационарного лечения осуществляли подбор базисной медикаментозной терапии, включающей анти-тромботические, антигипертензивные, гиполипидемические и антиаритмические средства, рекомендованные для последующего длительного приема.
В период стационарного лечения осуществляли подбор базисной медикаментозной терапии, включающей анти-тромботические, антигипертензивные, гиполипидемические и антиаритмические средства, рекомендованные для последующего длительного приема.
Для сопоставимости полученных результатов в качестве нулевой временно'й точки проспективного наблюдения принято окончание острого периода ИИ — 21—22-е сутки. В эти сроки оценивали неврологические расстройства, функциональный статус и проводили ХМ ЭКГ с оценкой ВРС.
На амбулаторном этапе исследования каждые 3 мес, используя опросник для телефонного интервью, осуществляли унифицированный опрос пациентов или их родственников, при этом получали информацию о состоянии больного, степени социальной и профессиональной адаптации, наличии ССО, проводимой медикаментозной терапии. При необходимости осуществлялись очные амбулаторные консультации, коррекция терапии. Длительность проспективного наблюдения составила 35 (28; 40) мес.
В качестве суммарной конечной точки (СКТ) регистрировали повторный инсульт, транзиторные ишемические атаки, ИМ, нестабильную стенокардию, острую сердечную недостаточность, острую декомпенсацию хронической сердечной недостаточности (ХСН), при которой потребовалась госпитализация, все случаи сердечно-сосудистой смерти.
Статистическую обработку полученных данных проводили с помощью пакета программ Statistica 7.0. Данные представлены в виде медианы с указанием 25-го и 75-го процентилей их распределения — Ме (25-й процентиль;75-й процентиль). В зависимости от наличия или отсутствия конкретного анализируемого фактора были рассчитаны относительный риск (ОР) достижения СКТ на основании сравнения частот бинарного признака в двух несвязанных группах, а также 95% доверительный интервал (ДИ) ОР по методу Katz (однофакторный анализ). Выделенные прогностически неблагоприятные значения переменных, для которых значения критерия статистической значимости при однофакторном анализе составили <0,05, включали в многофакторный регрессионный анализ, выполняемый пошаговым методом. Затем были построены кривые времени наступления неблагоприятного исхода (по методу Каплана—Мейера). Для определения независимых предикторов неблагоприятного исхода заболевания также использовали регрессионный анализ в моделях пропорционального риска Кокса. Статистически значимыми считали различия при p<0,05.
Результаты
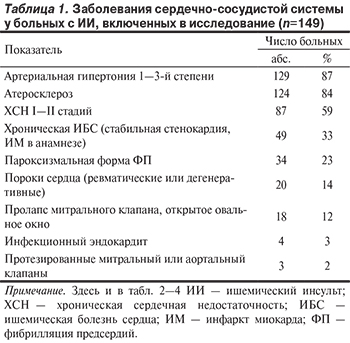
На основании данных анамнеза, соматического и кардиологического обследования были установлены основные нозологические формы сердечно-сосудистых заболеваний у обследованных пациентов (табл. 1). Атеросклероз диагностировали на основании результатов визуализации аорты и ее ветвей, периферических артерий. ХСН была преимущественно диастолической и соответствовала критериям I и II стадий. Ишемическая болезнь сердца (ИБС) представлена стабильной формой стенокардии II—III функционального класса и постинфарктным кардиосклерозом.
По данным нейровизуализации, у 109 (74%) больных инфаркт мозга локализовался в каротидной системе, у 39 (26%) — в вертебрально-базилярной системе. В большинстве наблюдений ишемический очаг был средней или малой величины: 65 (44%) и 74 (50%) больных соответственно. У 8 (5%) пациентов величина инфаркта мозга была большой, у 1 больного имелось обширное поражение мозга. Множественные инфаркты головного мозга визуализированы у 65 (44%) пациентов. Для 26 (18%) пациентов перенесенный инсульт явился повторным. Атеросклеротические стенозы БЦА более 70% диагностированы у 35 (23%) пациентов. Атеротромботический инсульт верифицирован у 56 (38%) пациентов, лакунарный — у 42 (28%), кардиоэмболический — у 38 (26%). У 12 (8%) больных инсульт развился вследствие других уточненных либо неуточненных причин.
К концу острого периода инсульта (21-е сутки) 89% больных были функционально независимы либо имели небольшое снижение активности, но сохраняли способность обслуживать себя без посторонней помощи. В среднем по группе оценка по Скандинавской шкале составила 57 (53; 60) баллов, по модифицированной шкале Рэнкин — 1 (1; 2) балл.
Длительность проспективного наблюдения варьировала от 9 мес (зафиксирована сердечно-сосудистая смерть у 1 больного) до 10 лет и в среднем составила 35 (28; 40) мес. К прежней работе или к нормальной бытовой и социальной активности вернулись 55 (37%) человек. Остальные пациенты в основном были независимы в бытовом отношении. Продолжали курение 44 (30%) больных.
На протяжении всего периода наблюдения проводился мониторинг базисной медикаментозной терапии. В целом пациенты характеризовались удовлетворительной приверженностью к лечению. Антитромботические препараты постоянно принимали 129 (87%) пациентов, из них тромбоцитарные антиагреганты (ацетилсалициловая кислота, клопидогрел) — 99 (67%) и пероральные антикоагулянты (варфарин, дабигатран) — 30 (20%). Базисную антигипертензивную терапию регулярно получали 119 (80%) больных, при этом на монотерапии находились 33 (22%) больных, остальные пациенты получали комбинированное лечение. Ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов к ангиотензину II (БРА) принимали 110 (74%) больных, тиазидные или тиазидоподобные диуретики — 66 (45%), β-адреноблокаторы — 46 (31%), блокаторы кальциевых каналов дигидропиридинового ряда — 35 (24%). У 70% больных были достигнуты и стабильно удерживались целевые уровни артериального давления. Статины постоянно получали 72 (49%) пациента.
В плановом порядке у 9 (6%) пациентов осуществлено хирургическое сосудистое вмешательство: у 4 больных — каротидная эндартерэктомия, у 4 — каротидная баллонная ангиопластика со стентированием, у 1 — экстраинтракраниальный микроанастомоз.
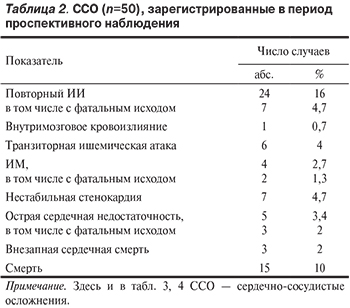
За время наблюдения у 37 (25%) пациентов зарегистрировано 50 ССО, учитываемых в рамках СКТ, при этом у 6 (16%) из 37 пациентов последовательно развивались церебральные и кардиальные нарушения (табл. 2). У 15 (10%) больных вследствие сердечно-сосудистых причин наступила смерть. По экстренным показаниям у 2 больных была выполнена коронарная ангиопластика со стентированием, у 1 — каротидная эндартерэктомия. В среднем по группе первое церебральное осложнение развилось через 20 (9; 33) мес, первое кардиальное — через 21 (15; 44) мес. Значительного различия во времени наступления первого церебрального или кардиального осложнения не было. Кумулятивный риск развития ССО в среднем через 3 года (35,6 мес) составил 19,3%, а кумулятивная доля больных с летальным исходом — 9%.
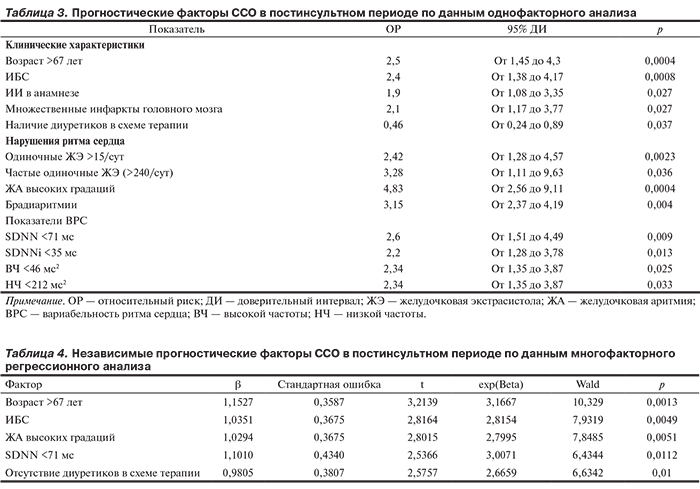
Для определения прогностических факторов ССО был выполнен сопоставительный анализ характеристик групп больных, достигших СКТ, и остальных пациентов, в результате которого выявлена сопряженность развития ССО с рядом клинических факторов, аритмий и показателей ВРС (табл. 3). Напротив, наличие в составе базисной медикаментозной терапии тиазидных или тиазидоподобных диуретиков ассоциировалось с уменьшением риска развития ССО. Необходимо отметить, что взаимосвязи величины и локализации ишемического очага, подтипа инсульта и выраженности неврологических расстройств с риском развития ССО в нашем исследовании не выявлено.
Очевидно, что у больного нередко одновременно существует несколько прогностически значимых факторов, действие которых может вариативно сочетаться и перекрываться. Поэтому для определения независимых предикторов ССО после ИИ был выполнен многофакторный анализ. Среди клинических и нейровизуализационных характеристик независимый эффект оказывали наличие хронических форм ИБС (p=0,0042) и возраст старше 67 лет (p=0,005), отсутствие в схеме лечения тиазидных/тиазидоподобных диуретиков (p=0,007). Среди аритмий независимое влияние на развитие ССО оказывали частая одиночная ЖЭ (p=0,036), ЖА высоких градаций (p=0,0007) и брадиаритмии (p=0,002). При оценке влияния ВРС на постинсультный прогноз в многофакторной модели (SDNN <71 мс, SDNNi <34 мс, ВЧ <46 мс2, НЧ <212 мс2) выявлен суммарный достаточно значимый эффект (критерий χ2 9,358766; df=4; p=0,05275), при этом наиболее существенным было воздействие показателя, характеризующего совокупную вегетативную активность (SDNN).
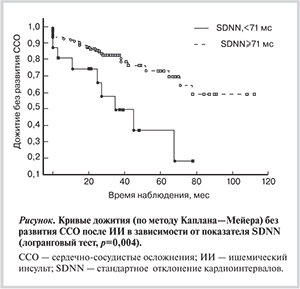
Следующим шагом обработки полученных результатов стал многофакторный регрессионный анализ в модели пропорциональных рисков Кокса, по данным которого (табл. 4) статистически значимыми независимыми предикторами ССО после ИИ явились возраст >67 лет, наличие хронической ИБС, ЖА высоких градаций, показатель SDNN <71 мс (см. рисунок), отсутствие тиазидных или тиазидоподобных диуретиков в схеме базисной антигипертензивной терапии.
Обсуждение
В настоящее время разработана единая стратегия вторичной профилактики ССО после инсульта, основанная на принципах доказательной медицины и активно внедряемая в практическое здравоохранение. Строгое соблюдение пациентами рекомендаций позволяет существенно уменьшить риск развития ССО в постинсультном периоде, улучшить прогноз, увеличить продолжительность жизни. Несмотря на это, по данным ряда исследований, приверженность пациентов к лечению на протяжении длительного постинсультного периода неуклонно снижается, особенно у пожилых пациентов с множественными факторами риска [10—12].
 В нашем исследовании пациенты в целом характеризовались хорошей приверженностью к рекомендациям в рамках вторичной профилактики ССО. Так, большинство пациентов постоянно на протяжении всего периода наблюдения получали базисную медикаментозную терапию, включая антитромботические, антигипертензивные и гиполипидемические (статины) препараты.
В нашем исследовании пациенты в целом характеризовались хорошей приверженностью к рекомендациям в рамках вторичной профилактики ССО. Так, большинство пациентов постоянно на протяжении всего периода наблюдения получали базисную медикаментозную терапию, включая антитромботические, антигипертензивные и гиполипидемические (статины) препараты.
За время собственного проспективного наблюдения за когортой пациентов, перенесших ИИ, частота развития ССО была существенно ниже, чем в других исследованиях [13—16]. Достигнутые результаты могут быть объяснены активным динамическим врачебным контролем, благодаря чему достигалась высокая приверженность к получаемой терапии. Кроме того, исходно в исследование не включались пациенты с тяжелой декомпенсированной соматической патологией и с выраженной неврологической симптоматикой, заведомо имевшие высокий риск развития осложнений, связанных с обездвиженностью. В исследовании не участвовали также пациенты с постоянной формой ФП, которая способна дополнительно ухудшить прогноз.
В результате комплексной оценки вклада каждого прогностического фактора в развитие ССО у больных, перенесших ИИ, был выявлен ряд независимых предикторов: возраст старше 67 лет, наличие хронических форм ИБС, наличие ЖА высоких градаций, снижение показателя SDNN 70 мс и ниже. Кроме того, было установлено, что включение в базисную медикаментозную терапию пациентов, перенесших ИИ, тиазидных или тиазидоподобных диуретиков независимо ассоциируется с достоверным улучшением долгосрочного прогноза.
Пожилой возраст как фактор неблагоприятного прогноза ССО отмечался и ранее [2, 17]. Прогностический потенциал этого признака следует рассматривать, прежде всего, с позиций накопления зависящих от возраста заболеваний, которые могут самостоятельно негативно влиять на выживаемость. Неизбежно, даже в случае высокой приверженности к медикаментозной терапии, по мере старения пациента происходит прогрессирование атеросклероза, патологии сердца и гипертонического ремоделирования сердечно-сосудистой системы. Кроме того, с увеличением возраста повышается вероятность развития деменции, что само ассоциируется с увеличением риска развития ССО. В нашем исследовании более неблагоприятный прогноз отмечен у больных старше 67 лет, т.е. относительно нестарых. Вероятно, это связано с имевшимися сопутствующими заболеваниями пациентов, включенных в исследование.
Определение хронических форм ИБС как независимого предиктора развития ССО вполне закономерно. Ранее ИБС в качестве предиктора ИМ и ВСС в отдаленном постинсультном периоде рассматривалась в работе M.S. Dhamoon и соавт. [3].При этом необходимо учитывать, что клинические проявления ИБС свидетельствуют не только о наличии коронарного атеро-склероза, но и о мультифокальном атеросклеротическом поражении, включая БЦА [18]. Следует специально подчеркнуть, что пациенты со стабильными проявлениями ИБС при кажущемся клиническом благополучии представляют собой группу высокого риска обострений атеротромбоза в коронарном, церебральном и периферическом сосудистом бассейне [19].
Среди других кардиальных нарушений у больных с базовым синусовым ритмом статистически значимо ассоциировалось с повышением риска развития ССО в отдаленном постинсультном периоде наличие ЖА высоких градаций (частые одиночные, парные ЖЭ, пароксизмы ЖТ). ЖА высоких градаций традиционно рассматриваются в качестве основных маркеров ВСС, риск которой возрастает при наличии у пациентов таких форм патологии сердца, как острый ИМ, постинфарктный кардиосклероз, стенокардия напряжения, гипертрофия ЛЖ [20—23]. Полагают также, что ЖЭ являются причиной атриовентрикулярного ремоделирования сердца, увеличения числа новых случаев пароксизмальной ФП и гемодинамических расстройств, что в свою очередь сопряжено с риском развития церебральных осложнений [24].
Вопросы состояния вегетативного гомеостаза у больных с ИИ находятся в фокусе внимания исследователей [25, 26]. Научная гипотеза состоит в том, что вегетативный дисбаланс вызывает дизрегуляцию гомеостаза и может задолго предшествовать клинически значимым осложнениям [27, 28]. Соответственно оценка состояния вегетативной регуляции может предоставить возможность прогнозирования ССО и в дальнейшем путем оптимизации превентивных мероприятий повысить эффективность их профилактики. SDNN — показатель, характеризующий суммарную вегетативную активность и косвенно отражающий возможности адаптации в изменяющихся условиях внешней и внутренней среды организма [6]. Уменьшение этого показателя соответствует снижению резерва адаптации, причем это касается всех составляющих — как симпатического (НЧ), так и парасимпатического (ВЧ, SDNNi) звена регуляции, а также вагосимпатического баланса [28]. В нашем исследовании установлено самостоятельное значение ВРС как прогностического фактора ССО после ИИ, сохраняющееся после введения поправки на возраст больных и не зависящее от наличия аритмий. Ранее в кардиологической клинике было установлено, что изменение ВРС, а именно снижение показателя SDNN менее 70 мс, ассоциируется с ухудшением прогноза у больных после ИМ с фракцией выброса ЛЖ менее 35% [29—31]. Вероятно, снижение ВРС является следствием совокупных изменений не только сердца, но и головного мозга, что согласуется с данными литературы [32]. По всей видимости, пороговая величина SDNN, равная 70 мс, имеет универсальное значение для прогнозирования ССО после перенесенного ИМ и ИИ.
В ряде работ указывалось на неблагоприятное прогностическое значение для развития ССО ранее перенесенного ИИ [14, 15, 33]. В нашем исследовании при однофакторном анализе установлено, что выживаемость без ССО в отдаленном постинсультном периоде ниже у пациентов, ранее перенесших инсульт и имеющих множественные инфаркты головного мозга (см. табл. 3). Однако в ходе множественного регрессионного анализа (в том числе в модели Кокса) наличие еще одного инсульта в анамнезе, как и множественных инфарктов головного мозга (по данным нейровизуализации), не подтвердили своего значения в качестве независимого прогностического фактора развития ССО. Несомненно, что повторные нарушения мозгового кровообращения в анамнезе — свидетельство наличия факторов очень высокого риска развития ССО. В то же время отсутствие конечного этапа континуума (достижение СКТ) доказывает достаточно высокую эффективность превентивных мероприятий в предупреждении ССО у наблюдаемых больных, что выражается в снижении потенциала реализации их неблагоприятного влияния на прогноз.
Среди поведенческих факторов риска развития ССО (курение, соблюдение рекомендаций по медикаментозной терапии) мы не выявили клинически значимых предикторов ССО. Возможно, одним из объяснений служит довольно высокая приверженность к лечению в нашем исследовании. Однако включение тиазидных или тиазидоподобных диуретиков в состав базисной терапии было сопряжено с улучшением отдаленного прогноза. Это согласуется с данными проспективных плацебо-контролируемых исследований, продемонстрировавших, что назначение препаратов данных классов дополнительно снижало частоту развития повторного инсульта [34—36]. Для объяснения данного факта выдвинута гипотеза, согласно которой тиазидные/тиазидоподобные диуретики наряду с антагонистами кальциевых каналов дигидропиридинового ряда и БРА приводят к повышению концентрации ангиотензина II в крови. Это способствует усилению эффектов, опосредуемых рецепторами ангиотензина II 2-го типа, что сопровождается активизацией коллатерального церебрального кровообращения и повышением устойчивости к гипоксии за счет инактивации перекисных радикалов в артериальной стенке [37]. В нашем исследовании благоприятное действие постоянного приема антагонистов кальциевых каналов и БРА не было продемонстрировано, что, вероятно, связано с небольшим числом пациентов, принимавших данные препараты.
Мы не выявили ассоциации ССО с наличием и выраженностью АГ, атеросклероза сосудов головы и ФП. По нашему мнению, это объясняется широкой распространенностью АГ в изучаемой когорте пациентов, приверженностью больных к базисной медикаментозной терапии, а также регистрацией в рамках СКТ кардиальных осложнений, для которых предопределяющими факторами помимо АГ являются выраженность коронарного атеросклероза, систолическая дисфункция ЛЖ, но не атеросклероз артерий мозга [38, 39].
Заключение
Стало очевидным, что многие факторы риска развития сердечно-сосудистых осложнений остаются нераспознанными, о некоторых факторах (возможно, имеющих наибольшее значение) мы еще не знаем, соответственно точно оценить индивидуальный риск развития сердечно-сосудистых осложнений у больного, в том числе перенесшего инсульт, не всегда представляется возможным. Прогностические факторы для церебральных и кардиальных осложнений могут быть различными. Имеющиеся стандартные шкалы не могут объективно отразить суммарный риск развития всех сердечно-сосудистых осложнений в течение длительного времени после ишемического инсульта. В результате комплексной оценки значимости разнообразных факторов риска нами было выявлено, что наиболее весомый вклад в развитие сердечно-сосудистых осложнений после ишемического инсульта вносят возраст >67 лет, наличие хронической формы ишемической болезни сердца, желудочковых аритмий высоких градаций, показатель SDNN <71 мс. Напротив, включение тиазидных или тиазидоподобных диуретиков в схему базисной антигипертензивной терапии ассоциируется с улучшением прогноза. Необходимо подчеркнуть важность многопрофильной оценки больного, перенесшего ишемический инсульт, с детальным анализом кардиального статуса и состояния вариабельности ритма сердца. Подобный подход позволит проводить индивидуальную оценку риска развития сердечно-сосудистых осложнений в отдаленные сроки после инсульта для более эффективного планирования мероприятий по вторичной профилактике, повышения приверженности больных к лечению и улучшения их отдаленного прогноза.



