Сердечно-сосудистые заболевания (ССЗ) служат ведущей причиной смертности населения во всем мире. По данным Всемирной организации здравоохранения, ежегодно в мире от ССЗ умирают 17,5 млн человек, что составляет около 30% в структуре всех причин смертности [1]. Основными ССЗ, определяющими смертность населения, являются коронарная болезнь сердца (КБС) и мозговой инсульт (МИ).
Следует отметить, что во многих азиатских странах (в первую очередь Китай и Япония) на рубеже веков складывается ситуация, получившая название «инсультный парадокс». Суть ее заключается в том, что данные проспективных исследований, опубликованных после 90-х годов прошлого века, свидетельствуют о существенном преобладании частоты развития инсульта над частотой развития инфаркта миокарда (ИМ). Так, соотношение частоты развития инсульта и частоты развития ИМ, по данным Оxford vascular study [2], составляет 1,38, а по суммарным данным 7 так называемых восточных исследований, достигает 7,3 [3—6]. При этом в ближайшие десятилетия ожидается увеличение числа больных, умирающих от острой церебральной патологии.
Хотя традиционные факторы риска (ФР) развития КБС и МИ хорошо известны, они позволяют прогнозировать течение заболевания не у всех больных. У 10—20% больных с КБС ФР отсутствуют, в 35% случаев у умерших больных с КБС уровень холестерина (ХС) липопротеидов низкой плотности (ЛНП) находится в пределах нормы [7, 8]. Многообещающим в прогнозировании риска развития КБС и МИ является использование новых маркеров воспаления, играющих важную роль в патогенезе нестабильности атеросклеротической бляшки (АСБ) [9]. Одним из таких белков является липопротеин-ассоциированная фосфолипаза А2 (Лп-ФЛА2), которая специфична в отношении сосудистого воспаления [10]. Этот фермент относится к семейству фосфолипазы А2 и продуцируется моноцитами, тучными клетками, клетками Купфера и Т-лимфоцитами [11]. В плазме 80% Лп-ФЛА2 связано с ЛНП, оставшиеся 20% связаны с липопротеидами высокой плотности (ЛВП) и липопротеидами очень низкой плотности (ЛОНП) [12].
 Лп-ФЛА2 гидролизует фосфолипиды на поверхности окисленных ЛНП в субэндотелиальном пространстве. Гидролизу подвергается центральная эфирная связь фосфолипидов, в результате чего образуются окисленные жирные кислоты и лизофосфатидилхолин, который является медиатором воспаления и проатерогенным фактором [9]. Лизофосфатидилхолин — сильный хемоаттрактант для макрофагов и Т-лимфоцитов, он индуцирует миграцию гладких мышечных клеток, нарушает функцию эндотелия и стимулирует экспрессию молекул адгезии и цитокинов [13, 14].
Лп-ФЛА2 гидролизует фосфолипиды на поверхности окисленных ЛНП в субэндотелиальном пространстве. Гидролизу подвергается центральная эфирная связь фосфолипидов, в результате чего образуются окисленные жирные кислоты и лизофосфатидилхолин, который является медиатором воспаления и проатерогенным фактором [9]. Лизофосфатидилхолин — сильный хемоаттрактант для макрофагов и Т-лимфоцитов, он индуцирует миграцию гладких мышечных клеток, нарушает функцию эндотелия и стимулирует экспрессию молекул адгезии и цитокинов [13, 14].
Приводятся многочисленные доказательства того, что повышенный уровень Лп-ФЛА2 в плазме независимо ассоциируется с риском возникновения КБС и ишемического инсульта (ИИ) [15—17]. Недавно опубликованы результаты мета-анализа 32 проспективных клинических исследований, согласно которому уровни Лп-ФЛА2 значимо связаны с риском развития ССЗ по типу непрерывной линейно-логарифмической зависимости [18]. В то же время приводятся доказательства того, что прогностическая значимость уровней Лп-ФЛА2 в наибольшей степени проявляется в отсутствие традиционных ФР. В работе S. Robins и соавт. [19] оценивалась прогностическая значимость Лп-ФЛА2 при уровне ХС ЛНП <3,0 ммоль/л в популяции больных с низкими уровнями ХС ЛВП (<0,8 ммоль/л). При этом авторы выявили, что повышение концентрации Лп-ФЛА2 у больных без повышенного уровня ХС ЛНП ведет к увеличению риска развития сердечно-сосудистых осложнений (ССО). C.M. Ballantyne и соавт. [20] оценили большую популяцию пациентов, но выраженная корреляция уровня Лп-ФЛА2 с риском развития КБС была обнаружена только в подгруппе с уровнем ХС ЛНП <3,4 ммоль/л.
Целью настоящего исследования явилось изучение ассоциации массы Лп-ФЛА2 с наличием ИИ у больных эссенциальной гипертензией (ЭГ).
Материал и методы
Обследованы 60 больных ЭГ с неосложненным течением (1-я группа, средний возраст 54,9±6,7 года) и 90 больных ЭГ, перенесших ИИ, подтвержденный данными магнитно-резонансной томографии головного мозга (2-я группа, средний возраст 58,1±7,1 года). Кроме того, все пациенты были дополнительно разделены на 2 группы. В группу А вошли 70 пациентов с высоким уровнем ХС ЛНП (средний возраст 58,2±6,2 года), в группу Б — 80 больных с нормальным или умеренно повышенным уровнем ХС ЛНП (средний возраст 55,6±7,7 года). Под высоким уровнем ХС ЛНП понимали его повышение >3,36 ммоль/л (согласно классификации АТР III, 2001).
Критериями исключения из исследования явились вторичные формы артериальной гипертензии, ИМ или эпизод нестабильной стенокардии менее чем за 6 мес до включения в исследование, высокий функциональный класс сердечной недостаточности (III—IV по классификации NYHA), печеночная или почечная недостаточность, онкологические заболевания.
Всем больным проведено измерение роста, массы тела, окружности талии, артериального давления и частоты сердечных сокращений. Содержание в крови глюкозы, общего холестерина (ОХС), триглицеридов (ТГ) и ХС ЛВП определяли на биохимическом автоанализаторе Sinhron CX4-DELTA. Концентрацию ХС ЛНП вычисляли по формуле Фридвальда (1972): ЛНП = ОХС – (ТГ/2,2) – ЛВП.
Массу Лп-ФЛА2 определяли с помощью PLAC-теста методом иммунотурбодиметрии в формате ELISA.
Состояние сонных артерий (СА) изучали на аппарате Sequoia-512. Общую сонную артерию (ОСА) сканировали в продольном сечении с помощью линейного датчика с частотой 7,5 МГц. При дуплексном сканировании каротидного бассейна исследовали бифуркацию брахиоцефального ствола, дистальный, средний и проксимальный отделы ОСА, бифуркацию ОСА и проксимальную треть внутренней и наружной СА справа и слева.
Толщину интимы—медии (ТИМ) измеряли в средней трети по задней стенки ОСА в местах, свободных от АСБ, как расстояние от внутренней границы между просветом артерии и интимой до границы между медией и адвентицией.
При наличии атеросклеротического поражения ТИМmах составлял поперечный размер АСБ, ТИМ и липидные депозиты. При множественном поражении учитывали размер АСБ, имеющей наибольший поперечный размер. АСБ считали локальное увеличение ТИМ более 0,11 см. Степень сужения сосуда определяли исходя из отношения диаметра артерии в зоне максимального сужения к диаметру «референтного» сегмента сосуда, в качестве которого выступал предполагаемый/должный диаметр СА на уровне максимального сужения (критерии европейского исследования ECST, 1991).
Статистическую обработку полученных данных проводили при помощи программы Statistica 6.0 и пакета стандартных статистических программ. Нормальность распределения определяли по критериям Шапиро—Уилка и Лильефорса. Достоверность различий между группами оценивали с помощью непараметрических критериев Манна—Уитни и Колмогорова—Смирнова, а также параметрического критерия t Стьюдента. Изучение взаимосвязи между показателями проводили с помощью корреляционного анализа с вычислением коэффициента корреляции Спирмена (r). Для оценки прогностической значимости метаболических факторов и Лп-ФЛА2 в развитии ИИ применяли многофакторный регрессионный анализ с пошаговым включением в модель. Различия считали достоверными при p<0,05.
Результаты
Клинико-функциональная характеристика обследованных пациентов представлена в табл. 1.
Выделенные группы больных существенно не различались по полу, в то же время пациенты, перенесшие ИИ, оказались несколько старше (р<0,05). При изучении структуры сопутствующей кардиальной патологии оказалось, что анализируемые группы пациентов не различались по частоте развития КБС, однако во 2-й группе достоверно чаще регистрировался сахарный диабет и ИМ (р<0,05). Пациенты, перенесшие ИИ, имели несколько более низкий уровень ОХС и ХС ЛВП, однако различия не достигали статистической значимости. У пациентов, перенесших ИИ, существенно чаще выявлялся атеросклероз СА (74,7% против 58,3%; p<0,05).
Средний уровень Лп-ФЛА2 в обследованной группе составил 269 нг/мл, при этом отмечался значительный размах значений данного показателя: значения 10-го и 90-го процентили составили 162 и 394 нг/мл соответственно.
Уровень Лп-ФЛА2 у больных, перенесших МИ, достигал 275±92 нг/мл и существенно не отличался от такового у больных без инсульта (260±77 нг/мл, различия недостоверны). Нами не выявлено различий по массе Лп-ФЛА2 в зависимости от возраста (257±95 нг/мл до 56 лет и 277±80 нг/мл старше 56 лет) и пола (261±87 нг/мл у женщин и 290±93 нг/мл у мужчин).
При проведении корреляционного анализа оказалось, что у больных 1-й группы выявлялась прямая корреляция уровня Лп-ФЛА2 с возрастом (r=0,27; p<0,05), концентрацией ХС ЛВП (r=0,30; p<0,05) и ХС ЛНП (r=0,28; p<0,05) и отрицательная ассоциация с уровнем ТГ (r=–0,28; p<0,05). В то же время у больных ЭГ, перенесших ИИ, обнаружена отрицательная связь массы Лп-ФЛА2 с индексом массы тела (r=–0,21; p<0,05) и уровнем глюкозы в крови (r=–0,23; p<0,05). Взаимосвязи уровня Лп-ФЛА2 с липидными показателями у больных 2-й группы нами не выявлено.
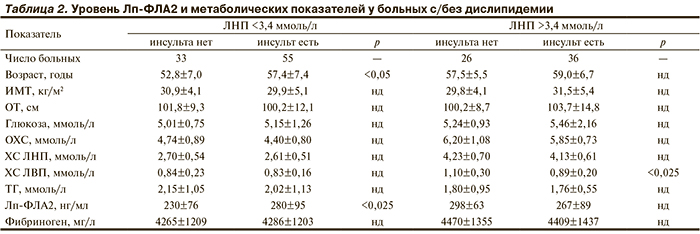
В группе без дислипидемии (уровень ЛНП <3,4 ммоль/л) пациенты, перенесшие ИИ, были несколько старше (57,4±7,4 года против 52,8±7,0 года; р<0,05) и имели более высокий уровень Лп-ФЛА2 (280±95 нг/мл против 230±76 нг/мл; р<0,025) по сравнению с группой больных ЭГ с неосложненным течением заболевания (табл. 2).
В группе с дислипидемией (уровень ЛНП >3,4 ммоль/л) между пациентами с анамнезом ИИ и без инсульта не выявлялись существенные различия по возрасту, степени нарушения жирового, углеводного обмена, а также по уровню ТГ, ОХС и ХС ЛНП (p>0,05). Кроме того, масса Лп-ФЛА2, составив у пациентов 1-й группы 298±63 нг/мл, значимо не отличалась от значений аналогичного показателя у пациентов с ИИ (267±89 нг/мл, различия недостоверны). В то же время у лиц, перенесших инсульт, регистрировался достоверно более низкий уровень ХС ЛВП по сравнению с больными с неосложненным течением ЭГ (0,89±0,20 и 1,10±0,30 ммоль/л соответственно; р<0,025) (см. табл. 2).

С целью выявления независимых предикторов развития ИИ мы использовали многофакторный регрессионный анализ с пошаговым включением в модель. Были сформированы 3 модели, в которых в качестве зависимых переменных использовалось наличие МИ в общей группе, а также в группах больных с дислипидемией и без нее. В качестве независимых переменных в модель вошли возраст, индекс массы тела, объем талии, уровни в крови глюкозы, ОХС, ТГ, ХС ЛНП, ХС ЛВП, фибриногена и масса Лп-ФЛА2, а также ТИМ и атеросклероз СА.
При анализе полученных результатов оказалось, что независимыми факторами, ассоциирующимися с развитием ИИ в исследуемой популяции, являются возраст (β=0,23; p<0,01) и сниженный уровень ХС ЛВП (β=–0,21; p<0,02). Кроме того, развитию инсульта в общей популяции способствовало наличие атеросклероза СА (β=0,12; p=0,13) и уровень ОХС (β=–0,12; р=0,17), однако их вклад в увеличение риска был менее выраженным (табл. 3).
В группе пациентов с дислипидемией и перенесенным ИИ наиболее значимая негативная ассоциация выявлялась для ХС ЛВП (β=–0,33; p<0,005). Среди больных без дислипидемии (уровень ХС ЛНП <3,4 ммоль/л) независимыми показателями, ассоциированными с перенесенными острыми мозговыми катастрофами по ишемическому типу, явились возраст (β=0,25; p<0,02) и повышенный уровень Лп-ФЛА2 (β=0,23; p<0,05).
Обсуждение
Наиболее частой причиной острого ИИ служат атеросклероз и атеротромбоз [21—24]. В настоящее время считается, что атеросклероз является заболеванием, в патогенезе которого важную роль играет воспаление в сосудистой стенке. Воспаление создает в субэндотелиальном пространстве токсическую среду, стимулирующую рост АСБ, способствующую ее дестабилизации, что приводит к разрыву АСБ и закупорке просвета артерии. Клиническим последствием усиления воспаления внутри АСБ является возрастание риска возникновения ССО, в том числе ИИ.
Лп-ФЛА2 — специфичный в отношении сосудистого воспаления новый биомаркер, который информирует о воспалении АСБ и степени ее стабильности. В плазме 80% Лп-ФЛА2 связано с ЛНП, 10—15% — с ЛВП и 5—10% циркулирует в составе ЛОНП [25]. Поскольку уровни циркулирующей Лп-ФЛА2 зависят от концентрации ее основного транспортера (ЛНП), значимая взаимосвязь между этими показателями отмечена во многих исследованиях [26—28]. В нашем исследовании также выявлена умеренная ассоциация между уровнем Лп-ФЛА2 и содержанием ХС ЛНП (r=0,28; p<0,05), однако указанная взаимосвязь наблюдалась только у пациентов с неосложненным течением ЭГ. В этой группе выявлялась также ассоциация массы Лп-ФЛА2 с уровнем ХС ЛВП, ТГ и возрастом. В то же время у больных, перенесших ИИ, зависимости содержания Лп-ФЛА2 с показателями липидного состава крови нами не выявлено, что, возможно, является следствием применения гиполипидемических препаратов (статинов).
Увеличение уровня Лп-ФЛА2 в сыворотке крови свидетельствует о наличии АСБ, склонной к разрыву, и, согласно результатам проведенных исследований, коррелирует с риском развития ССЗ, в том числе атеросклероза СА и инсульта. Однако результаты этих исследований не всегда однозначны.
В частности, M. Persson и соавт. [29] провели проспективное наблюдение за 5393 лицами без ССЗ в течение 10 лет. За время наблюдения в исследуемой группе произошло 347 острых сосудистых событий (195 ИМ и 152 ИИ). С поправкой на возраст и пол у больных, концентрация Лп-ФЛА2 у которых соответствовала верхнему терцилю распределения, относительный риск развития ИИ составил 1,92 (1,20—3,10) по сравнению с больными, у которых концентрация Лп-ФЛА2 находилась в нижнем терциле. Сходные данные получены в рамках исследования ARIC [20], Роттердамском популяционном исследовании [30] и ряде других [31].
В то же время некоторые авторы не смогли выявить взаимосвязи между массой или активностью Лп-ФЛА2 с развитием ССЗ. В частности, об этом сообщают J. Oldgren и соавт. [32], которым в исследовании GUSTO IV не удалось обнаружить ассоциации между уровнем Лп-ФЛА2 и риском развития ССО, включая МИ, в течение 1 года проспективного наблюдения. Аналогичные результаты получены в исследовании PROVE IT-TIMI 22, в котором также не выявлено взаимосвязи активности Лп-ФЛА2 с риском развития ССЗ [33]. M.L. Muzzio и соавт. [34] не выявили различий по уровню Лп-ФЛА2 в группах больных КБС и контрольной группой.
В ряде исследований продемонстрирована ассоциация развития атеросклероза с уровнем Лп-ФЛА2 в зависимости от степени гиперлипидемии. Так, D.N. Kiortsis и соавт. (2005) [35] не выявили взаимосвязи ТИМ с уровнем Лп-ФЛА2 у пациентов с повышенным уровнем липидов крови. Сходные данные в отношении ассоциации массы Лп-ФЛА2 с атеросклерозом СА приводят S. Campo и соавт. [36]. S.J. Robins и соавт. [19] в рамках Фрамингемского исследования продемонстрировали, что повышенный уровень Лп-ФЛА2 увеличивает риск развития ССО у пациентов с низким уровнем ХС ЛНП (<3,0 ммоль/л). C.M. Ballantyne и соавт. [20] в рамках исследования ARIC оценили большую популяцию пациентов, при этом выраженная корреляция уровня Лп-ФЛА2 с риском развития КБС найдена только в подгруппе с низким уровнем ХС ЛНП (<3,4 ммоль/л).
Согласно результатам нашего исследования, в группе с низким уровнем ХС ЛНП (<3,4 ммоль/л) масса Лп-ФЛА2 у больных с инсультом оказалась выше, чем у пациентов с неосложненным течением ЭГ. При этом установлено, что в данной группе независимая ассоциация с перенесенным инсультом выявлялась для возраста и уровня Лп-ФЛА2. В группе пациентов с высоким уровнем ХС ЛНП (>3,4 ммоль/л) масса Лп-ФЛА2 не различалась у больных ЭГ с инсультом в анамнезе и без инсульта, при этом наблюдалась взаимосвязь анамнеза острых нарушений мозгового кровообращения только с низким уровнем ХС ЛВП.
По нашему мнению, полученные результаты свидетельствуют о том, что при выраженных нарушениях липидного обмена и высоком уровне традиционных ФР развития ССЗ роль Лп-ФЛА2 в развитии острых церебральных катастроф, а возможно и атеросклероза другой локализации, снижается. Однако при низком уровне традиционных метаболических ФР доминирующую роль в процессах атерогенеза и дестабилизации АСБ начинают играть провоспалительные субстанции, в частности, Лп-ФЛА2.



