Хроническая сердечная недостаточность (ХСН) со сниженной фракцией выброса (ФВ) — состояние, характеризующееся отчетливой тенденцией к росту распространенности и ассоциацией с высокой смертностью [1]. В качестве причины устойчивого увеличения числа больных с ХСН со сниженной ФВ рассматриваются факторы, связанные с образом жизни, старением населения, повышением выживаемости больных после инфаркта миокарда (ИМ) [2]. В экономически развитых странах распространенность ХСН составляет 1—2% во взрослой популяции и увеличивается до 10% и более среди людей старше 70 лет [3, 4]. По данным эпидемиологических исследований, проведенных за последние 10 лет в нашей стране с охватом большого числа регионов (ЭПОХА-ХСН, ЭПОХА-О-ХСН), распространенность ХСН в популяции составляет 7% (7,9 млн человек) и растет в среднем на 1,2 человека на 1000 населения в год [5—8].
 Современное лечение больных с ХСН со сниженной ФВ направлено на блокаду ренин-ангиотензин-альдостероновой системы (РААС) и симпатической части вегетативной нервной системы (С-ВНС). Общепризнанный стандарт лечения ХСН составляют ингибиторы ангиотензинпревращающего фермента (АПФ) или блокаторы АТ1-рецепторов ангиотензина II (АТII) — БРА, β-адреноблокаторы, антагонисты минералокортикоидных рецепторов (АМКР) и диуретики [3, 8, 9]. Рандомизированные контролируемые исследования убедительно доказали, что ингибиторы АПФ, БРА, β-адреноблокаторы и АМКР увеличивают выживаемость больных с ХСН со сниженной ФВ и снижают число госпитализаций. Однако, несмотря на широкое и все более частое применение этой терапии, резидуальная заболеваемость и смертность больных остаются высокими: 50% из них умирают в течение 5 лет после установления диагноза ХСН. Этот факт подчеркивает необходимость дальнейшего поиска новых терапевтических подходов с доказанной эффективностью [1, 10].
Современное лечение больных с ХСН со сниженной ФВ направлено на блокаду ренин-ангиотензин-альдостероновой системы (РААС) и симпатической части вегетативной нервной системы (С-ВНС). Общепризнанный стандарт лечения ХСН составляют ингибиторы ангиотензинпревращающего фермента (АПФ) или блокаторы АТ1-рецепторов ангиотензина II (АТII) — БРА, β-адреноблокаторы, антагонисты минералокортикоидных рецепторов (АМКР) и диуретики [3, 8, 9]. Рандомизированные контролируемые исследования убедительно доказали, что ингибиторы АПФ, БРА, β-адреноблокаторы и АМКР увеличивают выживаемость больных с ХСН со сниженной ФВ и снижают число госпитализаций. Однако, несмотря на широкое и все более частое применение этой терапии, резидуальная заболеваемость и смертность больных остаются высокими: 50% из них умирают в течение 5 лет после установления диагноза ХСН. Этот факт подчеркивает необходимость дальнейшего поиска новых терапевтических подходов с доказанной эффективностью [1, 10].
РААС и система натрийуретических пептидов (НУП) являются контррегуляторными нейрогуморальными механизмами (табл. 1). Будучи состоянием нейрогуморального дисбаланса, ХСН характеризуется гиперактивностью РААС и сниженной активностью системы НУП. Восстановление нейрогуморального баланса путем блокады РААС и модуляции активности НУП рассматривается как потенциально клинически благоприятное терапевтическое воздействие.
LCZ696 — первый представитель класса препаратов, обладающих способностью одновременно блокировать АТ1-рецепторы АТII и нейтральную эндопептидазу (НЭП) неприлизин. В англоязычной литературе класс получил название ARNi (от Angiotensin Receptor and Neprilysin Inhibitors). После перорального применения LCZ696 метаболизируется до БРА валсартана и сакубитрила (пролекарство ингибитора неприлизина), который в свою очередь метаболизируется до активного ингибитора неприлизина LBQ657 [11].
Система НУП является важной эндокринной системой регуляции сосудистого тонуса и водно-электролитного баланса. Семейство НУП представлено генетически разными, но схожими по структуре пептидами — предсердным НУП, НУП типа В (мозговой НУП) и типа С [12]. Предсердный НУП и НУП типа В преимущественно экспрессируются в сердце и попадают в кровоток в ответ на увеличение нагрузки на миокард [13]. Повышение продукции НУП обнаруживается уже на ранних стадиях ХСН [14]. НУП типа С вырабатывается преимущественно эндотелиальными клетками и действует как паракринный гормон [13]. НУП удаляются из кровотока и инактивируются путем клиренса, опосредованного клиренсовым рецептором, и путем неприлизин-зависимой протеолитической деградации. Неприлизин — основной путь деградации НУП. В отличие от НУП типа В предсердный НУП и НУП типа С деградируются неприлизином в большей степени [12]. НУП реализуют свои эффекты путем активации связанных с мембраной рецепторов гуанилциклазы (NPR-A и -B), тем самым увеличивая концентрацию вторичного мессенджера — циклического гуанозинмонофосфата (цГМФ), который опосредует многие эффекты НУП в отношении сердечно-сосудистой системы и почек [12, 14]. Широкий спектр потенциально благоприятных таких эффектов НУП включает снижение артериального давления (АД), вазодилатацию, натрийурез, диурез, увеличение скорости клубочковой фильтрации (СКФ) и почечного кровотока, ингибирование высвобождения ренина и альдостерона, снижение симпатической активности, антигипертрофические и антипролиферативные эффекты, улучшение липолиза и митохондриального биогенеза [12, 14—16]. LCZ696 усиливает физиологические эффекты НУП, ингибируя их неприлизин-опосредованную деградацию. Кроме того, неприлизин также участвует в деградации сосудорасширяющих (субстанции P, адреномедулина, брадикинина) и сосудосуживающих пептидов (эндотелина-1 — ЭТ-1, АТII) [10].
 LCZ696 ингибирует РААС путем блокады АТ1-рецепторов АТII, уменьшая тем самым опосредованную АТII вазоконстрикцию, активность альдостерона, почечную задержку натрия и воды, активацию пролиферации гладких мышечных клеток и, следовательно, ремоделирование сердца и сосудов [17, 18]. Блокада AT1-рецепторов приводит к увеличению концентрации АТII и по механизму обратной связи — к повышению секреции ренина и активности ренина плазмы (АРП). Следовательно, повышение концентрации АТII и АРП может служить маркером блокады АТ1-рецепторов.
LCZ696 ингибирует РААС путем блокады АТ1-рецепторов АТII, уменьшая тем самым опосредованную АТII вазоконстрикцию, активность альдостерона, почечную задержку натрия и воды, активацию пролиферации гладких мышечных клеток и, следовательно, ремоделирование сердца и сосудов [17, 18]. Блокада AT1-рецепторов приводит к увеличению концентрации АТII и по механизму обратной связи — к повышению секреции ренина и активности ренина плазмы (АРП). Следовательно, повышение концентрации АТII и АРП может служить маркером блокады АТ1-рецепторов.
Данная статья посвящена фрагменту клинического исследования, в котором LCZ696 был впервые назначен пациентам с ХСН и сниженной ФВ, и отражает его результаты по оценке переносимости и эффектов на некоторые биомаркеры.
Материал и методы
Исследование было одноцентровым открытым нерандомизированным неконтролируемым фазы IIa (http://www.clinicaltrials.gov; NCT00913653). Протокол был одобрен Национальным комитетом по этике и локальным Этическим комитетом. Исследование было организовано компанией «Новартис Фарма АГ» (Швейцария) и выполнено в Центре РУДН по изучению новых лекарственных и диагностических препаратов в 2009 г.
Критерии отбора больных. После подписания информированного согласия в исследование включались мужчины и женщины (без детородного потенциала) старше 18 лет с документированной ХСН со сниженной ФВ ≤ 40% II—IV функционального класса по классификации New York Heart Association (NYHA). На момент включения пациенты должны были получать стандартную терапию ХСН стабильными дозами препаратов в течение ≥1 мес. Другие критерии включения подразумевали уровень систолического АД (САД) ≥110 мм рт.ст., СКФ ≥30 мл/мин/1,73 м2, уровень калия в сыворотке ≤5,2 ммоль/л в период скрининга. Основными критериями исключения служили изолированная правожелудочковая недостаточность, клинически значимое поражение клапанов сердца, гипертрофическая кардиомиопатия, вторичные кардиомиопатии, анамнез или планируемая трансплантация сердца, нестабильная стенокардия или ИМ в течение 6 мес до включения. Не включали больных, получавших комбинацию ингибитора АПФ и БРА, с анамнезом ангионевротического отека, превышением верхней границы нормы активности печеночных трансаминаз более чем в 3 раза. Скрининговое обследование прошли 36 пациентов, из которых 30 были включены в исследование.
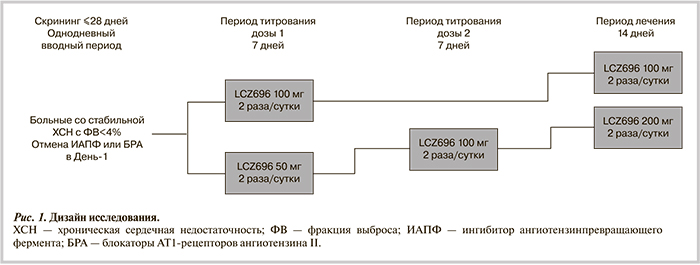
Дизайн исследования. Период скрининга состоял из <28 дней, когда у пациентов оценивались критерии включения и исключения. На протяжении этого периода пациенты продолжали получать стабильную предшествующую терапию по поводу ХСН. Вводный период исследования состоял из одного дня (–1-й день), когда пациентам отменялись ранее принимаемые ингибиторы АПФ или БРА, а другая терапия по поводу ХСН оставалась неизменной. Последнее условие соблюдалось на протяжении всего периода наблюдения.
После однодневного вводного периода в зависимости от ранее получаемой дозы блокатора РААС терапия LCZ696 могла быть начата с 50 или 100 мг 2 раза в сутки. Все пациенты начали прием препарата с дозы 100 мг 2 раза в сутки. Через 7 дней всем пациентам доза была повышена до целевой 200 мг 2 раза в сутки, длительность приема которой составила 14 дней. Таким образом, общая продолжительность приема LCZ696 составила 21 день (рис. 1).

Для обеспечения наблюдения и контроля приверженности к лечению пациенты были госпитализированы на все время проведения исследования. Пациенты получали стандартизованную диету с дневным содержанием 3 г натрия (1130 мэкв) и 5 г калия (128 мэкв) для снижения вариабельности фармакодинамических параметров.
Критерии досрочного прекращения участия пациента в исследовании. Пациенты могли в любой момент добровольно прекратить участие в исследовании. Критерии исключения из исследования подразумевали непереносимость повышения дозы препарата до 200 мг 2 раза в сутки, клинически проявляющуюся или ортостатическую гипотонию, неконтролируемую артериальную гипертонию (САД >160 мм рт.ст.), ухудшение симптомов ХСН. Лабораторные критерии прекращения исследования включали повышение уровня калия в сыворотке >5,5 ммоль/л, повышение креатинина в сыворотке >3,0 мг/дл, удвоение уровня креатинина в сыворотке. Все лабораторные изменения должны были быть подтверждены повторным исследованием скомпрометированного параметра. Исследование для пациента могло быть прекращено в случае развития любых других нежелательных явлений, включая значительные изменения лабораторных параметров и электрокардиограммы (ЭКГ), если, по мнению исследователя, они требовали отмены исследуемого препарата.
Мониторирование безопасности. С целью мониторирования безопасности и переносимости терапии пациентам выполнялось исследование ЭКГ, АД, частоты сердечных сокращений (ЧСС), электролитов, функции печени и почек перед назначением, через 7 и 21 день приема LCZ696. Для измерения АД использовали валидированный автоматический осциллометрический прибор. Уровень АД и ЧСС оценивали через 3 мин в положении пациента лежа перед первым приемом препарата и через 2, 4 и 12 ч после первого приема препарата в 1-й день и после утреннего приема в 7-й и 21-й дни. Перед началом приема препарата, в 7-й и 21-й дни лечения было выполнено 24-часовое мониторирование АД с использованием портативной системы BPro («HealthStats», Сингапур) на запястье недоминантной руки. Регистрация АД производилась с интервалом между измерениями 15 мин в период с 8.00 до 20.00 и 20 мин — в период с 20.00 до 8.00.

Фармакодинамические исследования. Поскольку исследуемые фармакодинамические параметры чувствительны к положению тела и стрессу, пациенты находились в положении лежа в спокойной обстановке не менее 30 мин до взятия крови. Фармакодинамические параметры включали определение в плазме предсердного НУП, цГМФ, N-концевого про-НУП типа В (NT-proBNP), концентрации альдостерона, ЭТ-1, ренина и АРП. Образцы плазмы отбирали до начала приема LCZ696, перед утренним приемом и через 4, 12, 16 и 24 ч после на 7-й и 21-й дни лечения (т.е. через 7 дней приема дозы 100 мг 2 раза в сутки и 14 дней — 200 мг 2 раза в сутки). Для анализа биомаркеров в моче ее образцы собирали с 12-часовыми интервалами на протяжении 24 ч перед началом приема препарата, на 7-й и 21-й дни. Оценивали объем мочи, концентрацию натрия, калия, креатинина, предсердного НУП, цГМФ и NT-proBNP.
Статистический анализ. Все пациенты, получившие хотя бы одну дозу исследуемого препарата, были включены в анализ безопасности и переносимости. В исследование фармакодинамических эффектов были включены пациенты, получившие хотя бы одну дозу препарата и хотя бы с однократной последующей оценкой исследуемых параметров. Для биомаркеров плазмы и мочи были рассчитаны средние геометрические значения исходно (до приема препарата), через 7 и 21 дней лечения. Отношение средних геометрических значений параметров на 21-й день приема препарата к исходным было рассчитано для пациентов, полностью завершивших исследование. Для полученных показателей были определены 95% доверительный интервал (ДИ) и двустороннее значение p с использованием парного критерия t для лог-трансформированных данных.
Результаты
Характеристика больных. В исследование были включены 30 пациентов с ХСН II—III функционального класса по классификации NYHA. Характеристика больных представлена в табл. 2. Средний возраст пациентов составил 62,0±9,3 (±SD) года, 83,3% (n=25) — мужчины. У большинства больных имелся анамнез перенесенного ИМ (90%, n=27) и АГ (87%, n=26). В качестве терапии ХСН до включения в исследование все больные получали ингибитор АПФ, 90% (n=27) — β-адреноблокаторы, по 33,3% (n=10) — спиронолактон и нитраты, 63,3% (n=19) — фуросемид.

Все 30 больных завершили 7-дневный период приема LCZ696 в дозе 100 мг 2 раза в сутки и перешли в период 14-дневного лечения удвоенной дозой препарата. Были исключены из исследования ввиду превышения предустановленного уровня калиемии 5,5 ммоль/л 3 больных. Оставшиеся 27 (90%) больных завершили исследование в соответствии с протоколом.
Фармакодинамические эффекты LCZ696. Биомаркеры ингибирования неприлизина. На протяжении всего периода приема препарата отмечено повышение уровня цГМФ в плазме, который достоверно превышал исходные значения как на 7-й, так и на 21-й дни лечения (табл. 3).
Уровень предсердного НУП достоверно не изменился при лечении обеими дозами LCZ696. Тенденция к повышению концентрации цГМФ в моче была отмечена на 7-й день и достигла достоверности к 21-му дню лечения. Количество предсердного НУП в моче было достоверно выше по сравнению с исходным в конце каждого дозового периода. Последнее косвенно свидетельствует о том, что невозможность выявить повышение уровня предсердного НУП в плазме, несмотря на повышение цГМФ, могла быть связана с нестабильностью аналита в плазме (более стабилен в моче) и возможными техническими погрешностями обработки образцов.
Биомаркеры блокады АТ1-рецепторов АТII. На 7-й и 21-й дни лечения было отмечено значительное повышение концентрации ренина в плазме и его активности, характерное для блокады АТ1-рецепторов АТII (см. табл. 3).

Биомаркеры потенциально благоприятных эффектов при ХСН. На 7-й день приема LCZ696 в дозе 100 мг 2 раза в сутки была отмечена тенденция к снижению уровня альдостерона и ЭТ-1 в плазме. Это снижение достигло достоверности на 21-й день (т.е. после 14 дней приема препарата в дозе 200 мг 2 раза в сутки). На 21-й день отношение концентраций альдостерона и ЭТ-1 к соответствующим исходным показателям составило 0,79 (при 95% ДИ от 0,65 до 0,95; р=0,017) и 0,80 (при 95% ДИ от 0,71 до 0,91; р=0,001; рис. 2).
Концентрация NT-proBNP в плазме достоверно снизилась на 7-й и 21-й дни лечения (см. рис. 2). Аналогичные изменения отмечены для уровня NT-proBNP в моче, который также достоверно снизился: отношение к исходному уровню составило 0,68 (при 95% ДИ от 0,55 до 0,83; р<0,001) через 7 дней приема LCZ696 100 мг 2 раза в сутки и 0,74 (95% ДИ 0,59, 0,94; р<0,017) на 21-й день лечения (14 дней приема LCZ696 200 мг 2 раза в сутки; см. рис. 2). Поскольку NT-proBNP не является субстратом для неприлизина, эти данные могут отражать гемодинамическую разгрузку.
За время наблюдения не было отмечено достоверных изменений уровня натрия, калия и креатинина в моче. Средний уровень экскреции натрия на 21-й день лечения был больше, чем на 7-й или исходно (табл. 4). Трактовка таких различий в качестве эффекта исследуемого препарата представляет сложности ввиду сопутствующей терапии диуретиками (см. табл. 2).
Динамика АД и ЧСС. Лечение LCZ696 привело к достоверному (p<0,05) снижению уровня АД в положении лежа по сравнению с исходным (САД 135,5±14,2 мм рт.ст., ДАД 80±9,06 мм рт.ст. [±SD]): на 7-й день уровень САД составил 119,1±17,08 мм рт.ст., ДАД 71,9±10,3 мм рт.ст.; снижение от исходного уровня соответственно 16,3±11,83 и 8,1±8,06 мм рт.ст., на 21-й день снижение для САД составило 14,9±10,16 мм рт.ст., ДАД 7,1±8,28 мм рт.ст. Аналогично среднесуточные значения САД (исходно 133,5±12,2 мм рт.ст. и ДАД (81,5±9,2 мм рт.ст.) снизились на 7-й день соответственно на 14,4±18,35 и 10,3±12,98 мм рт.ст. и сохранились на уровне 7-го дня до 21-го, когда снижение по сравнению с исходным составляло соответственно 15,4±17,83 и 10,5±11,11 мм рт.ст. Снижение АД было достоверным как в дневные, так и в ночные часы (p<0,05). Дневное САД/ДАД исходно составляло 135,5±12,5/82,8±9,1 мм рт.ст., через 7 дней — 120,7±17,3/71,4±10,9 мм рт.ст. и через 21 день — 121,3±17,0/74,0±9,6 мм рт.ст. Для ночного АД соответствующие значения составили 129,3±13,7/79,0±10,3; 113,7±15,2/68,2±11 и 111,7±19,3/68,2±10,9 мм рт.ст. На фоне лечения не появились эпизоды гипотонии ни в дневное, ни в ночное время. Динамика АД свидетельствует, что основное снижение АД наблюдалось после перехода с ингибитора АПФ на LCZ696, а удвоение дозы не приводило к дальнейшему значительному его снижению. Таким образом, снижение АД хорошо переносилось пациентами, ни у одного из них не отмечено симптомов, связанных с изменением АД. Не отмечено эпизодов гипотонии, которые могли бы быть расценены как нежелательное явление или привести к досрочному прекращению участия в исследовании.

ЧСС за период исследования существенно не изменилась: исходно 65,5±10,25, на 21-й день 62,8±9,67 уд/мин.
Безопасность и переносимость. Во время исследования не было смертей или серьезных нежелательных явлений. Нежелательные явления были отмечены у 21 (70%) из 30 пациентов, у 16 (53,3 %) — в период 7-дневного приема LCZ696 100 мг 2 раза в сутки, у 15 (50%) — в 14-дневный период приема удвоенной дозы препарата.
Наиболее часто (у 16; 53,3% пациентов) нежелательные явления выявлялись при лабораторно-инструментальных исследованиях. Наиболее частыми нежелательными явлениями были повышение уровня калия и креатинина в сыворотке, удлинение интервала PR и головокружение. Частота нежелательных явлений не зависела от дозы препарата, большинство из них разрешились до окончания исследования. Нежелательные явления, отмеченные более чем у одного пациента, перечислены в табл. 5.
За исключением изменений уровня калия и креатинина в сыворотке ни одно из нежелательных явлений не было расценено исследователями как связанное с приемом исследуемого препарата.
Динамика уровней калия и креатинина в сыворотке в ходе исследования представлена на рис. 3. Незначительное повышение уровня калия отмечено на 16-й день приема препарата (5,28±0,69 ммоль/л) с возвратом к исходному уровню на 21-й день лечения (4,75±0,43 ммоль/л). Как уже отмечалось, 3 пациента были исключены из исследования в связи с подтвержденной гиперкалиемией >5,5 ммоль/л. Концентрация калия перед первым приемом препарата и на момент исключения у этих больных составляла соответственно 5,8 и 6,7 ммоль/л, 4,7 и 5,6 ммоль/л, 4,5 и 5,7 ммоль/л.
 У 2 из этих пациентов имелось незначительное нарушение функции почек в виде повышения уровня креатинина в сыворотке до 123 и 112 мкмоль/л, один пациент получал терапию АМКР. Не исключено, что эти факторы могли сыграть роль в повышении уровня калия в крови. Поскольку у 2 из 3 пациентов уровень калия >5,5 ммоль/л соответствовал критериям досрочного прекращения исследования на 16-й день лечения, видимо, это определило повышение уровня калия в сыворотке в среднем по группе именно в этот срок. В ходе исследования не было выявлено клинически значимых изменений концентрации креатинина в сыворотке.
У 2 из этих пациентов имелось незначительное нарушение функции почек в виде повышения уровня креатинина в сыворотке до 123 и 112 мкмоль/л, один пациент получал терапию АМКР. Не исключено, что эти факторы могли сыграть роль в повышении уровня калия в крови. Поскольку у 2 из 3 пациентов уровень калия >5,5 ммоль/л соответствовал критериям досрочного прекращения исследования на 16-й день лечения, видимо, это определило повышение уровня калия в сыворотке в среднем по группе именно в этот срок. В ходе исследования не было выявлено клинически значимых изменений концентрации креатинина в сыворотке.
Обсуждение
НУП изначально изучались в связи со своими диагностическими и прогностическими возможностями при СН у человека, но в настоящее время рассматриваются в качестве потенциальных инновационных терапевтических препаратов для лечения острого кардиоренального синдрома (I типа) и других сердечно-сосудистых заболеваний (ССЗ), включая АГ и метаболический синдром [13]. В 1986 г. опубликована фундаментальная работа, которая ознаменовала начало применения НУП как маркеров ССЗ [19]. С этого времени НУП, в частности BNP и NT-proBNP, используют в диагностике и прогнозировании течения СН. Ввиду специфических биологических свойств НУП рассматривают как потенциальное эффективное лечение СН [14, 20, 21].
ХСН со сниженной ФВ — прогрессирующий синдром, характеризующийся повышенным давлением наполнения желудочков и сниженным сердечным выбросом. В патогенезе ХСН ведущая роль принадлежит нейрогуморальной активации РААС и С-ВНС. Благоприятные последствия блокады РААС и С-ВНС при ХСН со сниженной ФВ убедительно подтверждены [3, 8, 22]. Кардиоренальные эффекты НУП, противоположные эффектам активированных РААС и С-ВНС, считаются желательными у пациентов с ХСН и служат обоснованием для ее модуляции с целью лечения.
Желаемые эффекты НУП могут быть достигнуты двумя способами: введением извне или замедлением их деградации.
В качестве реализации первой стратегии наиболее изучен эффект препаратов НУП — уларитида (синтезированного, подобного предсердному НУП) и несиритида (рекомбинантного мозгового НУП) у больных с острой декомпенсацией ХСН [23]. Целевая популяция химерного НУП цендеритида схожа, предпринимаются попытки его постоянного применения [24]. Трудности этой терапевтической стратегии связаны с проблемами обеспечения длительного приема препарата и необходимостью профилактики ферментного распада под действием НЭП.
Неприлизин — основной путь деградации НУП. Активность неприлизина повышена при ХСН, что приводит к ускоренной деградации НУП, поэтому блокада фермента привлекательна в качестве терапевтической цели.
Первым препаратом для реализации этого подхода был омапатрилат, сочетавший в себе свойства блокатора неприлизина и ингибитора РААС, причем последний эффект достигался путем ингибирования АПФ.
Омапатрилат был более эффективен в отношении снижения АД при сравнении с другими антигипертензивными препаратами [25]. В исследованиях у больных с ХСН омапатрилат приводил к дозозависимому снижению давления заклинивания в легочных капиллярах, повышению сердечного выброса и снижению концентраций норадреналина [26, 27].
В исследовании OVERTURE (Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events) с включением 5770 пациентов с ХСН II—IV функционального класса NYHА при продолжительности наблюдения в среднем 14,5 мес не было выявлено различий между омапатрилатом и эналаприлом по влиянию на первичную конечную точку, представленную смертностью и госпитализацией по поводу ХСН (относительный риск — ОР 0,94 при 95% ДИ от 0,86 до 1,03) [28]. Вторичный анализ этого исследования показал, что терапия омапатрилатом была ассоциирована со снижением комбинации сердечно-сосудистой смертности и повторных госпитализаций, при этом наибольшая польза отмечена у пациентов с АГ, что оставляло определенную долю оптимизма, несмотря на общие результаты исследования. Омапатрилат назначался однократно в сутки, что обеспечивало эффективное ингибирование АПФ (90% через 2 ч при использовании минимальной дозы), однако ингибирование неприлизина, оцениваемое по пиковой концентрации цГМФ, было относительно краткосрочным (1,25—1,8-кратное повышение через 4—8 ч) [29, 30]. В связи с этим были выдвинуты предположения, что баланс между ингибированием неприлизина и АПФ и исходами мог бы быть достигнут при дозировании препарата 2 раза в сутки. Кроме того, терапия омапатрилатом ассоциировалась со значительным увеличением риска развития ангионевротичесого отека [31], что в конечном счете привело к прекращению разработки этого препарата. Считается, что ангионевротический отек связан с увеличением уровня брадикинина. Возможным объяснением роста частоты этого осложнения при использовании омапатрилата может быть его способность ингибировать аминопептидазу Р, которая наряду с АПФ участвует в деградации брадикинина [32].
Несмотря на результаты исследований с омапатрилатом, терапевтическая стратегия сочетанного ингибирования неприлизина и РААС одним препаратом по-прежнему актуальна, особенно при возможности решения проблемы ангионевротического отека. LCZ696 — первый представитель класса препаратов с высокой селективностью в отношении ингибирования неприлизина и блокады АТ1-рецепторов АТII, не влияющий на АПФ и аминопетидазу Р. В недавно завершившемся исследовании III фазы с оценкой исходов — PARADIGM-HF — LCZ696 продемонстрировал преимущества по сравнению с эналаприлом в отношении снижения сердечно-сосудистой и общей смертности и частоты госпитализаций по поводу СН у больных с ХСН со сниженной ФВ [33]. В этом исследовании 8399 пациентов после открытого для врача 2-недельного вводного периода лечения эналаприлом 10 мг 2 раза в сутки были рандомизированы для продолжения этой терапии или приема LCZ686 200 мг 2 раза в сутки. Медиана наблюдения составила 27 мес ввиду того, что преимущества нового препарата пересекли предопределенную статистическую границу. Первичная конечная точка была представлена комбинацией смерти от ССЗ и госпитализаций по поводу СН, однако исследование было спланировано для возможности выявить различия по сердечно-сосудистой смертности.
Снижение риска по первичной конечной точке на фоне терапии LCZ696 составило 20% (ОР 0,80 при 95% ДИ от 0,73 до 0,87; р<0,001), общей смертности 16% (0,84 при 95% ДИ от 0,76 дo 0,93; р<0,001), сердечно-сосудистой смерти 20% (0,80 при 95% ДИ от 0,71 до 0,89; р<0,001) (рис. 4, 5), госпитализаций по поводу СН 21% (р<0,001). Среди получавших LCZ696 было больше пациентов с гипотонией (14% против 9,2%; р<0,05) и слабовыраженным ангионевротическим отеком (0,4% против <0,3%), но с меньшей частотой нарушения функции почек (креатинин в сыворотке >2,5 мг/дл 3,3% против 4,5%; р=0,07; креатинин в сыворотке >3,0 мг/дл 1,5% против 2%; р=0,10), гиперкалиемии (>5,5 ммоль/л 16,1% против 17,3%; р=0,15; креатинин в сыворотке >6,0 ммоль/л 4,3% против 5,6%; р=0,07) и кашля (11,3% против 14,3%; р<0,001). Частота прекращения приема препаратов в связи с нежелательными явлениями составила 10,7% в группе LCZ696 и 12,3% в группе эналаприла (р=0,03). Преимущества LCZ696 наблюдались во всех предопределенных подгруппах.
Дальнейший анализ результатов PARADIGM-HF показал статистически значимые преимущества LCZ696 в отношении частоты ряда клинических проявлений у выживших пациентов и существенное улучшение качества жизни и общего клинического статуса [34].
Проведенное нами исследование — первый опыт применения LCZ696 у пациентов с ХСН со сниженной ФВ. В это исследование отбирались пациенты, получавшие стабильные дозы стандартной терапии ХСН, включая ингибиторы АПФ и β-адреноблокаторы. Назначение препарата 3 раза в сутки (такой же режим был использован затем в исследовании PARADIGM-HF) было выбрано для обеспечения стабильного 24-часового ингибирования неприлизина и снижения риска развития гипотонии. Ранее было продемонстрировано, что однократное применение LCZ696 в дозах 100, 200 и 400 мг обеспечивает системную экспозицию (площадь под кривой) к валсартану, эквивалентную экспозициям при применении валсартана в дозах 80, 160 и 320 мг соответственно, что совпадает с одобренными дозами для лечения ХСН [11]. Более низкая начальная доза LCZ696 могла быть выбрана врачом-исследователем на основании ранее принимаемых пациентом доз блокаторов РААС.
В целом прием LCZ696 100 мг 2 раза в сутки в течение 7 дней и 200 мг 2 раза в сутки в течение 14 дней хорошо переносился пациентами, включая переход с ранее принимаемого ингибитора АПФ. В ходе исследования не было зарегистрировано смертей или серьезных нежелательных явлений. Нежелательные явления регистрировались с равной частотой при использовании двух режимов дозирования: 53% в течение 7-дневного приема LCZ696 100 мг 2 раза в сутки и 50% — в течение 14-дневного периода приема удвоенной дозы. Исключены из исследования 3 пациента ввиду подтвержденного превышения предопределенного протоколом уровня калия 5,5 ммоль/л. Максимальная концентрация калия в сыворотке и ее прирост по сравнению с исходной составили у этих больных соответственно от 5,6 до 6,7 ммоль/л и от 0,9 до 1,2 ммоль/л. Исходно нарушенная функция почек имелась у 2 из 3 этих пациентов, 1 из них получал спиронолактон, что могло сыграть роль факторов, предрасполагающих к развитию гиперкалиемии. Не было зарегистрировано случаев ангионевротического отека. Снижение уровня АД в положении на спине и среднесуточного АД, зарегистрированное на 7-й день приема LCZ696, сохранялось и на 21-й день без дальнейшей динамики после удвоения дозы. Несмотря на сопутствующую терапию диуретиками и вазодилататорами (в том числе нитратами), которые сами могут быть причиной гиповолемии и гипотонии, не наблюдалось избыточного снижения АД на фоне терапии обеими дозами LCZ696.
Изменения биомаркеров в плазме и моче, которые наблюдались в ходе исследования, соответствуют механизму действия LCZ696. Увеличение концентрации цГМФ в плазме и моче и концентрации предсердного НУП в моче отражают ингибирование неприлизина. Такие же изменения этих биомаркеров отмечены и в предыдущих исследованиях [11, 30]. Более того, статистически значимое повышение концентрации цГМФ в плазме отмечалось в оба интервала дозирования, что указывает на эффективное ингибирование неприлизина и подтверждает правильность выбранного режима назначения 2 раза в сутки у пациентов с ХСН. Отсутствие существенных изменений уровня предсердного НУП в плазме мы склонны объяснить нестабильностью этого анализа и возможным анализом после истечения периода стабильность образцов ввиду технических погрешностей.
Ингибирование РААС при использовании LCZ696 подтверждалось повышением АРП и концентрации ренина в плазме, характерными для БРА [35].
Неприлизин опосредует деградацию предсердного НУП и НУП типа С [36], но не участвует в деградации NT-proBNP [37] — биомаркера, отражающего гемодинамическую нагрузку на сердце, и является хорошо документированным предиктором исходов у пациентов с ХСН. Раннее и стабильное снижение этого биомаркера отражает потенциальную гемодинамическую разгрузку левого желудочка при использовании LCZ696 [38].
Неприлизин участвует в деградации ряда других вазоактивных пептидов, в частности, ЭТ-1 и АТII [39, 40]. Если от повышения НУП, связанного с ингибированием неприлизина, ожидаются благоприятные сердечно-сосудистые и кардиоренальные эффекты, то потенциальное повышение уровней ЭТ-1 и АТII может оказать противоположное действие. Полученные данные демонстрируют, что прием LCZ696 в течение 21 дня пациентами с ХСН со сниженной ФВ ассоциирован с уменьшением уровня ЭТ-1. Это указывает на то, что опосредованная неприлизином деградация ЭТ-1 может не иметь клинического значения, или то, что продукция этого пептида может модулироваться восстановлением сосудистого гомеостаза или улучшением функции эндотелия при применении LCZ696. Концентрация АТII не измерялась в данном исследовании, однако потенциальное ее увеличение при ингибировании неприлизина дополнительно к ожидаемому от блокады АТ1-рецепторов является дополнительным обоснованием для двойного ингибирования этих механизмов путем применения LCZ696.
АМКР улучшают исходы при ХСН со сниженной ФВ [41]. LCZ696 снизил уровень альдостерона в плазме на 21% на 21-й день лечения. Поскольку как НУП, так и блокаторы РААС могут снижать уровень альдостерона, неясно, насколько полученный эффект отражает блокаду АТ1-рецепторов АТII или ингибирование неприлизина, или воздействие на обе системы.
В исследовании у больных АГ 8-недельное лечение как LCZ696 400 мг/сут, так и валсартаном 320 мг/сут ассоциировалось со снижением уровня альдостерона в плазме [42].
Таким образом, полученные данные предоставили важную информацию для понимания механизма действия и благоприятных последствий применения LCZ696 у больных с ХСН со сниженной ФВ, отмеченных в исследовании PARADIGM-HF.
Основным ограничением нашего исследования являются его открытый неконтролируемый дизайн и малый размер выборки, который не позволяет дифференцировать некоторые фармакодинамические эффекты ингибирования неприлизина и блокады АТ1-рецепторов АТII.
В зависимости от дозы ингибитора АПФ до начала исследования LCZ696 мог быть назначен в начальной дозе 50 или 100 мг 2 раза в сутки с обязательным повышением дозы до 200 мг 2 раза в сутки. У всех включенных пациентов начальная доза составила 100 мг 2 раза в сутки. В день перед первым назначением LCZ696 (–1-й день) пациенты не получали блокатор РААС.



