По данным литературы, ежегодные нефатальный инфаркт миокарда в общей популяции больных ишемической болезнью сердца (ИБС) развивается с частотой до 2,7% в год [1]. Практически все эти пациенты имеют клинические проявления мультифокального атеросклероза, сочетание с артериальной гипертонией и/или сахарным диабетом, метаболическим синдромом и психологическими диcтрессами. Основная нагрузка на амбулаторном этапе по приему таких пациентов лежит на участковом терапевте. Каждый раз участковому врачу приходится сталкиваться с проблемой оценки прогноза для жизни и здоровья пациентов с постинфарктным кардиосклерозом (ПИКС), оценки риска повторного события и потребности в реваскуляризации, обеспечения профилактики и лечения основного заболевания, его осложнений и сопутствующей патологии. Основа лечения больных с ПИКС — модификация устранимых факторов риска и комплексная медикаментозная терапия, направленная на улучшение прогноза [1]. Целью лечения больных с ПИКС в рамках диспансерного наблюдения является предотвращение прогрессирования хронической сердечной недостаточности (ХСН), улучшение качества жизни (КЖ), уменьшение количества госпитализаций и улучшение прогноза жизни [1]. Несмотря на то что существуют медицинские стандарты и протоколы ведения подобных пациентов, клинически значимой эффективности не всегда удается добиться, и поиск методик, улучшающих прогноз у данных больных, является крайне актуальным.
Почти 30 лет в нашей стране используется лекарственное средство милдронат — 3-(2,2,2-триметилгидразиний) пропионата дигидрат (мельдоний) — структурный аналог природного метаболита γ-бутиробетаина, который в условиях ишемии уменьшает поступление жирных кислот в цитозоль и митохондрии [2], тормозит β-окисление, уменьшает потребность клеток в кислороде [3], восстанавливает транспорт АТФ от митохондрии к цитозолю [4, 5]. Достаточный уровень энергосинтеза дает клеткам возможность поддерживать свой гомеостаз, морфологическую целостность [6].
Недостаток энергии возникает при любом варианте ИБС, изменяется структура и функция кардиомиоцитов, происходит развитие очагового и/или диффузного кардиосклероза и прогрессирование ХСН [7, 8].
С учетом изложенного была поставлена цель: оценить клиническую эффективность препарата милдронат (мельдоний) у больных в раннем постинфарктном периоде.
Материал и методы
Проведено открытое наблюдательное проспективное рандомизированное контролируемое сравнительное в параллельных группах исследование продолжительностью 12 нед. В исследование включены 67 пациентов в возрасте от 40 до 70 лет, перенесших ИМ, выписанных под амбулаторное наблюдение. Пациенты рандомизированы методом слепых конвертов в 2 группы: 1-я группа — 28 человек с Q-ИМ, 4 — с не-Q-ИМ), 2-я группа — 28 человек с Q-ИМ, 7 — с не-Q-ИМ).
Критериями включения являлись перенесенный ИМ и добровольно подписанное информированное согласие. Критериями исключения были декомпенсированные или нестабильные сопутствующие соматические заболевания; острые психические состояния; психические расстройства (деменция); злоупотребление алкоголем.
В амбулаторных условиях все пациенты продолжали получать дезагреганты (ацетилсалициловая кислота 100 мг), ингибиторы ангиотензинпревращающего фермента (периндоприл 5—10 мг), β-адреноблокаторы (бисопролол 5—20 мг), статины (симвастатин 40 мг), при необходимости — нитроглицерин в таблетках. При наличии сахарного диабета или метаболического синдрома выполнялись рекомендации эндокринолога. Пациенты 2-й группы дополнительно принимали милдронат по 500 мг 2 раза в день в течение 12 нед.
Исследование разрешено этическим комитетом ГБОУ ВПО «Омский государственный медицинский университет» Минздрава РФ.
Данные о состоянии пациентов были получены при физическом обследовании, проведении электрокардиографии, эхокардиографии (ЭхоКГ), холтеровском, или суточном мониторировании (СМ) электрокардиограммы (ЭКГ), велоэргометрической пробы, теста с 6-минутной ходьбой, СМ артериального давления (СМАД), общих анализов крови и мочи, уровня глюкозы в крови, показателей холестерина и его фракций. Для оценки уровня тревоги применяли личностную шкалу тревоги Teylor, адаптированную Т.А. Немчиновым [9]. КЖ изучали с помощью адаптированного русифицированного специализированного опросника — краткая форма оценки здоровья, разработанного на основе «Medical Outcomes Study-Short Form (MOS-SF-36) [10, 11].
Статистический анализ данных осуществляли с использованием пакетов Statistica-6, программы Microsoft Excel. Данные представлены в виде М±SD, где М – среднее арифметическое, SD – стандартное отклонение; в случае выявления распределения, отличного от нормального, указывались медиана и интерквартильный размах показателя [12, 13].
Результаты и обсуждение
Группы пациентов, включенных в исследование, были однородны. В 1-ю группу входили 32 человека, средний возраст 56,8±4,9, из них 21 мужчина, 26 больных с АГ. Во 2-ю группу были включены 35 пациентов, средний возраст 57,6±5,9 года, из них 24 мужчины, 27 с повышенным АД.
Больных беспокоили утомляемость, беспокойство, чувство страха, нарушение сна, головные боли, шум в ушах, головокружение, мелькание мушек перед глазами, снижение настроения без различий между группами. При использовании личностной шкалы Teylor у пациентов выявлялись симптомы тревоги различной степени тяжести. Количество пациентов с высоким уровнем тревоги в обеих группах статически не отличались и составило 52%.

Исследуемые жаловались на ангинозные приступы, снимающиеся таблетками нитроглицерина, без статистически значимых различий по группам. Частота ангинозных приступов стенокардии высоко коррелировала с уровнем тревоги (r=0,793; р=0,001).
При осмотре пациентов отмечалась высокая распространенность факторов риска развития сердечно-сосудистых заболеваний: отягощенный семейный анамнез у 92% всех пациентов обоего пола и всех возрастных категорий, курение у 62% мужчин и 6 женщин, ожирение у 54,6% мужчин и 74,4% женщин, гиподинамия у 64,5% мужчин и у 80% женщин. Из сопутствующих заболеваний определялись артериальная гипертензия, цереброваскулярные заболевания (4%), заболевания периферических сосудов (2,2%), хронические бронхиты (32%), язвенная болезнь (15%), сахарный диабет — СД(11%).
При объективном осмотре среди больных обеих групп преобладали пациенты гиперстенического телосложения с повышенным индексом массы тела больше 25 (70%).
При исследовании кожных покровов отмечались выраженная подкожная сосудистая сеть на лице (n=58), ксантелазмы (n=50), инъецированность склер (n=49). У 10% пациентов выявлялось увеличение щитовидной железы до I степени. При перкуссии легких определялся легочный звук с коробочным оттенком, при аускультации выслушивалось везикулярное дыхание и только у курящих — единичные сухие хрипы. Частота дыхательных движений составляла 21±2,5. Перкуторно границы сердца были смещены влево на 0,5—1,0 см от среднеключичной линии без существенных различий по группам. При выслушивании сердца определялось ослабление I тона, акцент II тона над аортой (n=35), систолический шум над верхушкой сердца (n=50). При пальпации органов брюшной полости отмечалось увеличение живота за счет подкожного жирового слоя без увеличения границ печени. Периферических отеков не фиксировалось.
У большинства больных имелись тахикардия, высокие цифры офисного систолического АД (САД) и диастолического АД (ДАД) (табл. 1). Полученные данные высоко коррелировали с уровнем тревоги пациентов (r=5,6; р<0,05 и r=6,1; р<0,05).
Показатели, полученные при лабораторном обследовании, находились в пределах возрастных и половых норм и статически значимо не различались между группами. Однако в 84% случаев были выявлены отклонения липидного состава крови с повышением уровня общего холестерина (ОХС), холестерина (ХС) липопротеидов низкой плотности (ЛНП), триглицеридов, со снижением уровня ХС липопротеидов высокой плотности (ЛВП) без статистически значимых различий по группам. Уровень глюкозы в крови у пациентов с СД колебался от 6,2 до 7,1 ммоль/л.
При анализе ЭКГ фиксировались (n=4) нарушения проводимости (АВ-блокады I степени, неполная блокада правой или левой ножки пучка Гиса), выявлялись изменения конечной части желудочковых комплексов, признаки гипертрофии миокарда левых отделов сердца (1-я группа —73,8%, 2-я группа — 73%) без статически значимых различий по группам.
По данным СМ ЭКГ фиксировались нарушения ритма в виде предсердных экстрасистол, пароксизмальных нарушений ритма сердца, эпизоды депрессий сегмента ST (табл. 2).
При анализе показателей вариабельности ритма сердца (ВРС) исходно у пациентов обеих групп выявлялись снижение SDNN и уменьшение доли больных с SDNN <50 мс (табл. 3). Это свидетельствует о повышении активности симпатической нервной системы, что является прогностически неблагоприятным признаком возникновения опасных аритмий и внезапной смерти [7, 14].
По данным морфометрических показателей ЛЖ и центральной гемодинамики (ЭхоКГ), у пациентов 1-й и 2-й групп отмечалось увеличение конечного систолического и конечного диастолического размеров, массы миокарда (ММ), индекса массы миокарда (ИММ), снижение фракции выброса левого желудочка (ФВ ЛЖ), склерогенные изменения клапанного аппарата сердца в различной степени выраженности без статистически значимых различий по группам.
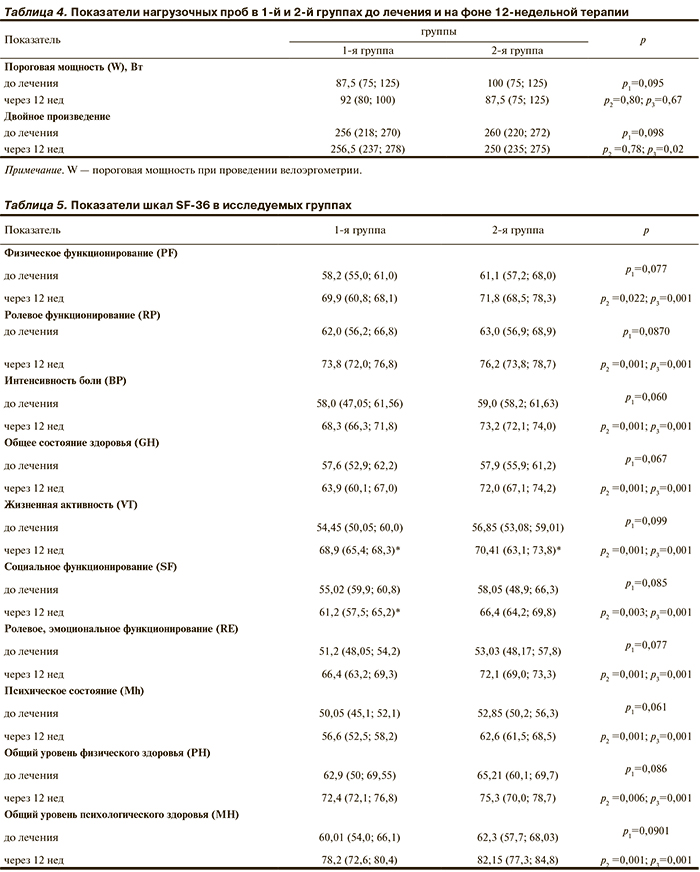
Показатели нагрузочных проб, тест с 6-минутной ходьбой в обеих группах показали снижение переносимости физической нагрузки без различий по группам (табл. 4).
При анализе показателей КЖ, полученных в ходе обработки опросника SF-36, у больных в раннем постинфарктном периоде отмечалось снижение показателей социального функционирования (SF), интенсивности боли (BP), ролевого эмоционального функционирования (RE), психического состояния (Mh), общего уровня психологического здоровья (MH), шкалам жизненной активности (VT), общего уровня состояния здоровья (GH), общего уровня физического здоровья (PH) (табл. 5).
К концу 12-й недели наблюдения у всех пациентов уменьшилось количество жалоб на головную боль, утомляемость, нарушение сна, мелькание мушек перед глазами, шум в ушах, головокружение (p<0,05).
При оценке уровня тревоги через 12 нед лечения получено статистически значимое снижение тревоги в обеих группах: 1-я группа до лечения 41,2 (25,5; 50,0) балла, после лечения 35,0 (24; 35) балла, 2-я группа до лечения 39,7 (31,5; 45,5) балла, после лечения 13,5 (10,0; 18,5) балла (р=0,001). Однако в группе стандартной терапии при положительной динамике уровень тревоги по-прежнему соответствовал высокому, а в группе комбинированной терапии достиг низкого (р=0,001).
В группе комбинированной терапии с добавлением мельдония (милдроната) уменьшилось количество жалоб на загрудинные боли и количество принимаемых таблеток нитроглицерина в неделю (р<0,001).
Объективный статус пациентов оставался прежним, однако отмечалось достоверное снижение частоты сердечных сокращений (ЧСС), САД и ДАД в обеих группах (см. табл. 1).
В результате проведенной терапии у больных были достигнуты целевые уровни АД и ЧСС, при этом более выраженные результаты получены в группе комбинированной терапии с мельдонием.
На фоне лечения у пациентов достигнуто снижение уровня ОХС: 1-я группа до лечения 5,6 (5,3; 7,7) ммоль/л, после лечения 4,6 (4,3; 6,1) ммоль/л; 2-я группа до лечения 5,8 (5,1; 7,5) ммоль/л, после лечения 4,5 (4,1; 6,0) ммоль/л. Достоверное снижение концентрации ЛНП в обеих группах: 1-я группа до лечения 3,8 (3,6; 4,8) ммоль/л, после лечения 2,5 (1,8; 3,1) ммоль/л, 2-я группа до лечения 3,7 (3,65; 4,55) ммоль/л, после лечения 2,3 (1,7; 2,9) ммоль/л (р=0,001). Подобная динамика отмечалась при наблюдении за уровнем триглицеридов: 1-я группа до лечения 2,3 (1,6; 3,0) ммоль/л, после лечения 1,65 (1,6; 2,4) ммоль/л, 2-я группа до лечения 2,2 (1,6; 2,7) ммоль/л, после лечения 1,60 (1,4; 2,5) ммоль/л (р=0,001). При этом достигнуто достоверное увеличение концентрации ЛВП: 1-я группа до лечения 0,98 (0,94; 1,3) ммоль/л, после лечения 1,2 (1,0; 1,5) ммоль/л; 2-я группа до лечения 0,98 (0,93; 1,45) ммоль/л, после лечения 1,2 (0,99; 1,3) ммоль/л (р=0,002).
Анализ результатов СМ ЭКГ выявил достоверное снижение частоты депрессий сегмента ST, эпизодов нарушений возбудимости и проводимости с лучшими результатами во 2-й группе (см. табл. 2).
Включение мельдония в состав базисной терапии у больных ИБС в раннем постинфарктном периоде сопровождалось увеличением как средних значений SDNN, так и уменьшением долей больных с SDNN <50 мс (см. табл. 3) с достоверными различиями во 2-й группе.
По результатам нагрузочных проб через 12 нед на фоне терапии возросла переносимость физической нагрузки с достоверной выраженностью во 2-й группе (табл. 4).
При ЭхоКГ-контроле все показатели имели положительную тенденцию. Особенно важно подчеркнуть сохранение ММ ЛЖ, ИММ ЛЖ и ФВ ЛЖ у пациентов в раннем постинфарктном периоде за 12 нед наблюдения. ММ: 1-я группа до лечения 178,0±15,0 г, после лечения 208,0±14,0 г; 2-я группа до лечения 201,0±11,0 г, после лечения 220,0±18,0г; ИММЛЖ: 1-я группа до лечения 108,0±15,0 г/м2, после лечения 122,0±9,0 г/м2; 2-я группа до лечения 104,0±5,0 г/м2, после лечения 117,0±4,0 г/м2; ФВ: 1-я группа до лечения 56,1±6,4%, после лечения 61,1±5,4%; 2-я группа до лечения 55,9±3,8%, после лечения 64,6±4,9%.
При оценке толерантности к физической нагрузке по группам получено достоверное увеличение пройденного расстояния в течение 6 мин: 1-я группа до лечения 312,5±8,56 м, после лечения 382,4±10,2 м; 2-я группа до лечения 335,7±7,42 м, после лечения 395,7±9,43 м (р=0,001). Однако показатели функционального класса (ФК) СН как до лечения (1-я группа 2,37±0,6; 2-я группа 2,18±0,6), так и после лечения (1-я группа 2,15±0,12; 2-я группа 2,01±0,24) имели только положительную направленность.
Несомненно, что снижение тревожности, уменьшение жалоб, увеличение физических возможностей не могло не сказаться на оценке пациентами своего здоровья (см. табл. 5).
Как видно из приведенной таблицы, все показатели КЖ на фоне лечения достоверно увеличились с максимальной выраженностью у пациентов, получавших комбинированную терапию с мельдонием.
По данным D. Osoba (2000), для опросников, в которых оценки по шкалам варьируют от 0 до 100 баллов, клинически значимыми считаются различия равные 10% или больше от исходной величины за период не менее 4 нед. У пациентов, пролеченных с использованием мельдония, все показатели увеличились от 14 до 24%. Особенно следует отметить показатель GH, характеризующий оценку больными своего общего состояния здоровья в настоящий момент и перспектив лечения. В группе стандартной терапии этот показатель увеличился на 18% (p=0,003), а во 2-й группе — на 20% (р=0,002).
Обсуждение
В результате лечения зарегистрировано снижение уровня тревожности пациентов на фоне комбинированной терапии, что свидетельствует об увеличении адаптивных, антистрессовых возможностей у пролеченных больных. Подобные эффекты могут быть связаны с нормализацией экспрессии белков нейродегенерации, воспаления и апоптоза, влияния на холинергическую передачу нервных импульсов при восполнении энергозатрат нервными клетками [15, 16].
Известно, что постинфарктный период у людей с высоким уровнем тревожности протекает гораздо тяжелее, чаще отмечается атипичная клиническая картина, более низкая эффективность базисной терапии и неблагоприятный прогноз [17, 18].
Смертность этих больных в 2—6 раз выше, чем в общей популяции [19, 20]. Полученное снижение уровня тревожности пациентов является благоприятным прогностическим фактором течения ИБС.
На фоне комбинированной терапии с мельдонием достигнуты целевые уровни ЧСС, снижение АД. Полученные результаты свидетельствует о снижении напряженности механизмов психологической защиты и улучшении психологической адаптации больных к перенесенному стрессу [21, 22]. Кроме того, в работах других авторов указывается, что мельдоний усиливает действие β-адреноблокаторов, антигипертензивных средств и вазодилататоров [1, 2]. Известно, что ЧСС и показатели АД напрямую связаны с прогнозом у больных ИБС [23, 24].
На фоне комбинированной терапии с мельдонием установлено увеличение ВРС, уменьшение эпизодов нарушений ритма, что подтверждает нормализацию вегетативного статуса больных [6, 11]. На фоне торпидности ВСР чаще возникают фатальные нарушения деятельности сердца [25, 26]. Снижение частоты нарушений ритма сердца у пациентов группы лечения с мельдоноием свидетельствует о поддержании электрической стабильности миокарда, является благоприятным по прогнозу развития фибрилляции желудочков и внезапной смерти [5].
В группе пациентов, получавших мельдоний в дополнение к стандартной терапии ИБС, статистически значимо улучшались показатели липидного состава крови, что, по-видимому, связано с увеличением физических возможностей пациентов этой группы. Достижение целевого уровня ХС ЛНП уменьшает число повторных ИМ, нестабильной стенокардии и смерти на 25—40% [27, 28].
Очень важным, с нашей точки зрения, является сохранение ММ и ФВ ЛЖ у пациентов на фоне комбинированной терапии в раннем постинфарктном периоде. Клинические и экспериментальные исследования в постинфарктном периоде показали, что при лечении мельдонием потеря мышечной массы стенки ЛЖ существенно уменьшается [5, 29]. Потеря мышечной ММ напрямую связана с прогрессированием СН [30—32]. Отдаленный прогноз жизни у больных ХСН с сохраненной систолической функцией ЛЖ лучше, чем при ХСН со сниженной ФВ [33].
При введении к рекомендованной терапии ПИКС мельдонием в дозе 1000 мг/сут уменьшалось количество приступов стенокардии в неделю, количество эпизодов депрессий сегментов ST при СМ ЭКГ, увеличивался показатель двойного произведения при проведении нагрузочных проб, возрастало расстояние по результатам теста с 6-минутной ходьбой. Полученные результаты, по-видимому, обусловлены использованием энергетически выгодной пировиноградной кислоты в цикле Кребса за счет восстановления равновесия процессов доставки кислорода и его потребления, предупреждения нарушения транспорта АТФ, устранения накопления токсичных продуктов обмена.
В опубликованных ранее исследованиях [34] также были выявлены антиишемический эффект мельдония на фоне стандартной терапии стабильной стенокардии напряжения, подтвержденные данными велоэргометрии и перфузионной сцинтиграфии. Любая ишемия миокарда вызывает развитие кардиосклероза, ремоделирование сердца с появлением и прогрессированием ХСН [7, 8]. Уменьшение частоты развития ишемии, полученной в нашем исследовании при добавлении мельдония к стандартной терапии ИБС, улучшает прогноз по формированию ХСН в постинфарктном периоде. Механизм действия комбинированной терапии, по-видимому, связан с улучшением энегрообеспечения кардиомиоцитов [15, 16]. При изучении проявлений СН в отдаленном постинфарктном периоде отмечено уменьшение числа больных с тяжелыми проявлениями СН при применении милдроната [35]. Эти данные согласуются с достоверной динамикой СН в многоцентровом двойном слепом плацебо-контролируемом исследовании «Милосердие» [36]. В нем показано увеличение числа пациентов с ХСН I ФК до 63—78% на фоне 6-недельной непрерывной терапии мельдонием [37]. Аналогичные данные были получены М.Е. Стаценко и соавт. (2003), которые продемонстрировали достоверное снижение ФК СН на протяжении 12 нед лечения мельдонием в дозе 1,0—1,5 г в составе базовой терапии по сравнению с группой пациентов, не получавших милдронат [38]. Полученные результаты подтверждают целесообразность включения метаболического препарата мельдоний в программу комплексного лечения больных с ХСН с сохраненной систолической функцией ЛЖ [36].
Наши результаты продемонстрировали достоверные изменения показателей КЖ больных через 12 нед лечения, особенно в группе комбинированной терапии с мельдонием. Отмечено повышение толерантности к физической нагрузке, увеличение социальной активности, энергичности, а также улучшение общего психического состояния и суммарной оценки здоровья, что согласуется с данными других исследований [35, 39].
Параметры КЖ являются более значимыми независимыми прогностическими факторами в отношении выживаемости больного, чем общесоматический статус [40—42]. Кроме того, оценка КЖ имеет большое значение при экспертизе лекарственных средств, так как с позиции фармакоэкономики наиболее выгодными являются средства, улучшающие КЖ пациентов [43, 44].
В рамках обсуждения полученных результатов важно указать на отсутствие побочных эффектов за время наблюдения пациентов при использовании препарата мельдоний (милдронат), что согласуется с другими данными литературы [6, 45—48]. Учитывая, что полученные результаты полностью удовлетворяют цели лечения больных с ПИКС в рамках амбулаторного наблюдения, необходимо инициировать действия к принятию решений о включении цитопротектора мельдония в стандарт лечения пациентов в постинфарктном периоде.



