Известно, что гипертрофия миокарда левого желудочка (ГЛЖ) у больных артериальной гипертензией (АГ) достоверно повышает риск развития сердечно-сосудистых осложнений, в частности сердечной недостаточности (СН).
На начальных этапах развития ГЛЖ при АГ сохраняется нормальная архитектоника миокарда, так как вслед за увеличивающимися в размере кардиомиоцитами увеличивается и количество сосудов микроциркуляторного русла [1].
Но затем относительная плотность капиллярной сети снижается, наступает несоответствие между количеством сосудов микроциркуляторного русла и размером кардиомиоцитов, что приводит к хронической гипоксии миокарда [1—3].
Фактор роста эндотелия сосудов (vascular endothelial growth factor —VEGF) — сигнальный белок, играющий ключевую роль в регуляции ангиогенеза. Процесс ангиогенеза у взрослого человека происходит в течение всей жизни, когда появляется необходимость в дополнительной васкуляризации.
У человека установлено 5 вариантов VEGF: A, B, C, D и плацентарный фактор роста. Самым распространенным и изученным является VEGF-A. Он запускает неоангиогенез, повышает проницаемость сосудов, приводит к миграции клеток, а также препятствует апоптозу клеток эндотелия [4].
Ген VEGF-A кодирует синтез различных по длине белковых молекул VEGF-A. Так, число аминокислот в молекуле VEGF-A может быть равным 121, 145, 165, 183, 189 и 206 [5]. Большинство молекул VEGF-A165 привязаны к клеточным поверхностям и экстрацеллюлярному матриксу, но часть из них в свободной форме находится в кровотоке [6]. Вероятно поэтому, именно данная изоформа наиболее активна и приспособляема при различных физиологических и патологических состояниях, а также перспективна в качестве биомаркера периферической крови.
 Накоплено достаточно данных в исследованиях in vitro и на животных, проясняющих молекулярные механизмы развития гипертрофии и ремоделирования миокарда при АГ. Доказано независимое негативное влияние появления гипертрофии миокарда на прогноз у больного АГ. Теперь требуется выработка стратификационного подхода к пациенту с ГЛЖ, в котором использовались бы не только визуальные методы оценки, но и биохимические маркеры гипертрофии.
Накоплено достаточно данных в исследованиях in vitro и на животных, проясняющих молекулярные механизмы развития гипертрофии и ремоделирования миокарда при АГ. Доказано независимое негативное влияние появления гипертрофии миокарда на прогноз у больного АГ. Теперь требуется выработка стратификационного подхода к пациенту с ГЛЖ, в котором использовались бы не только визуальные методы оценки, но и биохимические маркеры гипертрофии.
Несмотря на обширные экспериментальные данные, демонстрирующие вовлеченность VEGF в процессы развития и декомпенсации гипертонического сердца [1, 7, 8], подобных клинических исследований у пациентов с АГ и ГЛЖ не проводилось.
Целью нашей работы было изучение взаимосвязи уровня VEGF-A165 в периферической крови у больных АГ с ГЛЖ и СН.
Материал и методы
Обследованы 47 больных с установленным при эхокардиографии (ЭхоКГ) утолщением стенок левого желудочка (ЛЖ).
К ним подобрана группа контроля из 47 человек с нормальной толщиной стенок ЛЖ, сопоставимых по возрасту и полу.
Больные находились на стационарном лечении в кардиологическом отделении ГБУЗ «Городская клиническая больницы №17» ДЗ Москвы. ГЛЖ диагностировалась при ЭхоКГ.
Критериями включения были толщина миокарда ЛЖ 16 мм и более, отсутствие патологии (крупноочагового инфаркта миокарда или миокардита в анамнезе), приводящей к нарушению локальной сократимости миокарда ЛЖ или снижению фракции выброса (ФВ) ЛЖ, согласие больного на использование данных в научных целях. В исследование не включали больных с клинически значимой клапанной патологией, а также больных с онкопатологией в течение 5 лет до включения.
Трансторакальную ЭхоКГ проводили на ультразвуковом аппарате с мультичастотным фазированным датчиком 3S-RS (1,7—4,0 МГц). Основные позиции двухмерного изображения записывались из парастернального доступа по длинной и короткой осям и верхушечного доступа на 2 (А2С), 4 (А4С) камеры и по длинной оси (LAX). В дальнейшем применялся стандартный протокол исследования, рекомендованный Американской ассоциацией ЭхоКГ [9]. Определение конечного диастолического (КДО) и конечного систолического (КСО) объемов ЛЖ, а также КСО левого предсердия (ЛП) проводили методом дисков, расчет ФВ ЛЖ по формуле: ФВ ЛЖ=(КДО-КСО)/КДО×100%.
Масса миокарда ЛЖ рассчитывалась по формуле Devereux: 0,8×[1,04×(МЖП+КДР+ЗСЛЖ)3-КДР3]+0,6, где КДР — конечный диастолический размер ЛЖ, МЖП — толщина межжелудочковой перегородки в диастолу, ЗСЛЖ — толщина задней стенки ЛЖ в диастолу.
Индекс массы миокарда ЛЖ рассчитывали путем деления на площадь поверхности тела, которую рассчитывали по формуле Дюбуа и Дюбуа: (масса тела [кг])0,425×(рост [см])0,725/139,2.
Диастолическую функцию ЛЖ оценивали с помощью тканевого допплера движения фиброзного кольца митрального клапана в латеральной позиции (пик E′) и отношения пика Е трансмитрального кровотока к пику E′. Наличие диастолической дисфункции ЛЖ констатировали при E′<10 см/с и Е/E′>8.
Систолическую функцию ЛЖ оценивали, помимо ФВ ЛЖ, по скорости пика S′ тканевого допплера движения фиброзного кольца митрального клапана в латеральной позиции. Наличие систолической дисфункции ЛЖ определяли при S′<6 см/с.
Наличие АГ устанавливали на основании данных анамнеза, а также приема антигипертензивных препаратов либо выявляли впервые по результатам офисных измерений, если артериальное давление (АД) превышало 140 мм рт.ст. для систолического (САД) или 90 мм рт.ст. для диастолического (ДАД).
Статус курения присваивали в случае, если больной курил на момент включения в исследование или ранее, а к моменту включения в исследование отказался от него.
 Инсульт в анамнезе устанавливали по данным предшествующих госпитализаций, подтверждали методами визуализации, а в отсутствие последних уточняли при указании на наличие очаговой симптоматики в анамнезе или осмотре больного. Во многих случаях природу инсульта установить было невозможно.
Инсульт в анамнезе устанавливали по данным предшествующих госпитализаций, подтверждали методами визуализации, а в отсутствие последних уточняли при указании на наличие очаговой симптоматики в анамнезе или осмотре больного. Во многих случаях природу инсульта установить было невозможно.
Сахарный диабет (СД) выявляли по результатам анализа крови с определением уровня глюкозы натощак либо факту приема гипогликемических препаратов.
Под мерцательной аритмией в анамнезе принимали все формы аритмии: постоянную, персистирующую или пароксизмальную (по данным выписных эпикризов), либо бессимптомную (по данным суточного мониторирования электрокардиограммы длительностью не менее 30 с).
Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле MDRD (Modification of Diet in Renal Disease Study): СКФ*=186×(креатинин сыворотки, мкмоль/л)×0,0113-1,154 (возраст, годы)-0,203. * — для женщин результат умножали на 0,742.
Определение уровня VEGF-А165 в крови. Образцы крови брали из локтевой вены системой Vacutainer натощак ≥8 ч. После центрифугирования сыворотку переносили в транспортные пробирки и замораживали при температуре ниже -20 °С. Уровень VEGF-A165 определяли с помощью тестов BioSource International, основанных на методе «сэндвич» твердофазного иммуноферментного анализа.
Статистическая обработка. Полученные данные обрабатывали с использованием статистической программы SPSS 21.0.
Данные по протяженным величинам представляли в виде среднее значение±стандартное отклонение (M±SD). Распределение всех переменных считали ненормальным и сравнение средних величин проводили с использованием критерия Манна—Уитни. Дискретные величины сравнивали по χ2-критерию Пирсона. Для всех видов анализа статистически значимыми считали различия при р<0,05.
Результаты
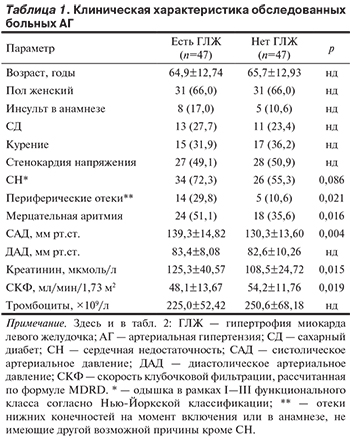
В группе больных ГЛЖ средний возраст составил 64,9 года. Женщины составляли 66%. У 100% больных ГЛЖ имелась АГ.
У 17% пациентов в анамнезе был инсульт, у 27,7% — СД, 31,9% курили на момент включения либо ранее (табл. 1).
В группе контроля без ГЛЖ средний возраст составил 65,7 года. У 100% больных имелась АГ, у 10,6% в анамнезе был инсульт, у 23,4% — СД, 36,2% курили на момент включения или ранее. Статистически значимые различия по этим показателям между группами отсутствовали (см. табл. 1).
Сравнение по клиническим характеристикам групп больных АГ с ГЛЖ и больных контрольной группы выявило следующие различия: привычные уровни САД были выше у больных АГ с ГЛЖ (р=0,004). У них также чаще регистрировалась мерцательная аритмия (р=0,016), выше был уровень креатинина в сыворотке крови (р=0,015) и ниже СКФ (р=0,019).
Важной характеристикой двух групп явилось отсутствие статистически значимых различий по числу тромбоцитов в крови, так как это могло независимо повлиять на концентрацию VEGF в сыворотке крови и скомпрометировать результаты работы.
Число больных с жалобами на стенокардию напряжения (49,1% против 50,9%) не различалось. В то же время больных с клиническими признаками СН было больше в группе ГЛЖ, хотя статистическая значимость данного различия не была достигнута, вероятно, из-за недостаточного числа больных (72,3% против 55,3%; р=0,086). Больных с признаками застойной СН (периферические отеки) было также достоверно больше в группе ГЛЖ (29,8% против 10,6%; р=0,021; см. табл. 1).
По данным ЭхоКГ в группе ГЛЖ помимо предусмотренных критерием включения различий в толщине стенок ЛЖ и массе миокарда были меньше КДО ЛЖ (р<0,0001), больше КСО ЛП (р<0,0001), имелась диастолическая дисфункция (пик Е′= 6,6 см/с, E/E′=12,9). Систолическая функция была на пограничных значениях (пик S′=6,6 см/с). У больных без ГЛЖ диастолическая и систолическая функции ЛЖ были сохранены (пик Е′=10,3 см/с, E/E′=7,5, пик S′=8,7 см/с; табл. 2).
 Уровень VEGF-A165 в сыворотке крови оказался достоверно ниже в группе больных ГЛЖ по сравнению с группой контроля (273,3±41,75 пг/мл против 426,6±50,00 пг/мл; р=0,016). Уровень VEGF-A165 у больных ГЛЖ и СН III функционального класса (ФК) по Нью-Йоркской классификации составил 140,4±51,49 пг/мл, что высоко достоверно отличалось от уровня VEGF-A165 у больных без ГЛЖ (p<0,001; см. рисунок).
Уровень VEGF-A165 в сыворотке крови оказался достоверно ниже в группе больных ГЛЖ по сравнению с группой контроля (273,3±41,75 пг/мл против 426,6±50,00 пг/мл; р=0,016). Уровень VEGF-A165 у больных ГЛЖ и СН III функционального класса (ФК) по Нью-Йоркской классификации составил 140,4±51,49 пг/мл, что высоко достоверно отличалось от уровня VEGF-A165 у больных без ГЛЖ (p<0,001; см. рисунок).
Таким образом, в нашей группе больных АГ уровень VEGF-A165 оказался статистически значимо ниже у больных с ГЛЖ и еще более низким при сочетании ГЛЖ и СН.
Обсуждение
Более высокая распространенность мерцательной аритмии, сниженная функция почек, наличие эхокардиографических признаков диастолической и систолической дисфункций миокарда ЛЖ подтверждают негативное влияние ГЛЖ на течение АГ.
Мы специально отбирали больных с выраженной ГЛЖ (16 мм и более), чтобы повысить вероятность выявления различий в уровне VEGF в периферической крови. Полученные нами более низкие уровни VEGF-A165 в сыворотке у больных ГЛЖ мы объясняем временнóй стадийностью процессов неоангиогенеза и ремоделирования при ГЛЖ. Это согласуется с данными экспериментальных исследований на животных, в которых оценивался уровень экспрессии VEGF в миокарде с течением времени при развитии индуцированной гипертрофии.
Так, в работе на белых крысах, которые подвергались вдыханию угольной пыли в течение 12 нед, изучали уровень VEGF в сыворотке с одновременным гистологическим исследованием миокарда на каждой неделе эксперимента. К концу 1-й недели регистрировался высокий уровень VEGF, превышающий уровень в контрольной группе крыс в 1,7 раза. При этом структура кардиомиоцитов оставалась сохранной. На 3-й неделе вдыхания угольной пыли уровень VEGF оставался повышенным в 1,2 раза. Гистологически фиксировались признаки повышенной проницаемости сосудистой стенки. К 6-й неделе произошло резкое (в 1,5 раза по сравнению с контролем) снижение уровня VEGF, что сопровождалось признаками дисфункции эндотелия и начальным апоптозом кардиомиоцитов. На 9-й неделе уровень VEGF в сыворотке крови сохранялся ниже контрольных значений почти в 1,5 раза, что, по мнению авторов, было связано с усилением апоптотической активности клеток, выраженной дисфункцией эндотелия, развитием периваскулярного фиброза и, как следствие, снижением секреторной способности миокарда [10].
В другой работе морфометрия миокарда и оценка экспрессии VEGF у мышей на всех стадиях развития ГЛЖ показали следующее: в первые 14 дней после перевязки аорты сократительная способность миокарда ЛЖ оставалась сохранной, увеличивались размер кардиомиоцитов и количество микрососудов, а также экспрессия VEGF.
С 15-го дня эксперимента наблюдались значительное снижение сократимости миокарда ЛЖ, расширение полости ЛЖ, усиление фиброза, снижение относительного количества микрососудов и экспрессии VEGF [1].
Изменение уровня экспрессии VEGF в миокарде по мере развития и декомпенсации ГЛЖ имеет молекулярное объяснение. В сердце, подвергающемся перегрузке давлением, миокард ишемизируется и значительно повышается уровень индуцируемого гипоксией фактора 1-го типа (hypoxia-inducible factor — Hif-1) — важного регулятора антигипоксических ответов. Hif-1 активирует транскрипцию сотен генов, тем или иным образом связанных с доставкой кислорода и адаптацией тканей к ишемии, в числе которых VEGF [11]. При длительно существующей гипоксии транскрипторная активность Hif-1 может подавляться накапливающимся белком р53 [1]. Белок р53 (опухолевый супрессор р53), содержащийся во всех клетках организма и в норме находящийся в неактивном состоянии, при повреждении ДНК вследствие длительного или интенсивного стресса запускает остановку клеточного цикла вплоть до апоптоза, тем самым препятствуя развитию опухолей. Таким образом, с течением времени клетки гипертрофированного миокарда, подвергаясь стрессу, накапливают р53. В определенный момент времени этот белок активизируется, чтобы предотвратить неконтролируемый рост ставших патологическими клеток миокарда. Активация р53 ингибирует Hif-1, что приводит к снижению стимуляции экспрессии VEGF.
В клинической практике фиксация момента снижения уровня VEGF может оказаться ранним маркером начала развития СН у больных ГЛЖ.
В работе Е.Н. Березиковой и соавт. изучались уровни VEGF в сыворотке крови больных ишемической СН различных ФК [12].
Так, у мужчин/женщин с II ФК уровень VEGF был равен 331,7/333,8 пг/мл, с III ФК — 251,3/201,8 пг/мл, а с IV ФК 136,2/172,0 пг/мл. Очевидно, уровень VEGF в нашей работе у больных ГЛЖ сопоставим с уровнями VEGF у больных СН II и III ФК в работе Е.Н. Березиковой. В то же время обращает на себя внимание еще более низкий уровень VEGF в сыворотке крови у больных СН IV ФК, каковых в нашей работе не было, и достаточно высокие уровни VEGF у наших больных без ГЛЖ, оказавшихся самыми «легкими».
Таким образом, изменение концентрации VEGF у человека в процессе ремоделирования миокарда ЛЖ отражает стадию процесса, при этом сначала происходит ее повышение, а затем снижение.
В 2013 г. были опубликованы результаты Фрамингенского 10-летнего проспективного исследования, включившего 3440 больных в возрасте 65±11 лет, в котором была показана независимая прогностическая роль повышенного уровня VEGF в сыворотке крови в развитии инсульта/транзиторной ишемической атаки (1,21 при 95% доверительном интервале от 1,04 до 1,40; p=0,012), в том числе ишемического (p=0,04). Добавление уровня VEGF к классической Фрамингемской шкале риска развития инсульта привело к значительному повышению ее прогностической ценности [13].
Для того чтобы установить пороговые уровни VEGF для различных стадий ГЛЖ и начать использовать уровень VEGF в периферической крови в качестве маркера развития СН у пациентов с ГЛЖ, необходимо проведение популяционных проспективных исследований. Но уже сейчас по результатам проведенных исследований, в том числе нашей работы, можно констатировать, что в отсутствие онкопатологии этот белок, а точнее начало снижения его уровня, может стать сигналом декомпенсации «гипертонического сердца» и необходимости интенсификации антигипертензивной и, возможно, другой антигипертрофической и антисклеротической терапии.
Ограничения работы. Концентрации VEGF были измерены в периферической крови, но не были соотнесены с экспрессией этого белка в миокарде, что затруднительно в исследованиях у человека. Таким образом, заключение о снижении концентрации VEGF в сыворотке в процессе развития гипертрофии миокарда при АГ у человека основано на косвенных доказательствах: математических корреляциях и анализе данных предыдущих экспериментальных работ на животных. Мы использовали сыворотку для определения уровня VEGF, а не плазму. Использование плазмы, по данным ряда авторов, могло бы повысить точность определения уровней VEGF [14, 15].
Вывод
Наличие гипертрофии левого желудочка и сердечной недостаточности у больных артериальной гипертензией ассоциируется с более низкими уровнями фактора роста эндотелия сосудов (VEGF-A165) в периферической крови.



