Хроническая сердечная недостаточность (ХСН) — одно из наиболее распространенных и прогностически неблагоприятных заболеваний с вовлечением в эту патологию 2—4% всего населения. По данным исследования ЭПОХА-ХСН, распространенность ХСН в Российской Федерации составляет 7% [1, 2]. Несмотря на достигнутый значительный прогресс в диагностике и лечении ХСН, смертность при этой патологии остается высокой: 12% за 1 год и 36% за 3 года [2—4]. Ввиду неблагоприятного течения и высокой смертности пациентов с ХСН большое значение придается роли различных многообразных патогенетических факторов в прогнозировании характера течения и исходов этого заболевания. Раскрытие патогенетических звеньев с новых теоретических позиций и определение нетрадиционных факторов риска развития ишемической болезни сердца — ИБС (наряду с такими факторами риска, как гиперхолестеринемия, артериальная гипертония — АГ, курение, сахарный диабет — СД 2-го типа), влияющих на клиническую картину и прогноз ХСН, стимулирует поиск новых эффективных направлений в кардиологии, касающихся ранней диагностики, профилактики и лечения декомпенсации сердца с использованием как ранее известных, так и вновь открытых молекулярных и клеточных мишеней для эффективного воздействия лекарственных средств. В связи с этим актуальной задачей является определение надежных предикторов сердечно-сосудистых осложнений (ССО), доступных для широкой клинической практики, позволяющих выявить пациентов с высоким риском развития ССО для целевой более активной вторичной медикаментозной профилактики и хирургической коррекции соответствующей патологии.
В настоящее время показана высокая прогностическая значимость жесткости артериальной стенки (ЖАС) в качестве нового независимого предиктора и фактора риска развития ССО у больных ИБС, АГ, СД 2-го типа, терминальной стадией болезни почек, у пожилых пациентов и в общей популяции [5—8].
Патофизиологические и клинические последствия повышенной ЖАС следует рассматривать во взаимосвязи с состоянием насосной функции сердца, отражающей взаимодействие между сердцем и артериальной системой, так называемое сердечно-сосудистое сопряжение (ССС) [9]. Опубликованы единичные работы, подтверждающие клиническое значение ССС [9, 10] у пациентов с ИБС и при развитии ХСН.
Для оценки ССС по данным эхокардиографии (ЭхоКГ) вычисляют отношение эффективной артериальной эластичности (Еа) к конечно-систолической эластичности ЛЖ (Es) на основе анализа кривой объем—давление левого желудочка (ЛЖ).
В последние годы в литературе представлены убедительные доказательства надежности использования натрийуретического пептида B-типа (BNP) в качестве раннего независимого биомаркера дисфункции миокарда и сердечной недостаточности (СН). BNP и N-концевой proBNP высвобождаются из кардиомиоцитов предсердий и желудочков сердца в ответ на механическое растяжение миокарда и увеличение трансмурального давления [11—14]. Уровни BNP и NT-proBNP, установленные как у больных острым ИМ, так и у пациентов со стабильной ИБС, показали большую прогностическую значимость, существенно превышающую таковую тропонинов. Однако прогностическая значимость и клиническое значение CCC с определением экспрессии NT-proBNP , а также связь таковых с риском развития ССО у особой когорты пациентов с постинфарктной дисфункцией миокарда при развитии ХСН не определена.
Цель исследования — определить клиническую значимость CCC.
Материал и методы
Критерии включения в исследование: наличие клинических симптомов ХСН II—IV ФК по NYHA, развившихся после перенесенного Q-образующего инфаркта миокарда (Q-ИМ) давностью 6 мес и более. Пациентам проводили ЭКГ, ЭхоКГ, анализ уровня NT-proBNP и селективную коронарографию, что позволяло оценить характер и выраженность ишемической или постинфарктной дисфункции ЛЖ.
Критерии исключения из исследования: острый коронарный синдром, ИМ давностью менее 6 мес, гемодинамические поражения клапанов сердца, тяжелые болезни печени и почек, соединительной ткани, злокачественные новообразования. За время проспективного наблюдения пациентов регистрировали частоту первичной конечной точки (летальность) и комбинированной конечной точки, включавшей прогрессирование ХСН, повторные нефатальные ИМ, мозговые инсульты, потребность в коронарной реваскуляризации, общее число ССО. Клиническое состояние пациентов с определением ФК ХСН по NYHA оценивали в соответствии с Национальными рекомендациями ВНОК и ОСН по диагностике и лечению ХСН [14].
 Внутрисердечную гемодинамику изучали методом ЭхоКГ на аппарате Phillips HD 15 с определением стандартных показателей [15]. Оценку одного из основных показателей насосной функции сердца — ССС — осуществляли по отношению Ea/Es: эффективной эластичности артерий (Еа) к конечно-систолической эластичности ЛЖ (Es), вычисляемого на основе анализа кривой объем—давление ЛЖ по формуле: ССС=Еа/Еs [9, 10].
Внутрисердечную гемодинамику изучали методом ЭхоКГ на аппарате Phillips HD 15 с определением стандартных показателей [15]. Оценку одного из основных показателей насосной функции сердца — ССС — осуществляли по отношению Ea/Es: эффективной эластичности артерий (Еа) к конечно-систолической эластичности ЛЖ (Es), вычисляемого на основе анализа кривой объем—давление ЛЖ по формуле: ССС=Еа/Еs [9, 10].
Уровень NT-proBNP определяли иммуноферментным методом с использованием набора фирмы Biomedica Slovakia. Согласно рекомендациям фирмы-производителя набора, референсными значениями для уровня NT-proBNP являлись 4,8 пг/мл. Известно, что причиной повышения уровня в сыворотке BNP, NT-proBNP помимо ишемической или постинфарктной дисфункции миокарда, ХСН и гипертрофии ЛЖ могут быть и другие состояния. Поэтому мы не включали в исследование пациентов с ОКС, лиц старше 75 лет, с воспалительными заболеваниями сердца.
Статистическую обработку полученных данных производили с использованием пакета программ Statistica 10,0. Тестирование параметров распределения выполняли с использованием критерия Колмогорова—Смирнова. При параметрическом характере распределения данные представляли в виде М±m (среднее, стандартное отклонение), при непараметрическом распределении — в виде Me (LQ; UQ) (медиана, верхний и нижний квартили). Сравнительный анализ двух несвязанных групп проводили с использованием t-критерия Стьюдента, U-критерия Манна—Уитни или χ2-критерия.
Для выявления тесноты связи между исследуемыми различными показателями рассчитывали коэффициенты ранговой корреляции по Спирмену. Для оценки диагностической значимости соотношения Еа/Еs и теста с NT-proBNP определяли их чувствительность и специфичность посредством ROC-анализа.
В зависимости от величины Еа/Еs и уровня NT-proBNP строили вероятностные временны'е кривые Каплана—Майера для развития ССО с анализом достоверности различий посредством логрангового теста. Достоверными считали различия при р<0,005.
Результаты
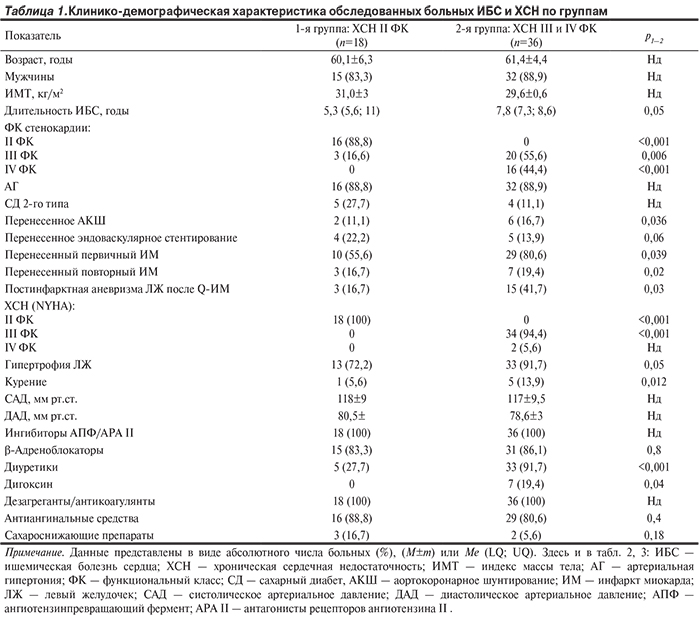
В исследование включены 54 пациента (47 мужчин и 7 женщин) в возрасте от 42 до 73 лет (средний возраст 61,7±8,6 года), разделенных на 2 группы (табл. 1). В 1-ю группу (n=18) вошли пациенты с ИБС с клиническими проявлениями умеренно выраженной ХСН II ФК по NYHA при сохраненной ФВ ЛЖ (55±10,4%). Во 2-ю группу (n=36) вошли больные ХСН III ФК при низкой ФВ ЛЖ (30,4±6,8%). Основной причиной СН являлся перенесенный ИМ, ассоциированный с ишемической или постинфарктной дисфункцией ЛЖ, наиболее выраженной во 2-й группе. Клинически в 1-й группе отмечалась стенокардия напряжения II ФК в 88,8% случаев.
Во 2-й группе доминировала стенокардия III ФК (55,6%) и IV ФК (44,4%). Перенесенный первичный крупноочаговый ИМ регистрировался у большинства пациентов: у 55,6% в 1-й группе и у 80,6% во 2-й. Повторные нефатальные ИМ преобладали (19,4%) во 2-й группе по сравнению с 16,7% в 1-й группе (р=0,02). Постинфарктные аневризмы ЛЖ регистрировались чаще более чем в 2 раза (р=0,03) во 2-й группе: 15 (41,7%) пациентов по сравнению с 3 (16,7%). Коронарная реваскуляризация в виде аортокоронарного шунтирования (АКШ) или эндоваскулярного стентирования выполнялась одинаково часто в обеих группах — примерно у 1/3 пациентов. Артериальная гипертония 2-й степени сопутствовала ИБС у 88% пациентов. Компенсированный СД 2-го типа диагностировался у 5 (27,7%) и в 4 (11,1%) случаях соответствующих групп. Постоянно курили в 1-й и 2-й группе 1 (5,6%) и 5 (13,9%) пациентов соответственно.
В исследование включали пациентов, клиническое состояние которых сохранялось стабильным в течение не менее 2 нед на постоянной базовой терапии, согласно рекомендациям по диагностике и лечению ХСН [15].
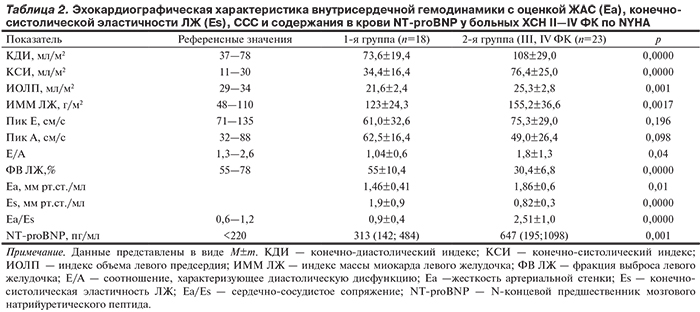
Эхокардиографическая характеристика внутрисердечной гемодинамики с анализом миокардиальной и артериальной жесткости (по показателям Еа, Еs и ССС — Еа/Еs) и уровня NT-proBNP с учетом тяжести ХСН по группам, представлены в табл. 2
У больных 1-й группы клиническим проявлениям умеренной ХСН II ФК и сохраненной ФВ ЛЖ 55±10,4% сопутствовали изменения параметров внутрисердечной гемодинамики, по данным ЭхоКГ, в пределах референсных значений за исключением ИММ ЛЖ, медиана которого 141,5 г/м2 (95; 188,0) на 32,8% превышала норму (р=0,01). Показатели ЖАС (Еа), конечно-систолической эластичности ЛЖ (Еs) и отношения Еа/Еs, отражающего ССС как один из важнейших показателей насосной функции сердца, варьировались в пределах нормы. Среднее значение по группе Еа/Еs составило 0,9±0,4. Анализ уровня экспрессии в крови NT-proBNP показал, что у 8 (44%) пациентов уровень этого биомаркера был менее 100 пг/мл (15; 76,0); у других 10 (55,6%) превышал 100 пг/мл, медиана составила 313 пг/мл.
У больных 2-й группы ХСН III ФК с низкой ФВ ЛЖ (30,4±6,8%) отмечался возросший (р=0,00000) более чем в 2 раза показатель сердечно-сосудистого сопряжения, Еа/Еs достигало 2,51±1,0 (см. табл. 2). Установлено высоко достоверное изменение (р=0,001) основных эхокардиографических параметров ЛЖ, характерное для ишемического или постинфарктного ремоделирования ЛЖ.
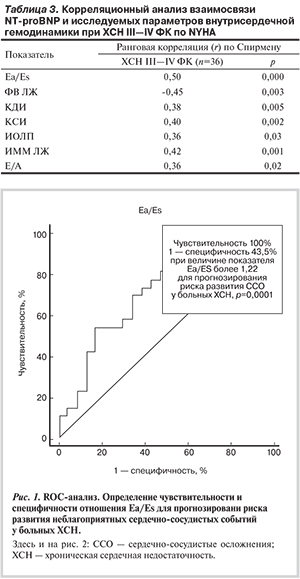
Уровень NT-proBNP менее 100 пг/мл диагностировался в 8 (22,2%) случаях, у 28 (77,8%) медиана уровня NT-proBNP составила 647 пг/мл, более чем в 2 раза превышая уровень такового в 1-й группе (р=0,001). Поскольку до настоящего времени не определена значимость ССС в качестве детерминанты экспрессии NT-proBNP и ишемического ремоделирования ЛЖ, у больных ХСН III ФК был проведен корреляционный анализ взаимосвязи уровня NT-proBNP и исследуемых параметров внутрисердечной гемодинамики (табл. 3). Выявлена тесная корреляция повышенного уровня NT-proBNP с показателем ССС по Еа/Еs (r=0,50; р=0,0000), отрицательная связь со сниженной ФВ ЛЖ (r=-0,45; р=0,003) и с ИММ ЛЖ (r=0,42; р=0,001); умеренная корреляция имелась между уровнем NT-proBNP и другими ЭхоКГ параметрами ЛЖ: конечно-диастолическим индексом (r=0,38; р=0,005), конечно-систолическим индексом (r=0,40; р=0,002), индексом объема левого предсердия (r=0,36; р=0,02).
 В течение 6-месячного периода наблюдения у больных 1-й группы с ХСН II ФК развились ССО в 8 (44,4%) случаях, причиной которых являлось прогрессирование коронарной и сердечной недостаточности. В связи с этим в 7 (38,9%) случаях была выполнена эндоваскулярная коронарная реваскуляризация посредством стентирования и в одном случае — АКШ, обеспечившие существенное улучшение качества жизни пациентов и отдаленного прогноза.
В течение 6-месячного периода наблюдения у больных 1-й группы с ХСН II ФК развились ССО в 8 (44,4%) случаях, причиной которых являлось прогрессирование коронарной и сердечной недостаточности. В связи с этим в 7 (38,9%) случаях была выполнена эндоваскулярная коронарная реваскуляризация посредством стентирования и в одном случае — АКШ, обеспечившие существенное улучшение качества жизни пациентов и отдаленного прогноза.
Во 2-й группе с ХСН III ФК с выраженной ишемической или постинфарктной дисфункцией ЛЖ при низкой ФВ ЛЖ (30,4±6,8%) и высоким значением показателя ССС (р=0,0000) в одном случае был зарегистрирован летальный исход в связи с прогрессированием СН. Развитие ССО произошло в течение 6 мес наблюдения у 15 (41,7%) пациентов: у 14 (39%) — прогрессирование коронарной и сердечной недостаточности и у 1 (2,8%) — нефатальный мозговой инсульт. Успешная коронарная реваскуляризация посредством стентирования была выполнена 5 (13,9%) больным, АКШ — еще 4 (11,1%) пациентам.
При проведении ROC-анализа площадь под кривой (AUC±S.E.) для CCC cоставила 0,74±0,07 (при 95% доверительном интервале — ДИ от 0,59 до 0,85; р=0,001). При определении на ROC-кривой точек, соответствующих оптимальному соотношению чувствительности и специфичности, выявлено, что уровень показателя ССС более 1,22 (чувствительность 100%, специфичность 43,5%) позволяет с наибольшей вероятностью прогнозировать ССО у больных ХСН (рис. 1).
Уровень NT-proBNP в крови >303,4 пг/мл служил прогностическим признаком клинических исходов с чувствительностью 65,5% и специфичностью 88% (AUC=0,76±0,07 при 95% ДИ от 0,63 до 0,87; р=0,0001, рис. 2).
Пороговые значения сердечно-сосудистого сопряжения по Еа/Еs и уровню NT-proBNP, установленные на основании ROC-анализа, использовали для оценки кумулятивной вероятности развития ССО и смерти по Каплану—Майеру в течение 6-месячного периода наблюдения пациентов с ХСН.
Установлено, что вероятность летального исхода, повторного ИМ, мозгового инсульта и декомпенсации ХСН в течение 6 мес при повышенном ССС с Еа/Еs≥2,51 высоко достоверно (р=0,001) превышало таковую при Еа/Еs<2,51. Анализ вероятности развития ССО в зависимости от уровня NT-proBNP>313 пг/мл, кумулятивная частота конечной комбинированной конечной точки, за которую принимались все случаи неблагоприятных сердечно-сосудистых событий в ходе 12-месячного обследования, включая случаи развития повторных нефатальных ИМ, мозговых инсультов, прогрессирования СН, атеросклероза, необходимость эндоваскулярной коронарной реваскуляризации и АКШ, кардиальную смертность, существенно (р=0,001) превышала таковую в 1-й группе больных ХСН II ФК при уровне NT-proBNP<313 пг/мл (рис. 3).
Обсуждение
Результаты проведенного исследования в целом согласуются с данными других исследований, посвященных оценке прогностической значимости маркеров Еа/Еs и BNP при ХСН [9, 13], и рекомендациями по диагностике и лечению СН [16 —18].
Пороговые значения для Ea/Es и уровня NT-proBNP, установленные нами на основании ROC-анализа, использовались для однофакторного анализа прогноза жизнедеятельности пациентов по Каплану—Майеру при развитии неблагоприятных ССО, ассоциированных с ХСН.
Прогностическая значимость ЖАС в качестве независимого предиктора ССО впервые была продемонстрирована на популяции больных АГ [18]. Было также показано, что ЖАС играет важную патогенетическую роль в развитии гипертрофии и ригидности миокарда у больных ХСН.
При этом эксцентрическое ремоделирование и гипертрофия ЛЖ в патогенезе СН представляются одними из основных факторов [5, 6, 8]. В Роттердамском исследовании убедительно продемонстрирована независимая взаимосвязь ЖАС с уровнем экспрессии NT-proBNP у больных ИБС [7]. Доказано клиническое значение ЖАС, идентифицируемой по скорости пульсовой волны в аорте, как независимого фактора риска и предиктора ССО в различных популяциях: при АГ, СД 2-го типа, ИБС, ХСН, у пожилых пациентов и в общей популяции [6—8].
В последнее время представлены данные, касающиеся клинической оценки механизма ССС в качестве ключевого фактора патофизиологии насосной функции сердца, определяемой соотношением Еа/Еs [9]. Показано, что ССС достоверно характеризует состояние миокардиальной и артериальной жесткости и является одним из важнейших патофизиологических звеньев СН [10]. Установлено, что повышение миокардиальной и артериальной жесткости нарушает перфузию миокарда, до 50% увеличивая коронарный кровоток во время систолы, что может способствовать прогрессированию региональной коронарной ишемии при снижении сократимости и систолического давления ЛЖ [9]. По данным нашего исследования, во 2-й группе пациентов с клинически выраженной ХСН наблюдалось повышенное (р=0,0000) ССС с увеличением Еа/Еs до 2,51±1 (см. табл. 2).
По данным литературы, окончательно не установлены детерминанты ССС у больных ХСН. В связи с этим представлялась важной оценка взаимосвязи ССС, идентифицируемого соотношением Еа/Еs, с экспрессией NT-proBNP при развитии ХСН у больных, перенесших ИМ.
Сравнительный анализ кумулятивной вероятности ССО и смерти методом Каплана—Майера показал, что при уровне экспрессии NT-proBNP>313 пг/мл вероятность возникновения ССО (по частоте комбинированной конечной точки, включающей смерть, повторный ИМ, мозговой инсульт, декомпенсация ХСН) регистрировалась чаще (р=0,001), чем у пациентов с уровнем NT-proBNP<313 пг/мл. У пациентов с ХСН III ФК по NYHA с уровнем NT-proBNP>313 пг/мл имелась большая потребность в коронарной реваскуляризации (р=0,01), чем у больных с NT-proBNP<313 пг/мл. Анализ корреляции уровня NT-proBNP с параметрами ССС по Еа/Еs у пациентов с ХСН III ФК показал тесную связь (r=0,5; р=0,0000), сопоставляемую с низкой ФВ ЛЖ (r=-0,45; р=0,003). Положительные корреляции повышенного уровня NT-proBNP прослеживались с ИММ ЛЖ (r=0,42; р=0,001), КСИ (r=0,40; р=0,002), отношением Е/А (r=0,36; p=0,02), отражающем диастолическую дисфункцию ЛЖ. Установленная нами положительная взаимосвязь уровня NT-proBNP, Ea/Es и КСИ у пациентов с ХСН III ФК при низкой ФВ ЛЖ служит проявлением ишемического ремоделирования миокарда. Именно в силу этой причины увеличенный КДО вызывает дилатацию ЛЖ и служит главным патофизиологическим стимулом повышенной экспрессии NT-proBNP ишемизированным миокардом.
Выявленная тесная связь Еа/Еs и уровня NT-proBNP, а также более высокие значения ССС и повышенной экспрессии NT-proBNP у пациентов с более тяжелой ХСН по сравнению с умеренной по тяжести ХСН отражает, с одной стороны, неуклонное возрастание экспрессии NT-proBNP пропорционально выраженности ремоделирования сердца, ассоциированного с систолической и диастолической дисфункцией ЛЖ, с другой стороны — увеличение артериальной и миокардиальной жесткости. Следовательно, ССС, идентифицируемое Еа/Еs, является в определенной мере детерминантой повышенной экспрессии NT-proBNP, позволяющей прогнозировать степень риска развития и тяжесть ХСН.
Таким образом, представленные данные свидетельствуют о том, что новый, сравнительно малоизвестный в клинической практике маркер ишемического ремоделирования ЛЖ и СН — ССС и его Еа/Еs (детерминанты миокардиальной и артериальной жесткости), ассоциируемые с повышенной экспрессией NT-proBNP, имеют самостоятельное клиническое и прогностическое значение, что должно стать предметом дальнейших исследований. Уже в настоящее время оценка показателей Еа/Еs может быть полезна при выборе терапии, направленной на улучшение качества жизни и отдаленного прогноза у больных ишемической кардиомиопатией и ХСН.




