Прогнозирование исходов инфаркта миокарда (ИМ) представляет актуальную проблему современной кардиологии. Определение риска неблагоприятного течения острой коронарной патологии на современном этапе должно учитывать не только тяжесть основного заболевания, но также преморбидный фон и патологические состояния, развивающиеся при ИМ. В частности, роль дисфункции почек (ДП) в развитии неблагоприятных исходов при ИМ как в ближайшем, так и в отдаленном периодах не вызывает сомнений, находя подтверждение в работах многих авторов [1—3]. В этой связи особую актуальность приобретает изучение биомаркеров, отражающих типовые патологические процессы, закономерно развивающиеся в миокарде, а также в других органах и тканях как после ИМ, так и независимо от него.
В частности, фиброзирование миокарда составляет основу постинфарктного ремоделирования, однако этот патологический процесс, как известно, может развиваться не только в сердце, но и в почках, легких, печени, также оказывая непосредственное влияние на прогноз. Изучение маркера фиброзирования — галектина — может повысить эффективность прогнозирования неблагоприятного течения ИМ. Имеющиеся данные в основном касаются роли галектина в развитии и прогрессировании сердечной недостаточности (СН), преимущественно отражая ее морфологический субстрат.
Определение предикторной роли галектина в развитии неблагоприятного прогноза при ИМ представляет несомненный интерес не только с позиции рискометрии, но и возможности терапевтического воздействия, с учетом полученных результатов ряда экспериментальных работ [4, 5]. Значение галектина при ИМ, ДП, а также его роли в качестве предиктора или маркера неблагоприятного течения ближайшего (госпитального) и отдаленного (годового) постинфарктных периодов в настоящее время активно изучаются.
Целью настоящего исследования явилась оценка связи галектина сыворотки крови и ДП в госпитальном и годовом прогнозировании неблагоприятного течения ИМ с подъемом сегмента ST (ИМпST).
Материал и методы
В исследование были включены 128 больных, из них 88 (68,75%) мужчин, средний возраст которых составлял 63 (58; 71) года и 40 (31,25%) женщин, средний возраст 57 (51; 64) лет. Включали больных ИМпST, госпитализированных в период с января 2008 г. по декабрь 2010 г. в сроки до 24 ч от момента развития клинических симптомов заболевания с диагнозом ИМпST, который был установлен при наличии как минимум двух критериев из перечисленных ниже (при этом обязательным являлось повышение уровня биохимических маркеров некроза миокарда):
- клинические данные (ангинозный болевой синдром в грудной клетке длительностью более 20 мин);
- электрокардиографические данные (подъем сегмента ST на 1 мм и более, выявленный не менее чем в 2 смежных отведениях, или впервые возникшая полная блокада левой ножки пучка Гиса);
- биохимические показатели (повышение уровня кардиоспецифичного тропонина Т и/или изоформы МВ креатинфосфокиназы). Критерием включения в протокол явилось также проведение необходимого объема лабораторных исследований, включая определение уровней цистатина С и галектина в сыворотке крови.
Критерии исключения из исследования: возраст пациента моложе 18 лет, ИМ, осложнивший чрескожное коронарное вмешательство (ЧКВ) или коронарное шунтирование, психические заболевания, сопутствующая патология, значительно влияющая на исходы и прогноз: онкологические заболевания, терминальная стадия гепатоцеллюлярной недостаточности, острые инфекционные заболевания или обострение хронических.
Всем пациентам помимо сбора анамнеза проводили стандартные лабораторные и инструментальные исследования: физическое обследование, запись электрокардиограммы в 16 отведениях, проведение эхокардиографии с оценкой фракции выброса левого желудочка (ФВ ЛЖ) и зон нарушения локальной сократимости, взятие крови для определения уровня кардиоспецифических ферментов (тропонина Т, креатинфосфокиназы общей и ее фракции МВ), а также уровня гемоглобина, креатинина, глюкозы, общего холестерина, липидного состава и концентраций цистатина С и галектина-3.
Расчет скорости клубочковой фильтрации (СКФ) выполнен несколькими способами: по формуле MDRD [6] — с учетом уровня креатинина в сыворотке крови, оцененного на 1-е и 12-е сутки ИМпST, по уровню цистатина С, оцененного на 12-е сутки, по формуле Hoek — СКФ [мл/мин/1,73 м2]=(80,35/цистатин C [мг/л]) — 4,3 [7]. Кроме того, определен клиренс креатинина по формуле Кокрофта—Гаулта, мл/мин [8]. Больных с СКФ по цистатину С, оцененному на 12-е сутки ИМпST, менее 60 мл/мин/1,73 м2 было 81 (63,28%).
Материалом для исследования служила сыворотка крови пациентов. Для получения сыворотки кровь брали из локтевой вены утром натощак в вакуумные пробирки Vacuette. Сыворотку, полученную методом центрифугирования, аликвотировали и до проведения исследования хранили в низкотемпературном холодильнике при температуре –40 °С.
Определение концентрации галектина-3 в сыворотке крови (нг/мл) и цистатина С (нг/мл) на 1-е и 12-е сутки от госпитализации проводили методом твердофазного иммуноферментного анализа с использованием коммерческих наборов и в соответствии с протоколами производителей галектина-3, цистатина C. Регистрацию результатов осуществляли на планшетном ридере «УНИПЛАН».
Диагноз сахарного диабета (СД), хронической болезни почек (ХБП) устанавливали на основании данных анамнеза, анализа амбулаторных карт пациентов и оценки показателей углеводного обмена, а также креатинина с расчетом СКФ (по формуле MDRD) в период индексной госпитализации.
Для всех пациентов при поступлении в клинику был определен метод реперфузионной терапии: проведение ЧКВ (ангиопластика и/или стентирование) симптомсвязанной коронарной артерии, тромболитическая терапия (ТЛТ). Реперфузионную терапию не проводили при наличии общепринятых противопоказаний или технических ограничений.
На этапе стационарного лечения выполняли оценку проявлений коронарной недостаточности (развития ранней постинфарктной стенокардии — РПИС, рецидива ИМ), степени острой СН по классификации Killip, летальности. Через год от начала наблюдения проанализирована информация о следующих неблагоприятных исходах: смерть, повторный ИМ, прогрессирование стенокардии, экстренная коронарная реваскуляризация, декомпенсация хронической СН.
Протокол проведенного исследования был одобрен локальным Этическим комитетом ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН», разработанным в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г., и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003 г., и строился по принципу добровольного информированного согласия пациента на участие в исследовании (с подписанием соответствующей формы).
Статистическую обработку данных исследования осуществляли с помощью программы Statistica 7.0. Результаты представлены в виде абсолютных и относительных частот (n, %) или медианы и интерквартильного размаха — Me (25-й процентиль; 75-й процентиль). Для анализа различий частот использовали критерий χ2 Пирсона. Две независимые группы по количественному признаку сравнивали с помощью U-критерия Манна—Уитни. Для оценки зависимости между переменными использовался коэффициент ранговой корреляции Спирмена. Для выявления независимых предикторов развития неблагоприятных исходов использовали метод логистической регрессии. Рассчитывали отношения шансов и 95% доверительные интервалы. Различия считали статистически значимыми при уровне р<0,05.
Результаты
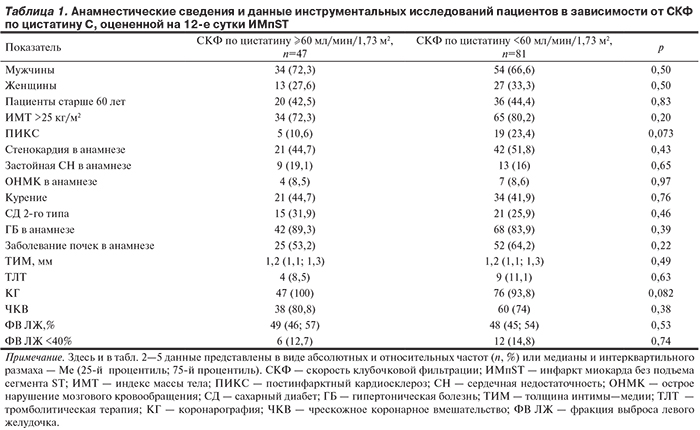
В зависимости от СКФ по уровню цистатина С, оцененному на 12-е сутки ИМпST, выделены 2 группы пациентов — 1-я группа (n=47, 36,72%) с нормальной функцией почек (СКФ ≥60 мл/мин/1,73 м2) и 2-я группа (n=81, 63,28%) с наличием ДП (СКФ <60 мл/мин/1,73 м2).
Анализируемые группы не имели половых и возрастных различий (табл. 1). Кроме того, пациенты обеих групп были сопоставимы по частоте развития в анамнезе случаев острого нарушения мозгового кровообращения, клинических проявлений стенокардии, по наличию гипертонической болезни, СД 2-го типа и курению. В группе пациентов с СКФ <60 мл/мин/1,73 м2 несколько чаще встречались больные старше 60 лет, с индексом массы тела >25 кг/м2 и ФВ ЛЖ менее 40%. У пациентов этой же группы в большем числе случаев отмечены заболевания почек в анамнезе. Больные с ДП чаще подвергались ТЛТ, а пациенты с нормальной функцией почек — ЧКВ. Частота развития постинфарктного кардиосклероза была в 2 раза выше у пациентов с ДП (23,4% против 10,6%), однако статистической значимости полученные различия не достигли (р=0,073).
Проанализированы некоторые лабораторные показатели (табл. 2). По концентрации общего холестерина и гликемии группы не различались. Выявлены статистически значимые различия по уровню креатинина в крови на момент госпитализации, до коронарографии и по минимальному/максимальному уровням этого показателя — с большими значениями в группе с СКФ по цистатину С <60 мл/мин/1,73 м2. Однако все полученные результаты не превышали нормы. Анализ динамики клиренса креатинина и СКФ по формуле MDRD на 12-е сутки заболевания показал, что частота отрицательной динамики указанных показателей была статистически значимо выше у пациентов со сниженной СКФ по цистатину С. Так, снижение клиренса креатинина в указанные сроки у пациентов с ДП выявлено в 28,4% случаев, а у пациентов без ДП — в 10,6% (р=0,014). Уменьшение СКФ по MDRD на 12-е сутки у пациентов со сниженной СКФ по цистатину С (41,9%) отмечалось также соответственно чаще, чем у больных без ДП (21,3%; р=0,017).
В табл. 3 отражены уровни галектина на 1-е сутки и динамика к 12-м суткам ИМпST. Видно, что группы имели статистически значимые различия между средними значениями данного маркера. Концентрация этого показателя в обоих случаях была выше у пациентов с ДП. Кроме того, в 50,6% случаев концентрация изучаемого маркера превышала референсные значения (17,8 нг/мл) в группе с СКФ <60 мл/мин/1,73 м2, а в группе с нормальной СКФ — в 32% случаев (р=0,039).

В табл. 4 представлены результаты корреляционного анализа. Наиболее статистически значимой является связь частоты РПИС и роста концентрации галектина к 12-м суткам выше допустимых значений (р=0,042). В других случаях взаимосвязи различных факторов с увеличением концентрации галектина к 12-м суткам ИМпST демонстрировали пограничную статистическую значимость.
Для выявления факторов, ассоциированных с развитием неблагоприятного отдаленного прогноза, был проведен однофакторный анализ (табл. 5). Для анализа были выбраны лишь те показатели, которые продемонстрировали достоверные различия при сравнительном анализе: СКФ MDRD <60 мл/мин/1,73 м2, снижение клиренса креатинина перед выпиской, снижение СКФ перед выпиской и повышение концентрации галектина >17,8 нг/мл на 12-е сутки ИМпST. При однофакторном анализе отмечено, что все выбранные показатели повышали вероятность развития неблагоприятных исходов в течение года после ИМ.
Чтобы оценить факторы, независимо влияющие на вероятность развития неблагоприятного отдаленного прогноза, был проведен пошаговый логистический регрессионный анализ, в который включили факторы, для которых была выявлена связь с риском формирования неблагоприятного прогноза по результатам однофакторного анализа. Оказалось, что независимыми факторами, ассоциированными с развитием неблагоприятного отдаленного исхода, являлись снижение клиренса креатинина <60 мл/мин перед выпиской (р=0,033) и повышение концентрации галектина >17,8 нг/мл на 12-е сутки ИМпST (р=0,038).
Обсуждение
В настоящее время адекватная оценка функции почек как необходимое условие эффективного прогнозирования течения ближайшего и отдаленного постинфарктных периодов представляет актуальную задачу. Предложенные методы определения функции почек (СКФ по формуле MDRD, по цистатину С, клиренс креатинина) имеют ограничения, поскольку представляют собой расчетные показатели. В настоящем исследовании выявлены однонаправленные изменения показателей, отражающих функциональное состояние почек у больных ИМпST. Так, группа пациентов со снижением СКФ, вычисленной по уровню цистатина С, характеризовалась статистически значимо более низкой СКФ, определенной по концентрации креатинина в сыворотке крови (по формуле MDRD), и клиренса креатинина (по формуле Кокрофта—Гаулта).
С учетом роли ДП в оценке прогноза больных ИМ определение потенциала маркеров, отражающих типовые патологические процессы, происходящие в миокарде и почках, представляет определенный интерес.
Так, галектин — новый биомаркер неблагоприятного прогноза у пациентов с СН. Ранее отмечена связь повышенного уровня галектина с летальностью больных с острой СН, а также продемонстрировано его независимое от других маркеров влияние на долгосрочный (4-летний) прогноз у пациентов этой категории [9—11]. Кроме того, имеются указания на ассоциацию повышенного уровня галектина с новыми случаями СН среди здоровых лиц [12], а также смертностью от всех причин в общей популяции [13]; предположительно такое влияние галектина связано с фиброзом не только миокарда [14], но и почек, легких [15], а также с циррозом печени [16].
Повышение уровня галектина ассоциируется с прогрессированием СН, выступая в качестве посредника ремоделирования сердца с развитием фиброза миокарда [17]. Однако имеющиеся данные позволяют рассматривать его в качестве «системного» биомаркера, в целом отражающего неблагоприятный прогноз, а также наличие и прогрессирование почечной недостаточности [18]. В частности, имеются данные об ассоциации галектина с фиброзом почек и неблагоприятным исходом у больных с терминальной стадией ХБП, включая смерть от различных причин, в том числе сердечно-сосудистых осложнений [19].
В проведенном исследовании выявлено повышение концентрации галектина в сыворотке крови у больных ИМпST со сниженной СКФ по цистатину С по сравнению с пациентами с нормальной функцией почек, при этом статистически значимо более высокое содержание галектина при ДП отмечено как на 1-е, так и на 12-е сутки ИМ. Кроме того, число лиц с превышением референсного уровня этого маркера (более 17,8 нг/мл) оказалось достоверно больше в группе больных ИМпST с СКФ по цистатину С <60 мл/мин/1,73 м2.
Определяя значение галектина для оценки прогноза у больных ИМпST, следует отметить данные N.S. Sherwi и соавт. (2011 г.) о том, что повышенный уровень галектина, отражая нарушение функции почек в большей степени, чем ФВ ЛЖ и концентрация N-концевого предшественника натрийуретического петида, является предиктором неблагоприятного исхода у больных с СН [20].
Кроме того, существует мнение о ДП как посреднике влияния галектина на ремоделирование сердца, развитие и прогрессирование СН. Альтернативная точка зрения предполагает самостоятельное влияние галектина на сердце и почки, при этом нарушение функции почек в большей степени, чем галектин, отражает риск декомпенсации СН [12]. Другими авторами (2011 г.) продемонстрирована ассоциация уровня галектина с ДП независимо от наличия СН [21, 22].
Ранее также показана прямая корреляция между уровнем галектина и маркерами воспаления, в частности, С-реактивного белка, свидетельствующая о связи воспаления с процессами фиброзирования [23].
Однако мнение о прогностической роли галектина неоднозначно. По данным HF-ACTION Study (2012 г.) с участием 895 пациентов с СН, в одномерной логистической регрессионной модели продемонстрировано независимое влияние галектина в концентрации более 17,8 нг/мл на развитие фатальных желудочковых нарушений ритма и декомпенсации деятельности сердца с развитием летального исхода, но в многомерном анализе эта ассоциация не сохранялась, уступая место влиянию других предикторов, и вопрос о прогностической роли галектина, в том числе при СН, остался открытым [24].
В выполненном исследовании у больных ИМпST продемонстрировано самостоятельное прогностическое значение как ДП (CКФ по цистатину С, MDRD и клиренсу креатинина), так и независимое от нарушения функции почек влияние повышенного уровня галектина более 17,8 нг/мл (на 12-е сутки ИМ) для реализации неблагоприятного годового прогноза. Дальнейшее изучение роли галектина в реализации неблагоприятных исходов ИМ позволит уточнить генез этого влияния.
Заключение
Таким образом, у больных инфарктом миокарда с подъемом сегмента ST наличие дисфункции почек (снижение скорости клубочковой фильтрации по цистатину С, креатинину в сыворотке крови <60 мл/мин/1,73 м2, клиренс креатинина <60 мл/мин), а также повышение концентрации галектина >17,8 нг/мл на 12-е сутки инфаркта миокарда определены в качестве независимых предикторов неблагоприятного годового прогноза. Кроме того, повышение уровня галектина прямо коррелирует с наличием ранней постинфарктной стенокардии.



