Сахарный диабет (СД) представляет собой глобальную проблему современного здравоохранения, заболеваемость которым растет пропорционально урбанизации, увеличению возраста населения и распространенности ожирения [1].
Высокая заболеваемость СД сопровождается увеличением распространенности хронической болезни почек (ХБП) [2], причем такой вариант сочетанной патологии будет встречаться все чаще, создавая трудности при лечении больных данной категории [3].
В 2009 г. в США установлено, что у 40% больных СД 2-го типа имеются различные стадии ХБП [4], однако не только СД, но и ХБП ассоциируется с высоким риском развития сердечно-сосудистых осложнений (ССО). Так, у пациентов с патологией почек отмечается более высокая смертность от заболеваний сердца, чем от терминальной стадии хронической почечной недостаточности [5]. Но несмотря на очевидность частого сочетания СД и ХБП, последняя нередко остается нераспознанной и, соответственно, не учитывается в оценке суммарного риска неблагоприятных исходов и не подвергается своевременной коррекции [6].
Важно подчеркнуть, что своевременная и адекватная коррекция факторов, ответственных за прогрессирование дисфункции почек (ДП), приводит не только к увеличению периода до наступления почечной недостаточности, но и способна уменьшить количество осложнений СД и в целом снизить риск развития ССО [7]. Однако роль СД и ДП в развитии неблагоприятных исходов острых форм ишемической болезни сердца (ИБС), в частности инфаркта миокарда с подъемом сегмента ST (ИМпST), продолжает активно обсуждаться как с позиции изолированного влияния СД и ДП, так и их сочетания.
 Целью настоящего исследования явилась оценка роли ДП в реализации неблагоприятных исходов госпитального и отдаленного (1 год) этапов лечения у больных ИМпST на фоне СД.
Целью настоящего исследования явилась оценка роли ДП в реализации неблагоприятных исходов госпитального и отдаленного (1 год) этапов лечения у больных ИМпST на фоне СД.
Материал и методы
С 2008 по 2010 г. на базе Кемеровского кардиологического диспансера проводилось регистровое исследование острого коронарного синдрома (ОКС) с подъемом сегмента ST, основанное на принципе ведения российского регистра ОКС «РЕКОРД» [8].
Протокол исследования соответствовал стандартам локального этического комитета Федерального государственного бюджетного учреждения «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний» СО РАМН, разработанным в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003.
Используемый протокол опирался на принцип добровольного информированного согласия пациента на участие в исследовании (с подписанием соответствующей формы).
В исследование были включены 954 пациента с ИМпST, госпитализированные в период с января 2008 по декабрь 2010 г. в сроки до 24 ч от момента развития клинических симптомов заболевания.
Диагноз ИМпST устанавливали на основании: 1) клинических данных (ангинозный болевой синдром в грудной клетке длительностью более 20 мин); 2) данных электрокардиографии (подъем сегмента ST на 1 мм и более, выявленный не менее чем в двух смежных отведениях, или впервые возникшая полная блокада левой ножки пучка Гиса); 3) биохимических показателей (повышение уровня кардиоспецифичного тропонина Т и/или изоформы МВ креатинфосфокиназы).
Критериями исключения из исследования явились возраст пациента моложе 18 лет, онкологические заболевания, терминальная стадия гепатоцеллюлярной недостаточности, острые инфекционные заболевания или обострение хронических, психические заболевания, ИМ, осложнивший чрескожное коронарное вмешательство (ЧКВ) или коронарное шунтирование.
Схема обследования для всех пациентов включала сбор анамнеза, физическое обследование, запись электрокардиограммы в 16 отведениях, проведение эхокардиографии с оценкой фракции выброса левого желудочка и зон нарушения локальной сократимости, определение уровня тропонина Т, креатинфосфокиназы общей и ее изоформы МВ, а также уровня гемоглобина, креатинина, глюкозы, общего холестерина и липидного состава крови. Контроль гликемии у пациентов с СД осуществляли в соответствии с алгоритмами специализированной медицинской помощи [9].
Для расчета скорости клубочковой фильтрации (СКФ) использована формула MDRD [10] с учетом уровня креатинина в сыворотке крови, оцененного при поступлении больного в стационар. При СКФ менее 60 мл/мин/1,73 м2 пациентов относили в группу с ДП. Пороговый уровень СКФ (менее 60 мл/мин/1,73 м2) определен по статистически значимому увеличению риска развития ССО с учетом данных мета-анализа 40 клинических исследований с общим числом пациентов более 425 тыс. [11].
Диагноз СД устанавливали на основании данных анамнеза, а также анализа амбулаторных карт пациентов и оценки показателей углеводного обмена в период индексной госпитализации (гликемии при поступлении, натощак и постпрандиально на 10—12-е сутки стационарного лечения).
Для всех пациентов при поступлении в клинику был определен метод реперфузионной терапии: проведение ЧКВ (ангиопластика и/или стентирование) симптомсвязанной артерии, тромболитическая терапия. Реперфузионная терапия не проводилась при наличии общепринятых противопоказаний либо технических ограничений.
Консервативное лечение включало антикоагулянты, дезагреганты, ингибиторы ангиотензинпревращающего фермента (АПФ), β-адреноблокаторы, статины (в отсутствие противопоказаний), нитраты, антагонисты кальциевых каналов, диуретики, инотропные и антиаритмические препараты (по показаниям). Лечение по поводу СД осуществлялось под контролем эндокринолога и включало только диету у 58 (33,1%) пациентов; пероральные сахароснижающие препараты — у 96 (54,9%), преимущественно (91,7%) из группы сульфонилмочевины; комбинированное лечение — диета, сахароснижающие препараты и инсулин — было назначено 21 (12%) больному.
Анализ терапии в течение года после ИМпST не выявил существенных различий по сравнению с госпитальным этапом, увеличилось лишь число больных, принимающих статины (до 78% по сравнению с 63% на стационарном этапе), и среди пациентов с СД в 3 раза увеличилась доля больных, которым назначались бигуаниды.
На этапе стационарного лечения, а также через 1 год проводилась оценка проявлений коронарной недостаточности (развитие ранней постинфарктной/прогрессирующей стенокардии, рецидива/повторного ИМ), степени острой сердечной недостаточности по классификации Killip, функ-ционального класса хронической сердечной недостаточности (ХСН) по классификации Нью-Йоркской ассоциации сердца, летальности и смертности в отдаленный период.
Общее число пациентов, включенных в исследование, составило 954, из них 620 (65%) мужчин и 334 (35%) женщины. Средний возраст в общей выборке составил 63,4 (62,6—64,2) года, у мужчин — 60,3 (59,4—61,1) года, у женщин — 69,2 (68,1—70,4) года. СД верифицирован у 175 (18,3%) пациентов с учетом данных анамнеза, а также оценки гликемии натощак и постпрандиально. Основные анамнестические показатели и распространенность факторов риска (ФР) развития ИБС в общей группе пациентов представлены в табл. 1.
Статистическую обработку данных исследования осуществляли с помощью программы SPSS версии 16.0 (США). Для анализа различий частот использовали χ2-критерий Пирсона. Две независимые группы по количественному признаку сравнивали с помощью U-критерия Манна—Уитни. Критерий Крускала—Уоллиса использован для сравнения нескольких независимых групп. Для выявления независимых предикторов развития неблагоприятных исходов использовали метод логистической регрессии с вычислением отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Различия считали статистически значимыми при р<0,05.
Результаты
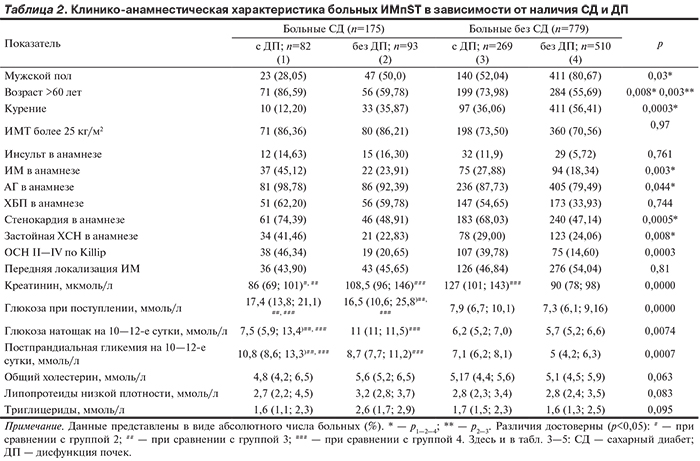
Пациенты были распределены в 4 группы в зависимости от наличия СД и ДП (табл. 2): в 1-ю группу вошли больные ИМпST с СД и ДП (n=82, 46,9%), во 2-ю группу — пациенты с СД без ДП (n=93, 53,1%), в 3-ю — больные без СД со сниженной СКФ (n=269, 34,5%), в 4-ю — без нарушений почечной функции и углеводного обмена (n=510, 65,5%).
Наименее благоприятной с позиции выявления ФР развития ССО и данных анамнеза являлась группа больных ИМпST в сочетании с СД и ДП. Эта группа достоверно отличалась от групп без нарушений углеводного обмена и ДП, а также пациентов с ДП без СД по возрасту (преобладанием лиц старше 60 лет), полу, перенесенным ИМ, инсультам, наличию стенокардии, ХСН и артериальной гипертонии (АГ) в анамнезе. Самая благоприятная группа представлена пациентами без нарушений углеводного обмена и функции почек. Промежуточное положение занимали группы пациентов с ДП без СД и с нормальной функцией почек и СД — они оказались сопоставимы по основным ФР развития ССО и анамнестическим характеристикам. Закономерно больные СД характеризовались более высоким уровнем гликемии при поступлении, натощак и постпрандиально, независимо от наличия ДП.
Анализ проведенных коронарографии (КГ) и первичных ЧКВ на симптомсвязанной коронарной артерии выявил более частое применение диагностических и лечебных рентгенконтрастных процедур у больных ИМпST без СД и с нормальной функцией почек, а минимальное — в группе с СД и ДП, а также без СД, но со сниженной СКФ (табл. 3).
Это, безусловно, оказало влияние на исходы в группах сравнения. Достоверно реже КГ проводили у пациентов с ДП независимо от наличия СД. Одним из основных ограничений в проведении рентгенконтрастных диагностических процедур при ИМ является снижение СКФ. По частоте проведения ЧКВ достоверные различия выявлены при сравнении групп пациентов с ДП и СД, а также СД без нарушений функции почек, что можно объяснить особенностями поражения коронарного русла при СД, а именно преобладанием диффузного поражения коронарных артерий с вовлечением дистального русла. В ранее опубликованных нами статьях приведены данные о частоте проведения КГ и ЧКВ у больных ИМ и СД с оценкой влияния рентгенконтрастных методов реваскуляризации на госпитальный и отдаленный исходы [12, 13].
Сравнение летальности в группах с СД и ДП и без таковых (табл. 4) выявило тенденцию к ее увеличению у пациентов с СД и сохраненной функцией почек по сравнению с больными без СД и ДП (р=0,49). Максимальная летальность отмечена у пациентов с ИМпST в сочетании с СД и ДП — в 3 раза выше, чем в группе больных СД без ДП (р=0,002); в 3,8 раза превысила летальность по сравнению с группой пациентов с сохраненной функцией почек и без СД; в 1,4 раза была выше, чем в группе больных без СД и СКФ менее 60 мл/мин/1,73 м2 (р=0,09).
Прогностическая значимость СД, ДП в развитии ранних нефатальных осложнений ИМ оценена с помощью логистической регрессии. Так, согласно полученным данным, риск развития неблагоприятного исхода (нефатального рецидива ИМ, ранней постинфарктной стенокардии, инсульта, острой сердечной недостаточности) повышается в 1,42 (при 95% ДИ от 1,13 до 1,79) раза на фоне СД; в 1,58 (при 95% ДИ от 1,29 до 1,94) раза при наличии ДП и в 3,6 (при 95% ДИ от 2,01 до 3,89) раза в случае сочетания СД и ДП.
Анализ летальных исходов после года наблюдения выявил статистически значимые различия; так, в группе сочетания СД и ДП отмечено максимальное количество смертей — 36,6%, а минимальное — в отсутствие СД и ДП — 11,4% (см. табл. 4). Однако особого внимания заслуживает сравнение групп с наличием СД без ДП и с ДП без СД — смертность на годовом этапе наблюдения составила 13 и 27,7% соответственно (χ2=64,187; р=0,0001).
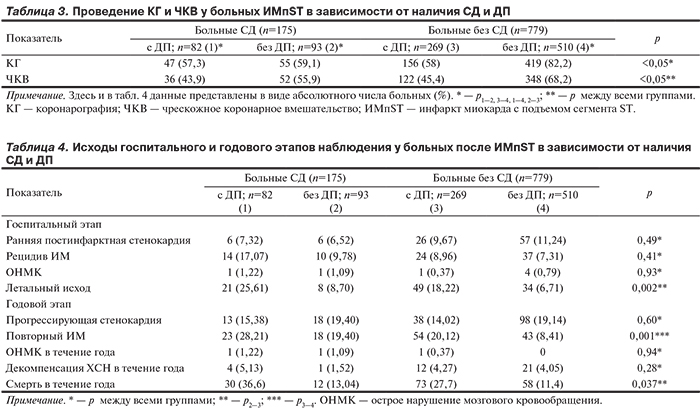
По частоте развития других осложнений, включая прогрессирующую стенокардию, инсульт, декомпенсацию ХСН, на годовом этапе наблюдения статистически значимых различий в группах сравнения не выявлено.
При проведении однофакторного анализа установлены ассоциации ряда ФР развития ССО (возраст старше 60 лет, женский пол, АГ и др.) и характеристик ИМ с летальностью и годовой смертностью (табл. 5). Так, наличие ДП в остром периоде ИМ увеличивает риск смерти как в стационаре, так и в течение года наблюдения в 3,3 раза, в то время как наличие СД ассоциировалось с увеличением летальности в 1,6 раза и не оказало статистически значимого влияния на годовую смертность. Однако такие параметры, как уровень глюкозы в крови, концентрация креатинина и показатели липидного состава сыворотки крови, а также применение лекарственных препаратов различных групп, включая ингибиторы АПФ и статины, не вошли в качестве значимых ковариат в одномерную модель оценки риска смерти как в стационаре, так и в течение года наблюдения.
Представленные данные демонстрируют не только ассоциации ДП и СД с другими ФР развития ССО, такими как возраст и пол, но и указывают на самостоятельное значение снижения функции почек и наличия СД в развитии фатальных осложнений ИМпST в госпитальном периоде. Причем ДП в остром периоде ИМпST сохраняла негативное влияние не только на ближайший, но и на отдаленный прогноз. Кроме того, следует отметить, что ДП можно рассматривать как один из механизмов реализации неблагоприятного прогностического влияния СД.
Обсуждение
Проведенное в настоящем исследовании сравнение групп больных ИМпST с СД и ДП и без таковых выявило существенные различия в их клинико-анамнестических характеристиках. Так, наличие СД и ДП было ассоциировано с женским полом, более старшим возрастом пациентов, наличием стенокардии, застойной ХСН, АГ, перенесенного ИМ в анамнезе и более частыми клиническими проявлениями ОСН (Killip II—IV) по сравнению с пациентами с наличием только СД или ДП. Закономерно более благоприятные клинико-анамнестические данные характеризовали группу больных ИМ без нарушений углеводного обмена и ДП.
Как было показано J.R. Sowers и соавт., повышенный риск развития ССО при СД ассоциирован с такими традиционными факторами, как дислипидемия, АГ, ожирение [14, 15], эти же факторы частично реализуют эффекты ДП как предиктора сердечно-сосудистых заболеваний (ССЗ).
В то же время наличие СД сопряжено не только с потенциальным риском развития макрососудистых осложнений, но, как правило, на этапе верификации диагноза сопровождается органными поражениями. Так, среди больных СД 2-го типа риск развития ССО повышен за годы до выявления гипергликемии. Клиническим проявлениям СД, как правило, предшествуют инсулинорезистентность, метаболический синдром, нарушение липидного обмена [16]. Кроме того, у больных СД повышенный риск развития ССО связан с воспалением, дисфункцией эндотелия, повышенной активностью тромбоцитов, гиперкоагуляцией [17], которые также составляют основу формирования и прогрессирования ДП — независимого ФР развития ССЗ [18].

Безусловный интерес представляет сравнение исходов в группах пациентов с ДП без нарушений углеводного обмена и с нормальной функцией почек и СД. Проведенный в настоящей работе анализ позволяет сделать вывод об ассоциации и СД и ДП с традиционными ФР развития ССО и негативном влиянии нарушений углеводного обмена и ДП на прогноз, причем в большей степени на развитие фатальных как ранних, так и поздних осложнений ИМпST.
При этом важно отметить, что именно ССЗ, в частности ИМ, являются основной причиной смерти больных СД и ХБП [19].
Однако нами установлено самостоятельное независимое влияние СД и ДП — наличие СД в 1,6 раза увеличивает риск смерти в госпитальном периоде, а наличие ДП ассоциировано с более чем 3-кратным увеличением риска не только смерти в стационаре, но и в течение года наблюдения.
Сопоставление исходов в группах пациентов с ДП без нарушений углеводного обмена и с сохранной функцией почек и СД позволяет оценить значение указанных факторов для формирования неблагоприятного прогноза при ИМ.
Выявленная закономерность свидетельствует о значительной роли ДП в реализации неблагоприятного прогноза у больных СД, при этом нарушение функции почек сохраняет самостоятельное прогностическое значение у больных ИМпST как в госпитальном, так и в отдаленном (годовом) периодах независимо от наличия СД. Следует подчеркнуть, что полученные результаты демонстрируют влияние СД на формирование неблагоприятных исходов посредством органных поражений, в частности сопровождающихся ДП.
Вместе с тем наличие СД и ДП может негативно влиять на исходы ИМ за счет существенного ограничения использования современных методов лечения. Так, ЧКВ имеет худшие исходы при СД по сравнению с таковым в отсутствие нарушений углеводного обмена, в частности отмечено увеличение рестенозов почти в 2 раза [20].
ДП нередко является серьезным фактором, ограничивающим использование рентгеноконтрастных методов диагностики и лечения больных ИМ, что оказывает негативное влияние на ближайшие и отдаленные исходы. В проведенном исследовании пациенты с ИМпST в сочетании с СД и ДП наименее часто подвергались ЧКВ — в 1,6 раза реже, чем больные без нарушений углеводного обмена и функции почек; в 1,3 раза реже по сравнению с группой СД без ДП. Вместе с тем продолжает активно обсуждаться факт более благоприятного влияния ЧКВ на исходы ИМ именно у больных СД и ДП [21], что требует дальнейшего изучения с формированием обоснованного персонализированного подхода к выбору инвазивной тактики ведения больных ИМ в сочетании с СД и ДП.
Выводы
- Дисфункция почек, оцененная по расчетной скорости клубочковой фильтрации (менее 60 мл/мин/1,73 м2 по формуле MDRD), ассоциируется с рядом факторов риска развития сердечно-сосудистых осложнений, при этом сохраняет самостоятельное неблагоприятное клиническое и прогностическое значение у больных инфарктом миокарда с подъемом сегмента ST.
- Дисфункция почек оказывает существенное влияние на реализацию неблагоприятных исходов у больных инфарктом миокарда с подъемом сегмента ST на фоне сахарного диабета, кроме того, доказана бóльшая прогностическая значимость сочетания сахарного диабета и дисфункции почек, а также изолированного нарушения функции почек для формирования неблагоприятного госпитального и отдаленного прогнозов инфаркта миокарда по сравнению с влиянием сахарного диабета.



