Стентирование коронарных артерий (КА) является приоритетным способом реваскуляризации сердца как при стабильной форме ишемической болезни сердца (ИБС), так и в рамках острого коронарного синдрома. Ежегодно в мире выполняется более 1,7 млн процедур чрескожного коронарного вмешательства (ЧКВ) [1]. Одна из краеугольных проблем, которая может возникнуть после имплантации стента, — это рестеноз, причиной которого служат повреждение эндотелия, гиперплазия неоинтимы и тромбоз стента, связанный с неполной аппозицией эндопротеза, недостаточной эндотелизацией и проблемами, обусловленными антитромбоцитарной терапией [2].
Частота рестеноза, под которым понимается сужение в области стентированного сегмента ≥50%, после установки стента без лекарственного покрытия может составлять от 10 до 40% и зависит от клинических особенностей пациента, вида поражения и характера вмешательства [2]. Принципиальных достижений в профилактике и лечении рестеноза после имплантации коронарных стентов удалось достичь только в начале XXI века, когда в клинической практике стали применяться стенты с лекарственным покрытием, обеспечивающим антипролиферативный эффект. В их основу положен принцип локального выделения цитостатиков, подавляющих гиперплазию гладких мышечных клеток и соединительной ткани.
 До недавнего времени, пока не была накоплена достаточная доказательная база, применение стентов с лекарственным покрытием не рекомендовалось для первичного ЧКВ, однако и в настоящее время этот вопрос остается нерешенным. Значительная часть исследований, посвященных вопросу применения стентов с лекарственным покрытием, касается стабильных стенозов, и была выполнена на выборках пациентов без включения больных из группы высокого риска или с тяжелой сопутствующей патологией [3].
До недавнего времени, пока не была накоплена достаточная доказательная база, применение стентов с лекарственным покрытием не рекомендовалось для первичного ЧКВ, однако и в настоящее время этот вопрос остается нерешенным. Значительная часть исследований, посвященных вопросу применения стентов с лекарственным покрытием, касается стабильных стенозов, и была выполнена на выборках пациентов без включения больных из группы высокого риска или с тяжелой сопутствующей патологией [3].
Одним из наиболее крупных исследований в области применения стентов с лекарственным покрытием при ЧКВ по поводу инфаркта миокарда с подъемом сегмента ST (ИМпST) стал мета-анализ 13 рандомизированных исследований со средним периодом наблюдения не менее 6 мес, выполненный в 2010 г. [4]. В данном мета-анализе показана позитивная роль стентов с лекарственным покрытием при инфаркте миокарда (ИМ) в сравнении со стентами без лекарственного покрытия по влиянию на риск развития повторного ИМ, частоту реваскуляризации целевого сосуда (TVR) и рестеноза, однако различий по общей смертности и тромбозу стента не прослеживалось, что согласуется с данными других исследований [5—7].
Известно, что первичное ЧКВ является оптимальным видом реперфузионной терапии при ИМпST при условии его быстрого выполнения в центрах, обладающих достаточным опытом [8—12]. При этом было показано, что больные с реокклюзией инфаркт-связанной артерии (ИСА) после первичного ЧКВ имеют крайне неблагоприятный прогноз на протяжении 12 мес наблюдения [13]. Таким образом, одной из важнейших проблем среди пациентов, подвергшихся первичному ЧКВ, являются сохранение проходимости стентированного сегмента в ИСА, предотвращение его острого и подострого тромбоза, а также реваскуляризация других КА, имеющих гемодинамически значимое стенотическое поражение [14, 15].
В рекомендациях Европейского общества кардиологов (версия 2014 г.) появилась более четкая детализация подходов к выбору тактики реваскуляризации у пациентов с ИМпST при многососудистом поражении коронарного русла [16]. Несмотря на то что первичное ЧКВ все еще должно ограничиваться только ИСА (за исключением случаев с кардиогенным шоком или персистирующей ишемией; рекомендация класс IIa, уровень доказательства B), в случае манифестации ишемии поэтапная реваскуляризация сосудов, не связанных с зоной инфаркта, должна выполняться в жестко лимитированные сроки — от нескольких дней до 1 нед (класс доказательства IIa, уровень B). Более того, рекомендации были дополнены стандартом, позволяющим выполнение ЧКВ не только на ИСА, но и на значимых поражениях других КА в рамках первичного ЧКВ у больных определенных групп (класс доказательства IIb, уровень B). Эти стандарты появились благодаря публикации данных рандомизированного исследования PRAMI, в котором изучалась превентивная роль стентирования артерий, не связанных с областью инфарцирования в рамках многососудистого первичного ЧКВ [17]. В этом исследовании показана превентивная роль стентирования не только ИСА, но и других КА, имеющих гемодинамически значимое стенотическое поражение, в рамках одной чрескожной процедуры, что выражалось в существенном снижении частоты «первичной конечной точки» (кардиальная смерть, нефатальный ИМ и рефрактерная стенокардия) по сравнению с больными, подвергающимися вмешательству лишь на ИСА при первичном ЧКВ.
Таким образом, имеющиеся на настоящем уровне развития знания в целом поддерживают использование стентов с лекарственным покрытием при первичном ЧКВ, что имеет ряд преимуществ по сравнению со стентами без лекарственного покрытия. При этом комплекс вопросов, касающихся данного раздела интервенционной кардиологии, изучен недостаточно и содержит ряд противоречивых данных. В частности, не существует полноценной доказательной базы, касающейся механизмов и риска очень позднего тромбоза стентов с лекарственным покрытием, имплантированных в острую стадию ИМпST, нет достаточного объема данных об эффективности стентов с лекарственным покрытием второго поколения, отсутствуют результаты исследований, изучающих результаты применения второго поколения стентов, содержащих лекарство, при различных стратегиях реваскуляризации у больных ИМпST при многососудистом поражении коронарного русла.
 Рекомендации Европейского общества кардиологов (версия 2014 г.) признают целесообразность многососудистого стентирования в рамках первичного ЧКВ не только у больных с кардиогенным шоком или рефрактерной ишемией, но и у пациентов со стабильной гемодинамикой, основываясь на доказательствах превентивной роли такого подхода [16, 17]. Можно предположить, что важнейшим компонентом превентивной составляющей ЧКВ при ИМпST и многососудистом поражении коронарного русла являются современные поколения стентов с лекарственным покрытием, что требует пристального изучения различных тактик реваскуляризации с их применением в рамках рандомизированных исследований, являющихся основой доказательной базы.
Рекомендации Европейского общества кардиологов (версия 2014 г.) признают целесообразность многососудистого стентирования в рамках первичного ЧКВ не только у больных с кардиогенным шоком или рефрактерной ишемией, но и у пациентов со стабильной гемодинамикой, основываясь на доказательствах превентивной роли такого подхода [16, 17]. Можно предположить, что важнейшим компонентом превентивной составляющей ЧКВ при ИМпST и многососудистом поражении коронарного русла являются современные поколения стентов с лекарственным покрытием, что требует пристального изучения различных тактик реваскуляризации с их применением в рамках рандомизированных исследований, являющихся основой доказательной базы.
Материал и методы
В исследование включали пациентов с ИМпST и многососудистым поражением, которые подверглись первичному ЧКВ. Протокол исследования соответствовал этическим нормам Хельсинкской декларации (версия 1975 г.), был одобрен локальным Этическим комитетом; кроме того, рандомизированное исследование было зарегистрировано на сайте www.clinical.gov (NCT01781715).
Под многососудистым поражением понимали наличие стенозов 2 основных эпикардиальных артерий и более или их крупных ветвей (≥2,5 мм) ≥70%. Критериями исключения являлись следующие: 1) однососудистое поражение; 2) острая сердечная недостаточность Killip 3—4 (отек легких или кардиогенный шок); 3) поражение ствола левой КА ≥50%; 4) малый диаметр КА (≤2,5 мм).
Все включенные в исследование больные имели длительный ангинозный приступ (≥30 мин), начавшийся менее чем за 12 ч до госпитализации, подъем сегмента на электрокардиограмме ≥1 мм в 2 последовательных отведениях от конечностей и более или ≥2 мм в грудных отведениях. Под успешным ЧКВ понимали финальный кровоток по целевым артериям не менее третьей градации TIMI с резидуальным остаточным стенозом ≤20%. Перед началом ЧКВ все пациенты получали нагрузочную дозу ацетилсалициловой кислоты и клопидогрела и нефракционированный гепарин. Базовое медикаментозное сопровождение после ЧКВ подразумевало назначение ацетилсалициловой кислоты, клопидогрела (на 12 мес), β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента и статинов. Все основные исследуемые группы пациентов были сопоставимы по спектру назначаемых лекарственных препаратов. Во всех случаях больные подписывали информированное согласие на участие в исследовании.
После скринингового обследования пациенты, соответствующие критериям включения и не имеющие критериев исключения, рандомизировались (метод конвертов) в одну из 2 исследуемых групп: 1) многососудистое стентирование в рамках первичного ЧКВ; 2) многососудистое стентирование в рамках поэтапной реваскуляризации (8,6±4,2 дня). Клинические и ангиографические данные были собраны в единую электронную базу.
«Первичными конечными точками» исследования были клинически значимые сердечно-сосудистые осложнения, куда были отнесены все случаи смерти (кардиальной и некардиальной), повторный ИМ, повторное вмешательство на целевых (TVR) и нецелевых (non-TVR) артериях. Кроме того, оценивали частоту «комбинированной конечной точки», суммирующей смерть, повторный ИМ и незапланированное вмешательство на целевых и нецелевых артериях.
Определенный тромбоз стента изучали на всем протяжении наблюдения, согласно общепринятой классификации ARC (Academic Research Consortium) [18]. Оценку результатов проводили с помощью сбора клинических данных при визите пациента в клинику или путем телефонного опроса спустя 30 дней и 12 мес после индексного события.
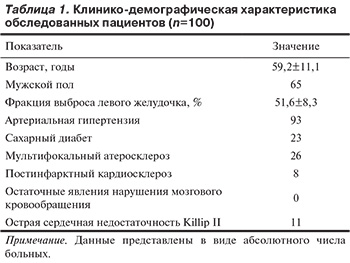
В табл. 1 приведены клинико-демографические показатели данной когорты пациентов. Средний возраст больных составил 59,2±11,1 года, преобладали больные мужского пола с сохраненной фракцией выброса левого желудочка.
В табл. 2 отражена ангиографическая характеристика пациентов, имплантированных стентов и тактики реваскуляризации. Благодаря использованной методике рандомизации (метод конвертов) соотношение пациентов в исследованных группах (одномоментное многососудистое стентирование и поэтапная реваскуляризация) составило 1:1.
 Обязательным условием исследования было выполнение второго этапа ЧКВ на сосудах, не связанных с инфарктом, в течение госпитального периода. Данный интервал составил 8,6±4,2 дня. У многих пациентов имелось трехсосудистое гемодинамически значимое поражение коронарного русла (44%), тяжесть поражения по шкале SYNTAX составляла 18,4±7,7 балла. Правая и передняя нисходящая являлись инфаркт-связанными КА в 47 и 40% случаев соответственно, при этом поражение огибающей артерии являлось причиной ИМ только у 13% пациентов.
Обязательным условием исследования было выполнение второго этапа ЧКВ на сосудах, не связанных с инфарктом, в течение госпитального периода. Данный интервал составил 8,6±4,2 дня. У многих пациентов имелось трехсосудистое гемодинамически значимое поражение коронарного русла (44%), тяжесть поражения по шкале SYNTAX составляла 18,4±7,7 балла. Правая и передняя нисходящая являлись инфаркт-связанными КА в 47 и 40% случаев соответственно, при этом поражение огибающей артерии являлось причиной ИМ только у 13% пациентов.
Дизайн исследования предполагал использование идентичных стентов с лекарственным покрытием второго поколения в 100% случаев. В каждом случае имплантировали стенты Resolute Integrity, покрытые зотаролимусом.
Таким образом, дизайн данного рандомизированного исследования был направлен на включение в анализ однородной когорты пациентов с ИМпST и многососудистым поражением, которые подвергались различным чрескожным стратегиям реваскуляризации в сроки, не превышающие 12 ч от момента развития симптомов заболевания. Исследуемая выборка характеризовались преобладанием пациентов мужского пола с сохранной глобальной сократительной способностью левого желудочка и существенной долей больных с сахарным диабетом и мультифокальным атеросклерозом. Значительное количество пациентов имело трехсосудистое поражение эпикардиальных артерий умеренной тяжести по шкале SYNTAX. В рамках исследования применялись однородные стенты с лекарственным покрытием (зотаролимус) второго поколения.
Статистическую обработку полученных данных проводили с использованием программного пакета Statistica version 6.0 (StatSoft, Inc. www.statsoft.com). Для описания признаков с нормальным распределением использовали среднее значение с указанием стандартного отклонения. Сравнение количественных признаков в группах проводили с помощью критерия Манна—Уитни. При оценке качественных признаков использовали критерий χ2 Пирсона с поправкой Йетса. Различия принимали как статистически значимые при р<0,05.
Результаты
Глобальная задача настоящего исследования предполагала изучение результатов различных тактик реваскуляризации у пациентов с ИМпST и многососудистым поражением. Пациенты исследуемых групп были сопоставимы по всем основным показателям.
В рамках анализа 30-дневных результатов различных тактик реваскуляризации с использованием стентов с лекарственным покрытием второго поколения в рандомизированном исследовании не получено статистически значимых различий по «конечным точкам» между исследуемыми группами (табл. 3).
В выборке пациентов, подвергшихся поэтапному ЧКВ, сердечно-сосудистых осложнений не зарегистрировано, тогда как среди больных, которым выполнялось одномоментное многососудистое стентирование при первичном ЧКВ, имелся один случай кардиальной смерти от прогрессирующей острой сердечной недостаточности у пожилой пациентки на 7-е сутки после ИМпST и ЧКВ, осложнившегося воздушной эмболией правой КА при окклюзии передней межжелудочковой и ветви тупого края.
В этой же группе пациентов выявлен один случай тромбоза одного из трех имплантированных стентов, произошедший на 14-е сутки после ЧКВ у пожилого больного с сахарным диабетом, с развитием нефатального ИМ. С учетом малого диаметра стента (2,5 мм) и отсутствия признаков ишемии на момент выполнения коронарографии повторная реваскуляризация целевого сосуда данному больному не выполнялась.
В рамках анализа годовых результатов различных тактик реваскуляризации с использованием стентов с лекарственным покрытием второго поколения в рандомизированном исследовании не получено статистически значимых различий по «конечным точкам» между исследуемыми группами (табл. 4).
В выборке пациентов, подвергшихся поэтапному ЧКВ спустя 6 мес после индексного события, был зарегистрирован единственный случай смерти, носящей некардиальный характер (рак прямой кишки), при этом дополнительных к 30-дневным результатам фатальных исходов в группе многососудистого стентирования не отмечено.
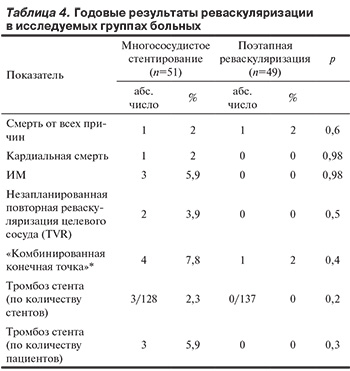 У пациентов, подвергшихся одномоментному многососудистому стентированию в рамках первичного ЧКВ, дополнительно произошло 2 случая тромбоза стента, ставших причиной нефатального ИМ и показанием к экстренной повторной реваскуляризации целевых сосудов. Эти осложнения стали следствием досрочной несанкционированной отмены пациентами двухкомпонентной антитромбоцитарной терапии спустя 3 и 6 мес после ЧКВ соответственно. Характерно, что в каждом из этих случаев отмечался тромбоз лишь одного из 3 имплантированных стентов в артериях, не связанных с зоной первичного повреждения миокарда.
У пациентов, подвергшихся одномоментному многососудистому стентированию в рамках первичного ЧКВ, дополнительно произошло 2 случая тромбоза стента, ставших причиной нефатального ИМ и показанием к экстренной повторной реваскуляризации целевых сосудов. Эти осложнения стали следствием досрочной несанкционированной отмены пациентами двухкомпонентной антитромбоцитарной терапии спустя 3 и 6 мес после ЧКВ соответственно. Характерно, что в каждом из этих случаев отмечался тромбоз лишь одного из 3 имплантированных стентов в артериях, не связанных с зоной первичного повреждения миокарда.
Таким образом, годовые исходы ЧКВ в группах многососудистого стентирования и поэтапной реваскуляризации с использованием стентов с лекарственным покрытием второго поколения статистически значимо не различались. Следует отметить, что тактика одномоментного многососудистого стентирования в представленных результатах выглядит в более высокой степени сопряженной с риском неблагоприятных исходов на протяжении 12 мес наблюдения. Это связано с развитием тромбоза стента у 3 пациентов. Однако очевидно, что наиболее клинически значимыми факторами данного осложнения являлась не тактика многососудистого стентирования, а несанкционированная отмена пациентами антитромбоцитарных препаратов.
Обсуждение
В рамках анализа 30-дневных результатов различных тактик реваскуляризации с использованием стентов с лекарственным покрытием второго поколения в рандомизированном исследовании не получено статистически значимых различий по «конечным точкам» между исследуемыми группами. В выборке пациентов, подвергшихся поэтапному ЧКВ, не зарегистрировано сердечно-сосудистых осложнений, тогда как среди больных, которым выполнялось одномоментное многососудистое стентирование при первичном ЧКВ, имел место один случай кардиальной смерти, связанной с большим объемом поврежденного миокарда и ятрогенным осложнением ЧКВ.
Некоторое увеличение риска тромбоза стентов в группе пациентов, получивших многососудистое стентирование в рамках первичного ЧКВ, в сравнении с группой поэтапного ЧКВ свидетельствует об особой важности постоянного приема пациентами препаратов двухкомпонентной антитромбоцитарной терапии на протяжении 12 мес.
Одной из ключевых гипотез, подтвержденной результатами данного рандомизированного исследования, была идея о том, что в когорте пациентов с ИМпST и многососудистым поражением, подвергшихся многососудистому стентированию при первичном ЧКВ или в рамках поэтапного подхода (8,6±4,2 дня), применение стентов с покрытием зотаролимусом дает многообещающие результаты, несмотря на исходно тяжелое состояние пациентов, в том числе обусловленное высокой распространенностью сахарного диабета (23%).
В соответствии с предыдущими рекомендациями по реваскуляризации ЧКВ при ИМпST должно выполняться лишь на ИСА, за исключением случаев кардиогенного шока [19]. Эти рекомендации основаны на гипотезе, что однососудистое ЧКВ более безопасно и экономически приемлемо. Действительно, ряд исследований показывают преимущества консервативного подхода со стентированием только ИСА, выражающиеся в снижении риска развития осложнений, связанных с ишемией миокарда в области кровоснабжения не-ИСА, уменьшении времени процедуры, объема рентгеноконтрастного вещества и дозы излучения [20, 21]. При этом отсутствуют результаты рандомизированных исследований, которые бы могли дать окончательный ответ на вопрос о выборе тактики реваскуляризации при ИМпST и многососудистом поражении. Кроме того, нет доказательной базы, оценивающей результаты применения стентов с лекарственным покрытием второго поколения в данной когорте больных. Это особенно важно с учетом появления новых современных коронарных стентов с лекарственным покрытием, способных существенным образом улучшить исходы реваскуляризации.
Рекомендации Европейского общества кардиологов (версия 2014 г.) признают целесообразность многососудистого стентирования в рамках первичного ЧКВ не только у больных с кардиогенным шоком или рефрактерной ишемией, но и у пациентов со стабильной гемодинамикой, основываясь на доказательствах превентивной роли такого подхода [16, 17]. Настоящее исследование преследовало цель дополнить наши знания об исходах ЧКВ с использованием стентов с лекарственным покрытием второго поколения при многососудистом стентировании в рамках первичного ЧКВ и этапной реваскуляризации (8,6±4,2 дня между этапами) у больных ИМпST. Было показано, что многососудистое стентирование в рамках первичного ЧКВ у пациентов с ИМпST при использовании стентов второго поколения, содержащих зотаролимус, ассоциируется с низкой частотой сердечно-сосудистых осложнений на протяжении 12 мес наблюдения. Это становится понятно при сравнении результатов с данными литературы, полученными на выборке пациентов с ИМпST и многососудистым поражением с использованием различных стентов. Так, риск неблагоприятных исходов в данной группе больных на протяжении 12 мес по результатам ряда исследований колеблется от 23,9 до 28%, частота повторного ИМ 1,6—8,8%, смерти 3,3—6,3%, тромбоза стента 1,8—4,2% [22, 23]. В настоящем рандомизированном исследовании при годовом наблюдении «комбинированная конечная точка», а также ИМ, смерть и тромбоз стента регистрировались с частотой 7,8, 5,9, 2 и 2,3%, соответственно.
Возможным объяснением высокой результативности тактики многососудистого ЧКВ (первичного и поэтапного) со стентами с лекарственным покрытием второго поколения являются оптимальные сроки полной реваскуляризации, а также хорошие характеристики данного устройства (доставляемость, радиальная устойчивость, толщина страт, состав полимерного покрытия и др.), позволяющие выполнить эффективное лечение при многососудистом поражении у больных ИМпST. К тому же системный воспалительный ответ, имеющийся при данной патологии, непосредственно связан с дестабилизацией атеросклеротических бляшек не только в ИСА, но и в других регионах коронарного русла, в связи с чем полная или субтотальная реваскуляризация может положительно влиять на исходы заболевания.
Полученные результаты подтверждают выдвинутую гипотезу о том, что многососудистое стентирование (при первичном ЧКВ или поэтапное) с применением стентов с лекарственным покрытием второго поколения безопасно и эффективно, что также может иметь и финансовую целесообразность по сравнению с неполной реваскуляризацией за счет снижения риска развития осложнений и числа внеплановых ЧКВ. Кроме того, данная тактика более удобна для пациента в отсутствие необходимости в повторной госпитализации для выполнения экстренного или планового ЧКВ.
Таким образом, в когорте пациентов с ИМпST и многососудистым поражением коронарного русла, подвергшихся реваскуляризации с применением стентов с лекарственным покрытием второго поколения, многососудистое стентирование в рамках первичного ЧКВ и поэтапной реваскуляризации (8,6±4,2 дня между этапами) дают сопоставимые удовлетворительные результаты и безопасность, а также демонстрируют большую эффективность при сравнении годовых результатов с данными литературы, включающими другие различные виды стентов.
Заключение
Результаты современных исследований и регистров не предлагают окончательных и оптимальных подходов к реваскуляризации у больных инфарктом миокарда с подъемом сегмента ST и многососудистым поражением. С учетом полученных в настоящем исследовании результатов становится очевидным, что многососудистое стентирование в рамках первичного чрескожного коронарного вмешательства (ЧКВ) и поэтапной реваскуляризации с лимитированным временны'м интервалом между ЧКВ может быть безопасной и эффективной опцией лечения больных инфарктом миокарда с подъемом сегмента ST с многососудистым поражением коронарного русла. По всей видимости, тенденция к более благоприятным исходам реваскуляризации одним из представленных способов многососудистого стентирования обусловлена, в частности, неопределенностью оптимальных сроков выполнения второго этапа ЧКВ (на сосудах, не связанных с областью инфарцирования миокарда) и ограниченной доступностью этого этапа для пациентов в условиях клинической практики. Несмотря на неоднозначное место многососудистого стентирования в рамках первичного ЧКВ у больных без кардиогенного шока, в представленном исследовании эта тактика не ассоциировалась с существенным возрастанием риска ни одного из учитываемых неблагоприятных событий в ближайшем и отдаленном периоде наблюдения по сравнению с поэтапной реваскуляризацией. Возможным объяснением высокой результативности тактики многососудистого ЧКВ (первичного и поэтапного) со стентами с лекарственным покрытием в виде зотаролимуса второго поколения являются оптимальные сроки полной реваскуляризации, а также хорошие характеристики данного устройства, позволяющие выполнить эффективное лечение при многососудистом поражении у больных инфарктом миокарда с подъемом сегмента ST.



