Проблема сохранения жизнеспособности миокарда и восстановление его функциональной активности при острой ишемии остается одной из важнейших в современной кардиологии. Широкое внедрение в лечение больных с острым коронарным синдромом (ОКС) в России тромболизиса, коронарной ангиопластики в сочетании с традиционными антикоагулянтами и дезагрегантами позволили за последние 10 лет ощутимо сократить смертность и снизить постинфарктную инвалидность больных [1]. В то же время тромболизис с учетом показаний удается осуществить лишь в 30% случаев ОКС, а почти 40% больным с ОКС ангиопластика не выполняется вследствие отдаленности специализированных центров или поздней обращаемости [2].
Вместе с тем тромболизис и внутрикоронарная ангиопластика, как правило, сопровождаются реперфузионной аритмией [3], развивающимися вследствие генерации в зоне реперфузии большого числа свободных радикалов в результате ускоренного окисления в кардиомиоцитах недоокисленных жирных кислот как продуктов энергетического обмена. Эти свободные радикалы обладают выраженными аритмогенными свойствами [4], активируют свертывающую систему крови, оказывают непосредственное повреждающее действие на мембрану кардиомиоцитов и их внутриклеточные структуры [5—7]. В связи с этим применение антиоксидантных кардиоцитопротекторов с первых часов ОКС представляется целесообразным. Ввиду того что жизнеспособность и восстановление функциональной активности миокарда при ОКС определяются в условиях гипоксии и окислительного стресса сохранением на должном уровне синтеза АТФ [8], уменьшение потребности ишемизированного миокарда в кислороде в этих условиях является оправданным. Оно может быть достигнуто благодаря использованию кардиопротекторов — средств, уменьшающих потребность клетки в кислороде для синтеза каждой молекулы АТФ [9]. Доказана способность отдельных препаратов ускорять восстановление сократимости левого желудочка (ЛЖ) и уменьшать выраженность реперфузионных аритмий при внутрикоронарном введении препарата на фоне реканализации инфаркт-ответственной артерии [10, 11].


Особый интерес вызывает отечественный кардиоцитопротектор мельдоний (милдронат, ОАО «Фармстандарт», Россия; АО «Гриндекс», Латвия), в основе действия которого лежит способность блокировать образование карнитина (из γ-бутиробетаина за счет конкурентного ингибирования γ-бутиробетаингидроксилазы), обеспечивающего транспорт свободных жирных кислот (СЖК) в митохондрии клетки. В результате ограничивается поступление СЖК как субстрата β-окисления в митохондрии. Основным источником энергии для синтеза АТФ при этом становится глюкоза, на окисление которой для синтеза АТФ требуется на 13—14% кислорода меньше, чем при окислении СЖК. При этом мельдоний не препятствует транспорту короткоцепочечных СЖК в митохондриии, что исключает дефицит субстрата окисления в случае умеренной гипоксиии [12]. Важно, что увеличение в крови γ-бутиробетаина сопровождается активацией экспрессии NO-синтазы, индуцирующей генерацию NO, а это определяет эндотелийпротективную активность милдроната [13]. Несмотря на большое число работ, доказавших кардиопротективную эффективность мельдония при стабильной стенокардии [14], хронической сердечной недостаточности [15—17], выражавшуюся в уменьшении частоты ангинозных приступов, повышении физической толерантности к физической нагрузке, способности препарата улучшать течение постинфарктного периода [18—20], опыт его применения в острый период инфаркта миокарда (ИМ) остается недостаточным. В отдельных работах показана способность мельдония при остром ИМ сокращать объем ишемизированного миокарда [21], замедлять формирование очага некроза [22], улучшать клиническое течение болезни, сокращать число осложнений, ускорять динамику электрокардиограммы (ЭКГ) и выраженность сердечной недостаточности [23, 24]. Все это доказывает перспективность широкого применения мельдония с первых часов ОКС в составе комплексной терапии. Однако комплексных исследований по оценке клинической эффективности мельдония при его использовании в составе комплексной терапии с первых часов лечения ОКС не проводилось.
 Цель работы: определить клиническую эффективность мельдония в составе комплексной терапии больных ОКС с подъемом сегмента ST на стационарном этапе реабилитации с оценкой параметров внутрисердечной гемодинамики, аритмической активности и состояния процессов свободнорадикального окисления при использовании препарата с первых часов
Цель работы: определить клиническую эффективность мельдония в составе комплексной терапии больных ОКС с подъемом сегмента ST на стационарном этапе реабилитации с оценкой параметров внутрисердечной гемодинамики, аритмической активности и состояния процессов свободнорадикального окисления при использовании препарата с первых часов
Материал и методы
В открытое рандомизированное (критерии рандомизации — пол, возраст, локализация ИМ — передний, задний) исследование включены 140 больных в возрасте 45—60 лет (54,8±3,1 года; 105 мужчин и 35 женщин в период менопаузы) с ОКС с подъемом сегмента ST и последующим исходом в Q-инфаркт миокарда (ИМ), без клинических проявлений хронической сердечной недостаточности в анамнезе. Больные разделены на 4 группы по характеру проводимой терапии: 1-я — получавшие тромболитическую терапию (ТЛТ) в сочетании с милдронатом (n=40), 2-я — получавшие ТЛТ без милдроната (n=40), 3-я — получавшие милдронат без тромболизиса (n=30), 4-я (n=30) — не получавшие ТЛТ и милдроната (в 3-й и 4-й группах тромболизис не проводился в связи с наличием противопоказаний — обострения язвенной болезни двенадцатиперстной кишки менее 3 мес — 12%), обращаемость более 6 ч с момента болевого приступа (68%), наличие в анамнезе за последние 6 мес нарушения мозгового кровообращения (15%), отказ пациента от тромболизиса (5%). В исследование включали пациентов с эффективным тромболизисом (сокращение элевации ST на 50% и более). Критерии включения — наличие ОКС в первые 6—12 ч, информированного согласия, отсутствие ангиопластики в 1-е сутки болезни. Из исследования исключали пациентов с кардиогенным шоком в 1-е сутки ОКС, клинически значимыми нарушениями ритма, проводимости, фибрилляцией предсердий, частой экстрасистолией при поступлении, стойкими нарушениями ритма (за исключением 12-часового периода с момента начала тромболизиса), препятствующими допплер-эхокардиографической оценке внутрисердечной гемодинамики, артериальной гипертонией 3-й степени, клапанными и врожденными пороками сердца, выраженными нарушениями функции органов дыхания, мочевыделения, пищеварения, ожирением более II степени, сахарным диабетом, а также хронической сердечной недостаточностью в анамнезе более I стадии. Верификацию ОКС проводили с учетом клинической картины, данных ЭКГ и уровня фракции МВ креатинфосфокиназы (МВ-КФК).
В качестве тромболитика использовали алтеплазу с 90-минутным режимом дозирования в течение 6 ч после начала симптомов ОКС — 15 мг внутривенно струйно, 50 мг — в виде внутривенной инфузии в течение первых 30 мин с последующей инфузией 35 мг в течение 60 мин.
 Милдронат вводили с момента поступления 1 г/сут внутривенно в течение 2 нед с переходом на пероральный прием до 1,5 мес. Базовая терапия во всех 4 группах включала нефракционированный гепарин (внутривенно струйно 5000 ед/ч до начала ТЛТ с последующей инфузией 1000 ед/ч в 1-е сутки под контролем активированного частичного тромбопластинового времени с последующим переходом при стабилизации состояния на фракционированный гепарин), ацетилсалициловую кислоту 150 мг/сут,метопролол 100—150 мг/сут, морфин в 1-е сутки для купирования болевого синдрома. В отдельных случаях, при наличии постинфарктной стенокардии дополняли изосорбид мононитратом (40—60 мг/сут).
Милдронат вводили с момента поступления 1 г/сут внутривенно в течение 2 нед с переходом на пероральный прием до 1,5 мес. Базовая терапия во всех 4 группах включала нефракционированный гепарин (внутривенно струйно 5000 ед/ч до начала ТЛТ с последующей инфузией 1000 ед/ч в 1-е сутки под контролем активированного частичного тромбопластинового времени с последующим переходом при стабилизации состояния на фракционированный гепарин), ацетилсалициловую кислоту 150 мг/сут,метопролол 100—150 мг/сут, морфин в 1-е сутки для купирования болевого синдрома. В отдельных случаях, при наличии постинфарктной стенокардии дополняли изосорбид мононитратом (40—60 мг/сут).
Больным, получавшим ТЛТ, в последующем выполняли ангиопластику инфаркт-ответственной артерии.
Методы исследования включали оценку параметров внутрисердечной гемодинамики, состояния процессов свободнорадикального окисления, отражающих выраженность окислительного стресса, пронатрийуретического гормона (NT-proBNP) как маркера степени левожелудочковой недостаточности в связи с экспрессией пептида в ответ на острое повышение внутрипредсердного давления при ОКС и развившемся ИМ [25, 26]. В 1-е, 7, 14 и 22—24-е сутки методом допплер-эхокардиографии (3,5—5 МГц, Vivit-5S), оценивали систолодиастолическую функцию ЛЖ с расчетом параметров трансмитрального потока: раннего и позднего диастолического наполнения — пики Е, А, Е/А, времени замедления раннего диастолического наполнения (DТЕ), время изоволюмического расслабления (IVRT) и сокращения ЛЖ (IVCT), фракцию выброса (ФВ), конечный диастолический объем (КДО) и конечное диастолическое давление (КДД) в полости ЛЖ (по Th. Stock) [27]. Рассчитывали индекс сократимости (ИС) ЛЖ как сумму баллов сократимости каждого из 16 сегментов ЛЖ/16 (сегменты в состоянии нормо-, гипо, а-, дискинезии оценивали соответственно в 1, 2, 3 и 4 балла; в норме ИС=1) [28]. Оценку аритмической активности проводили путем суточного холтеровского мониторирования в первые 12 ч с момента начала тромболизиса (оценку проводили по B. Lown и M. Wolf, 1971, в модификации M. Ryan, 1975), а также на 5-е, 14 и 22-е сутки с регистрацией числа желудочковых (ЖЭ) и наджелудочковых экстрасистол (НЖЭ).
Уровень липопероксидов в крови оценивали в 1-е, 2, 3, 7, 14 и 22-е сутки по содержанию первичных — диеновые конъюгаты (ДК; при D233), и вторичных — малоновый диальдегид (МДА) [29], продуктов перекисного окисления липидов в крови. Содержание NT-proBNP в крови определяли в 1-е, 5 и 20-е сутки. Уровень МВ-КФК оценивали в течение 6 ч с момента поступления. У всех больных, включенных в исследование, отмечено повышение уровня МВ-КФК, превышающее референтные значения более чем в 3 раза: группа, получавшая тромболизис+мельдоний — 87,7±4,9 ед/л, тромболизис — 102,4±5,7 ед/л, традиционную терапию без тромболизиса+мельдоний — 95,8±6,1 ед/л, только традиционную терапию — 84,6±5,3 ед/л.
Статистическую обработку данных выполняли стандартными методами параметрической статистики (Statistica 6.0), результаты представлены в виде средних значений и среднеквадратичных отклонений (M±m).
Результаты и обсуждение
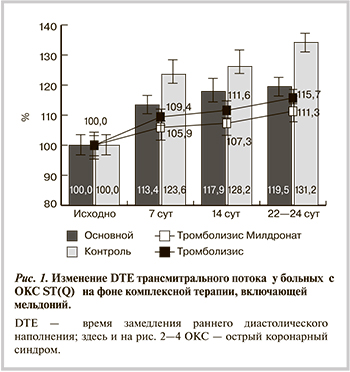
При оценке исходного состояния параметров внутрисердечной гемодинамики (табл. 1) во всех группах установлены низкие значения ФВ и КДО, невысокий уровень IVRT, некоторое снижение IVCT, повышение ИС, обусловленное наличием зон а- и гипокинезии ЛЖ, пониженное значение VE, соотношения VE/VА (менее 1), повышение величины VА, а также пограничные значения DTE, что соответствует I типу диастолической дисфункции ЛЖ и характерно для острого периода ИМ [27]. Анализ динамики параметров диастолической функции ЛЖ как одних из чувствительных и информативных показателей функционального состояния миокарда при ОКС и ИМ [30] показал, что включение милдроната в комплексную терапию больных с тромболизисом в значительной мере ускоряло восстановление VЕ: к 7-м суткам – на 11,9%, к 14-м суткам — на 26,6%, к 22-м суткам — на 28,6%, в то время как в группе сравнения в прирост начался с 14-х суток (на 10,1%), к 22-м суткам составил лишь 18,5%. Применение милдроната у больных без тромболизиса также ускоряло восстановление VЕ: к 7-м суткам – на 11,1%, к 14-м суткам — на 21,9%, к 22-м суткам — на 24,7%, в контрольной группе сравнения прирост начался лишь с 14-х суток (на 9%), к 22-м суткам — 15,5% (р<0,05). При этом в группах больных с тромболизисом не удалось обнаружить воздействия мельдония на степень увеличения продолжительности DTE, однако у больных без тромболизиса на фоне лечения мельдонием повышение DTE было более выраженным (p<0,05), чем без цитопротектора, соответственно на 19,5 и 31,3% к 22-м суткам (рис. 1). VА под влиянием мельдония у больных с тромболизисом снижалось в большей степени к 22-м суткам (на 22,3%), чем в группе сравнения с тромболизисом (на 12,4%; р<0,05). У больных без тромболизиса различия по интенсивности снижения VА между получавшей и не получавшей мельдоний группами (р<0,05) проявлялись с 14-х суток (на 21,6 и 10% соответственно), к 22-м суткам соответственно на 22,8 и 14,1%. Отношение VЕ/VА на фоне приема мельдония также возрастало в большей степени в обеих группах (рис. 2). В частности, у больных с тромболизисом, получавших мельдоний, VЕ /VА возрастало по сравнению с исходным к 7-м суткам на 19,7%, к 14-м суткам — на 54,5%, к 22-м суткам — на 63,6%, в контрольной группе сравнения с тромболизисом увеличение начиналось лишь с 14-х суток (на 17,2%) и продолжалось до 22-х суток (на 38,9%; р<0,05). У больных, получавших мельдоний без тромболизиса, также отмечен более выраженный прирост VЕ/VА, чем в контрольной группе, не получавшей мельдоний: к 7-м суткам на 21,37% только при лечении милдронатом, к 14-м суткам — на 62,9 и 21,2% соответственно, к 22-м суткам — на 67,2, 37,8% (р<0,05).
О позитивном влиянии мельдония на диастолическую функцию ЛЖ свидетельствовало менее выраженное (р<0,05) снижение IVRT к 22-м суткам в группах больных с тромболизисом (на 9%) и без него (на 8,4%), в то время как у лиц, не получавших мельдоний, сокращение IVRT регистрировалось уже к 14-м суткам как реакция на увеличение физической нагрузки в процессе госпитальной реабилитации [31], а к 22-м суткам уменьшение IVRT составляло соответственно 16,3 и 17,2%. Особенностей в характере восстановления ФВ и снижения КДО в процессе лечения в каждой из групп не обнаружено. Примечательно, что увеличение КДО наблюдалось лишь в процессе приема мельдония — к 22-м суткам при ТЛТ на 17,3%, без тромболизиса — на 12,5%.
Достоверных различий по характеру динамики ИС в группах больных, получавших и не получавших милдронат, не найдено, во всех случаях наблюдалось некоторое снижение ИС, свидетельствующее об улучшении сократительной активности отдельных сегментов ЛЖ в процессе госпитальной реабилитации. Особенностей снижения IVСT в группах не обнаружено.
Указанные изменения гемодинамики сердца на фоне лечения милдронатом сочетались с позитивной динамикой концентрации NT-proBNP в крови (см. табл. 1, рис. 3).
В 1-е сутки у всех больных наблюдалась повышенная концентрация NT-proBNP в крови, что отражало нарушение систолодиастолической функции ЛЖ при ОКС [32]. Включение мельдония в комплексную терапию сопровождалось дальнейшим менее выраженным приростом концентрации NT-proBNP в крови в процессе лечения как на фоне ТЛТ (к 14-м суткам — на 25,7%, к 22-м суткам — на 22,9%), так и без нее (к 5-м суткам — на 12,9%, к 14-м суткам — на 15,3%, к 22-м суткам — на 19,3%), в то время как в группах сравнения (без мельдония) после тромболизиса (к 5-м суткам — на 35,05%, к 14-м суткам — на 46,8%, к 22-м суткам — на 37,1%) и без ТЛТ (к 5-м суткам — на 34,3%, к 14-м суткам — на 51%, к 22-м суткам — на 39,9%) содержание NT-proBNP возрастало в большей степени (р<0,05).
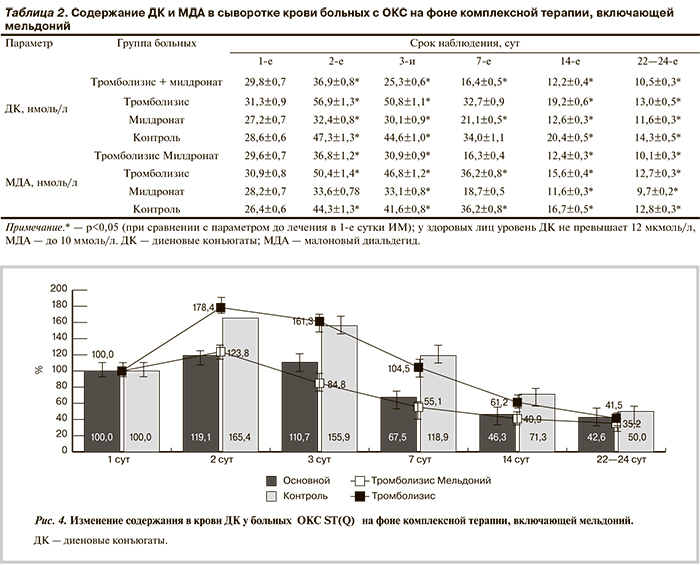
У всех включенных в исследование больных уровень продуктов деградации липопероксидов значительно превышал норму уже в 1-е сутки, ко 2-м суткам он достигал максимальных значений, после чего плавно снижался, приближался к референтным значениям (табл. 2, рис. 4). При этом в случаях проведения тромболизиса ко 2-м суткам уровень ДК и МДА был выше, чем у лиц без тромболизиса, что закономерно обусловлено реперфузионным синдромом. Включение мельдония в комплексную терапию существенно ограничивало прирост указанных параметров у больных как с тромболизисом, так и без него. В частности, при тромболизисе без мельдония уровень ДК ко 2-м суткам возрастал на 78,4%, в сочетании с мельдонием лишь — на 23,8%.
У больных в контрольной группе прирост составил 65,4%, при лечении мельдония — лишь 19,1%. Последующее снижение концентрации ДК при применении мельдония происходило более выраженными и ускоренными темпами. При тромболизисе в сочетании с мельдонием уровень ДК к 3-м суткам начинал снижаться на 15,2% и был меньше исходного, к 7-м суткам — на 44,9% и к 14-м суткам приближался к референтным значениям. У больных с тромболизисом без приема мельдония уровень ДК к 3-м суткам снизился незначительно и превышал исходный уровень на 61,3 %, к 7-м суткам достиг исходного уровня, к 14-м суткам снизился на 38,8%, значительно превышая референтные значения, к которым он приблизился лишь к 22-м суткам. У больных, не получавших ТЛТ на фоне приема мельдония, концентрация ДК к 3-м суткам превышала исходную лишь на 10,7%, к 7-м суткам была ниже исходной на 32,5%, к 14-м суткам — на 53,7%, приближаясь к референтным значениям. У лиц, не получавших мельдоний и тромболитики, уровень ДК к 3-м суткам превышал исходный на 55,9%, к 7-м суткам — на 18,9% и лишь к 14-м суткам стал ниже исходного на 28,7%, к 22-м суткам — на 50,1%, не достигнув референтных значений. Динамика концентрации МДА во всех группах носила аналогичный характер. Указанные различия между группами достоверны (р<0,05).

Таким образом, милдронат ограничивал прирост уровней ДК и МДА и ускорял их снижение в обеих группах больных, что свидетельствует об уменьшении выраженности окислительного стресса у больных ОКС с исходом в ИМ в течение 3-недельного периода реабилитации.
Оценка эктопической желудочковой активности в период проведения тромболизиса показала (табл. 3), что включение в комплексную терапию милдроната приводит к существенному сокращению числа желудочковых экстрасистол (ЖЭ) высоких градаций и большей, чем в группе сравнения, частоты ЖЭ низких градаций. Обращает внимание, что указанные особенности распределения градаций ЖЭ по частоте сочетаются с уменьшением уже в 1-е сутки терапии уровня продуктов перекисного окисления липидов у больных ОКС, применяющих на фоне тромболизиса милдронат. Это свидетельствует о способности препарата уменьшать наиболее опасные аритмические проявления реперфузионного синдрома. Вероятно, это обусловлено как его антиоксидантной, так и непосредственно цитопротективной активностью, ведущей к электрической стабилизации миокарда [33, 34], а также способностью повышать экспрессию NO эндотелием артерий [35, 36], что, несомненно, улучшает перфузию ишемизированной зоны.
Способность милдроната в составе комплексной терапии повышать электрическую стабильность миокарда в период госпитальной реабилитации ИМ доказывают и другие результаты настоящего исследования (табл. 4). В частности, число ЖЭ в группе, в которой проведен тромболизис и не применялся милдронат, к 14-м суткам по сравнению с 5-ми сутками возросло на 40,1%, что, видимо, обусловлено расширением в этот период двигательной активности.
В группе, где тромболизис сочетался с милдронатом, увеличение числа ЖЭ менее значимо — на 20,3% (p<0,05). В группах больных без тромболизиса по сравнению с 1-ми сутками число ЖЭ сокращается к 5-м суткам — при лечении мельдонием лишь на 58%, в группе без мельдония — на 69,5%.
К 14-м суткам число ЖЭ несколько возрастает, при лечении мельдонием на 73%, без его использования — на 84,3% (р<0,05). К 22-м суткам по числу ЖЭ различия между исследуемыми группами исчезают. По числу НЖЭ различия между группами с тромболизисом, получавшими мельдоний, и группами сравнения не определяются в течение всего периода наблюдения. Однако у пациентов без тромболизиса, получавших мельдоний, в отличие от контрольной группы НЖЭ возникали реже, в сравнении с 1-ми сутками к 5-м суткам их число не изменилось, в контрольной группе — возросло на 27%, к 14-м суткам в основной группе — число НЖЭ возросло на 26,9%, в контрольной — на 74,1%, к 22-м суткам — на 56,0% и 117,2 % соответственно.
Таким образом, включение мельдония в комплексную терапию больных ОКС с первых часов позволяет сократить число желудочковых нарушений ритма высоких градаций по Lown при реперфузионном синдроме на фоне тромболизиса, уменьшить в процессе госпитальной реабилитации прирост как ЖЭ, так и НЖЭ.
Включение мельдония (милдроната) в терапию ОКС с исходом в Q-ИМ повышало электрическую стабильность миокарда, ускоряло восстановление диастолической функции ЛЖ, что согласуется со снижением концентрации NT-proBNP в крови в результате уменьшения его генерации и, бесспорно, свидетельствует об улучшении функциональной активности миокарда ЛЖ [27] за счет улучшения энергетического метаболизма кардиомиоцитов [37] и снижения выраженности окислительного стресса на фоне ИМ.
Это подтверждается уменьшением концентраций продуктов деградации липопероксидов — ДК и МДА, в крови. Применение мельдония в дебюте медикаментозной терапии ОКС позволяет уменьшить последствия реперфузионного синдрома при ТЛТ. Это подтверждается уменьшением числа ЖЭ высоких градаций в первые 6 ч после тромболизиса, что уменьшает вероятность возникновения фатальных аритмий и улучшает прогноз госпитального этапа реабилитации больных ОКС с исходом в Q-ИМ. Полученные результаты свидетельствуют о реальной перспективности применения мельдония с первых минут лечения ОКС, что позволит улучшить клиническое течение болезни, ускорить восстановление функциональной активности ЛЖ, снизить вероятность аритмических осложнений.
Выводы
- Включение мельдония (милдроната) в комплексную терапию больных с острым коронарным синдромом улучшает диастолическую функцию миокарда левого желудочка, что проявляется восстановлением параметров трансмитрального потока и сопровождается снижением содержания NT-proBNP в крови.
- Применение мельдония с первых часов госпитальной терапии в сочетании с тромболитиками при острым коронарным синдроме уменьшает частоту аритмических эпизодов в процессе госпитальной реабилитации.
- Терапия мельдонием у больных с острым коронарным синдромом уменьшает проявления окислительного стресса, что подтверждается менее выраженным приростом в крови концентрации диеновых конъюгатов и малонового диальдегида — продуктов деградации липопероксидов.



