Несмотря на современное лечение острого коронарного синдрома (ОКС), частота неблагоприятных исходов в среднесрочной и более отдаленной перспективе остается неприемлемо высокой. Так, в ретроспективном когортном исследовании, объединившем сведения из национальных баз данных Швеции о 97 254 больных, которые были госпитализированы с инфарктом миокарда (ИМ) с 2006 по 2011 г. и оставались в живых в течение 1 нед после выписки, совокупная частота смерти от сердечно-сосудистых осложнений, развития несмертельного повторного ИМ или несмертельного инсульта в течение ближайшего года составила 18,3% [1].
У больных, не имевших указанных неблагоприятных исходов в первые 12 мес, их частота в последующие 3 года составила 20%.
По данным Британской и Бельгийской частей регистра GRACE, за 5 лет не было существенных различий по смертности у лиц, перенесших ИМ со стойким подъемом сегмента ST на электрокардиограмме (ЭКГ), ИМ без подъема сегмента ST или нестабильную стенокардию (19%, 22 и 17% соответственно), причем среди умерших после ИМ с подъемом сегмента ST на ЭКГ летальный исход наступал после выписки в 68% случаях, при ИМ без подъема сегмента ST — в 86% случаев, при нестабильной стенокардии — у 97% больных [2].
Причину возобновления ишемии миокарда после ОКС изучали в проспективном исследовании PROSPECT, включившем 697 больных, которым было успешно проведено коронарное стентирование. Сумма случаев смерти от кардиальных причин, остановки сердца, ИМ или госпитализации из-за нестабильной стенокардии за 3 года составила 20,4% и была наиболее высокой в первый год после ОКС [3]. При этом оказалось, что только половина случаев повторного утяжеления коронарной болезни сердца обусловлена стенозами, ответственными за первоначальное возникновение ОКС, в то время как у остальных больных ухудшение было сопряжено с поражением других сегментов коронарного русла. Очевидно, это свидетельствует о том, что усилия по вторичной профилактике ОКС должны быть направлены не только на профилактику тромбоза стента в стенозе, ставшего причиной нестабильности, но и на предотвращение тромботических осложнений в других участках коронарного русла. С этой точки зрения, ОКС можно рассматривать как маркер повышенного риска тромботических осложнений атеросклероза как системного заболевания, длительное усиленное антитромботическое лечение — как попытку предотвратить клинически выраженное тромбообразование при разрыве ранимых атеросклеротических бляшек в коронарных артериях.
Таким образом, в настоящее время существует потребность в улучшении подходов к длительной вторичной профилактике коронарного тромбоза после перенесенного ОКС. Одним из способов улучшить прогноз заболевания является повышение эффективности антитромботического лечения. Вместе с тем большая степень угнетения процессов тромбообразования обычно сопряжена с увеличением частоты кровотечений, поэтому насущной задачей является обеспечение приемлемого соотношения пользы и риска антитромботических вмешательств. Этого можно добиться как за счет появления более эффективных и безопасных режимов лечения, так и за счет избирательного применения усиленной антитромботической терапии у пациентов с достаточно высоким риском развития тромботических осложнений (когда ожидаемая польза активного лечения максимальна), с одной стороны, и не слишком выраженной опасностью спровоцировать тяжелое кровотечение — с другой.
Наиболее распространенным подходом к длительной вторичной профилактике коронарного тромбоза после ОКС у больных, не имеющих показаний к длительному использованию антикоагулянтов, является сочетание ацетилсалициловой кислоты (АСК) и блокатора рецептора тромбоцитов P2Y12 клопидогрела, которое рекомендуется использовать на протяжении ближайшего года [4—8]. Повысить эффективность лечения больных отдельных категорий с ОКС можно за счет замены клопидогрела блокаторами рецептора P2Y12 с более выраженным подавлением функциональной активности тромбоцитов — тикагрелором или прасугрелом.
Другое перспективное направление — усилить антитромботическое лечение за счет добавления к сочетанию АСК и клопидогрела перорального антикоагулянта.
Основания для длительного применения антикоагулянтов после ОКС. Процессы свертывания крови, приводящие к образованию фибрина, и активация тромбоцитов, приводящая к их агрегации, тесно взаимосвязаны. Так, сборка протромбиназного комплекса, необходимого для образования тромбина, происходит на поверхности активированных тромбоцитов. Появившийся тромбин, с одной стороны, по механизму обратной связи может усилить свое образование, с другой, за счет активации соответствующего рецептора на мембране тромбоцитов способствует дальнейшему повышению их функциональной активности [9]. Уменьшение количества образовавшегося тромбина или блокада его воздействия антикоагулянтами способствует заметному усилению антитромботического эффекта. В настоящее время такой подход реализуется в первую неделю лечения ОКС за счет парентерального введения антикоагулянтов.
Вместе с тем свидетельства повышенного образования тромбина после ОКС сохраняются намного дольше. Так, в проспективном исследовании P.A. Merlini и соавт. уровень в плазме крови биохимических маркеров, свидетельствующих о продолжающемся образовании тромбина (фрагмент протромбина 1+2, фибринопептид А), у многих пациентов с неосложненным течением заболевания сохранялся повышенным через 6 мес после ИМ и эпизода нестабильной стенокардии [10]. Аналогичный результат получен при изучении концентрации фрагмента протромбина 1+2 в плазме крови у 319 последовательно поступивших больных в исследовании GUSTO IIb, причем усредненное значение этого показателя не снижалось и через 12 мес от начала заболевания [11]. Анализ уровня фрагмента протромбина 1+2 и D-димера в крови у 485 больных ОКС без стойкого подъема сегмента ST в исследовании CURE показал, что концентрации этих маркеров активации системы гемостаза повышаются к 7-м и не снижается к 30-м суткам после начала лечения, а добавление к АСК клопидогрела влияния на данный процесс не оказывает [12]. Все это делает привлекательной гипотезу о возможности повысить эффективность профилактики неблагоприятных исходов после ОКС с помощью длительного использования антикоагулянта.

В клинических исследованиях возможность предупреждения коронарных осложнений после ОКС за счет длительного применения антикоагулянтов продемонстрирована на примере антагонистов витамина К. Согласно накопленным фактам, антагонисты витамина К могут без потери эффективности лечения заменить клопидогрел в составе двухкомпонентной антитромбоцитарной терапии при целевых значениях международного нормализованного отношения (МНО) 2,0—2,5, а при целевом МНО 2,5—3,5, по-видимому, способны конкурировать с сочетанием этих двух антиагрегантов [13—20].
Хотя при добавлении антагониста витамина К к сочетанию АСК и клопидогрела ожидается уменьшение числа повторных ИМ, риск крупных кровотечений достаточно высок и способен нивелировать пользу от дополнительного снижения частоты развития осложнений, связанных с активацией тромбообразования в коронарных артериях [13, 18, 21, 22]. Поэтому трехкомпонентная антитромботическая терапия с длительным использованием антагонистов витамина К в настоящее время рассматривается преимущественно у больных ОКС, подвергнутых коронарному стентированию и одновременно нуждающихся в длительном использовании лечебных доз антикоагулянтов (в частности, при наличии фибрилляции предсердий). Ее применение в остальных случаях обычно не оправдано.
Опыт сочетания антагонистов витамина К с АСК и клопидогрелом указывает на важность выбора дозы перорального антикоагулянта в составе трехкомпонентной антитромботический терапии, которая должна быть подобрана таким образом, чтобы неизбежное увеличение опасности кровотечений оказалось приемлемым с клинической точки зрения и в итоге не препятствовало проявлению ожидаемого положительного влияния на частоту развития ишемических осложнений. Единственным пероральным антикоагулянтом, при клиническом изучении которого эта цель была достигнута, является ривароксабан.
Ривароксабан в профилактике неблагоприятных исходов после ОКС: основные результаты исследования ATLAS ACS 2—TIMI 51. Ривароксабан был одобрен Европейским медицинским агентством для использования при ОКС после появления результатов крупного (15 526 больных) проспективного многоцентрового двойного слепого плацебо-контролируемого исследования ATLAS ACS 2-TIMI 51 [23, 24]. Этому клиническому испытанию предшествовало аналогичное исследование ATLAS ACS-TIMI 46 меньшего размера (3491 больной), в результате которого из многих вариантов были выбраны две дозы ривароксабана, перспективные для дальнейшего изучения в добавление к АСК и ее сочетанию с клопидогрелом — 2,5 или 5 мг 2 раза в сутки [25].
Представление о контингенте больных ОКС, к которым относятся результаты исследования ATLAS ACS 2-TIMI 51, можно составить на основании критериев включения в это клиническое испытание и исключения из него (табл. 1). В исследование следовало отбирать больных ИМ или нестабильной стенокардией с высоким риском неблагоприятного течения заболевания (наличием смещений сегмента ST на ЭКГ или высокими значениями индекса риска TIMI). При этом больные моложе 54 лет должны были иметь сахарный диабет или ИМ в анамнезе. Таким образом, речь идет об ОКС с достаточно высоким риском неблагоприятного течения заболевания.
В исследование ривароксабана при ОКС не включали больных, нуждающихся в длительном использовании антикоагулянтов. Это крайне важно, поскольку изучавшаяся доза ривароксабана была в 2—4 раза ниже, чем необходима для профилактики инсульта при неклапанной фибрилляции предсердий (15—20 мг 1 раз в сутки) или длительного лечения проксимального тромбоза глубоких вен и/или тромбоэмболии легочной артерии (20 мг 1 раз в сутки). Причина выбора более низкой дозы ривароксабана при ОКС — стремление уменьшить риск кровотечений, когда препарат применяется не в качестве монотерапии, а в сочетании с двумя антиагрегантами. К другим важным ограничениям относили неприемлемо высокий риск кровотечений, включавший внутричерепное кровотечение в анамнезе. Ишемический инсульт (ИИ) или транзиторная ишемическая атака (ТИА) в анамнезе не служили препятствием для изучения ривароксабана в сочетании с АСК, но были отнесены к критериям невключения, когда одновременно применяли два антиагреганта. Как и в других исследованиях ривароксабана, ограничивающим фактором являлся клиренс креатинина ниже 30 мл/мин.
Рандомизация в исследовании ATLAS ACS 2-TIMI 51 осуществлялась с учетом решения врачей использовать монотерапию АСК или ее сочетание с производным тиенопиридина (клопидогрелом или тиклопидином). В итоге 93,2% больных получали два антиагреганта и только у 1049 использовалась монотерапия АСК. Соответственно, полученные результаты имеют отношение, прежде всего, к случаям, когда низкая доза перорального антикоагулянта добавляется к сочетанию АСК с клопидогрелом или тиклопидином, Одну из двух доз ривароксабана или плацебо добавляли к антиагрегантам в первые 7 сут (медиана 4,7 сут) после госпитализации (вслед за прекращением парентерального введения антикоагулянта), когда состояние больных было стабилизировано и завершены первоначальные этапы лечения ОКС (включая реваскуляризацию миокарда).
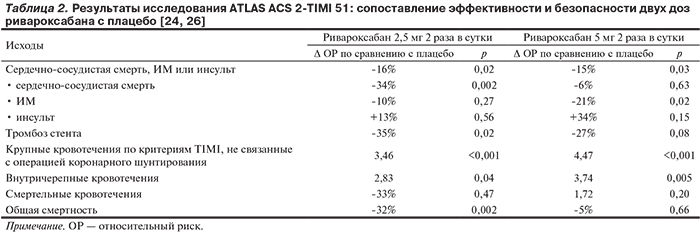
В исследовании ATLAS ACS 2-TIMI 51 достаточно хорошо представлены больные ИМ со стойким подъемом сегмента ST на ЭКГ (50,3%), ИМ без стойкого подъема сегмента ST на ЭКГ (25,6%), нестабильной стенокардией (24%) с умеренным и высоким риском неблагоприятного исхода (96,1% в этой категории имели сумму баллов по шкале TIMI не ниже 3). Тромболитическая терапия при ИМ со стойким подъемом сегмента ST на ЭКГ выполнялась 25,6%, чрескожное коронарное вмешательство (ЧКВ) для лечения ОКС – 60,1% пациентов. Таким образом, исследование ATLAS ACS 2-TIMI 51 позволяет проследить эффекты ривароксабана у широкого круга больных ОКС и высоким риском неблагоприятного течения заболевания и охарактеризовать его эффективность и безопасность при различных подходах к ведению подобных больных. Единственной подгруппой, мало представленной в данном клиническом испытании, является ОКС, в ранние сроки обусловивший необходимость операции коронарного шунтирования (всего 62 больных).
Основной результат исследования ATLAS ACS 2-TIMI 51 был положительным: сумма случаев сердечно-сосудистой смерти, ИМ или инсульта в среднем за 13,1 мес составила 8,9% в группах ривароксабана и 10,7% в группе плацебо, что соответствует снижению риска на 16% (р=0,008). В итоге предотвращено 17 неблагоприятных исходов на каждые 1000 леченых пациентов. Эффективность ривароксабана существенно не различалась при ИМ со стойким подъемом сегмента ST на ЭКГ, ИМ без стойкого подъема сегмента ST и у больных нестабильной стенокардией, имевших, согласно критериям отбора, повышенный риск неблагоприятного течения заболевания.
Результаты сопоставления двух изучавшихся доз ривароксабана с плацебо приведены в табл. 2. Обе дозы обеспечивали равное снижение риска суммы случаев сердечно-сосудистой смерти, ИМ или инсульта. Наряду с этим в группе пациентов, рандомизированных к дозе ривароксабана 2,5 мг 2 раза в сутки, отмечалось достоверное снижение риска тромбоза стента на 35%, сердечно-сосудистой и общей смертности на 34 и 32% соответственно. С другой стороны, добавление к лечению ривароксабана способствовало увеличению риска крупных кровотечений по критериям TIMI, не связанных с операцией коронарного шунтирования, в 3,46 раза и внутричерепных кровотечений в 2,83 раза. При этом риск смертельных кровотечений не увеличился. В итоге в абсолютном выражении в группе ривароксабана на каждую 1000 леченых пациентов было предотвращено 17 случаев сердечно-сосудистой смерти, ИМ или инсульта, 14 сердечно-сосудистых смертей, 16 смертей от всех причин, 7 тромбозов стента ценой 12 крупных кровотечений, не связанных с операцией коронарного шунтирования, и 2 внутричерепных кровотечений. Несмотря на увеличение частоты серьезных кровотечений, итоговый клинический эффект — снижение сердечно-сосудистой и общей смертности — указывает на преобладание пользы от добавления очень низкой дозы ривароксабана к антиагрегантам у больных с высоким риском неблагоприятного исхода, недавно перенесших ОКС. Именно эта доза ривароксабана и была рекомендована к практическому использованию.
У больных, рандомизированных к приему ривароксабана в дозе 5 мг 2 раза в сутки, отмечено еще более выраженное увеличение риска крупных и внутричерепных кровотечений, и не было положительного влияния на смертность. В итоге применение этой дозы признано неоправданным.
В дальнейшем был проведен анализ в подгруппах, позволяющий оценить роль ривароксабана в дозе 2,5 мг 2 раза в сутки в ситуациях, наиболее приближенных к повседневной практике лечения больных ОКС. Так, в подгруппе больных, исходно получавших АСК в сочетании с клопидогрелом или тиклопидином, итоги оценки эффективности ривароксабана воспроизводили общий результат исследования ATLAS ACS 2-TIMI 51: при сравнении с плацебо снижение риска суммы случаев сердечно-сосудистой смерти, ИМ или инсульта составило 15% (р=0,039), сердечно-сосудистой смерти 38% (р<0,001), смерти от всех причин 36% (р<0,001), что соответствовало предотвращению 14, 17 и 18 неблагоприятных исходов на каждую 1000 леченых пациентов соответственно. Сходный результат получен для ИМ со стойким подъемом сегмента ST на ЭКГ, причем положительное влияние добавления очень низкой дозы ривароксабана к сочетанию двух антиагрегантов на сердечно-сосудистую смертность при ЧКВ, тромболитической терапии и у больных, оставшихся без реперфузионного лечения, существенно не различалось [27]. Добавление ривароксабана способствовало снижению риска тромбоза как голометаллических стентов, так и стентов, выделяющих лекарственные вещества, и в целом у больных, подвергшихся стентированию сосудов, риск сердечно-сосудистой смерти в группе ривароксабана в дозе 2,5 мг 2 раза в сутки был ниже на 44% (р=0,014) [28]. Добавление к антиагрегантам ривароксабана способствовало снижению риска развития ИМ 1-го типа (по совокупным данным на 20%; р=0,01) как со сравнительно небольшим повышением уровней кардиоспецифичного тропонина или КФК-МВ в крови, так и в случаях, когда речь идет об обширном некрозе миокарда (пиковая концентрация сердечного тропонина от 200 или КФК-МВ от 10 раз выше верхней границы нормы) [29].
Таким образом, очевидно, что добавление низкой дозы ривароксабана к сочетанию АСК с клопидогрелом или тиклопидином у больных ОКС при достаточно высоком риске неблагоприятного исхода, с одной стороны, позволяет уменьшить частоту тромботических осложнений, с другой — может спровоцировать клинически значимые кровотечения. В целом представляется, что польза изученного подхода превосходит риск, поскольку в итоге отмечено снижение смертности.
Тем не менее в подобной ситуации особую актуальность приобретает вопрос, у каких категорий больных польза от усиления антитромботического лечения в наибольшей степени превосходит риск развития клинически значимых кровотечений. Иногда ответ можно получить при анализе подгрупп пациентов.
В исследовании ATLAS ACS 2-TIMI 51 степень снижения риска суммы сердечно-сосудистой смерти, ИМ или инсульта в различных подгруппах больных существенно не различалась [24]. Единственное исключение — малочисленная подгруппа с ИИ или ТИА в анамнезе, в которой при добавлении ривароксабана к монотерапии АСК отмечалась тенденция к увеличению частоты неблагоприятных исходов. Соответственно, наличие инсульта или ТИА в анамнезе считается противопоказанием к добавлению низкой дозы ривароксабана к антиагрегантам при ОКС. Не отмечено существенных отличий и по степени увеличения риска крупных кровотечений, не связанных с операцией коронарного шунтирования. Таким образом, анализ подгрупп в исследовании ATLAS ACS 2-TIMI 51 не дает возможности определить, у каких категорий больных, включенных в это клиническое испытание, применение ривароксабана наиболее оправдано.
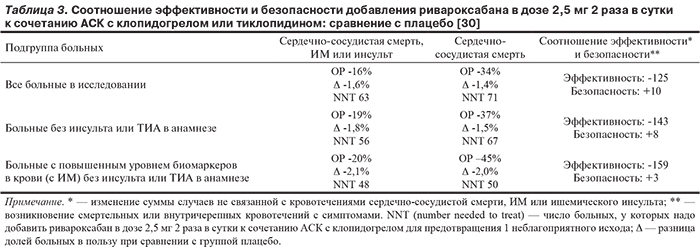
В дальнейшем был проведен сравнительный анализ абсолютной частоты предотвращенных и спровоцированных неблагоприятных исходов. Его результат представлен в табл. 3. Наиболее благоприятным соотношение эффективности (уменьшение числа ишемических событий вне связи с кровотечением) и риска (возникновение наиболее опасных кровотечений) оказалось в подгруппе пациентов с повышенным уровнем маркеров некроза миокарда в крови (с ИМ), не имевших инсульта или ТИА в анамнезе [30]. Снижение риска суммы случаев сердечно-сосудистой смерти, ИМ или инсульта составило у них 20% (р=0,007), сердечно-сосудистой смертности 45% (р<0,001), общей смертности 42% (р<0,001). В итоге именно о таких больных идет речь в официальных показаниях к применению ривароксабана после недавно перенесенного ОКС.
Таким образом, согласно результатам исследования ATLAS ACS 2-TIMI 51, у больных ОКС, не имеющих показаний к длительному использованию высоких доз антикоагулянтов, добавление к сочетанию АСК с клопидогрелом или тиклопидином очень низкой дозы ривароксабана (2,5 мг 2 раза в сутки) в среднем на 1 год способствует снижению совокупной частоты развития инсульта, тромбоза стента, а также сердечно-сосудистой и общей смертности. Это преимущество распространяется на больных ИМ с подъемом сегмента ST и больных ОКС без подъемов сегмента ST, имеющих высокий риск неблагоприятного течения заболевания. Данный подход сопровождается увеличением частоты возникновения клинически значимых кровотечений, однако опасность смертельных кровотечений не увеличивается и при надлежащем отборе больных ожидаемая польза перевешивает риск. В настоящее время наилучшими кандидатами для использования данного режима антитромботической терапии после ОКС представляются больные ИМ без инсульта или ТИА в анамнезе и высокого риска кровотечений (как минимум критериев исключения из исследования ATLAS).
Практические аспекты применения ривароксабана после ОКС. Несомненно, что на практике ривароксабан должен использоваться именно у больных тех категорий и именно таким образом, как это было изучено в исследовании ATLAS ACS -TIMI 51.
Длительное (не менее 1 года) применение ривароксабана в очень низкой дозе (2,5 мг 2 раза в сутки) следует добавить к сочетанию АСК с клопидогрелом или тиклопидином через 1—7 дней от начала лечения ОКС после прекращения парентерального введения антикоагулянта и завершения первоначальных стратегий лечения (включая ЧКВ) у достигших стабильного состояния больных ИМ (как с подъемом, так и без подъема сегмента ST на ЭКГ) как минимум без высокого риска развития кровотечений, инсульта или ТИА в анамнезе, фибрилляции предсердий и других показаний к длительному применению более высоких доз антикоагулянтов, клиренса креатинина <30 мл/мин, существенного заболевания печени, применения сильных ингибиторов CYP 3A4 и гликопротеина P.
В настоящее время после коронарного стентирования при ОКС у больных фибрилляцией предсердий с низким риском развития инсульта (сумма баллов по шкале CHA2DS2-VASc1 у мужчин или 2 у женщин) в качестве альтернативы подходам с использованием лечебных доз пероральных антикоагулянтов предлагают ограничиться двухкомпонентной антитромбоцитарной терапией [4]. Подобные больные могли включаться и в исследование ATLAS ACS 2-TIMI 51, что может сделать их потенциальными кандидатами для использования сочетания АСК, клопидогрела и низкой дозы ривароксабана (см. табл. 1). Однако последствия отказа от профилактики инсульта надлежащими дозами антикоагулянтов у больных этой категории остаются невыясненными.
Впервые возможность использования ривароксабана при ОКС предусмотрена в рекомендациях Европейского кардиологического общества по лечению острого ИМ с подъемом сегмента ST на ЭКГ, обновленных в 2012 г. [6]. Указано, что его применение в низкой дозе (2,5 мг 2 раза в сутки) можно рассматривать у отдельных больных, получающих АСК и клопидогрел при низком риске развития кровотечений (класс IIb, степень доказанности B). В последующем этот текст был воспроизведен для случаев выполнения ЧКВ при ОКС в рекомендациях Европейского кардиологического общества по реваскуляризации, обновленных в 2014 г. [8]. В обновленной версии рекомендаций Европейского кардиологического общества по лечению ОКС без стойкого подъема сегмента ST на ЭКГ, появившейся в 2015 г., отмечено, что «у больных ИМ без подъема ST, с высоким ишемическим риском и низким риском кровотечения, без инсульта или ТИА в анамнезе, получающих АСК и клопидогрел, низкая доза ривароксабана (2,5 мг 2 раза в сутки в течение примерно 1 года) может рассматриваться после прекращения парентерального введения антикоагулянтов» (класс IIb, степень доказательности B) [4].
При этом в рекомендациях не указано, каким образом выделять пациентов с низким риском кровотечения (или опасностью кровотечения, при которой добавление ривароксабана к антиагрегантам представляется оправданным). Предлагают только соблюдать осторожность у больных в возрасте старше 75 лет и с массой тела менее 60 кг [4]. Анализ исследования ATLAS ACS 2-TIMI 51 не дает по этому поводу особых указаний. Существующие шкалы оценки риска развития крупных кровотечений (CRUSADE, HAS-BLED и др.) не использовались для отбора больных к лечению ривароксабаном после ОКС и, соответственно, возможность их применения для этой цели неясна. В такой ситуации представляется разумным ограничить широкое применение ривароксабана как минимум у пациентов с повышенным риском развития кровотечений, которые не включались в исследование ATLAS ACS 2-TIMI 51 (см. табл. 1).
Ривароксабан и монотерапия АСК. У 1049 (6,8%) больных, включенных в исследование ATLAS ACS 2-TIMI 51, по тем или иным причинам с самого начала изучения использовалась монотерапия АСК. Из-за малого числа больных с достаточной надежностью судить об эффективности применения ривароксабана в этой подгруппе не представляется возможным. После увеличения числа наблюдений до 1604 за счет учета результатов применения ривароксабана в дополнение к монотерапии АСК в исследовании ATLAS ACS-TIMI 46, выполненном по аналогичному протоколу, оказалось, что риск суммы сердечно-сосудистой смерти, ИМ или инсульта достоверно ниже в группах ривароксабана (р=0,016) [31].
У отдельных больных в исследовании ATLAS ACS 2-TIMI 51 длительность использования ривароксабана была существенно больше 1 года и могла достигать 31 мес. Среди больных, исходно получавших сочетание АСК с клопидогрелом или тиклопидином, через 6 мес и более 72,6% продолжали принимать два антиагреганта. Через 12 мес и более производное тиенопиридина принимали 45,4% больных, через 18 мес и более – 19,4%. При этом несмотря на переход многих больных на монотерапию АСК, после 12 мес кривые накопления неблагоприятных исходов (сумма случаев сердечно-сосудистой смерти, ИМ или инсульта, а также сердечно-сосудистая и общая смертность) продолжали расходиться в пользу ривароксабана в дозе 2,5 мг 2 раза в сутки.
Все это позволяет надеяться, что при достаточно высоком риске неблагоприятного исхода продление приема ривароксабана может оказаться полезным и за пределами 1 года после ОКС, когда большинство больных прекращают двухкомпонентную антитромбоцитарную терапию и переходят на монотерапию АСК. Однако поскольку число наблюдений в столь отдаленные сроки заболевания было сравнительно небольшим, фактов для определенных практических рекомендаций пока недостаточно [4].
Сопоставление доступных возможностей усиленного антитромботического лечения после ОКС. В настоящее время в нашей стране у больных, не имеющих показаний к длительному применению антикоагулянтов, существуют две возможности повысить эффективность профилактики неблагоприятных исходов ОКС с помощью антитромботической терапии — предпочесть сочетанию АСК с клопидогрелом ее сочетание с тикагрелором или к сочетанию АСК с клопидогрелом добавить низкую дозу ривароксабана (2,5 мг 2 раза в сутки) [26, 32]. Оба подхода обеспечивают снижение совокупного риска сердечно-сосудистой смерти, развития ИМ или инсульта, а также опасности тромбоза стента, сердечно-сосудистой и общей смертности ценой роста частоты крупных кровотечений, не связанных с операцией коронарного шунтирования. Поскольку прямого сопоставления не проводилось, судить об их сравнительной эффективности и безопасности нельзя. Наиболее очевидными являются различия по контингентам изученных больных и особенностям применения на практике, на которые стоит обратить внимание при принятии решения.
Тикагрелор изучен и рекомендуется при ОКС без стойкого подъема сегмента ST на ЭКГ у больных с умеренным и высоким риском неблагоприятного исхода, а также при планируемом первичном ЧКВ у больных ИМ со стойким подъемом сегмента ST.
Соотношение эффективности и безопасности сочетания ривароксабана в дозе 2,5 мг 2 раза в сутки с АСК и клопидогрелом или тиклопидином было наиболее благоприятным при ИМ.
При этом анализ в подгруппах больных ИМ со стойким подъемом сегмента ST указывает на возможность длительного использования ривароксабана не только после первичного ЧКВ, но и после тромболитической терапии, а также у больных, оставшихся без реперфузионного лечения.
У больных ИИ или ТИА в анамнезе применение тикагрелора возможно, в то время как добавление ривароксабана к антиагрегантам противопоказано.
Лечение тикагрелором должно быть начато как можно раньше в первые сутки после возникновения симптомов, в то время как ривароксабан добавляют в первую неделю лечения у больных, находящихся в стабильном состоянии, после прекращения парентерального введения антикоагулянтов для лечения ОКС.
Очевидно также, что добавлять ривароксабан к сочетанию АСК с тикагрелором или прасугрелом нельзя.
Заключение
Частота неблагоприятных исходов после острого коронарного синдрома в среднесрочной и более отдаленной перспективе остается неприемлемо высокой. Одним из путей улучшить прогноз заболевания является усиление антитромботического лечения, по крайней мере, в случаях, когда опасность неблагоприятных исходов велика и нет чрезмерного риска спровоцировать тяжелое кровотечение. При отсутствии фибрилляции предсердий и других показаний к длительному применению высоких доз антикоагулянтов одним из таких подходов является добавление к сочетанию ацетилсалициловой кислоты с клопидогрелом или тиклопидином низкой дозы ривароксабана. При соответствующем отборе больных это может способствовать дополнительному снижению совокупной частоты неблагоприятных исходов, опасности тромбоза стента, сердечно-сосудистой и общей смертности.



