Хроническая болезнь почек (ХБП) широко распространена во всем мире и ассоциируется с повышенным риском смерти у пациентов с острым коронарным синдромом (ОКС) [1, 2]. Это обусловливает актуальность ранней диагностики и профилактики ХБП.
Данные об ассоциациях генетических полиморфизмов с нарушением функции почек у пациентов с сердечно-сосудистыми заболеваниями (ССЗ) ограничены. Вместе с тем известны генетические маркеры диабетической нефропатии (ДН) [3], различных наследственных заболеваний почек [4], терминальной стадии почечной недостаточности (ПН) [5]. A. Köttgen и соавт. в 2010 г. опубликовали результаты исследования с участием более 40 тыс. пациентов, выявившего ассоциацию некоторых однонуклеотидных полиморфизмов (SNP) генов UMOD, SHROOM3 и GATM-SPATA5L1 со снижением скорости клубочковой фильтрации (СКФ) [6, 7]. В работе Y.C. Campbell и соавт. (2010) показана ассоциация полиморфных вариантов (M235T и rs2148582 гена AGT и rs2131127 гена AGTR1) с уровнем СКФ менее 60 мл/мин/1,73 м2 [8].
При этом исследования, посвященные анализу ассоциации структурных полиморфизмов генов с нарушением функции почек у больных инфарктом миокарда (ИМ), практически отсутствуют.
Цель исследования: изучить ассоциации полиморфных вариантов генов воспалительного ответа, функции эндотелия, липидного обмена и коагуляции крови с нарушением функции почек у больных ИМ с подъемом сегмента ST (ИМпST).
Материал и методы
В исследование включен 171 пациент, госпитализированный в Кемеровский кардиологический диспансер по поводу ИМпST давностью менее 24 ч. Средний возраст больных составил 58,7 (57,4—60,0) года.
Алгоритм обследования включал сбор жалоб, данных анамнеза, клинический осмотр кардиологом, запись электрокардиограммы, оценку уровня кардиоспецифических ферментов, контроль показателей системной гемодинамики, проведение эхокардиографии в 1-е сутки заболевания.
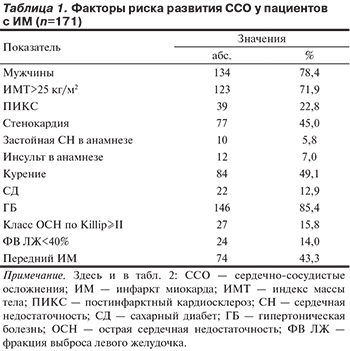 Средняя оценка риска по шкале GRACE составила 136,3 (132,5—140,1) балла, по шкале TIMI — 2,9 (2,6—3,2)балла. В табл. 1 приведены данные о частоте выявления традиционных факторов риска развития сердечно-сосудистых осложнений (ССО) в исследованной группе больных.
Средняя оценка риска по шкале GRACE составила 136,3 (132,5—140,1) балла, по шкале TIMI — 2,9 (2,6—3,2)балла. В табл. 1 приведены данные о частоте выявления традиционных факторов риска развития сердечно-сосудистых осложнений (ССО) в исследованной группе больных.
Всем пациентам в кратчайшие сроки определяли предпочтительный метод реперфузии миокарда — чрескожное коронарное вмешательство (ЧКВ) или системная тромболитическая терапия (ТЛТ). Реваскуляризацию миокарда не проводили при наличии технических ограничений вследствие особенностей анатомии коронарных сосудов, противопоказаний к ТЛТ или ЧКВ. Процедуре стентирования коронарных артерий подверглись 128 (74,8%) пациентов, ТЛТ — 11 (6,4%).
На 10—14-е сутки выполняли цветовое дуплексное сканирование экстракраниальных артерий и артерий нижних конечностей.
Расчет СКФ на момент поступления и выписки (16—20-е сутки от начала госпитализации) проводили по формуле MDRD (Modification of Diet in Renal Disease) [9]. Средние значения данного показателя в 1-е и на 16—20-е сутки у 171 пациента значимо не различались и составили 71,2 (68,2—74,2) и 71,3 (68,9—73,6) мл/мин/1,73 м2 соответственно (р=0,9). Таким образом, последующие расчеты данных проводили исходя из СКФ, оцененной при поступлении. Среди обследованных больных 90 (52,6%) имели указания на наличие в анамнезе патологии почек: мочекаменная болезнь у 3 (3,3%), хронический пиелонефрит у 85 (94,4%), ДН у 2 (2,3%) больных. При этом достоверных различий по СКФ у пациентов с и без заболеваний почек нами выявлено не было: 68,4 (64,3—72,5) и 74,3 (70,1—78,6) мл/мин/1,73 м2 соответственно; р=0,09.
У всех пациентов определены генотипы по 25 полиморфным вариантам 18 важнейших генов-кандидатов ССЗ [10].
Генотипирование проводили с помощью ДНК-чипа СИНКАР-1 (разработчики НИИ медицинской генетики СО РАМН и ООО «Геномная диагностика»). Использованный метод описан нами ранее [10].
Статистическую обработку данных осуществляли с помощью программ Statistica версии 10.0 и JMP версии 8.
Для анализа различий частот генотипов и аллелей использовали χ2-критерий Пирсона или точный тест Фишера при малом количестве наблюдений в какой-либо из подгрупп. Для оценки риска снижения СКФ в зависимости от генотипа рассчитывали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ). Для выявления прогностической значимости генетических полиморфизмов в отношении дисфункции почек (ДП) проводили регрессионный анализ с пошаговым алгоритмом отбора. Различия считали статистически значимыми при р<0,05.
Результаты
По результатам анализа показателей СКФ, оцененных в 1-е сутки, пациенты были разделены на 2 группы. В 1-ю вошел 121 пациент с нормальной СКФ (>90 мл/мин/1,73 м2) или легким ее снижением (60—89 мл/мин/1,73 м2), во 2-ю — 50 больных с СКФ 59,9 мл/мин/1,73 м2 и менее (29,2% от общего числа пациентов). В табл. 2 приведены результаты сравнения исследуемых групп больных по ряду клинико-диагностических показателей. Полученные данные демонстрируют, что ДП ассоциирована не только с показателями, учитываемыми при расчете СКФ (такими, как возраст и женский пол), но и с рядом других клинических параметров, в частности характеризующих степень атеросклеротического поражения сосудов — наличием в анамнезе стенокардии и стенозов периферических артерий от 50% и более.
Сравнение частот аллелей и генотипов по изучаемым полиморфизмам показало, что rs4291 гена ангиотензин-превращающего фермента (ACE) имел ассоциацию с фактом снижения СКФ: ОШ для носителей более редкого генотипа ТТ составило 2,31 (табл. 3). Таким образом, гомозиготный генотип ТТ является фактором риска развития ДП. Кроме того, rs4343 в этом же гене (ACE) и rs1800588 гена печеночной липазы (LIPC) выявлена тенденция к ассоциации со снижением СКФ: в случае rs4343 частота генотипа АА была несколько ниже в группе пациентов со сниженной СКФ; то же можно сказать о частоте гомозигот по частому аллелю С полиморфизма rs1800588. В обоих случаях уровень значимости ОШ для указанных генотипов составил менее 0,1 (см. табл. 3). Для остальных исследованных полиморфизмов различия частот аллелей и генотипов между двумя группами пациентов не являлись статистически значимыми.
Анализ сочетаний генотипов полиморфизмов rs4343 гена ACE и rs1800588 гена LIPC выявил, что генотип АА полиморфизма rs4343 в сочетании с генотипом СС полиморфизма rs1800588 ассоциирован с наименьшим риском ДП, тогда как генотипы GG и AG полиморфизма rs4343 гена ACE в сочетании с генотипами TT и CT полиморфизма rs1800588 гена LIPC — с наибольшим риском (табл. 4). В дополнение к данным, приведенным в таблице, следует заметить, что ОШ, рассчитанное для случая носительства условно «протективного» гомозиготного генотипа хотя бы по одному из двух полиморфизмов или по обоим (вариант 2+вариант 3), составило 0,50 (при 95% ДИ от 0,25 до 0,99). Таким образом, несмотря на «пограничный» уровень значимости, полученный для этих двух полиморфизмов отдельно, их совместный эффект является статистически значимым.
При анализе сочетаний генотипов по трем локусам: rs4291 и rs4343 гена ACE и rs1800588 гена LIPC установлено, что сочетание генотипов по трем генетическим вариантам (табл. 5) приводит к значительному увеличению риска (ОШ 4,42 при 95% ДИ от 1,37 до 14,26; р=0,012).
С целью выявления независимых предикторов ДП у больных ИМпST проведен линейный регрессионный анализ с пошаговым алгоритмом отбора (табл. 6). Первично в модель были включены все анамнестические и клинико-инструментальные показатели, являющиеся признанными факторами риска развития ССО, а также все 25 генетических полиморфизмов. Применение пошагового метода позволяет выбирать из множества показателей такие, которые вносили бы наиболее существенный вклад в вариацию изучаемой переменной (в нашем случае — СКФ менее 60 мл/мин/1,73 м2).
При пошаговом подходе факторы последовательно включаются в уравнение регрессии и проверяется их значимость. Если при включении в модель какого-то факторного признака коэффициент детерминации увеличивается, то данный признак существен и его включение в уравнение регрессии является необходимым. Результаты анализа показывают, что наиболее мощным фактором является уровень гликемии: так, при уровне глюкозы в крови более 8,8 ммоль/л (верхний квартиль гликемии у пациентов с СКФ менее 60 мл/мин/1,73 м2) риск выявления ДП увеличивался с 25,6 до 40% (ОШ 1,94 при 95% ДИ от 0,96 до 3,89; р=0,47). На втором (заключительном) этапе в модель оценки риска включен еще один фактор — сочетание генотипов полиморфизмов rs4343 и rs429 гена ACE и rs1800588 гена LIPC.

Обсуждение
Согласно данным исследования, у 29,2% обследованных пациентов СКФ составила менее 60 мл/мин/1,73 м2, что свидетельствует о высокой распространенности ДП у больных ИМпST. Ассоциация снижения СКФ со стенокардией и наличием мультифокального атеросклероза (см. табл. 3) доказывает связь между ПН и атеросклеротическим процессом. Наши предыдущие исследования с привлечением данных регистра пациентов с ОКС с подъемом сегмента ST показали, что снижение СКФ приводит к повышению частоты неблагоприятного как госпитального, так и отдаленного прогноза [11]. В наших исследованиях, как и в работах других авторов, показана роль острой сердечной недостаточности, мультифокального атеросклероза, гипергликемии в снижении СКФ [11—15]. Считается, что нарушение функции почек у больных ИМ обусловлено, главным образом, падением сердечного выброса или общего периферического сосудистого сопротивления и нейрогуморальной активацией, в результате чего снижаются почечный кровоток, давление на стенки приносящих артериол и доставка натрия к восходящей части петли Генле [16]. При этом исследования роли генетических факторов в формировании ДП немногочисленны.
Все это актуализирует поиск ранних предикторов ДП и новых аспектов ее формирования, что в конечном счете позволит улучшить методы лечения данных больных.
Ген ACE, кодирующий ангиотензин-1-превращающий фермент (АПФ), располагается на длинном плече 17-й хромосомы (17q23) [17]. Известно, что аллель А полиморфизма rs4343 тесно сцеплен с наличием последовательности Alu в 16-м интроне гена ACE размером 287 пар оснований (insertion, I), тогда как аллель G — с ее отсутствием (deletion, D) [17]. Это позволяет проводить параллель между имеющимися в литературе ассоциациями для полиморфизмов I/D и rs4343. Для полиморфизма rs4291 также наблюдается неполное неравновесие по сцеплению с rs4343 [18]. Полиморфизм I/D гена АСЕ является одним из наиболее подробно изученных полиморфизмов в связи с разнообразными фенотипами, главным образом, артериальной гипертензией (АГ) и вариабельностью показателей артериального давления (АД). Однако для этого гена получены ассоциации и с другими заболеваниями и количественными фенотипами, не всегда относящимися к сердечно-сосудистой системе, и его можно рассматривать как пример генетического локуса с плейотропным эффектом [19]. Для полиморфизма I/D ACE обычно аллель D связна с ДП. Значительное число исследований указывает на роль этого гена в нарушении функции почек. В исследовании M.R. Abdollahi (2008) изучали связь полиморфизма I/D с факторами риска развития ССЗ и метаболических нарушений в выборке 3253 британских женщин (60—79 лет); выявлена ассоциация только с диастолическим АД [20]. Имеются данные как о связи аллеля D с развитием АГ [20], так и об отсутствии таковой [21, 22]. У больных АГ аллель А полиморфизма rs4343 ассоциирован с гипертрофией левого желудочка [23]. В исследовании W. Yazhu (2011 г.) показано, что носительство аллеля G полиморфизма rs4343 гена ACE имеет протективный эффект в отношении фибрилляции предсердий (OШ 0,319 при 95% ДИ от 0,162 до 0,627; p=0,001) [24]. Предпринимались многочисленные попытки связать риск возникновения болезни Альцгеймера с полиморфизмами гена ACE. Однако в недавнем многоцентровом исследовании данная ассоциация не установлена [25]. В другом мета-анализе (9833 пациента) была выявлена связь аллеля D с увеличением толщины интимы—медии общей сонной артерии [26]. Данные о связи полиморфизмов I/D и rs4343 гена ACE с поражением коронарных артерий и инсультом в настоящее время противоречивы [27]. Так, в работе Y.C. Campbell и соавт. (2010) при исследовании генов ренин-ангиотензиновой системы в нескольких выборках людей различного расового происхождения была выявлена ассоциация полиморфизмов M235T и rs2148582 гена AGT, rs2131127 гена AGTR1 с уровнем СКФ менее 60 мл/мин/1,73 м2. Полиморфизмы ACE не показали ассоциации с уровнем СКФ, но имелась ассоциация полиморфизма rs4291 с уровнем белка в моче [8]. F. Mallamaci и соавт. (2000) выявили связь аллеля D с нефроангиосклерозом в сочетании с умеренной и тяжелой ПН [28]. Среди больных с исходной ХБП улучшение функции почек в течение 33 мес наблюдения у носителей генотипов II/ID коррелировало со снижением АД и степенью протеинурии, тогда как у больных с генотипом DD прогрессирование ПН не было связано с протеинурией [29]. В мета-анализе исследований, выполненных с 1994 по 2004 г. (14 727 пациентов), и работах 2012 г. показана связь между генотипом DD и ДН [30, 31]. Имеются данные об ассоциации генотипа DD с недиабетической нефропатией [32] и ее прогрессированием в течение 3 лет наблюдения [33]. Наконец, недавнее исследование, проведенное в китайской популяции, выявило ассоциацию rs4343 с СКФ [34]. Причину связи между геном ACE и ДН W. Huang и соавт. в эксперименте на животных индуцировали диабет у мышей, имеющих 1, 2 или 3 копии этого гена [35].
Через 12 нед у особей с 3 копиями регистрировались высокие уровни АД и протеинурия, которая коррелировала с уровнем АПФ в плазме. Это исследование показывает, что генетически детерминированное повышение уровня АПФ достаточно, чтобы привести к нефропатии.
Установлено, что генотипы DD и, соответственно, GG (rs4343) ассоциированы с более высоким уровнем АПФ в плазме, высокой активностью превращения ангиотензина I в ангиотензин II и разрушением брадикинина [36]. Показано также, что сочетание генотипов TT rs4291 и GG rs4343 ассоциировано со снижением активности АПФ и диастолического АД [37]. Согласно полученным нами результатам, именно эти генотипы были связаны со снижением СКФ. Это согласуется с гипотезой о причинах снижения функции почек у больных ИМ, описанной выше [16]; возможно, в остром периоде ИМ генетически обусловленная более высокая активность АПФ (и соответственно более высокая концентрация ангиотензина) препятствует снижению давления в почечных артериолах, что приводит к более высоким показателям СКФ. Таким образом, данные о связи полиморфизмов rs4291 и rs4343 гена ACE с ДП у больных ИМ в представленном нами исследовании, согласно приведенным данным, патогенетически обоснованы, однако требуют дальнейшего подтверждения с участием большего числа пациентов.
Согласно полученным нами данным, в группе больных со снижением СКФ имеется тенденция к более высокой частоте гетерозигот и гомозигот по аллелю Т полиморфизма rs1800588 гена печеночной липазы (LIPC) (см. табл. 4). В ряде исследований было показано, что аллель T полиморфизма rs1800588 связан с более низкой активностью своего продукта и повышением уровня триглицеридов [38—40]. При этом одни авторы выявили связь аллеля Т с повышением уровня холестерина липопротеидов высокой плотности [38], другие — со снижением [39]. C. Verdier и соавт. показана ассоциация аллеля Т полиморфизма rs1800588 гена LIPC с коронарным атеросклерозом и снижением лодыжечно-плечевого индекса [41]. Этот же аллель, по данным некоторых авторов, связан с увеличением толщины интимы—медии [42]. R.K.K. Leung и соавт. установили связь в многофакторной модели между развитием ДН и рядом полиморфизмов генов воспалительного ответа и метаболизма липидов, в частности, с rs1800588 гена LIPC. В данное исследование были включены больные сахарным диабетом 2-го типа (119 с и 554 без ДН) [43]. В другой работе генотип ТТ также был ассоциирован с повышенным риском ДН (ОШ 1,7; р=0,0009) [40].
Существует гипотеза о том, что генотип ТТ может увеличивать вероятность развития ДН, замедляя клиренс богатых триглицеридами остатков липопротеидов. При взаимодействии с другими факторами риска (например, гипергликемии) нарушения липидного обмена могут привести к повреждению почек и эндотелия, а уменьшение связывания с рецепторами для липазы может ускорить порочный круг дислипидемии, протеинурии и нефропатии [40].
В настоящее время липотоксичность обсуждается как один из возможных механизмов повреждения почек посредством гиперактивации фактора Виллебранда и гепарининдуцированной липопротеинлипазы [44], при этом аллель -514Т и в большей степени генотип ТТ ассоциированы с повышением уровня триглицеридов и холестерина, не входящего в липопротеиды высокой плотности [39, 40, 44].
Таким образом, полученная в настоящем исследовании тенденция к более высокой частоте аллеля Т (генотипов СТ и ТТ) полиморфизма rs1800588 гена LIPC у пациентов с ОКС и нарушением функции почек хорошо согласуется с данными литературы.
Ограничения исследования. В настоящее исследование включен только 171 пациент, что обусловливает необходимость продолжения работы в направлении увеличения выборки для получения более убедительных данных.
Заключение
У больных инфарктом миокарда с подъемом сегмента ST имеется ассоциация между сниженной скоростью клубочковой фильтрации, оцененной по уровню креатинина в сыворотке крови при поступлении в клинику, и генотипом TT rs4291 гена АСЕ, а также с сочетаниями генотипов rs4291, rs4343 гена ACE и rs1800588 гена LIPC. Более высокие значения ОШ, полученные для сочетаний данных генотипов по трем полиморфизмам, свидетельствуют о суммировании эффектов влияния генетических локусов на изучаемый признак.
Исследование выполнено при поддержке гранта РФФИ (№13-04-021620-а). Разработка ДНК-чипа «Синкар-1» осуществлена в рамках программы СТАРТ Фонда содействия развитию малых предприятий в научно-технической сфере (ООО «Геномная диагностика», контракт № 6830р/9535).



