Широкое применение современных технологий лечения инфаркта миокарда (ИМ) привело к значительному снижению летальности в острый и подострый периоды течения заболевания, появился феномен «доживания» больных до развития хронических осложнений (ironic failure of success) [1—3]. В то же время перед врачами возникла проблема тактики ведения больных в постинфарктный период для предупреждения рецидивов «коронарных атак», развития сердечной недостаточности (СН) [4—6]. Широкое применение чрескожного коронарного вмешательства и аортокоронарного шунтирования позволяет предупредить фатальный исход в острый период ИМ, но после выписки из стационара патологический процесс продолжается, это в первую очередь относится к проблеме атерогенеза, процессов ремоделирования сердца и сосудов [7—9].
До настоящего времени большее внимание уделялось терапии вторичного ремоделирования миокарда.
Эта проблема достаточно хорошо изучена с точки зрения как диагностики, так и коррекции [10—12]. В то же время не меньшее значение имеют нарушения эндотелия и ремоделирование сосудов, которые первыми поражаются при развитии и хронизации заболеваний сердечно-сосудистой системы, а эффективная коррекция изменений эндотелия и ремоделирования сосудов способны предупредить развитие поздних осложнений ИМ [13, 14]. Комбинация и взаимосвязь патологических процессов при ИМ обусловливают необходимость применения в первую очередь средств, оказывающих тканевые и сосудистые эффекты. Из препаратов, для которых доказаны подобные эффекты и влияние на дисфункцию эндотелия, несомненным лидером является ингибитор ангиотензинпревращающего фермента (АПФ) периндоприл [15—18].
В рамках широко известного исследования EUROPA отмечено улучшение функции эндотелия у больных стенокардией напряжения на фоне приема периндоприла [19—22]. У большинства больных ИМ фоновым заболеванием является гипертоническая болезнь, которая до развития ишемической болезни сердца (ИБС) ведет к первичному ремоделированию сердца и сосудов. Течение ИМ на фоне артериальной гипертензии (АГ) более тяжелое, сопровождается диастолической дисфункцией и ранними проявлениями СН [23, 24].
 В связи с этим представляет интерес применение периндоприла в сочетании с метаболически нейтральным диуретиком индапамидом (нолипрел А/форте/Би-форте, «Лаборатория Сервье») у больных ИМ, с нарушением эндотелийзависимой вазодилатацией (ЭЗВД). С учетом выявленного у индапамида антиоксидантного и противовоспалительного эффектов у больных СН его применение еще в большей степени повышает клинический эффект терапии [25—28].
В связи с этим представляет интерес применение периндоприла в сочетании с метаболически нейтральным диуретиком индапамидом (нолипрел А/форте/Би-форте, «Лаборатория Сервье») у больных ИМ, с нарушением эндотелийзависимой вазодилатацией (ЭЗВД). С учетом выявленного у индапамида антиоксидантного и противовоспалительного эффектов у больных СН его применение еще в большей степени повышает клинический эффект терапии [25—28].
Материал и методы
Обследованы 165 больных ИМ, все пациенты – мужчины моложе 60 лет (средний возраст 49,3 года). У 100 мужчин ИМ развился впервые, у 65 — повторно. У 93% больных отмечен Q-ИМ и QS-ИМ, подтвержденный клинически, электрокардиографически и с помощью лабораторных методов исследования. У 55% пациентов была поражена передняя стенка, у 45% — нижняя. У 95% больных развитию ИМ предшествовали АГ и курение (81%).
Всем пациентам проведены ультразвуковое сканирование брахиоцефальных и бедренных артерий, функциональная проба с реактивной гиперемией плечевой артерии, эхокардиография (ЭхоКГ). Исследование ЭЗВД плечевой артерии проводили по общепринятой методике D.S. Сelermajer и соавт. на фоне временной (в течение 12 ч) отмены лекарственных препаратов, активно влияющих на эндотелий. При первичном обследовании (2—4-е сутки острого периода ИМ) по величине ЭЗВД больные разделены на группы с нормальной ЭЗВД (n=23), сниженной (n=85), с вазоконстрикторной реакцией (n=57). Динамическое исследование через 6 мес проведено больным, которым не выполнялось ЧКВ.
ЭхоКГ проводили в 3 основных режимах — одномерном (М-режиме), двухмерном (В-режиме) и в импульсноволновом допплеровском режиме. Ультразвуковое сканирование сердца выполняли дважды — в остром периоде ИМ и в постинфарктном периоде (через 6 мес после первого исследования). Выделяли следующие типы ремоделирования левого желудочка (ЛЖ): концентрическое ремоделирование, концентрическую гипертрофию, эксцентрическую гипертрофию. Глобальную сократимость ЛЖ оценивали с помощью модифицированного метода Симпсона. Диастолическую функцию ЛЖ оценивали по характеру трансмитрального диастолического потока крови в импульсном допплеровском режиме.
Коронарографию (КГ) выполнили у 145 больных, учитывали распространенность окклюзий коронарных артерий, их локализацию, степень стеноза.
Лечение в остром периоде ИМ проводилось согласно общепринятым стандартам и включало анальгетики, антиагреганты (ацетилсалициловая кислота, клопидогрел), антикоагулянты (гепарин, низкомолекулярные гепарины), β-адреноблокаторы, ингибиторы АПФ, статины. Тромболитическая терапия проведена у 28% — алтеплазой, экстренное ЧКВ со стентированием выполнено 56% больных. По показаниям назначали антиаритмические препараты. В постинфарктном периоде все пациенты получали антиагреганты, ингибиторы АПФ, β-адреноблокаторы, статины. Больным с нарушением вазодилятации по типу вазоконстрикции назначали комбинированный препарат периндоприла с индапамидом.
Результаты и обсуждение
По данным ультразвукового исследования, у 94% больных ИМ в периферических сосудах лоцированы атеросклеротические бляшки. У большинства — плоские, со степенью стеноза сосуда менее 29%. У 8% выявлены крупные гемодинамически значимые бляшки с высокой степенью стеноза. Более тяжелые изменения сосудов отмечены при повторном ИМ. У 15,9% больных выявлены гемодинамически значимые бляшки со стенозом более 60%. Поражение периферических артерий у 61% было комбинированным с вовлечением как сонных, так и бедренных артерий. Изолированные бляшки встречались у 9% обследованных в сонных артериях и у 20% — в бедренных артериях. При обследовании пациентов через 6 мес число бляшек не уменьшилось, отмечались косвенные признаки их стабилизации — выравнивание поверхности и более равномерная эхо-структура.
Данные КГ в целом подтвердили результаты допплерографии периферических сосудов. Тяжесть изменений коронарных артерий была более выражена при повторном ИМ.
При первичном ИМ изменений ствола левой коронарной артерии не установлено ни у одного больного, у 33,3% пациентов отмечено поражение одной ветви, чаще передней межжелудочковой ветви, огибающей артерии, ветви тупого края задней боковой ветви. У 22,2% больных выявлено атеросклеротическое поражение 2 ветвей, у 38,9% — 3 ветвей. У 5,3% больных изменений при КГ не обнаружено. При повторном ИМ у 5,9% больных выявлена окклюзия (до 50%) ствола левой коронарной артерии.
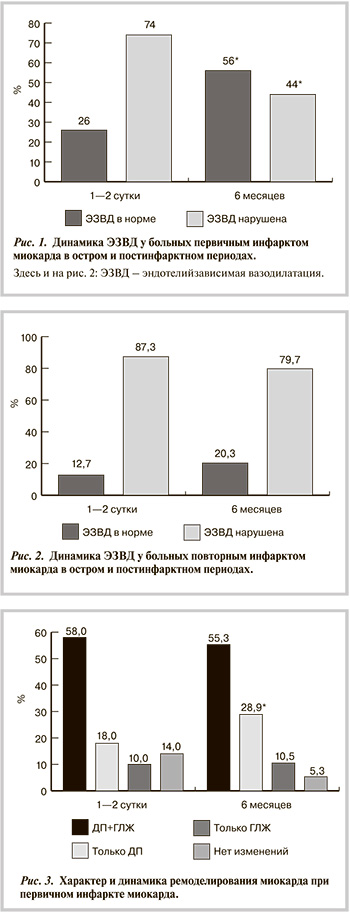
У всех пациентов этой группы отмечено поражение разной степени не менее 3 ветвей. У больных первичным ИМ при преобладающем одно- и двухсосудистом поражении степень и частота критического стеноза отдельных ветвей в целом была меньше (у 27,9%), чем при повторном ИМ (у 53%; p<0,05). Субтотальные стенозы некоторых ветвей при первичном ИМ отмечены у 66,7% больных. При повторном ИМ у каждого больного в какой-либо из ветвей встречался стеноз более 75%. Изменения ЭЗВД у больных представлены на рис. 1 и 2.
Полученные данные отражали значительные нарушения ЭЗВД в острый период заболевания. Нормальные показатели отмечены только у 1/4 больных первичным ИМ.
При повторном ИМ число больных с нормальной ЭЗВД было в 2 раза меньше (см. рис. 2). Через 6 мес при первичном ИМ достоверно увеличилось число больных с нормальной ЭЗВД (р<0,05). При повторном ИМ число больных с нормальной ЭЗВД увеличилось незначительно (р>0,05).
Характер нарушений ЭЗВД оказалось следующим: у 34% пациентов с первичным ИМ в остром периоде была парадоксальная вазоконстрикторная реакция, при повторном ИМ данная реакция отмечена у 49,2% больных. Анализ особенностей ЭЗВД у 15 больных с повторным ИМ, ранее наблюдавшихся в клинике, показал, что повторный ИМ у них развился на фоне сохраняющегося через 6 мес после первого ИМ нарушения ЭЗВД, причем у всех была вазоконстрикторная реакция.
Из 57 пациентов с вазоконстрикторной реакцией 6 проведено стентирование, остальные получали стандартную терапию, включая комбинированный препарат периндоприла с индапамидом, на протяжении 6 мес, начиная со 2—4-го дня стационарного лечения. Контрольное обследование данных больных через 6 мес показало, что при первичном ИМ число больных с вазоконстрикторной реакцией достоверно уменьшилось с 34 до 5% (р<0,05). При повторном ИМ число больных с вазоконстрикцией статистически незначимо уменьшилось на 10% (с 49,2 до 39,9%; р>0,05).
При анализе результатов ЭхоКГ в 1—2-е сутки ИМ и в динамике через 6 мес от начала заболевания получены следующие данные. В острый период, как при первичном, так и при повторном ИМ у большинства больных выявлены изменения основных ультразвуковых параметров миокарда: дилатация полостей (ДП) и гипертрофия левого желудочка (ГЛЖ) (рис. 2).
 Согласно данным, представленным на рис. 3, в острый период первичного ИМ у большинства больных выявлены признаки ремоделирования миокарда с преобладанием сочетания ДП и ГЛЖ, у 18% дилатация полостей была без ГЛЖ. Через 6 мес число пациентов без признаков ремоделирования несколько уменьшилось за счет достоверного увеличения числа больных с признаками дилатации полостей. У 14% пациентов признаков структурного ремоделирования миокарда не выявлено, но у 50% отмечена изолированная диастолическая дисфункция, сохраняющаяся и через 6 мес.
Согласно данным, представленным на рис. 3, в острый период первичного ИМ у большинства больных выявлены признаки ремоделирования миокарда с преобладанием сочетания ДП и ГЛЖ, у 18% дилатация полостей была без ГЛЖ. Через 6 мес число пациентов без признаков ремоделирования несколько уменьшилось за счет достоверного увеличения числа больных с признаками дилатации полостей. У 14% пациентов признаков структурного ремоделирования миокарда не выявлено, но у 50% отмечена изолированная диастолическая дисфункция, сохраняющаяся и через 6 мес.
При повторном ИМ (см. рис. 4) у всех обследованных больных выявлены признаки ремоделирования миокарда. У них чаще отмечено сочетание дилатации и ГЛЖ. При исследовании через 6 мес существенных динамических изменений не произошло. У всех больных с признаками ГЛЖ и у 50% с дилатацией полостей отмечена диастолическая дисфункция, стойко сохраняющаяся и через 6 мес.
При оценке типов ремоделирования миокарда более тяжелые изменения отмечены при повторном ИМ (см. таблицу).
У больных первичным ИМ с нарушенной ЭЗВД через 6 мес увеличилась частота концентрического ремоделирования и реже отмечалась концентрическая гипертрофия. В то же время число больных с эксцентрической гипертрофией и без признаков ремоделирования практически не изменилось.
При повторном ИМ характер ремоделирования за период динамического наблюдения практически не изменился. Несколько отличалась степень ГЛЖ, которая при первичном ИМ в остром периоде была легкой у 28% больных, умеренной — у 26%, тяжелой — у 16%. При повторном ИМ у 30,8% больных отмечалась тяжелая гипертрофия, у такого же числа — умеренная и у 21,5% больных — легкая степень.
При динамическом исследовании через 6 мес как при первичном, так и повторном ИМ статистически значимых изменений степени ГЛЖ не произошло.
Выявлены различия по динамике и характеру сократительной способности миокарда у обследованных больных в разные периоды ИМ. Наличие структурно-геометрических изменений сердца при первичном ИМ не привело к значительному нарушению сократительной способности миокарда в остром периоде. Только у 26% обследованных фракция выброса (ФВ) была менее 45%. За период наблюдения отмечена положительная динамика — у всех пациентов, принимавших комбинированный препарат периндоприла с индапамидом, ФВ нормализовалась. Иные показатели выявлены при повторном ИМ. Более чем у 1/3 больных ФВ была менее 45%, причем у 4,6% пациентов она не превышала 35%. Это объясняет высокую частоту развития у них острой левожелудочковой недостаточности (ОЛЖН), которая носила систолический характер. В постинфарктном периоде увеличение ФВ у больных данной группы отмечен только у в 50% случаев.
Таким образом, как первичный, так и повторный ИМ развивается на фоне распространенного атеросклероза, повторный ИМ — с субтотальным или тотальным поражением ряда ветвей коронарных артерий, что требует проведения обязательного хирургического лечения больных ИБС данной категории.
В остром периоде при первичном ИМ у 74% больных выявлено нарушение ЭЗВД, у 1/3 обследованных отмечена парадоксальная констрикция артерии. В постинфарктном периоде на фоне лечения наблюдалось некоторое улучшение ЭЗВД: вазоконстрикторная реакция выявлена только у 11% пациентов. При повторном ИМ в остром периоде нарушение ЭЗВД отмечено у 87,3% больных, причем у 50% выявлена вазоконстрикторная реакция, которая более чем у 1/3 сохранялась в постинфарктном периоде.
Возможно, при первичном ИМ нарушение функции эндотелия является динамичным, частично-обратимым процессом и, вероятно, обусловлено гемодинамическими нарушениями в ответ на поражение миокарда или является нейрогуморальной реакцией на стресс. При повторном ИМ эти нарушения усугубляются имевшейся ранее дисфункцией эндотелия и, возможно, произошедшим ранее ремоделированием миокарда. Все это объясняет бóльшую частоту развития осложнений при повторных ИМ.
У большинства больных с первичным и повторным ИМ в остром периоде выявлены структурно-геометрические изменения сердца — дилатация полостей, ГЛЖ. Для первичного ИМ характерно развитие преимущественно диастолической дисфункции без признаков ремоделирования миокарда. Данные изменения отчасти объясняются тем, что первичный ИМ развился на фоне длительно существующей АГ, длительного курения и других факторов риска, которые способствовали развитию ремоделирования, тем более что они встречались в комбинациях и усугубляли действие друг друга.
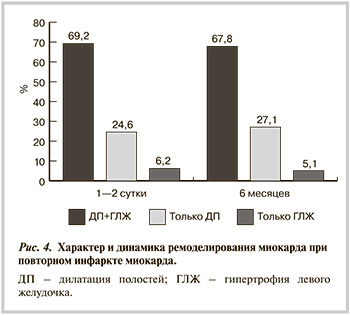 Для повторного ИМ характерны более тяжелые признаки ремоделирования с развитием не только концентрической гипертрофии, но и наиболее тяжелой и прогностически неблагоприятной формы ремоделирования — эксцентрической гипертрофии почти у 20% больных. Вероятно, это связано как с факторами, обусловливающими ремоделирование при первичном ИМ, так и с повторным ремоделированием после перенесенного ИМ. Не исключено, что эти изменения связаны и с нарушенной ЭЗВД, которая при повторном ИМ у многих носила характер парадоксальной вазоконстрикции. Сочетание этих изменений во многом определяет характер и тяжесть осложнений. При первичном ИМ — это диастолический вариант недостаточности кровообращения, легче поддающийся коррекции. При повторном ИМ у отдельных больных развивается систолический вариант недостаточности кровообращения, при котором требуется иной терапевтический подход.
Для повторного ИМ характерны более тяжелые признаки ремоделирования с развитием не только концентрической гипертрофии, но и наиболее тяжелой и прогностически неблагоприятной формы ремоделирования — эксцентрической гипертрофии почти у 20% больных. Вероятно, это связано как с факторами, обусловливающими ремоделирование при первичном ИМ, так и с повторным ремоделированием после перенесенного ИМ. Не исключено, что эти изменения связаны и с нарушенной ЭЗВД, которая при повторном ИМ у многих носила характер парадоксальной вазоконстрикции. Сочетание этих изменений во многом определяет характер и тяжесть осложнений. При первичном ИМ — это диастолический вариант недостаточности кровообращения, легче поддающийся коррекции. При повторном ИМ у отдельных больных развивается систолический вариант недостаточности кровообращения, при котором требуется иной терапевтический подход.
Выявленное сочетанное ремоделирование сосудов и миокарда у больных определяет направленность терапии, которая должна предупредить не только острые коронарные катастрофы, но и развитие отдаленных осложнений, определяющих феномен увеличения «доживания» больных. В этой терапии наиболее обоснованной точкой воздействия является эндотелий. Развитие стойкой вазоконстрикторной реакции сосудов уже в острый период ИМ запускает патофизиологические процессы, которые в конечном итоге приведут к клинически определяемой СН. Использование препаратов, нормализующих функцию эндотелия, позволяет обоснованно предупредить этот процесс. Особенно это важно у больных АГ, которая является основным фактором риска развития ИБС. Вазоконстрикторная реакция, характерная для 1/3 больных АГ, является основным механизмом прогрессирования ремоделирования миокарда и сосудов. Своевременная коррекция вазоконстрикции не менее важна, чем снижение артериального давления, так как предупреждает сосудистые катастрофы и формирование хронической СН. Среди ингибиторов АПФ препаратом выбора является периндоприла аргинин, который, по нашим данным, способен нормализовать функцию эндотелия, снизить проявления констрикторной реакции сосудов как при первичном, так и повторном ИМ.
Заключение
По данным, полученным в исследовании PERSPECTIVE, использование периндоприла способствует также стабилизации атеросклеротических бляшек и уменьшению риска тромбоза коронарных сосудов. Существенно не влияя на показатели ремоделирования миокарда в первые полгода после развития заболевания, комбинированный препарат периндоприла с индапамидом за счет снижения вазоконcтрикции и оптимизации гемодинамики способствует нормализации ФВ, т.е. фактически предупреждает формирование хронической СН. В ряду препаратов, используемых у больных АГ с перенесенным ИМ, комбинированный препарат периндоприла с индапамидом (нолипрел А/форте/Би-форте) занимает одно из ведущих мест как средство эффективной терапии, улучшающее прогноз, а его доступность и удобная форма фиксированной комбинации значительно повышают приверженность больных терапии.



